虎舌红多糖超声波辅助提取工艺优化及其抗氧化活性评价
邵金华 马永强 何福林 黎 涛 杨宇翔
(1. 哈尔滨商业大学,黑龙江 哈尔滨 150076;2. 湘南优势植物资源综合利用湖南省重点实验室,湖南 永州 425100;3. 湖南科技学院,湖南 永州 425100)
虎舌红多糖超声波辅助提取工艺优化及其抗氧化活性评价
邵金华1,2,3马永强1何福林2,3黎 涛2,3杨宇翔2,3
(1. 哈尔滨商业大学,黑龙江 哈尔滨 150076;2. 湘南优势植物资源综合利用湖南省重点实验室,湖南 永州 425100;3. 湖南科技学院,湖南 永州 425100)
以虎舌红为原料,蒸馏水为提取剂,对超声波辅助提取虎舌红多糖的工艺进行优化,并对虎舌红多糖的抗氧化性进行评价。结果表明:虎舌红多糖最佳提取工艺为提取温度65 ℃,提取时间20 min,料液比1∶15(g/mL),提取次数4 次,该条件下虎舌红多糖得率为(3.42±0.28) mg/g。虎舌红多糖有较好的抗氧化活性,当多糖浓度达到4 mg/mL时,对DPPH清除率强于相同浓度BHT;0.5%多糖对猪油抗氧化效果与相同浓度BHT相当。
虎舌红;多糖;超声波辅助提取;抗氧化活性
虎舌红(ArdisiamamillataHance),是紫金牛科(Myrsinaceae)紫金牛属(ArdisiaSwartz)植物,又叫天仙红衣、金丝红珠、红毛毡、毛凉伞、宝鼎红等,原产于中国,分布于湖南、广西、四川、江西等地[1]。该植物多供药用,具清热利湿、止咳化痰、抗癌、消肿解毒、活血止血等功效[2]。目前,对于虎舌红活性成分的研究,主要集中于虎舌红挥发油[3]、生物碱[4]、黄酮类成分[5-6]的研究。
多糖是一种重要的活性成分,具有抗氧化、抗病毒、抗肿瘤、降血糖、调节免疫、抗衰老、抗凝血的功能[7]。目前,对虎舌红多糖的研究较少,仅有一篇[8]关于虎舌红分离纯化与性质研究,在80 ℃下加热回流水提取。关于虎舌红多糖超声波辅助提取工艺及其抗氧化活性的研究,未见有相关报道。加热回流水提,能量消耗大、提取时间长、得率较低,而且多糖在提取的过程中容易造成降解,活性降低[9]。超声波辅助提取法具有效率高、耗能低、溶剂用量少等特点,已应用于多种植物有效成分提取[10-11],但在虎舌红多糖提取方面未见应用报道。本研究拟采用超声波辅助水提法提取虎舌红多糖,考察各个因素对虎舌红多糖得率的影响,在单因素试验基础上,利用正交试验对试验条件进行优化,并对其抗氧化活性进行评价,旨在为虎舌红多糖进一步研究提供理论基础,为新型抗氧化剂开发提供理论依据。
1 仪器与试剂
1.1 材料与试剂
虎舌红:采摘自湖南省永州湖南科技学院西山;
猪油:本实验室用市售猪板油制得;
葡萄糖、抗坏血酸、硫酸、苯酚、铁氰化钾、三氯乙酸、磷酸氢二钠、磷酸二氢钠:分析纯,天津博迪化工股份有限公司;
1,1-二苯基-2-三硝基苯肼、2,6-二叔丁基-4-甲基苯酚:分析纯,国药集团化学试剂有限公司。
1.2 仪器
超声波细胞粉碎机:scient29s-IIIN型,宁波新芝生物科技股份有限公司;
可见分光光度计:H722B型,上海舜宇恒平科学仪器有限公司;
电热真空干燥箱:DZF-6020型,北京中科环试仪器有限公司;
电子天平:JA3003型,上海舜宇恒平科学仪器有限公司;
旋转蒸发仪:R201D-Ⅱ型,郑州长城科工贸易有限公司;
循环水式真空泵:SHZ型,巩义市予博仪器设备贸易有限公司。
1.3 试验方法
1.3.1 多糖提取流程
虎舌红全草→切成1 cm小段→60 ℃烘干、粉碎,过60目筛→乙醚回流脱脂[料液比1∶25(g/mL),回流脱脂3 h]→脱脂后的残渣烘干(真空干燥60 ℃)、粉碎(40目)→超声波辅助蒸馏水提取→纱布过滤后抽滤→上清液(粗提取液)→活性炭脱色(2.5%搅拌40 min)→抽滤→上清液真空浓缩(75 ℃)为原体积的1/4→加入无水乙醇,至乙醇的终体积分数为75%→静置36 h后取沉淀→65 ℃真空干燥→虎舌红粗多糖
1.3.2 虎舌红多糖含量测定 采用苯酚—硫酸法[12]。
(1) 葡萄糖标准曲线绘制:精密称取干燥至恒重的葡萄糖对照品50 mg,置于500 mL容量瓶中,加水溶解并稀释至刻度,摇匀,即得葡萄糖对照品贮备液。准确量取上述对照品贮备液0.0,1.0,2.0,3.0,4.0,5.0 mL,分别置于10 mL容量瓶中,再分别各取1 mL加浓硫酸7.5 mL和5%苯酚1.5 mL,在490 nm波长处测定吸光度(A490 nm)。
(2) 样品多糖的含量测定:将浓缩的虎舌红多糖提取液置于10 mL容量瓶中,加水稀释至刻度,摇匀,取1 mL加浓硫酸7.5 mL和5% 苯酚1.5 mL,在490 nm波长处测定吸光度(A490 nm)。虎舌红多糖得率按式(1)计算:
(1)
式中:
P——多糖得率,mg/g;
c——样品浓度,μg/mL;
n——稀释倍数;
v——稀释体积,mL;
m——样品质量,g。
1.3.3 虎舌红多糖提取工艺优化
(1) 料液比对虎舌红多糖得率的影响:准确称取10.0 g 虎舌红脱脂后干燥粉末,料液比分别为1∶ 15,1∶20,1∶25,1∶30,1∶35(g/mL),超声温度为55 ℃,提取时间20 min(提取3 s,间隔2 s),提取次数1次,考察料液比对多糖提取得率的影响。
(2) 提取时间对虎舌红多糖得率的影响:准确称取10.0 g 虎舌红脱脂后干燥粉末,料液比按1.3.3(1)最优值,设置超声波提取时间分别为10,15,20,25,30 min(提取3 s,间隔2 s),提取温度55 ℃,提取1次,考察提取时间对虎舌红多糖提取得率的影响。
(3) 提取温度对虎舌红多糖得率的影响:准确称取10.0 g 虎舌红脱脂后干燥粉末,料液比按1.3.3(1)最优值,设置超声波提取时间为1.3.3(2)最优值,水提,设置提取温度为50,55,60,65,70 ℃,提取1次,考察提取温度对虎舌红多糖提取得率的影响。
(4) 提取次数对虎舌红多糖得率的影响:准确称取10.0 g 虎舌红脱脂后干燥粉末,料液比按1.3.3(1)最优值,设置超声波提取时间为1.3.3(2)最优值,提取温度为1.3.3(3)最优值,分别提取1,2,3,4,5次,考察超声温度对虎舌红多糖提取得率的影响。
(5) 正交优化设计:在单因素试验的基础上,以多糖提取得率为检测指标,采用L9(34)进行4因素3水平正交试验,综合考察多因素对多糖提取得率的影响。
1.3.4 多糖抗氧化活性检测
(1) DPPH自由基清除能力测定:向试管中依次加入6.5×10-5mol/L DPPH·溶液2.5 mL,分别加入5,10,15,20,25 mg/mL虎舌红多糖提取液1 mL、相同浓度BHT(阳性对照),蒸馏水补足到 4 mL,蒸馏水做对照,各管混合均匀,避光保存20 min后,在517 nm 处测定吸光度值[13]。样品对 DPPH自由基的清除率按式(2)计算:
(2)
式中:
K——DPPH自由基清除率,%;
A0——对照吸光度;
A——样品吸光度。
(2) 虎舌红多糖对猪油抗氧化能力测定:将猪油试样100 g,按照质量百分比 0.1%,0.3%,0.5%,0.7%,0.9%加入虎舌红多糖,以0.5% BHT为对照,搅拌均匀,然后置于(60±2) ℃的烘箱自氧化,每 48 h 取样测定猪油的过氧化值[14]。按GB/T 5538—2005 测定油脂的过氧化值。
2 结果与分析
2.1 葡萄糖标准曲线绘制
由图1可知,在10~50 μg/mL的浓度范围内,葡萄糖标准溶液浓度与吸光度有良好的线性关系。

图1 葡萄糖标准曲线
2.2 虎舌红多糖提取工艺优化
2.2.1 料液比对虎舌红多糖得率的影响 由图2可知,随着溶剂量的增加,虎舌红多糖得率逐渐增大,当料液比为1∶20(g/mL)时,多糖得率最大,之后多糖得率反而降低。在相同条件下,随着溶剂量的增加,多糖溶出量增加,溶剂量达到一定值后,多糖完全溶出,再增加溶剂的量,多糖得率不再增加,反而下降,可能是随着溶剂增加,促进了其它物质溶出,抑制多糖溶出;再者,溶剂量的增加,为后续浓缩操作带来困难,影响脱色剂用量。综合考虑,确定最佳料液比为1∶20(g/mL)。

不同字母表示存在显著性差异(P<0.05)
Figure 2 Effect of material- liquid ratio on yield of polysaccharides fromArdisiamamillataHance
2.2.2 提取时间对虎舌红多糖得率的影响 由图3可知,随着提取时间的增加,虎舌红多糖的得率也随之增大,在25 min时达到一个最大值,之后虎舌红多糖的得率下降,可能是提取时间过长,虎舌红多糖分解产生单糖,从而导致虎舌红多糖得率下降。综合考虑,确定最佳提取时间为25 min。2.2.3 提取温度对虎舌红多糖得率的影响 由图4可知,随着提取温度提高,虎舌红多糖得率增大,达到60 ℃时,得率最高,之后虎舌红多糖得率下降。可能是随着提取温度升高,液体介质黏度以及表面张力降低,但液体蒸气压增大,因而在液体介质中间容易拉开进而形成空化作用,使细胞破碎度增加,促使细胞多糖向外扩散,促使多糖得率增大,但当温度再增加,使细胞破碎度过大,促使多糖外的其它杂质被溶出,多糖得率下降。因此,确定60 ℃为最佳提取温度。
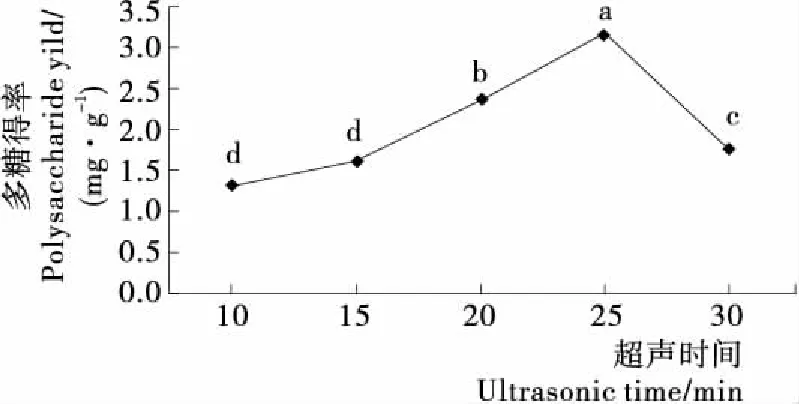
不同字母表示存在显著性差异(P<0.05)
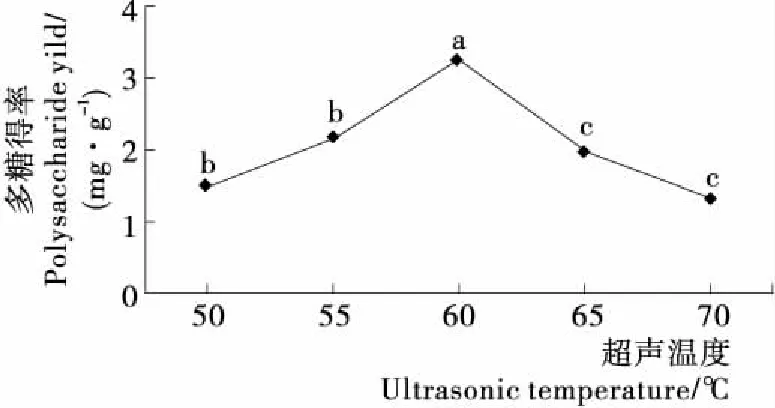
不同字母表示存在显著性差异(P<0.05)
Figure 4 Effect of ultrasonic temperature on yield of polysaccharides fromArdisiamamillataHance
2.2.4 提取次数对虎舌红多糖得率的影响 由图5可知,随着提取次数增加,多糖得率逐渐增加,提取次数达到3次后再增加提取次数时,多糖得率变化不大。可能是提取3次后,多糖已经完全浸出,固液相达到了平衡,再者,提取次数增加,能量消耗增大。综合考虑,虎舌红多糖提取次数选择3次。

不同字母表示存在显著性差异(P<0.05)
Figure 5 Effect of extraction times on yield of polysaccharides fromArdisiamamillataHance
2.2.5 正交试验 正交试验因素水平见表1,结果见表2,方差分析见表3。
由表2可知,影响虎舌红多糖得率因素的次序为:C>A>B>D,最佳工艺参数为:A3B1C1D3,即超声温度为65 ℃,超声时间为20 min,料液比为1∶15(g/mL),提取次数为4次。由表3方差分析可知,超声温度、超声时间、料液比对虎舌红多糖得率都有显著影响。由于正交表中无A3B1C1D3试验组,对此试验组进行了3次验证实验,此条件下,虎舌红多糖得率为(3.42±0.28) mg/g,得率高于其它试验组。

表1 正交试验因素水平表

表2 正交试验结果表

表3 方差分析表†
†F临界值19.000;*表示差异显著,P<0.05。
2.3 虎舌红多糖抗氧化活性研究
2.3.1 DPPH自由基清除能力测定 由图6可知,随着虎舌红多糖、BHT浓度增大,对DPPH清除率逐渐增大,呈现一定的量效关系,当虎舌红多糖浓度达到4 mg/mL时,其对DPPH清除率效果强于BHT。
2.3.2 虎舌红多糖对猪油抗氧化能力测定 由表4可知,随着多糖含量增加,对猪油的抗氧化效果增强,0.05% 多糖与0.05% BHT抗氧化效果较接近,此时,BHT抗氧化效果好于多糖;当多糖浓度达到0.07%,多糖的抗氧化效果好于BHT。由此可见,虎舌红多糖抗氧化效果较好,但是因为其是粗多糖,需要进一步纯化,纯化后的抗氧化效果可能好于BHT。

不同字母表示存在显著性差异(P<0.05)
Figure 6 Inhibitory effects of polysaccharides fromArdisiamamillataHance and BHT on DPPH
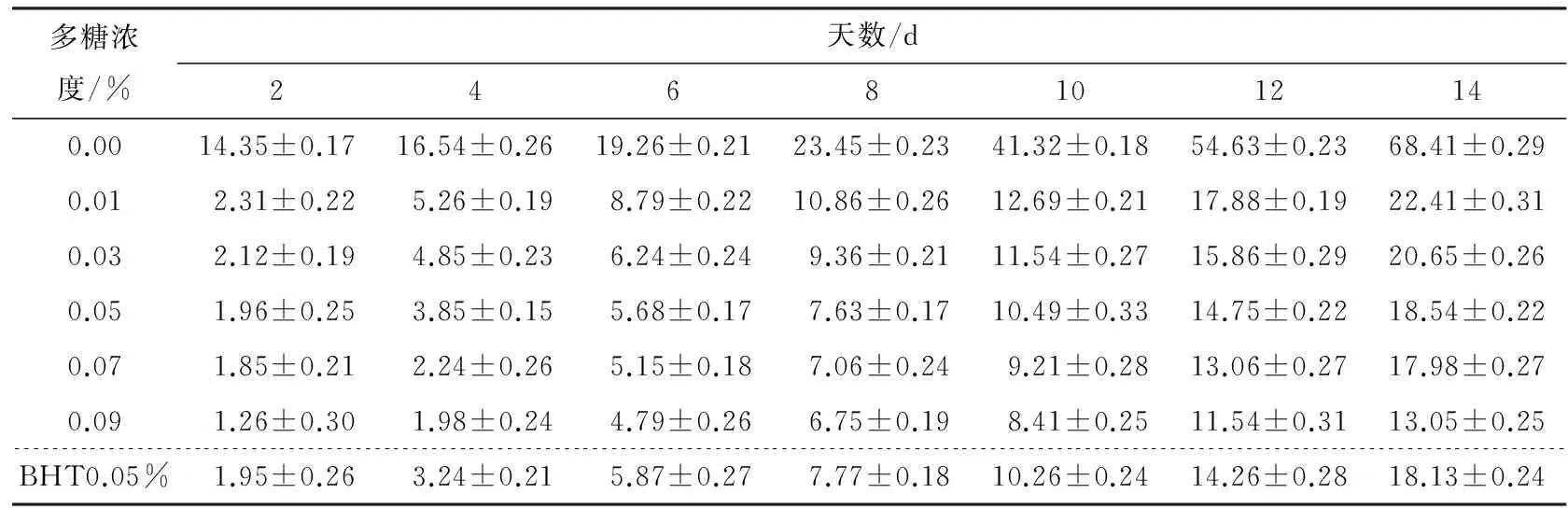
表4 虎舌红多糖、BHT对猪油抗氧化作用
3 结论
本试验结果表明,虎舌红多糖超声辅助提取工艺的最佳条件为提取温度65 ℃,提取时间20 min,料液比1∶15(g/mL),提取4次,该条件下虎舌红多糖得率为(3.42±0.28) mg/g。
通过本试验证明虎舌红多糖具有较好的抗氧化活性,粗多糖浓度达到5 mg/mL时,对DPPH清除率强于相同浓度BHT,在对猪油抗氧化试验过程中发现,粗多糖浓度达到0.7%时,对猪油的抗氧化效果强于对照0.5% BHT。虎舌红粗多糖的后续纯化、结构分析以及其结构与抗氧化性构效关系研究还有待进一步研究。
[1] 赵亚, 刘合刚. 紫金牛属植物研究近况[J]. 中草药, 1999, 30(3): 228-231.
[2] 凌育赵, 曾满枝. 虎舌红多糖的分离纯化与性质研究[J]. 分析试验室, 2007, 26(4): 93-96.
[3] 凌育赵, 曾满枝, 严志云. 超临界萃取气-质联用分析虎舌红挥发油化学成分[J]. 精细化工, 2005, 22(10): 766-769.
[4] 凌育赵, 曾满枝. 虎舌红生物碱类成分的提取分离与结构鉴定[J]. 精细化工, 2007, 24(7): 667-670.
[5] 刘经亮, 凌育赵, 王如意, 等. 虎舌红中黄酮类化学成分研究[J]. 中草药, 2015, 46(6): 808-811.
[6] 凌育赵, 凌苑妮, 贾冰涛. 大孔吸附树脂分离纯化虎舌红总黄酮[J]. 仲恺农业工程学院学报, 2012, 25(1): 44-47.
[7] 张雪春, 田智宇, 王振兴, 等. 核桃青皮多糖微波辅助提取工艺及抗氧化活性研究[J]. 食品与机械, 2016, 32(7): 146-151.
[8] 凌玉赵, 曾满枝. 虎舌红多糖的分离纯化与性质研究[J]. 分析实验室, 2007, 26(4): 93-96.
[9] 张会香, 杨世军, 曾金. 马蹄多糖微波辅助提取工艺优化及其抗氧化活性研究[J]. 食品与机械, 2016, 32(6): 164-167, 219.
[10] 薛菁, 吴晓彤, 王颖超, 等. 超声波辅助提取口蘑菌丝体多糖工艺优化[J]. 食品与机械, 2016, 32(1): 172-174.
[11] 郭丹钊, 郑威, 马海乐, 等. 超声波辅助提取樟芝菌丝体活性物质的工艺研究[J]. 食品与机械, 2016, 32(1): 158-161, 178.
[12] 郭金龙, 陈有君, 孙国琴, 等. 苯酚-硫酸法测定杏鲍菇多糖方法的研究[J]. 食品科学, 2008, 29(12): 555-558.
[13] 刘慧燕, 赵谋明. 江篱低分子量多糖的提取以及抗氧化活性的研究[J]. 食品工业科技, 2005, 26(3): 67-69.
[14] 郑立红. 生姜乙醇提取物在猪油中的抗氧化性的实验研究[J]. 中国食品添加剂, 2001, 12(5): 39-43.
Ultrasonic-assisted extraction of polysaccharide from ardisia mamillata and the evaluation of its antioxidant activity
SHAO Jin-hua1,2,3MAYong-qiang1HEFu-lin2,3LITao2,3YANGYu-xiang2,3
(1.HarbinUniversityofCommerce,Harbin,Heilongjiang150076,China; 2.KeyLaboratoryofComprehensiveUtilizationofAdvantagePlantsResourcesinHunanSouth,Yongzhou,Hunan425100,China; 3.HunanUniversityofScienceandTechnology,Yongzhou,Hunan425100,China)
A orthogonal test was utilized to optimize the ultrasonic-assisted extraction process of the polysaccharide inArdisiamamillatabased on the single-factor experiment, and its antioxidant activity was evaluated. The results demonstrated that the polysaccharide inArdisiamamillatacould be extracted best by using distilled water as the extracting agent, with the solid-liquid ratio 1∶15(g/mL)was treated , ultrasonated at 65 ℃ for 20 min, for 4 times. Thus the extracting rate of the polysaccharide fromArdisiamamillatawas (3.42±0.28) mg/g. Moreover, it was also found that the polysaccharide formArdisiamamillatapossessed good antioxidant activity. It was tested that the polysaccharide showed stronger clear ability of DPPH than that of BHT at concentration 4 mg/mL, and 0.5% polysaccharide had comparable antioxidant effect on lard with that of BHT.
Ardisiamamillata; polysaccharide, ultrasonic-assisted extraction, antioxidant activity
10.13652/j.issn.1003-5788.2016.12.036
湖南省教育厅重点项目(编号:16A904)
邵金华,女,湖南科技学院高级实验师,哈尔滨商业大学在读博士研究生。
马永强(1963—),男,哈尔滨商业大学教授,博士。 E-mail: qyma163@126.com
2016—09—30

