rpoB基因不同突变位点结核分枝杆菌利福平体外最小抑菌浓度的变化▲
万智敏向延根 马小华 石国民 范任华 彭雪峰
(1 南华大学临床医学院,衡阳市 421001,E-mail:304069315@qq.com;2 长沙市中心医院检验科,长沙市 410004)
论著·临床研究
rpoB基因不同突变位点结核分枝杆菌利福平体外最小抑菌浓度的变化▲
万智敏1,2向延根2马小华2石国民2范任华2彭雪峰2
(1 南华大学临床医学院,衡阳市 421001,E-mail:304069315@qq.com;2 长沙市中心医院检验科,长沙市 410004)
目的 探讨rpoB基因不同突变位点结核分枝杆菌利福平体外最小抑菌浓度(MIC)的变化。方法 收集人型的结核分枝杆菌菌株103株,利用基因芯片法筛选rpoB耐药突变基因菌株。采用绝对浓度法对所有菌株进行不同浓度的利福平药敏试验,观察不同菌株对利福平的MIC。结果 基因芯片共分离出55株rpoB突变株,48株非突变株。突变株MIC值为 (459.6±205.8)μg/ml,高于非突变株的(5.0±4.5)μg/ml(P<0.05)。55株rpoB突变株中突变位点分别为531(C→T)、526(C→G/T)和516(A→G/T),531(C→T)位点突变株的MIC值为(576.0±29.3)μg/ml,均高于516(A→G/T)的(432.9±38.2)μg/ml和526(C→G/T)的(355.5±59.5)μg/ml(P<0.05),但526(C→G/T)、516(A→G/T)位点突变株的MIC比较,差异无统计学意义(P>0.05)。结论 基因芯片检测结核分枝杆菌rpoB基因突变株与其耐药表型相关性较高。不同突变位点的结核杆分枝菌菌株对利福平的耐药程度有差异,可为临床合理用药提供参考。
结核分枝杆菌;rpoB基因;芯片基因;利福平;最小抑菌浓度
我国是结核病高负担国家,也是耐药结核高负担国家[1]。利福平作为一线抗结核药物,由于各种原因导致结核分枝杆菌对其产生耐药。基因芯片法是检测结核分枝杆菌耐药基因的新方法,对利福平耐药基因的检测与表型检测符合率在95.0%以上[2]。但是目前临床上对结核分枝杆菌利福平耐药性的研究多局限于定性检测,尚未对耐药基因相应位点的突变引起的耐药水平进行深入研究。本研究通过分析基因芯片分离出的rpoB突变株利福平耐药的情况,探讨rpoB基因不同突变位点对其利福平最小抑菌浓度(minimum inhibitory concentration,MIC)的影响,为临床用药提供参考。
1 材料和方法
1.1 菌株来源 收集长沙市中心医院2014年1月1日至2015年9月30日临床送检的肺结核患者痰标本,按照《结核病诊断实验室检验规程》[3]处理痰标本获得菌悬液,经在BACTEC MGIT-960结核杆菌培养仪(美国BD公司),用Middlebrook 7H9液体培养基(碧迪医疗器械上海有限公司,批号:5260715)培养,涂片鉴定为结核分枝杆菌阳性的菌株共103株,经PNB和TCH培养基鉴定均为人型结核分枝杆菌,且PNB敏感、TCH耐药。H37Rv标准菌株由中国结核病控制中心参比实验室提供。
1.2 主要仪器、设备和试剂 利福平纯药粉由美国Sigma公司提供(批号:Lot080M1506V);结核分枝杆菌耐利福平芯片检测配套设备包括Extractor 36核酸快速提取仪、BioMixerTMⅡ芯片杂交仪、SlideWasherTM8芯片洗干仪和LuScan 10K-B微阵列芯片扫描仪均为北京奥博生物有限公司生产;HB-100干式恒温金属浴(上海之信仪器有限公司);PCR扩增仪7300(美国ABI有限公司);H1650-W高速台式离心机(湖南湘仪有限公司);FX-1200-B2生物安全柜(上海瑞仰净化装备有限公司);DW-86L-388A低温冰箱(中国海尔有限公司);自制改良罗氏培养基按《结核病诊断细菌学检验规程》[3]进行配置。谷氨酸钠(加加集团有限公司,批号:GB/T8967);磷酸二氢钾(光华有限公司,批号:20110928);硫酸镁(批号:20110322)和枸橼酸镁(批号:20110627)为光复精细化工研究所生产;孔雀绿(批号:20110110)和吐温80(批号:20130927)均为科密欧化学试剂有限公司生产。
1.3 基因芯片法筛选耐药基因突变菌株
1.3.1 DNA提取:从Middlebrook 7H9液体培养基中吸取约1个麦氏单位浊度的人型结核分枝杆菌菌悬液20 μl于核酸提取管中,加入80 μl的核酸提取液试剂,用Extractor 36核酸快速提取仪震荡10 min,100℃金属浴5 min,12 000 r/min离心1 min,得到的核酸提取液放置于-20℃保存待检。
1.3.2 PCR扩增:取出PCR扩增试剂(北京奥博生物有限公司,批号:0112151601)自然解冻,瞬时离心至管底。每个菌株的核酸提取液标本进行3管反应,将扩增液1、2、3分别按每管18 μl分装,对于一个样本,向3管中分别加入同一样本DNA各2 μl,放入ABI7300PCR扩增仪中扩增。扩增条件设定为:37℃ 600 s;94℃ 600 s;94℃ 30 s,60℃ 30 s,72℃ 40 s,共35个循环;94℃ 30 s,72℃ 60 s,共10个循环;72℃ 420 s。
1.3.3 耐药基因检测:将扩增好的产物置于7300 PCR扩增仪中95℃变性5 min,冰浴5 min,取出杂交缓冲液按9 μl杂交缓冲液、3 μl+3 μl PCR产物的比例配制杂交混合液,吸取13.5 μl混合液加入杂交芯片加样孔中,置入已设置杂交条件为50℃、2 h的BioMixerTMⅡ芯片杂交仪中进行杂交。杂交完成后,再进行芯片洗涤、干燥、芯片扫描及结果判读。以试剂盒自带的阴阳性对照作为质控,利福平相关rpoB基因探针分布见表1。
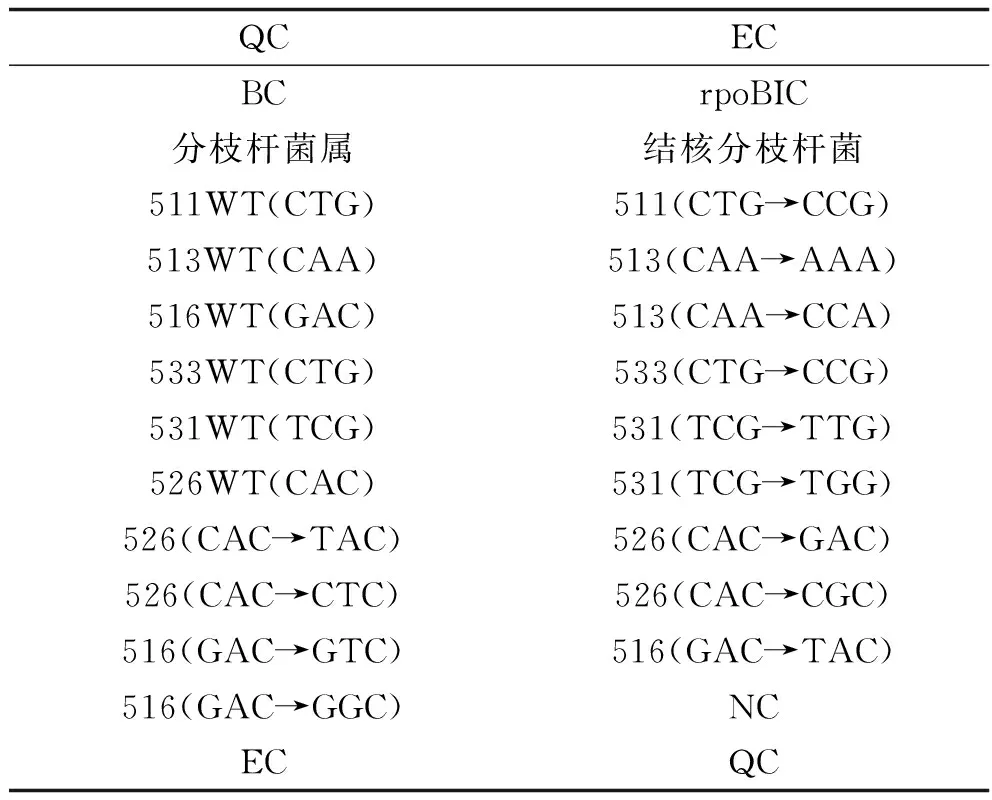
表1 利福平rpoB基因相应位点基因突变的类型
注:QC:表面化学质控探针;EC:杂交阳性外对照探针;BC:空白对照;NC:阴性对照探针;IC:内对照探针;WT:野生型。
1.4 罗氏培养基的制备及菌株的菌种复苏
1.4.1 改良罗氏培养基制备:按改良罗氏培养基配方称取谷氨酸钠28.8 g,磷酸二氢钾9.6 g,硫酸镁0.9 g、枸橼酸镁2.4 g,加2 400 ml水溶解后,加甘油48 ml、孔雀绿溶液80 ml,加入全卵液4 000 ml,充分混匀后倒入容量为10 ml的塑料杯子约7 ml,高压蒸汽灭菌备用。另配置10个不同利福平浓度的罗氏培养基,分别为5.0 μg/ml、10.0 μg/ml、20.0 μg/ml、40.0 μg/ml、80.0 μg/ml、160.0 μg/ml、320.0 μg/ml、640.0 μg/ml、1 280.0 μg/ml、2 560.0 μg/ml;罗氏培养基的利福平药物临界浓度为40.0 μg/ml。1.4.2 菌株的菌种复苏:对所有筛选的菌株标本进行菌种复苏,从Middlebrook 7H9液体培养基中取1ml的菌悬液加到改良罗氏培养基上,36℃温箱,培养1个月左右,待斜面长出菜花样的菌落。
1.5 菌株的药敏实验
1.5.1 菌液制备和菌种接种:按《结核病诊断细菌学检验规程》[3]进行微生物敏感性试验。在磨菌管中加入少量玻璃珠(8~10颗)、0.1 ml吐温80试剂、1 ml无菌生理盐水,用无菌接种环刮取改良罗氏培养基斜面上的分枝杆菌菌落数个,加入磨菌管内,盖紧管盖,漩涡振荡器震荡将分枝杆菌磨散,静置30 min;吸取菌液(避免吸取底部较大的颗粒)转移至无菌试管内,加入5ml无菌生理盐水培养液调制菌液浓度至0.5个麦氏浓度,再将0.5个麦氏浓度的菌悬液按1 ∶20倍稀释;用1 ml注射器吸取0.1 ml已稀释标本加入到不同浓度利福平罗氏培养基中,放入34℃温箱进行培养;1个月后观察培养基上耐药菌株的生长情况,并进行结果分析。
1.5.2 结果判读:严格按《结核病诊断实验室检验规程》[3]判读结果。敏感:培养基斜面上无菌落生长;耐药:菌落数占药敏培养基斜面面积1/4以上;当菌落数<20个时,报告实际的菌落数;无药对照管菌落数<50,需重新进行药敏试验。
1.6 质量保证 每批药敏试验均由经验丰富的人员操作,从培养基的配制到药敏试验、结果的报告均严格执行无菌操作规程,并用H37Rv标准株作为质控。
1.7 统计学分析 采用SPSS 19.0软件进行统计分析。计量资料以(x±s)表示,两组均数比较采用t检验,多组均数比较采用单因素方差分析,Levene检验方差齐性,方差不齐采用Dunnett检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 rpoB基因芯片筛选结果 根据实验需要,本次检测到的rpoB突变类型分别为531(C→T)、526(C→G/T)和516(A→G/T),本次检测的所有位点及ropB野生型基因芯片的检测结果见图1。

图1 不同rpoB突变位点基因芯片图
2.2 突变株与非突变株MIC比较 本次检测的rpoB突变类型分别为531(C→T)、526(C→G/T)和516(A→G/T)。103株标本中,基因芯片检测出55株为突变株,48株为非突变株。突变株MIC值为 (459.6±205.8)μg/ml,高于非突变株的(5.0±4.5)μg/ml(t=16.377,P<0.001)。2.3 不同突变类型MIC分布 突变菌株不同突变类型的MIC值比较,差异有统计学意义(P<0.05)。531(C→T)突变株MIC高于526(C→G/T)、516(A→G/T),差异均有统计学意义(P<0.05),而526(C→G/T)突变株MIC和516(A→G/T)突变株MIC比较,差异无统计学意义(P>0.05)。见表2。
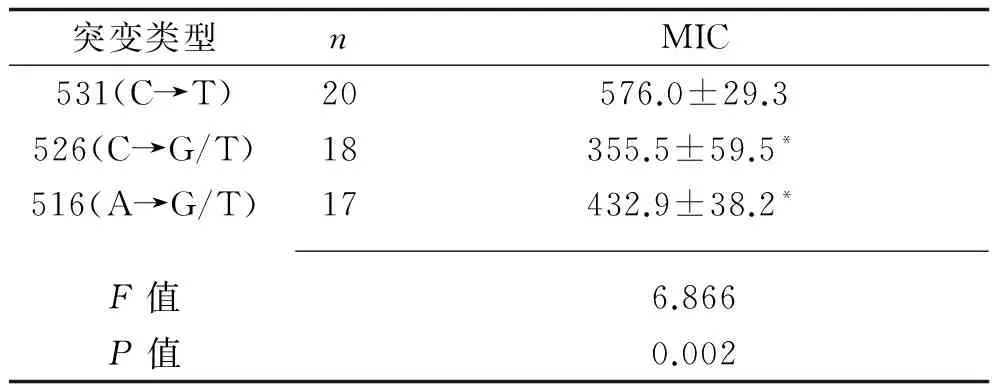
表2 突变菌株不同突变类型的MIC值比较(x±s,μg/ml)
注:与531(C→T)比较,*P<0.05。
3 讨 论
利福平是结核病的治疗方案中必不可少的一线药物之一,其主要作用机制是通过结合RNA聚合酶β亚基,使RNA聚合能力受到抑制,从而终止RNA的合成[4-5]。利福平耐药性主要是由集中在密码子507~533位碱基区域发生突变导致,这些区域称耐药决定区[6]。研究发现利福平治疗失败更容易引发耐多药结核[7]。但是临床上采用绝对浓度法界定利福平耐药临界值为40.0 μg/ml以判读耐药或敏感,并未根据耐药菌株对利福平耐药程度进行深入研究。因此,有必要对基因芯片法检测的rpoB基因突变株进行耐药表型MIC检测,以了解rpoB基因不同突变类型与利福平耐药表型之间的关系。
基因芯片法具有简单、快速等特点,逐渐被大多数结核病专科医院所采用,对rpoB突变的检测结果与RFP表型耐药的符合度达95.0%左右[8-9]。利福平耐药相关基因rpoB基因包括6个位点13种突变类型,包括531位TCG→TTG、531位TCG→TGG、526位CAC→GAC、526位CAC→TAC、526位CAC→CTC、526位CAC→CGC、511位CTG→CCG、513位CAA→CCA、513位CAA→AAA、516位GAC→GTC、516位GAC→TAC、516位GAC→GGC及533位CTG→CCG等[10]。本次研究采用基因芯片技术筛查了55例ropB突变型,基因突变类型分别为531位TCG→TTG、526位CCC→CGC和CCC→CTC和516位GAC→GTC及GAC→GGC。55株突变菌株MIC值为(459.6±205.8)μg/ml,而非突变株MIC值均在40.0 μg/ml以下,突变株总的MIC值明显高于非突变株(P<0.05),这说明结核分枝杆菌对利福平耐药的根本原因是rpoB基因相应位点产生突变,耐药主要是由耐药基因引起。本次研究的531位点突变株MIC值显著高于516位点和526位点突变株(P<0.05),这提示具有不同突变位点的菌株对利福平的耐药性存在差异,在临床上可以为耐多药的患者在无药可用的情况下提供用药参考。此外,本次研究中,516和526位点突变株MIC值比较,差异无统计学意义(P>0.05),这与文献报告的526位点引起高水平耐药而516位点引起低水平耐药有差异[11]。总之,rpoB基因不同的突变模式对利福平产生的耐药程度有显著的差异,可以为临床用药提供参考,特别是全耐药病人患者,可以根据不同的突变模式选择不同药物的MIC值来用药,但体内用药还需进一步临床试验验证[12]。
本研究尚存在不足之处:(1)本次试验选择的突变株例数偏少,可能所测MIC值存在偏差,下一步将扩大样本量进行研究;(2)本次分离的突变位点是本院主要的突变位点,尚未涉及到其他突变类型,下一步在扩大样本量的同时尽可能找出其他突变类型进行研究。此外,同一突变位点不同碱基之间的耐药情况是否存在差异尚待研究。(3)本次试验选取的标本时间跨度大,位于低温长时间保存的菌株可能会产生一定的变异抑或已经死亡导致未复苏成功。
[1] 中国防痨协会.耐药结核病化学治疗指南(2015)[J].中国防痨杂志,2015,37(5):421-469.
[2] 邓叶华,向延根,马小华,等.基因芯片法用于检测长沙地区结核分枝杆菌耐药性研究[J].国际检验医学杂志,2015,36(22):3 223-3 226.
[3] 中国防痨协会.结核病诊断细菌学检验规程[J].中国防痨杂志,1996,18(3):127-134.
[4] 李 艳,谭守勇,罗春明,等.依赖利福平与耐利福平结核杆菌肺结核的临床特点比较[J].南方医科大学学报,2013,33(2):287-289.
[5] Zhang Y,Telenti A.Genetics of drug resistance in Mycobacterium tuberculosis[M]//Jacobs WR,Hatfull GF.Molecular genetics of Mycobacteria.Washington,DC:ASM,2012:235.
[6] Telenti A,Imboden P,Marchesi F,et al.Detection of rifampicin-resistance mutations in Mycobacterium tuberculosis[J].Lancet,1993,341(8 846):647-650
[7] Malla P,Kanitz EE,Akhtar M,et al.Ambulatory-based standardized therapy for multi-drug resistant tuberculosis:experience from Nepal,2005-2006[J].PLoS One,2009,4(12):e8313.
[8] 崔振玲,胡忠义,王 洁,等.结核分枝杆菌临床分离株异烟肼耐药性四种测定方法的比较[J].中华结核和呼吸杂志,2005,28(4):245-249.
[9] 刘晶波,乐 军,韩 敏,等.分枝杆菌快速鉴定分子技术研究进展[J].国际呼吸杂志,2009,29(18):1 149-1 152.
[10]Jnawali HN,Hwang SC,Park YK,et al.Characterization of mutations in multi- and extensive drug resistance among strains of Mycobacterium tuberculosis clinical isolates in Republic of Korea[J].Diagn Microbiol Infect Dis,2013,76(2):187-196
[11]刘成永,张瑞梅,成 松,等.结核分枝杆菌耐利福平基因变异株的体外最小抑菌浓度研究[J].国际检验医学杂志,2014,35(3):258-260.
[12]何 霞,谭守勇,罗春明,等.应用MPT64为靶标快速检测结核分枝杆菌生长的研究[J].广东医学,2010,31(2):222-224.
Changes in minimal inhibitory concentration of rifampicin in vitro for mycobacterium tuberculosis strains with different rpoB gene mutation
WANZhi-min1,2,XIANGYan-gen2,MAXiao-hua2,SHIGuo-ming2,FANRen-hua2,PENGXue-feng2
(1ClinicalMedicalCollege,UniversityofSouthChina,Hengyang421001,China;2DepartmentofClinicalLaboratory,ChangshaCentralHospital,Changsha410004,China)
Objective To explore the changes in minimal inhibitory concentration(MIC) of rifampicin in vitro for mycobacterium tuberculosis strains with different rpoB gene mutation.Methods A total of 103 strains of human mycobacterium tuberculosis were collected,and the strains with drug-resistant mutant gene rpoB were screened using gene chip technology.The drug sensitivity test with different concentrations of rifampicin was conducted in all strains by absolute concentration method.Then the MICs of rifampicin for different strains were observed.Results Fifty-five strains with rpoB gene mutation and 48 without rpoB gene mutation were isolated by gene chip technology.The MIC of mutant strains was (459.6±205.8)μg/ml,and was higher than that of non-mutant strains[(5.0±4.5)μg/ml,P<0.05].The mutation sites of mutant strains included 531(C→T),526(C→G/T) and 516(A→G/T).The MIC of the strains with mutation site of 531(C→T)was (576.0±29.3)μg/ml,and was higher than that of the strains with 516(A→G/T)[(432.9±38.2)μg/ml] or 526(C→G/T)[(355.5±59.5)μg/ml,P<0.05].But there was no significant difference in the MIC between the mutation strains with 516(A→G/T) and 526(C→G/T)(P>0.05).Conclusion The mutation of rpoB gene identified by gene chip is closely related to the phenotype of drug resistance.Difference in severity of drug resistance for rifampicin is found among the strains of mycobacterium tuberculosis with different mutation sites,which can provide the references for clinical rational drug use. 【Key words】 Mycobacterium tuberculosis,rpoB gene,Gene chip,Rifampicin,Minimum inhibitory concentration
国家十二五重大专项课题(2013ZX10005004-004)
万智敏(1989~),女,本科,检验技师,研究方向:临床微生物学。
向延根(1963~),男,硕士,主任技师,研究方向:临床微生物学,E-mail:xiangyangen@126.com。
R 378.911
A
0253-4304(2016)06-0773-04
10.11675/j.issn.0253-4304.2016.06.06
2016-01-26
2016-04-20)

