替米沙坦对糖尿病心肌病大鼠心肌超微结构的影响及其作用机制
卫银芝 熊世熙 干学东 龚 斐 曹建雷
(1 湖北省黄石市中心医院老年病科,黄石市 435000,E-mail:wyz2008yjh@163.com;2 武汉大学中南医院心血管内科,武汉市 430071)
论著·基础研究
替米沙坦对糖尿病心肌病大鼠心肌超微结构的影响及其作用机制
卫银芝1熊世熙2干学东2龚 斐2曹建雷2
(1 湖北省黄石市中心医院老年病科,黄石市 435000,E-mail:wyz2008yjh@163.com;2 武汉大学中南医院心血管内科,武汉市 430071)
目的 探讨替米沙坦对糖尿病心肌病(DCM)大鼠心肌超微结构的影响及其可能作用机制。方法 30只健康雄性Wistar大鼠,随机分成空白组10只和糖尿病组20只,糖尿病组用链脲佐菌素腹腔注射诱导建立DCM模型,建模成功后随机分成对照组及治疗组各10只。治疗组给予替米沙坦(20 mg/kg)灌胃治疗,空白组和对照组给予相同体积的生理盐水灌胃。给药16周后,光镜和电镜下观察各组大鼠心肌病理改变,采用脱氧核苷酸末端转移酶介导的dUTP 缺口末端标记法检测心肌细胞凋亡情况,免疫组化法检测心肌细胞B淋巴细胞瘤因子-2(Bcl-2)、半胱氨酸-天冬氨酸蛋白酶-3(Caspase-3)及转化生长因子β1(TGF-β1)的表达情况。结果 光镜下对照组心肌细胞排列紊乱,心肌细胞核出现融合、消失、间质纤维化等改变,电镜下对照组心肌线粒体肿胀、嵴断裂甚至空泡化,肌丝成分减少、断裂。与对照组相比,治疗组光镜下心肌病理改变减轻,电镜下心肌超微结构病理改变也减轻。与空白组相比,对照组左室指数明显升高、凋亡细胞增多、Bcl-2表达减少,Caspase-3的表达及TGF-β1的A值增加(P<0.05);与对照组比较,治疗组左室指数及凋亡指数下降、Bcl-2表达增加,而Caspase-3及TGF-β1的表达减少(P<0.05)。结论 替米沙坦可以改善DCM大鼠心肌超微结构,延缓心室重构。
糖尿病心肌病;替米沙坦;心肌;转化生长因子β1;淋巴细胞瘤-2;半胱氨酸-天冬氨酸蛋白酶-3;大鼠;细胞超微结构;心室重构
糖尿病是一种发病率高的慢性疾病,估计中国目前已有超过9千万的糖尿病患者。心血管并发症是糖尿病患者致残、致死的主要原因,其中糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者严重的心血管并发症。DCM的发病机制是复杂的和多因素的,其具体的发病机制尚不清楚,肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的激活是其发病的一个重要因素。本研究采用血管紧张素 Ⅱ 受体拮抗剂(angiotensin Ⅱ receptor blocker,ARB)替米沙坦治疗链尿佐菌素(streptozotocin,STZ)诱发的DCM模型大鼠,观察用药前后DCM大鼠心肌病理及超微结构的改变,探讨替米沙坦对DCM的心脏保护作用及其作用机制。
1 材料与方法
1.1 实验动物及主要材料 2月龄健康雄性Wistar大鼠30只,体重200~250 g,平均体重220 g,由湖北省实验动物中心提供,动物合格证号:SCXK(鄂)2008-0005,在无特定病原体级动物房饲养。STZ购自Sigma公司;替米沙坦片(美卡素)购自上海勃林格殷格翰药业有限公司,批号:104337;脱氧核苷酸末端转移酶介导的dUTP 缺口末端标记[terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL]试剂盒购自南京凯基生物有限公司;B淋巴细胞瘤因子-2(B-cell lymphoma-2,Bcl-2)、半胱氨酸-天冬氨酸蛋白酶-3(Caspase-3)及转化生长因子-β1(transforming growth factor-β1,TGF-β1)免疫组化试剂盒购自Santa Cruz公司;日本日立公司生产的日立H-600型透射电镜。
1.2 实验方法
1.2.1 DCM模型的建立: 采用随机区组法将实验动物分为空白组10只、糖尿病组20只。用0.1 mmol/L的枸橼酸缓冲液(pH=4.2) 在冰浴中配制1%的STZ溶液。禁食12 h后,于糖尿病组大鼠的左下腹腹腔内一次性注射55 mg/kg的 STZ溶液。注射后第3天及第7天断尾取血测随机血糖,如血糖≥16.7 mmol/L,且有多饮、多食、多尿现象者,定为糖尿病大鼠。所有实验大鼠均建模成功。
1.2.2 处理方法:糖尿组大鼠建模成功后采用配对比较法随机分组,分成对照组10只及治疗组10只。治疗组用替米沙坦20 mg/(kg·d),以自来水溶解后灌胃,空白组和对照组给予相同体积的生理盐水灌胃,1次/d,持续16周。所有大鼠均给予常规饮食和饮水,每2周测血糖1次,期间空白组随机血糖≥7.8 mmol/L、其他两组随机血糖<16.7 mmol/L者被剔除出实验。给药16周末空腹12 h,结束实验。
1.2.3 标本的取材及制备:断颈处死大鼠,迅速打开胸腔取出心脏,轻柔除去心脏周围组织,用4℃预冷生理盐水冲洗,过滤纸吸取水分,用电子天平称重后迅速分解心脏,取左心室(含室间隔部分) 在电子天平上称重。左心室重量/体重值表示左心室指数(mg/g)。取一部分含心尖部左心室心肌用4%多聚甲醛中固定24 h后,石蜡包埋制成切片,常规苏木精-伊红(hematoxylin-eosin,HE)染色,光镜下观察心肌病理改变。另取一部分含心尖部的左心室心肌用3%戊二醛和1%锇酸固定,乙醇逐级脱水,丙酮浸透,环氧树脂812包埋,制成500~700 Ao(埃)的超薄切片,在透射电镜下观察心肌超微结构。
1.2.4 心肌细胞凋亡指数与心肌细胞Bcl-2、Caspase-3及TGF-β1表达的检测:(1)根据试剂盒说明书的操作步骤,采用TUNEL法检测心肌细胞凋亡,显微镜下细胞核中有棕黄色颗粒者为阳性细胞,即凋亡心肌细胞。随机计算5个高倍视野(×400)下的凋亡细胞数,凋亡指数(apoptotic index,AI)=凋亡细胞/100个细胞×100%。(2)根据试剂盒说明书的操作步骤,免疫组化法检测心肌细胞Bcl-2、Caspase-3及TGF-β1表达。Bcl-2在细胞质和核膜表达,阳性表达细胞为黄色或棕黄色。Caspase-3 主要存在细胞质中,阳性为细胞质中出现棕黄色颗粒。TGF-β1表达的阳性结果为细胞质中出现棕色或棕褐色染色。Bcl-2、Caspase-3采用每张切片在阳性表达区域选择5个无重叠视野,以平均计数阳性细胞核数所占视野所有细胞数目的百分比作为表达率;TGF-β1采用平均光密度值表示各样本心肌组织中TGF-β1免疫组化结果,以5个吸光度(A)的平均值作为各标本心肌组织中的表达水平。
1.3 统计学分析 采用SPSS 17.0 统计软件进行统计学分析,计量资料以(x±s)表示,比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 血糖变化 建模前空白组、对照组及治疗组血糖分别为(4.84±1.52)mmol/L、(4.73±1.48)mmol/L及(5.01±1.33)mmol/L,组间比较差异无统计学意义(F=0.153,P=0.874);实验过程中,空白组无大鼠血糖≥7.8 mmol/L,对照组及治疗组血糖均处于异常升高水平,无大鼠被剔除出实验。实验结束时,建模前空白组、对照组及治疗组血糖分别为(4.62±1.55)mmol/L、(25.12±8.23)mmol/L及(23.76±7.19)mmol/L,3组间血糖水平比较,差异有统计学意义(F=115.472,P=0.001),其中对照组及治疗组的血糖均高于空白组(P<0.05),而对照组及治疗组比较,差异无统计学意义(P>0.05)。
2.2 3组大鼠体重及左心室指数 建模时3组大鼠体重比较,差异无统计学意义(P<0.05);实验结束时,与空白组相比,对照组及治疗组大鼠体重下降(P<0.05),左室重量及左室指数明显增加(P<0.05);与对照组相比,治疗组体重差异无统计学意义(P>0.05),而左室重量及左心室指数下降(P<0.05);见表1。
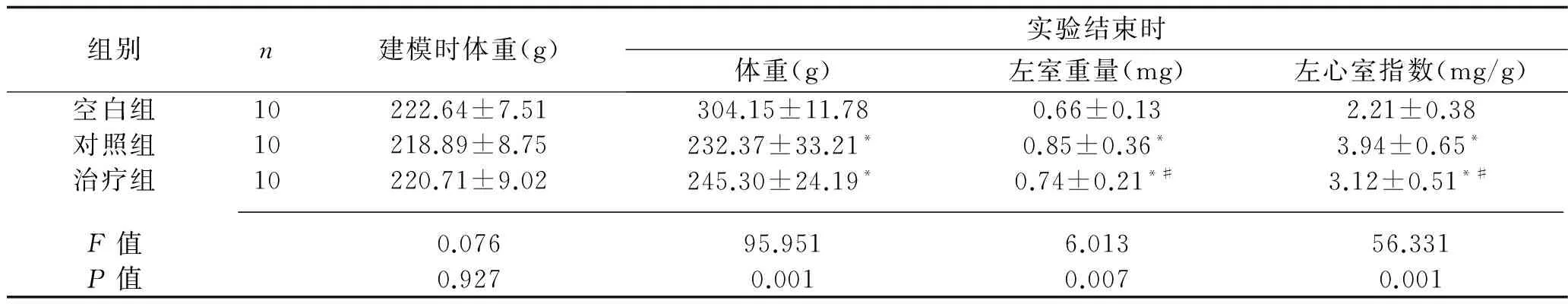
表1 3组大鼠体重及左心室指数比较(x±s)
注:与空白对照组比较,*P<0.05;与糖尿病对照组比较,#P<0.05。
2.3 光镜和电镜下观察心肌病理改变 光镜下观察,空白组心肌细胞排列整齐致密,细胞间质较少,细胞核分布均匀一致,肌纤维整齐,无明显断裂;对照组大鼠心肌细胞排列紊乱,或可见微小心肌坏死,间质纤维化明显,肌纤维部分断裂;治疗组心肌出现类似对照组病理改变,但程度减轻。电镜下观察,空白组大鼠心肌线粒体膜完整,嵴排列连续、整齐,肌丝整齐排列;对照组大鼠心肌线粒体肿胀、嵴断裂、大部分丢失、甚至空泡化,肌丝成分减少、断裂;治疗组大鼠心肌线粒体膜基本完整,少部分嵴断裂,线粒体损伤较对照组明显减轻。见图1。

图1 各组大鼠电镜下心肌超微结构(×10 000)
2.4 各组心肌组织细胞AI与Bcl-2、Caspase-3及TGF-β1表达率的比较 空白组偶见凋亡细胞;与空白组相比,对照组及治疗组AI明显增高,且Bcl-2表达率减少,Caspase-3表达率增加,大鼠心脏组织中TGF-β1平均A值显著升高(均P<0.05);与对照组相比,治疗组AI明显降低,Bcl-2表达率增加,Caspase-3表达率减少,TGF-β1平均A值降低。见表2及图2。

表2 3组心肌细胞AI与Bcl-2、Caspase-3及TGF-β1表达率的比较(x±s)
注:与空白对照组比较,*P<0.05;与对照组比较,#P<0.05。
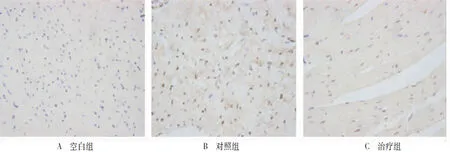
图2 各组心肌细胞凋亡情况(HE染色,×400)
3 讨 论
目前普遍认为DCM的特点是早期出现左室舒张功能障碍,并伴有心肌肥厚、心肌纤维化和心肌细胞凋亡的发展[1]。本实验中,对照组血糖处于异常升高水平,左室重量增加,左室指数升高,存在心肌肥厚;光镜下观察到心肌细胞排列紊乱,心肌细胞核出现融合、消失、间质纤维化等改变; TUNEL法检测心肌细胞AI也明显升高。这提示本实验的DCM大鼠模型成功。
在糖尿病者的心脏组织中可观察到亚细胞结构(如肌纤维膜、线粒体、内质网、肌原纤维和细胞外基质)存在不同程度的缺陷[2]。本实验在电镜下还观察到对照组大鼠心肌细胞肥大、 肌纤维断裂、肌丝扭曲以及线粒体增多、肿胀、变形、排列紊乱、结构不清等病理改变。荷尔蒙失调(包括升高的血浆儿茶酚胺和血管紧张素Ⅱ水平)、代谢障碍及氧化应激均是糖尿病的初始阶段导致心肌亚细胞缺陷的因素[2]。而DCM的致病因素包括高血糖、胰岛素抵抗、代谢紊乱、RAAS和内皮素系统的激活[1]。血管紧张素Ⅱ是RAAS系统中最主要的活性物质,也是导致心肌病理改变的重要因素,其在糖尿病心脏局部的生成量明显高于在循环系统中[3],其可以使心肌细胞肥大[4]以及左心室肥厚、心肌纤维化和心肌细胞凋亡[3],并主要通过血管紧张素-Ⅰ(angiotensin-Ⅰ,AT-Ⅰ)受体介导发挥作用[5]。替米沙坦是一种高选择性的ARB,可特异性地作用于AT-Ⅰ受体亚型,本实验给予替米沙坦干预后,与对照组相比,治疗组光镜下心肌病理改变减轻,电镜下心肌超微结构病理改变也减轻,左心室指数下降,心肌细胞凋亡减少。Ikejima等[6]发现替米沙坦可以抑制自身免疫性心肌病动物模型氧化应激反应及炎症因子表达,减轻心肌细胞凋亡,抑制心脏重构,改善心功能。那么,替米沙坦是通过怎样的机制改善DCM病理改变呢?
本实验中,对照组心肌细胞中Bcl-2表达率下降,Caspase-3及TGF-β1的表达率升高。Bcl-2是白血病蛋白家族中抗细胞凋亡亚族的主要代表,是线粒体凋亡途径的重要调控蛋白。Caspase-3被称为“死亡执行蛋白酶”,是在调控细胞凋亡过程中起重要作用的半胱天冬酶家族的主要成员,是多种凋亡途径的共同下游效应部分,在细胞凋亡过程中占据核心地位[7],同时也是Bcl-2的下游调控蛋白。TGF-β1是一种从血小板中分离出来的多功能蛋白肽。研究表明,TGF-β1及其下游蛋白参与心肌间质纤维化及心肌肥厚的病理过程[8]。通过AT-Ⅰ 受体起作用的AT-Ⅱ 和氧化应激在糖尿病诱导的心肌细胞凋亡、肥厚和纤维化中发挥了重要作用,给予AT-Ⅰ 受体阻断剂或抗氧化剂治疗有治疗DCM的作用[9]。长期高糖刺激下,心肌局部肾素-血管紧张素系统激活,AT-Ⅱ 作为肾素-血管紧张素系统的主要介质,刺激TGF-β生成,进一步促进细胞外基质增生,而ARB能抑制TGF-β1分泌并减轻心肌纤维化程度[10]。石永英等[11]建立原代培养大鼠的心肌细胞肥大模型,结果显示TGF-β1可使胚胎基因主要组织相容性复合体-β mRNA水平明显增高,心肌细胞RNA含量增加。同时TGF-β1可诱导心肌细胞凋亡率明显增加,并显著上调Caspase-3,并可能通过Caspase-3诱导心肌细胞凋亡,电镜观察也显示心肌细胞在TGF-β1诱导下同时存在肥大和凋亡表现。而Bcl-2与Caspase-3家族的关系也是相互的,一方面它参与抑制Caspase-3的合成,也通过抑止Cyt-c的释放来阻止Caspase-3的激活;另一方面,Bcl-2不仅作用于Caspase-3的上游,它还是Caspase-3的直接底物[12-13]。本实验中给予替米沙坦干预后,治疗组心肌细胞中Bcl-2表达率升高,Caspase-3及TGF-β1的表达率下降。提示替米沙坦可能是通过阻断RAAS系统的过度激活,抑制TGF-β1分泌,下调Caspase-3的表达,上调Bcl-2的表达延缓心肌纤维化和/或肥厚,同时减少心肌细胞凋亡的发生,改善心肌超微结构的作用,起到保护心肌作用。但具体的机制尚有待进一步研究。
综上所述,替米沙坦可以改善DCM大鼠心肌超微结构,延缓心室重构,其可能的作用机制是阻断RAS系统的过度激活、抑制TGF-β1分泌、下调Caspase-3表达并上调Bcl-2表达。
[1] Huynh K,Bernardo BC,Mcmullen JR,et al.Diabetic cardiomyopathy:mechanisms and new treatment strategies targeting antioxidant signaling pathways[J].Pharmacol Ther,2014,142(3):375-415.
[2] Dhalla NS,Rangi S,Zieroth S,et al.Alterations in sarcoplasmic reticulum and mitochondrial functions in diabetic cardiomyopathy[J].Exp Clin Cardiol,2012,17(3):115-120.
[3] Singh PV,Le B,Khode R,et al.Intracellular angiotensin Ⅱ production in diabetic rats is correlated with cardiomyocyte apoptosis,oxidative stress,and cardiac fibrosis[J].Diabetes,2008,57(12):3 297-3 306.
[4] Lin EQ,Irvine JC,Cao AH,et al.Nitroxyl(HNO) stimulates soluble guanylyl cyclase to suppress cardiomyocyte hypertrophy and superoxide generation[J].PLoS One,2012,7(4):e34 892.
[5] Hsueh WA,Wyne K.Renin-angiotensin-aldosterone system in diabetes and hypertension[J].J Clin Hypertens(Greenwich),2011,13(4):224-237.
[6] Ikejima H,Imanishi T,Tsujioka H,et al.Effects of telmisartan,a unique angiotensin receptor blocker with selective peroxisome proliferator-activated receptor-gamma-modulating activity,on nitric oxide bioavailability and atherosclerotic change[J].J Hypertens,2008,26(5):964-972.
[7] Odonkor CA,Achilefu S.Modulation of effector caspase cleavage determines response of breast and lung tumor cell lines to chemotherapy[J].Cancer Invest,2009,27(4):417-429.
[8] 张晓敏.TGF-β1/Smads信号通路与糖尿病心肌纤维化[J].医学综述,2012,18(11):1 644-1 647.
[9] Watanabe K,Thandavarayan RA,Harima M,et al.Role of differential signaling pathways and oxidative stress in diabetic cardiomyopathy[J].Curr Cardiol Rev,2010,6(4):280-290.
[10]Ruiz-Ortega M,Ruperez M,Esteban V,et al.Molecular mechanisms of angiotensin II-induced vascular injury[J].Curr Hypertens Rep,2003,5(1):73-79.
[11]石永英,董 颀,石永华,等.TGF-β1对体外培养的大鼠心肌细胞肥大和凋亡的影响[J].中国病理生理杂志,2009,25(4):802-805.
[12]Burton TR,Gibson SB.The role of Bcl-2 family member BNIP3 in cell death and disease:NIPping at the heels of cell death[J].Cell Death Differ,2009,16(4):515-523.
[13]Gustafsson AB,Gottlieb RA.Bcl-2 family members and apoptosis,taken to heart[J].Am J Physiol Cell Physiol,2007,292(1):C45-C51.
Effect of telmisartan on myocardial ultrastructure in rats with diabetic cardiomyopathy and its mechanism
WEIYin-zhi1,XIONGShi-xi2,GANXue-dong2,GONGFei2,CAOJian-lei2
(1DepartmentofGeriatrics,HuangshiCenterHospital,HubeiProvince,Huangshi435000,China;2DepartmentofCardiovascularMedicine,ZhongnanHospitalofWuhanUniversity,Wuhan430071,China)
Objective To explore the effect of telmisartan on myocardial ultrastructure in rats with diabetic cardiomyopathy(DCM) and its possible mechanism.Methods Thirty healthy male Wistar rats were randomly divided into blank group(n=10) and diabetic group(n=20).DCM model was established by transabdominal administration of streptozotocin in the diabetic group.After successful modeling,the diabetic group was randomly divided into control group and treatment group,with 10 rats in each group.Intragastric administration of telmisartan(20 mg/kg) was conducted in the treatment group,and intragastric administration of normal saline was conducted in the blank group and control group.After 16 weeks of administration,the myocardial pathological change was observed under light microscope and transmission electron microscope in each group,myocardial apoptosis index was examined by terminal deoxynueleotidyl transferase-mediated d-UTP nick end labeling,and the expressions of B-cell lymphoma-2(Bcl-2),Caspase-3 and transforming growth factor-β1(TGF-β1) were detected by immunohistochemistry.Results In the control group,the arrangement of myocardial cells was irregular,and the changes including fusion,vanishment and interstitial fibrosis were found in nucleus of myocardium under light microscope.Besides,the myocardial mitochondria lined irregularly,their cristae fractured and became vacuolation,and myofilaments decreased and fractured in the control group under transmission electron microscope.Compared with the control group,the pathological changes under light microscope and the myocardial ultrastructure under transmission electron microscope alleviated in the treatment group.Compared with the blank group,the left ventricular index and apoptosis index increased,the expression of Bcl-2 decreased,and the expression of Caspase-3 andAvalue of TGF-β1 increased in the control group(P<0.05).Compared with the control group,the left ventricular index and apoptosis index decreased,the expression of Bcl-2 increased,and the expressions of Caspase-3 andAvalue of TGF-β1 decreased in the treatment group(P<0.05).Conclusion Telmisartan can inprove the myocardial ultrastructure of rat with DCM,and slow the ventricular remodeling.
Diabetic cardiomyopathy,Telmisartan,Myocardium,Transforming growth factor-β1,B-cell lymphoma-2,Caspase-3,Rat,Cellular ultrastructure,Ventricular remodeling
卫银芝(1980~),女,硕士,主治医师,研究方向:心肌保护方面的研究。
熊世熙(1957~),男,硕士,主任医师,研究方向:心血管疾病,E-mail:xiongshixi@126.com。
R 362;R 587.1
A
0253-4304(2016)06-0766-04
10.11675/j.issn.0253-4304.2016.06.04
2016-02-19
2016-05-04)

