黄藤素对山羊子宫内膜上皮细胞的体外毒性研究
闫宝琪,董书伟,王东升,那立冬,2,桑梦琪,杨洪早,2,张世栋*,严作廷*
(1.中国农业科学院兰州畜牧与兽药研究所,中国农业科学院临床兽医学研究中心,甘肃省中兽药工程技术研究中心,兰州,730050;2.甘肃农业大学动物医学院,兰州,730070)
黄藤素对山羊子宫内膜上皮细胞的体外毒性研究
闫宝琪1,董书伟1,王东升1,那立冬1,2,桑梦琪1,杨洪早1,2,张世栋1*,严作廷1*
(1.中国农业科学院兰州畜牧与兽药研究所,中国农业科学院临床兽医学研究中心,甘肃省中兽药工程技术研究中心,兰州,730050;2.甘肃农业大学动物医学院,兰州,730070)
摘 要:为了探究黄藤素的体外细胞毒性,采用不同浓度的黄藤素作用山羊子宫内膜上皮细胞(EECs)后,采用MTT法绘制细胞生长曲线;倒置显微镜下观察细胞生长状态;瑞氏—姬姆萨染色法观察细胞形态学变化并通过测定乳酸脱氢酶(LDH)含量检测细胞膜的完整性。结果显示,当黄藤素的浓度为10~227μg/mL时,黄藤素对EECs有促增殖的作用;当浓度大于227μg/mL时出现细胞增殖抑制现象,药物对细胞的半数增殖抑制率(IC50)为360μg/mL;瑞氏—姬姆萨染色结果显示,100、200μg/mL的黄藤素作用于EECs时均未对其细胞核、细胞浆的形态产生影响;LDH结果显示,药物浓度≥250μg/mL时细胞LDH的释放量极显著高于正常细胞组(P<0.01)。综上所述,黄藤素作用于山羊EECs后呈现一定的毒性作用,且呈现显著的剂量依赖效应,作用于EECs的安全剂量范围为≤250μg/mL。
关键词:黄藤素;子宫内膜上皮细胞;细胞毒性;膜通透性
黄藤素(palmatine)又名掌叶防己碱、巴马汀、棕榈碱、非洲防己碱等,是从防己科植物黄藤的干燥藤茎中提取精制而得[1]。黄藤素的药理和生物活性十分广泛,主要被用来治疗胃肠道细菌感染引起的菌痢,还被广泛应用到治疗呼吸道感染、外科感染和妇科炎症等方面[2]。现代药理研究表明,黄藤素具有抑制多种革兰氏阴性和阳性细菌的效果,尤其对真菌敏感,还具有抗病毒、提高白细胞吞噬功能、提高机体免疫力及抗心率失常等作用[3]。子宫内膜炎(endometritis)是雌性哺乳动物的常见病之一,多发生于产后,是病原菌感染子宫内膜引起的炎症,常导致动物的繁殖障碍综合征,严重影响动物养殖的经济效益[4-5]。黄藤素有较好的抑菌抗炎效果,具有抗多种病原微生物的药理活性,对动物疾病治疗有较好的应用前景[6-7]。然而,应用黄藤素治疗奶牛等经济动物的子宫内膜炎还鲜有报道[8]。本试验采用山羊子宫内膜上皮细胞(EECs)作为试验材料,研究黄藤素的体外细胞毒性,为临床应用黄藤素治疗奶牛等经济动物子宫内膜炎的研究提供试验依据。
1 材料与方法
1.1材料
1.1.1细胞 山羊子宫内膜上皮细胞系(EECs)由西北农林科技大学动物医学院靳亚平教授惠赠。
1.1.2药品及试剂 黄藤素标准品购自上海源叶生物科技有限公司(HPLC≥98%),用细胞培养液将其稀释到所需要的浓度;DMEM/F12培养基购自Gibco公司;胎牛血清(FBS)购自杭州四季青公司;0.01mol/L磷酸盐缓冲液(PBS,pH 7.2~7.4)及MTT均购自Sigma公司;瑞氏—姬姆萨染料购自Solarbio公司;乳酸脱氢酶(LDH)检测试剂盒购自南京建成生物工程研究所有限公司。
1.1.3主要仪器 Memmert CO2培养箱;HeaL ForceB2型生物安全柜;SW-CJ-1CU型超净工作台;倒置显微镜(Leica DMI6000B);MDC M2e型多功能酶标仪。
1.2细胞培养
将永生化EECs从液氮中取出,37℃快速复苏,低速离心后添加含10%FBS、100U/mL青霉素和100μg/mL链霉素的DMEM/F12培养基,置于37℃、5%CO2、饱和湿度的培养箱内培养。
1.3细胞分组与处理
取100μL浓度为5×104个/mL的细胞悬液接种于96孔培养板,24h后弃去旧培养基,加入含不同浓度黄藤素的完全培养液100μL,黄藤素的终浓度分别为:0、20、40、60、80、100、120、150、180、200、250、300、350、400、450、500、550、600、650μg/mL,每个浓度设置8个复孔。
1.4MTT法检测黄藤素对EECs的增殖作用
继续培养48h后,观察细胞增殖情况。弃去旧培养基,加入5mg/mL的MTT 20μL,孵育4h。弃去多余的MTT,每孔加入200μL二甲基亚砜,低速振荡10min,使结晶物充分溶解,检测各孔D570nm值,计算细胞的半数增殖抑制率(IC50)[9-11]。IC50=(A2-A0)/(A1-A0)×100%,式中,A0,药物处理前D570nm值;A1,对照组D570nm值;A2:药物处理48h后D570nm值。以药物浓度为横坐标,细胞相对存活率为纵坐标,绘制曲线。
1.5瑞氏—姬姆萨染色法观察黄藤素对EECs形态的影响
取1mL浓度为5×104个/mL的细胞悬液接种于12孔培养板,培养24h后弃去旧培养基,加入含黄藤素终浓度为0、100、200μg/mL的完全培养液1mL,每个浓度设置4个复孔。继续培养48h后收集细胞(1 200r/min离心5min),加入500μL的无菌PBS重悬细胞,涂片,晾干,放入预冷的甲醇溶液中固定15~30min。接着滴加2~3瑞氏染液,染色2~3min后滴加等量的姬姆萨染液,染色10min。每张涂片计数100个细胞,于显微镜下观察细胞形态[12-14]。
1.6EECs细胞膜完整性的检测
取0.5mL浓度约为5×104个/mL的细胞悬液接种于24孔培养板,培养24h后,弃去旧培养基。分别加入含黄藤素终浓度为20、60、100、150、200、250、300、350μg/mL的完全培养液0.5mL,每组设3个重复孔。继续培养48h后收集细胞上清液,6 600r/min离心10min,严格按照LDH检测试剂盒说明书检测各组上清液中LDH的含量。
1.7数据分析
应用SAS 9.30软件分析数据,采用单因素方差分析进行统计分析,结果以平均值±标准差表示,Excel绘图软件进行绘图。
2 结果与分析
2.1黄藤素对EECs的增殖影响
由图1可知,当黄藤素的浓度处在10~227μg/mL时,对EECs有促增殖的作用。当黄藤素浓度在10~100μg/mL时,随着药物浓度的增加促增殖作用越明显,浓度达到100μg/mL时促增殖作用最大,且黄藤素浓度与细胞增殖率之间呈线性关系(y=0.0056x+1.3492,R2=0.9729);当黄藤素浓度在100~227μg/mL时,随着药物浓度的增加促增殖作用减弱,且黄藤素浓度与细胞增殖率之间也呈线性关系(y=-0.007x+2.5916,R2=0.9959);由图2可知,当浓度大于227μg/mL时出现细胞增殖抑制现象,且黄藤素的浓度与细胞增殖抑制率之间呈线性关系(y=-0.0017x+1.113,R2=0.9688);由此可计算,当细胞的增殖抑制率为50%时(IC50)黄藤素的作用浓度为360μg/mL。
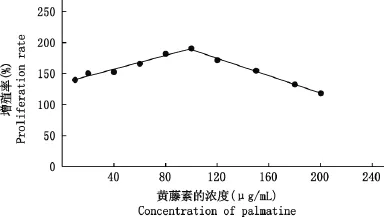
图1 0~227μg/mL黄藤素对EECs的促增殖作用Fig.1 Proliferation effect of palmatine on EECs at 0to 227μg/mL assayed by MTT

图2 227~600μg/mL黄藤素对EECs的增值抑制作用Fig.2 Proliferation inhibitory effect of palmatine on EECs at 227to 600μg/mL assayed by MTT
2.2黄藤素对EECs的细胞形态影响
正常的山羊EECs多数为梭形,少数呈三角形,核圆居中,培养24h后,细胞交织成网状。细胞贴壁良好,体积较大,折光性好,形态大小均匀一致(图3A);经100μg/mL黄藤素处理48h后,EECs的密度明显增大,且倒置显微镜下观察细胞生长状态良好(图3B);当黄藤素浓度达到200μg/mL时,作用相同时间内细胞的增殖密度低于100μg/mL黄藤素处理组,细胞间隙增大,细胞间存在少许细胞碎片,但细胞结构没有明显变化(图3C)。

图3 不同浓度黄藤素作用48h后对EECs生长状态的影响(大图100×;小图400×)Fig.3 The growth state of EECs treated with palmatine for 48h(big figure,100×;small figure,400×)
2.3黄藤素对EECs细胞核形态的影响
染色结果显示正常组和经100、200μg/mL的黄藤素作用48h的细胞胞质和胞核界限清晰,胞核完整,胞浆均匀,细胞边缘完整,视野内未出现死亡细胞及形态异常的细胞(图4)。

图4 不同浓度黄藤素作用48h后对EECs形态的影响(大图100×;小图400×)Fig.4 Morphology of EECs treated with palmatine for 48h(big figure,100×;small figure,400×)
2.4黄藤素对EECs细胞膜完整性的影响
由图5可知,与对照组相比,当黄藤素的浓度大于250μg/mL时细胞培养液中LDH的含量极显著升高(P<0.01);100μg/mL的黄藤素作用EECs后培养液中LDH的含量极显著低于正常细胞组(P<0.01);20、60、150、200μg/mL的黄藤素作用细胞后与正常细胞组相比LDH含量无显著差异(P>0.05)。

图5 不同浓度的黄藤素对EECs中LDH释放量的影响Fig.5 Effect of different concentration of palmatine on LDH release from EECs
3 讨 论
兰世平等[15]研究表明,黄藤素可能通过抑制NF-κB的活化下调支气管哮喘急性发作期患者的炎症水平。李馨雅[16]通过临床试验研究证实,与单纯西药治疗相比,黄藤素对治疗人慢性子宫内膜炎有明显作用。研究表明,黄藤素在临床上主要用于妇科盆腔炎、霉毒性阴道炎、宫颈糜烂与泌尿道感染等疾病的治疗[17-18]。广大科研人员在黄藤素提取工艺、人工合成技术、定量检测技术、药理作用等领域开展了深入研究,也取得了大量的研究成果。但黄藤素临床应用相对滞后,特别是在兽医临床上的应用鲜有报道[19]。研究黄藤素对细胞的毒性作用是阐明其临床用药安全性的前提条件。且研究表明,通过阴道给药治疗妇科炎症具有可避免口服给药的首关效应和血药浓度的谷峰现象,避免药物对于胃肠道的刺激、注射给药的疼痛与心理恐惧,通过“子宫首关效应”能够将药物靶向传递到子宫内膜组织[20],因此,生物利用度高、药效显著[21]。本试验开展黄藤素对子宫内膜上皮细胞体外的毒性研究,旨在为黄藤素治疗奶牛等经济动物子宫内膜炎的临床应用提供理论依据。
活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为难溶性的蓝紫色结晶物甲臜,并沉积在细胞中,而死细胞无此功能。甲臜被溶解后所测得的光密度值越小,说明细胞存活率越低[22-23]。本研究中MTT的结果表明,黄藤素对EECs增殖的促进或抑制作用与其浓度成一定的关系,在低于360μg/mL的剂量范围内对EECs无显著毒性作用。LDH是活细胞胞质内广泛存在的酶,正常情况下LDH不能透过细胞膜,但当细胞膜受损或细胞死亡导致细胞膜通透性改变时,则会释放到培养液中,释放的LDH与细胞膜的损伤程度或细胞死亡数成正比[24]。检测培养液中LDH含量可判断细胞膜的受损程度。本研究结果显示,当黄藤素浓度大于250μg/mL时细胞释放的LDH含量极显著升高,说明该剂量的黄藤素可引起细胞膜通透性显著增大,这可能与药物被细胞转运吸收相关联,但其具体机制有待进一步研究;250~360μg/mL的黄藤素虽然没有显著的细胞毒性,但对细胞活力和膜通透性有显著影响。此外,细胞生长状态和瑞氏—姬姆萨染色结果显示,200μg/mL的黄藤素对细胞形态与结构无明显影响,表明黄藤素的剂量在250μg/mL以内时,对细胞活力、细胞膜通透性和形态结构均无显著影响。
4 结 论
黄藤素对山羊子宫内膜上皮细胞的安全剂量为≤250μg/mL,该剂量范围内药物对细胞活力和形态结构无显著影响;大于该剂量的黄藤素可显著增大子宫内膜上皮细胞的膜通透性,产生细胞毒性作用。本试验结果可为黄藤素治疗奶牛等经济动物的子宫内膜炎临床应用提供一定参考依据。
参考文献:
[1] 杨小良,谢丽莎,龚志强.黄藤素的研究综述[J].中国医药指南,2009,7(17):42-44.
[2] 陈荣华,傅胜才.黄藤素的研制与应用文献综述[J].湖南畜牧兽医,2014,6:5-7.
[3] Bhadra K,Maiti M,Kumar G S.Molecular recognition of DNA by small molecules:AT base pair specific intercalative binding of cytotoxic plant alkaloid palmatine[J].BiochimBiophysActa,2007,1770(7):1071-1080.
[4] Madoz L V,Giuliodori M J,Jaureguiberry M,et al.The relationship between endometrial cytology during estrous cycle and cutoff points for the diagnosis of subclinical endometritis in grazing dairy cows[J].J DairySci,2013,96(7):4333-4339.
[5] Polat B,Cengiz M,Cannazik O,et al.Endometrial echotexture variables in postpartum cows with subclinical endometritis[J].AnimReprodSci,2015,155:50-55.
[6] 牛国一,王秋举,李珊珊,等.厚朴酚和黄藤素对鱼类3种常见致病菌的抑制效应[J].云南农业大学学报,2015,30(3):402-407.
[7] 吴春艳,张 艳,史 伟,等.黄藤素片治疗急性上呼吸道感染临床观察[J].中国医药导报,2009,6(5):168.
[8] 要瑞丽.黄藤素口服液新兽药的研制与开发[J].中国动物保健,2013,15(5):28-30.
[9] 杨 洋,吴国娟,李培峰,等.脂质体瞬时转染siRNA抑制肾小管上皮细胞去乙酰化蛋白酶1的表达[J].中国畜牧兽医,2012,39(8):4-9.
[10] 赵世云,赵新新,苏华荔,等.猪外周血T淋巴细胞增殖反应MTT检测方法的建立[J].中国畜牧兽医,2010,37(12):35-38.
[11] Ding L,Liu B,Qi L,et al.Anti-proliferation,cell cycle arrest and apoptosis induced by a natural xanthone fromGentianopsispaludosa Ma,in human promyelocytic leukemia cell line HL-60cells[J].Toxicology inVitro,2009,23(3):408-417.
[12] 何 珊.半边莲生物碱对白血病细胞抑制作用的初步研究[D].福州:福建师范大学,2013.
[13] 刘新利.NF-κB抑制剂和JNK抑制剂对白血病细胞的协同杀伤作用[D].上海:上海师范大学,2014.
[14] 孟 凡,靳宏辉.采用析因设计研究瑞氏-吉姆萨染色法的影响因素[J].医疗卫生装备,2015,36(8):124-126.
[15] 兰世平,叶春燕,王导新,等.黄藤素辅助治疗对支气管哮喘急性发作期患者炎症状态和肺功能的影响[J].西部医学,2015,27(4):496-498.
[16] 李馨雅.黄藤素胶囊治疗慢性子宫内膜炎的临床观察[J].中国实用医药,2015,10(1):156-157.
[17] 张秀军,任 松,陈月花,等.黄藤素序贯联合运动疗法治疗反复发作盆腔炎效果分析[J].海南医学学报,2015,21(3):418-420.
[18] 刘自强.黄藤素对宫腔镜检查感染的预防作用[J].中华实用诊断与治疗杂志,2012,26(8):821-822.
[19] 赵 武,陈荣宝,刘 伟,等.黄藤素研究进展[J].中国畜牧兽医,2015,41(5):267-270.
[20] Cicibelli E,de Ziegle R D,Buletti C,et al.Directtransport of progesterone from vagina to uterus[J].ObstetGynecol,2000,95(3):403-406.
[21] 李伟泽,付丽娜,赵 宁,等.黄藤素柔性纳米脂质体的制备及体外透黏膜给药研究[J].中国药学杂志,2015,50(24):2139-2145.
[22] Angius F,Floris A.Liposomes and MTT cell viability assay:An incompatible affair[J].Toxicologyin Vitro,2015,29(2):314-319.
[23] Stockert J C,Blázquez-Castro A,Cañete M,et al.MTT assay for cell viability:Intracellular localization of the formazan product is in lipid droplets[J].Acta Histochemica,2012,114(8):785-796.
[24] 彭仕琪.碘氧铋纳米材料对人类皮肤角质细胞的毒性研究[D].太原:太原理工大学,2015.
(责任编辑 姚倩倩)
中图分类号:R282.71
文献标识码:A
文章编号:1671-7236(2016)12-3239-06
doi:10.16431/j.cnki.1671-7236.2016.12.023
收稿日期:2016-05-31
基金项目:"十二五"国家科技支撑计划重点课题(2012BAD12B03);中国农业科学院科技创新工程项目(CAAS-ASTIP-2014-LIHPS-03);甘肃省自然科学基金(1506RJYA146)
作者简介:闫宝琪(1991-),女,内蒙古赤峰人,硕士,研究方向:奶牛疾病,E-mail:m15624955865@163.com
通信作者:*张世栋(1983-),男,甘肃张掖人,博士,助理研究员,研究方向:细胞生物学与药理学,E-mail:zhangshidong@caas.cn严作廷(1962-),男,甘肃武威人,副研究员,研究方向:兽医诊断与药物研发,E-mail:yanzuoting@caas.cn
The Study on the Cytotoxicity of Palmatine on Goat Endometrial Epithelial Cellsinvitro
YAN Bao-qi1,DONG Shu-wei1,WANG Dong-sheng1,NA Li-dong1,2,SANG Meng-qi1,YANG Hong-zao1,2,ZHANG Shi-dong1*,YAN Zuo-ting1*
(1.Engineering&TechnologyResearchCenterofTraditionalChineseVeterinaryMedicineofGansuProvince,LanzhouInstituteofAnimalHusbandryandPharmaceuticalSciences,ChineseAcademyof AgriculturalSciences,Lanzhou730050,China;2.CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
Abstract:To explore the cytotoxicity of palmatineinvitro,goat endometrial epithelial cells(EECs)were stimulated by different concentrations of palmatine,then the growth curve of cell was drew by MTT assay which could detect the cell proliferation.The cell growth state was observed by inverted microscope,and Wright-Giemsa staining was used to observe morphological changes of the cells while LDH test was used to check the membrane permeability of EECs.The results showed that when the concentration was 10to 227μg/mL,palmatine had a role in promoting proliferation of the EECs,while when the concentration was more than 227μg/mL,cell proliferation was inhibited,and 50%inhibitory rate of proliferation(IC50)of this drug on EECs was 360μg/mL.Wright-Giemsa staining results showed that themorphology of the nucleus and cytolymph were not significantly changed when 100and 200μg/mL palmatine effected EECs.LDH results showed that when the palmatine concentration was more than 250μg/mL,LDH content was extremely significantly higher than that of normal cell group(P<0.01).In conclusion,palma-tine presented certain toxic effect on EECs with a significant dose-response effect,and the safe dose range of palmatine was less than 250μg/mL.
Key words:palmatine;endometrial epithelial cells;cytotoxicity;membrane permeability

