新型鸭呼肠孤病毒σB蛋白的原核表达及其多克隆抗体制备
梅敏敏,梁国智,黄雯晶,李晓文,黄淑坚
(佛山科学技术学院生命科学学院,佛山528231)
新型鸭呼肠孤病毒σB蛋白的原核表达及其多克隆抗体制备
梅敏敏,梁国智,黄雯晶,李晓文,黄淑坚*
(佛山科学技术学院生命科学学院,佛山528231)
为制备新型鸭呼肠孤病毒(new-type duck reovirus,NDRV)XX株σB蛋白的多克隆抗体,试验经RT-PCR扩增NDRV XX株σB基因编码序列,构建原核表达质粒pET-32a(+)-σB,将其转化至大肠杆菌BL21(DE3)感受态细胞后,经IPTG诱导获得His-σB重组蛋白。SDS-PAGE显示成功表达出约55ku的融合蛋白,主要以包涵体形式存在,其表达时的最佳诱导时间、IPTG诱导浓度分别为3h和0.25mmol/L。经Ni2+柱亲和层析纯化获得可溶性重组蛋白,将蛋白经Western blotting和蛋白质谱鉴定为高纯度的σB重组蛋白,将纯化后σB重组蛋白按合理免疫程序免疫家兔,获得多抗隆抗体经Western blotting分析显示出特异性的反应。本试验结果为NDRVσB蛋白功能的深入研究及基因工程疫苗的研发奠定了基础。
新型鸭呼肠孤病毒;σB蛋白;原核表达;多克隆抗体
禽源呼肠孤病毒(avian reovirus,ARV)近年来已呈现出宿主多样性的特点,自然感染不仅局限于传统的鸡和火鸡,已经引起各种水禽不同程度的发病死亡,给养殖业的发展造成了巨大的经济损失[1]。番鸭呼肠孤病毒(muscovy duck reovirus,MDRV)能够引起番鸭产生番鸭呼肠孤病毒病(俗称“肝白点病”、“花肝病”等),死亡率为10%~50%。迄今为止,MDRV感染在南非、法国、以色列、意大利、德国和中国都有报道[2-4],其临床症状主要为软脚,病理变化主要为肝脏、脾脏表面有多量白色坏死点,无肝脏出血病变[5-8]。自2005年冬季以来,福建、浙江等省雏番鸭、雏半番鸭、麻鸭群中发生一种新的重大疫病,俗称“鸭新肝病”、“鸭坏死性肝炎”,发病率5%~32.5%,病死率差异较大,为4%~20%,但鸭日龄愈小,发病率、病死率愈高。最近研究表明,该病原体是一种新型鸭呼肠孤病毒(new-type duck reovirus,NDRV),该病引起的主要病变为肝脏不同程度点/斑块状出血和坏死、脾脏肿大坏死、心脏和法氏囊出血等,然而病鸭不软脚[7-8]。
NDRV属于呼肠孤病毒科正呼肠孤病毒属。在负染电镜下,病毒粒子呈球形、正二十面体立体对称、无囊膜、双层衣壳的dsRNA病毒[9]。与其他正呼肠孤病毒一样,NDRV病毒基因组的SDS-PAGE电泳图显示有10个RNA片段[9-10]。σB蛋白由S3基因编码(MDRV-89026和MDRV-89330由S2基因编码),为外衣壳的主要组分[10]。σB蛋白与鸭呼肠孤病毒(duck reovirus,DRV)的感染、致病性和免疫保护等方面相关,其携带群特异性中和抗原决定簇,能诱导细胞融合并产生群特异性中和抗体[1112]。σB可通过σC作用来提高感染细胞的能力,并在病毒的致病性上起着一定的作用[13]。
本研究拟对NDRV XX株的σB蛋白基因进行克隆,利用pET-32a(+)原核表达系统表达σB蛋白,并制备特异性的兔抗σB蛋白多克隆抗体,为研制σB蛋白相关疫苗提供依据,也为进一步研究σB蛋白的功能奠定基础。
1 材料与方法
1.1 病毒株、载体及试验动物
NDRV XX株于2011年采自于广东新兴某鸭场患鸭,由佛山科学技术学院预防兽医学实验室分离保存。大肠杆菌BL21(DE3)感受态细胞、原核表达载体pET-32a(+)均由华南农业大学兽医学院兽医微生物学研究室保存。5月龄健康雌性新西兰大白兔购自广东省医学实验动物中心。
1.2 主要试剂
Trizol Reagent、pMD18-T载体连接试剂盒、限制性内切酶KpnⅠ和SacⅠ、T4DNA连接酶、IPTG均购自TaKaRa公司;胶回收试剂盒、质粒提取试剂盒均购自Omega公司;一站式His标记蛋白纯化套装购自北京天恩泽基因科技有限公司;抗His标签鼠单克隆抗体、HRP标记的羊抗鼠IgG均购自北京康为公司;底物DAB、低分子质量蛋白标准均购自上海碧云天生物有限公司。
1.3 引物设计与合成
利用GenBank上已有的DRVσB蛋白基因序列(登录号:GQ888710)设计1对扩增σB蛋白基因完整编码区的特异性引物,引物序列为:S3F:5′-CGGGGTACCATGGAGGTGCGTGTGCCAAACTT-3′(下划线为KpnⅠ酶切位点);S3R:5′-CGAGCTCTTACCACCTACACTCCAGGAAGGAC-3′(下划线为SacⅠ酶切位点),预期扩增的片段大小为1 104bp。引物由上海英骏生物工程技术有限公司合成。
1.4 PCR扩增与表达载体的构建
用保存的病毒尿囊液采取传统法抽提总RNA,具体操作参见Trizol Reagent说明书。反转录按照Trizol Reverse Transcriptase M-MLV说明书进行。RT-PCR扩增σB完整编码区片段,PCR反应体系25μL:Primix ExTaqTM酶12.5μL,上、下游引物(10μmol/L)各1.0μL,cDNA模板2.0μL,ddH2O补足体系。PCR反应条件:94℃预变性4min;94℃变性30s,55℃退火45s,72℃延伸60s,30个循环;72℃延伸10min。取5μL PCR产物用1.0%琼脂糖凝胶电泳检测。
表达载体pET-32a(+)经KpnⅠ和SacⅠ双酶切的产物用1.0%琼脂糖凝胶电泳检测,胶回收的酶切产物与σB基因片段,按照T4DNA连接酶使用说明书,16℃连接过夜,连接体系为:pET-32a(+)1.0μL,Ligase Buffer 2.0μL,目的基因片段5.0μL,T4DNA连接酶1.0μL。取5μL连接产物转化大肠杆菌BL21(DE3)感受态细胞,挑取白色单克隆菌落接种于含氨苄青霉素(Amp+)的LB液体培养基,37℃、200r/min培养6h。取菌液进行PCR鉴定后,用质粒提取试剂盒提取重组质粒,进行双酶切鉴定。将鉴定正确的重组质粒送至上海英骏生物技术有限公司(广州)测序。
1.5 重组蛋白的诱导表达
将重组质粒转化大肠杆菌BL21(DE3)感受态细胞,挑阳性单菌落扩大培养。将过夜菌液按1∶100接种新鲜LB培养基(Amp+),37℃、220r/min振荡培养至D600nm为0.6左右。取1.0mL菌液作未诱导的对照组,其余加终浓度为1.0mmol/L IPTG,继续培养4h后取1mL菌液以12 000r/min离心30s,收获菌体。用无菌去离子水将菌体吹散混匀,通过SDSPAGE电泳检测外源蛋白的表达情况。
1.6 重组蛋白的SDS-PAGE检测
分别取上述方法获得的样品10μL进行检测。分离胶浓度为12%,积层胶浓度为5%。将样品加入等量的2×SDS上样缓冲液,100℃加热3~5min,12 000r/min离心1min,取上清作SDS-PAGE分析。电泳后,经考马斯亮蓝染色,4~6h后脱色摄像,凝胶可保存于双蒸水或7%乙酸溶液中。
1.7 诱导表达条件的优化
诱导时间的优化:按照上述诱导表达的步骤进行,分别加IPTG至终浓度为1.0mmol/L,然后37℃诱导培养0、1、2、3、4、5和6h,收集菌体,样品处理后经SDS-PAGE电泳检测蛋白表达情况。
IPTG诱导浓度的优化:按上述诱导表达的步骤在最佳时间诱导,分别加IPTG至终浓度为0、0.25、0.50、0.75、1.00、1.25和1.50mmol/L,然后37℃诱导培养3h,收集菌体,样品处理后经SDSPAGE电泳检测蛋白表达情况。
1.8 表达产物的鉴定
1.8.1 重组蛋白的Western bloting鉴定 将诱导表达的菌液处理经SDS-PAGE电泳后进行转膜,TBST洗膜后,转入含5%脱脂乳的TBST,4℃封闭过夜。弃封闭液,TBST洗膜后,转入1∶1 000稀释的抗His标签鼠单克隆抗体,室温平稳摇动2h。弃一抗,TBST洗膜后,再转入1∶5 000稀释的辣根过氧化物酶偶联的山羊抗小鼠IgG,室温平稳摇动1h,TBST洗膜后,加入DAB显色液,避光至出现条带即放入双蒸水中终止反应。
1.8.2 蛋白质谱鉴定 将诱导表达的菌液处理进行SDS-PAGE电泳,考马斯亮蓝染色与脱色后,切下目的条带送往苏州普泰生物技术有限公司进行Nano-LC-ESI-MS/MS蛋白质分析鉴定。
1.9 重组蛋白的可溶性分析和纯化
按最佳诱导条件大量诱导表达后,离心收集菌体,4℃、12 000r/min离心10min,PBS洗涤后,用原液10%体积的PBS重悬菌体于冰浴中进行超声波裂解,至菌液变清亮,4℃、12 000r/min离心20min,分别收集产物上清及沉淀进行SDSPAGE,对蛋白的可溶性进行分析。同时,收集最佳诱导条件的菌体,采用His标记蛋白纯化套装纯化重组蛋白。取上述纯化的融合蛋白置Millipore超滤管中浓缩,4 000r/min离心10min,20倍体积浓缩,使蛋白终浓度达到1mg/mL。
1.10 多克隆抗体的制备及鉴定
先后4次皮下多点注射免疫新西兰大白兔,免疫用量为500μL/只,首免取已纯化的蛋白加等量的完全弗氏佐剂,超声破碎仪乳化后免疫。14d后二免,纯化的蛋白与不完全弗氏佐剂等量乳化后免疫,以后每间隔7d加强免疫,均使用弗氏不完全佐剂,最后一次免疫后的14d,耳静脉采血收集血清。Western blotting检测血清抗体的特异性。
2 结果与分析
2.1 σB基因的扩增与重组表达质粒pET-32a(+)-σB的鉴定
PCR扩增得到NDRV XX株的σB基因,其大小约为1 104bp(图1),与预期结果相符。将构建的重组质粒用限制性内切酶KpnⅠ和SacⅠ进行双酶切,可见大小约为5 800和1 104bp的片段,与预期目的条带大小相符(图2)。测序结果与GenBank中公布的σB蛋白基因序列同源性达98.1%,进一步表明重组质粒构建成功。

图1 目的片段PCR扩增结果Fig.1 PCR amplification result of target fragment
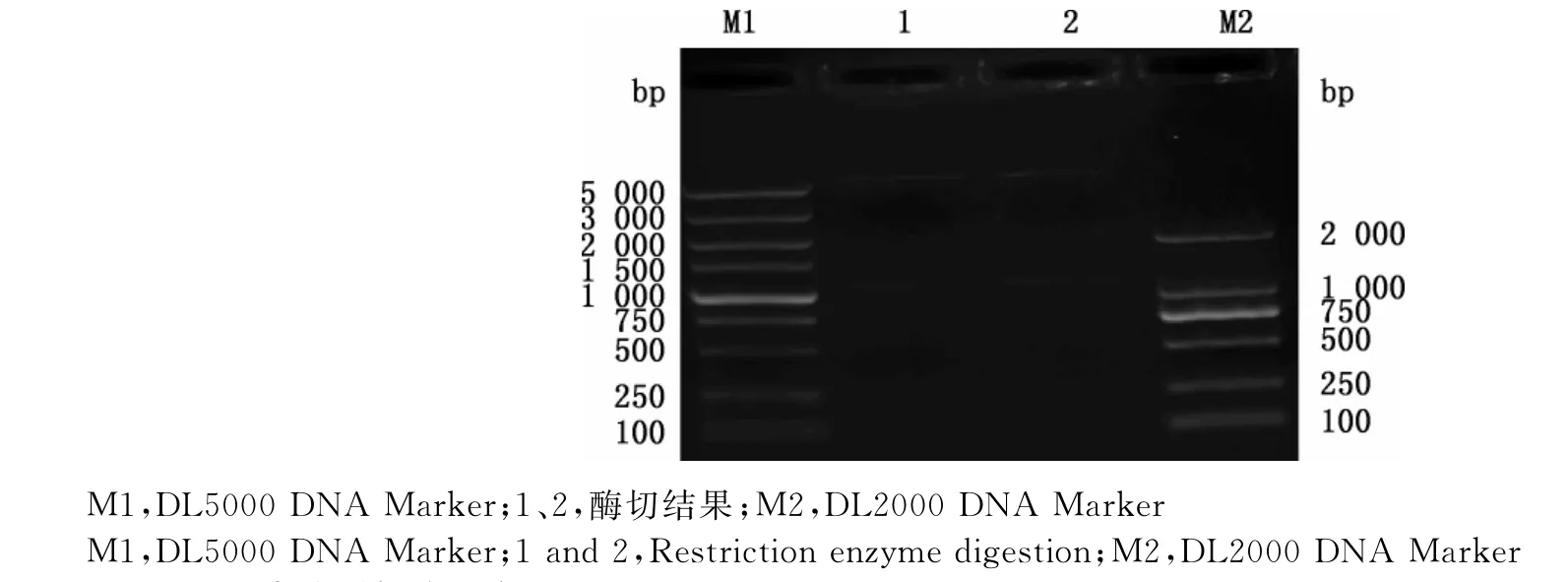
图2 重组表达质粒酶切产物Fig.2 Enzyme digestion products of the recombinant plasmid
2.2 表达产物的SDS-PAGE鉴定
2.2.1 重组蛋白的SDS-PAGE检测 重组表达质粒在宿主菌中诱导表达后,表达产物进行SDS-PAGE,结果可知表达产物在约55ku处出现一条目的条带,未诱导的重组质粒的表达产物在此处无条带出现(图3)。
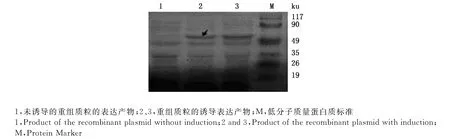
图3 重组表达质粒的表达产物的SDS-PAGE分析Fig.3 SDS-PAGE analysis products of the recombinant plasmid
2.2.2 诱导表达条件的优化 依单一变量原则分别对IPTG最佳诱导时间、诱导浓度进行优化。3h后蛋白表达量不再明显增加,确定最佳诱导时间为3h(图4)。不同浓度的IPTG表达量无明显差异(图5),考虑到经济和IPTG的细胞毒性,采用低浓度的IPTG(0.25mmol/L)即可。

图4 不同诱导时间下表达产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis products with different induction times

图5 不同IPTG诱导浓度下表达产物的SDS-PAGE分析Fig.5 SDS-PAGE analysis products with different inducer IPTG concentrations
2.3 蛋白质谱鉴定
表达产物SDS-PAGE电泳后,将目的蛋白条带切下进行蛋白质谱鉴定,经分析其对应于GenBank中公布的DRVσB蛋白氨基酸序列(图6),表明表达的蛋白为σB蛋白。

图6 σB蛋白质谱鉴定Fig.6 Protein mass spectrometry analysis of sigma B protein
2.4 重组蛋白的可溶性分析和纯化
在IPTG诱导浓度为0.25mmol/L,诱导时间为3h的条件下诱导表达菌液,分别收集超声破碎菌体的沉淀和上清进行SDS-PAGE电泳分析,结果可见表达的蛋白主要以不溶性包涵体形式存在,经蛋白纯化试剂盒纯化,获得了可溶性的重组蛋白(图7)。
2.5 重组蛋白σB和多克隆抗体的Western blotting鉴定
SDS-PAGE完毕后,将凝胶转移到PVDF膜上,经过Western blotting鉴定显示,重组蛋白σB可被抗His的单抗特异性识别,且分子质量符合预期大小(图8)。将制备的多克隆抗体经过Western blotting鉴定显示,多克隆抗体与重组蛋白σB有效结合,特异性较好(图9)。
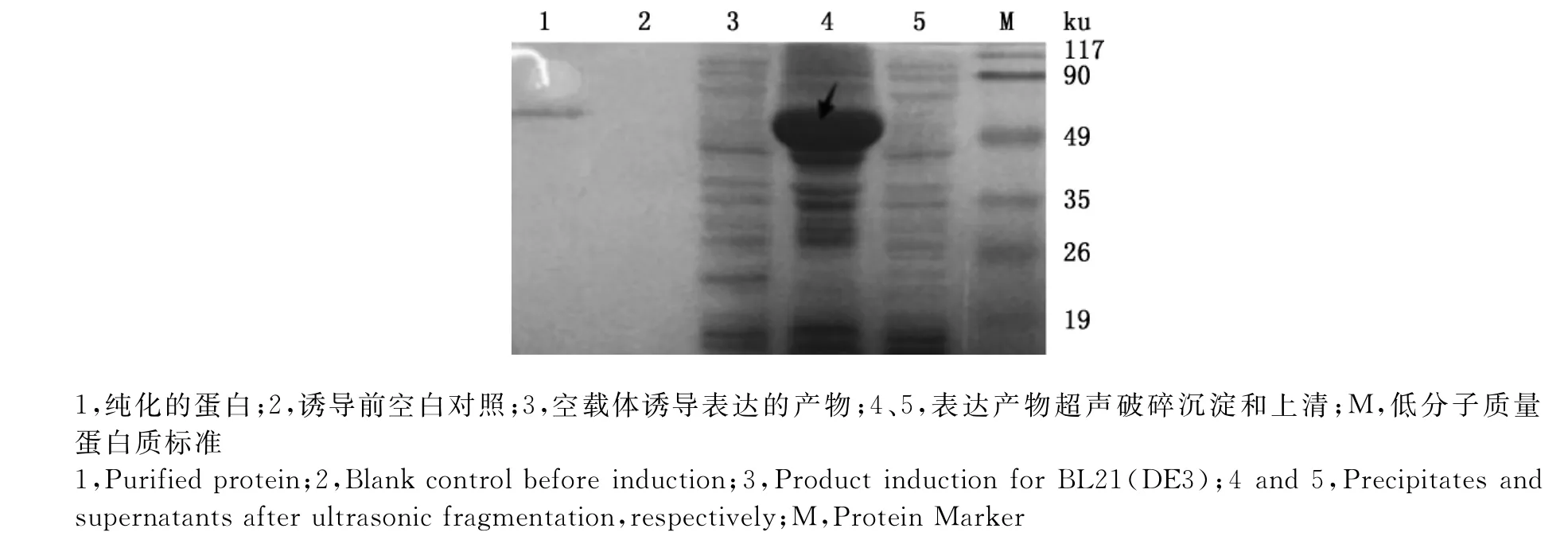
图7 重组蛋白的可溶性分析及纯化Fig.7 Purification and soluble analysis of the recombinant protein
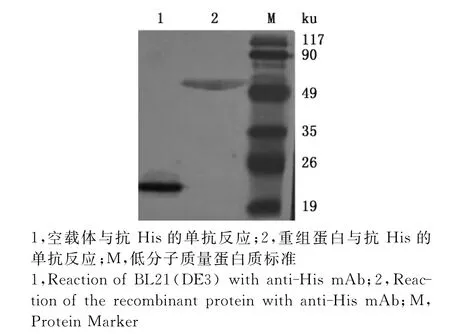
图8 重组蛋白Western blotting分析Fig.8 Western blotting analysis of the recombinant protein

图9 抗血清特异性检测Fig.9 Specificity detection of antiserum
3 讨 论
NDRV是近年来危害水禽健康的重要病原,流行趋势渐强。NDRV感染宿主后能损伤免疫器官,导致免疫抑制,往往继发其他病原的感染,给养鸭业带来巨大的经济损失,该病的宿主范围和致病性均强于DRV和MDRV。NDRVS3基因编码σB蛋白,σB蛋白为病毒外衣壳的重要组成部分,是重要的结构蛋白。目前,已经有许多学者对ARV和MDRV具有免疫原性的蛋白结构功能做了大量研究,王全溪[14]建立了检测DRV抗体的间接ELISA方法;孙陈莉[15]对σB蛋白进行了原核表达,并建立了间接ELISA方法;Yin等[16]制备了ARV的σB和σC蛋白的单克隆抗体,并对抗σB单克隆抗体鉴定了两个最小抗原线性表位;陈海鹏[17]、毕庄莉等[18]分别针对N-MDRV和NDRVσC重组蛋白构建了间接ELISA检测法;朱二鹏等[19]对MDRV的σNS蛋白进行原核表达并制备了多克隆抗体;但缺乏NDRVσB蛋白结构功能报道,如NDRVσB蛋白具体结构与功能是否与ARV和MDRV相似,是否也能诱导细胞产生型特异性中和抗体等。因此,NDRVσB蛋白结构与功能,尤其是免疫学上的功能值得深入研究。
大肠杆菌为常用的外源蛋白表达宿主,具有遗传背景清楚、载体受体系统完备、生长迅速、培养简单等优势,但也存在重组蛋白可溶性差、表达量低等不足。然而对特定蛋白的功能结构进行系统分析,需获得大量目的蛋白。由于来源成分复杂、理化性质不同及结构功能的多样性,表达蛋白的产量低及其纯化难一直是蛋白质结构研究中遇到的瓶颈问题,使得后续的结构分析和功能验证受到严重限制[20]。近年来,人们发现亲和标签与目标蛋白融合表达,可大大提高重组蛋白的产量,增强重组蛋白的可溶性,促进重组蛋白的正确折叠,而常用的亲和标签有His、GST、MBP、GBP等。
本试验将NDRV XX株的σB蛋白在含His标签的pET32a(+)表达载体中表达并转化大肠杆菌BL21(DE3)细胞,在构建原核表达载体的基础上,构建了有效的蛋白原核表达系统,对表达的重组σB蛋白再进行纯化、鉴定和多克隆抗体的制备。经IPTG的诱导表达高产量的目的蛋白,为后续的纯化提供有力的条件。而重组蛋白主要以包涵体形式存在,纯化方便。通过改变诱导剂IPTG的浓度对蛋白的表达产量影响甚微,这可能与σB基因中存在稀有密码子有关。将包涵体变性裂解后纯化蛋白,蛋白免疫印迹试验证明该蛋白具良好免疫原性,可用作诊断抗原或候选蛋白,纯化蛋白经免疫新西兰大白兔制备的抗σB蛋白的多克隆抗体特异性较好,为今后蛋白功能的深入研究及相关基因工程疫苗的研发奠定了基础。
4 结 论
本试验成功表达出约55ku的NDRVσB融合蛋白,主要以包涵体形式存在,其表达时的最佳诱导时间为3h,IPTG诱导浓度为0.25mmol/L。Ni2+柱亲和层析纯化后获得高纯度的σB重组蛋白。
[1] 马超英.禽肠孤病毒与禽白血病病毒双重RT-PCR检测方法的建立和应用[J].中国畜牧兽医,2013,40(2):53-56.
[2] Heffels-Redmann U,Muller H,Kaleta E F.Structural and biological characteristics of reoviruses isolated from Muscovy ducks(Cairinamoschata)[J].AvianPathology,1992,21(3):481-491.
[3] Malkinson M,Perk K,Weisman Y.Reovirus infection of young Muscovy ducks(Cairinamoschata)[J].AvianPathology,1981,10(4):433-440.
[4] Ni Y,Kemp M C.A comparative study of avian reovirus pathogenicity:Virus spread and replication and induction of lesions[J].AvianDiseases,1995,39(3):554-566.
[5] 袁远华,吴志新,黄兴国,等.新型鸭呼肠孤病毒病研究进展[J].养禽与禽病防治,2012,10:18-420.
[6] 卿柯香,袁远华,郭霄峰,等.NDRV和MDRV双重RT-PCR检测方法的建立[J].中国兽医杂志,2014,4:12-15.
[7] 陈少莺,陈仕龙,林锋强,等.一种新的鸭病(暂名鸭出血性坏死性肝炎)病原学研究初报[J].中国农学通报,2009,25(16):28-31.
[8] 袁远华,王俊峰,吴志新,等.1株番鸭源新型鸭呼肠孤病毒(QY株)生物学鉴定[J].中国兽医学报,2013,8:1174-1178.
[9] Wang S,Chen S L,Cheng X X,et al.Sequence and phylogenetic analysis of M-class genome segments of novel duck reovirus NP03[J].CanJVetRes,2015,79(2):147-150.
[10] Yun T,Yu B,Ni Z,et al.Genomic characteristics of a novel reovirus from Muscovy duckling in China[J].VetMicrobiol,2014,168(2-4):261-271.
[11] Chen Z L,Luo G F,Wang Q X,et al.Muscovy duck reovirus infection rapidly activates host innate immune signaling and induces an effective antiviral immune response involving critical interferons[J].Vet Microbiol,2014,175(2-4):232-243.
[12] Liu H J,Le L H,Hu H W,et al.Molecular evolution of avian reovirus:Evidence for genetic diversity and reassortment of the S-class genome segments and multiple cocirculating lineages[J].Virology,2003,314(1):336-349.
[13] Zhu Y Q,Li C F,Bi Z L,et al.Protective immune responses in ducklings induced by a suicidal DNA vaccine of the sigmaCgene of novel duck reovirus[J].VetImmunolImmunopathol,2015,165(1-2):88-92.
[14] 王全溪.番鸭呼肠孤病毒诊断技术研究[D].福州:福建农林大学,2004.
[15] 孙陈莉.检测致产蛋下降的鸭呼肠孤病毒抗原或抗体的ELISA方法的建立[D].扬州:扬州大学,2013.
[16] Yin C H,Qin L T,Sun M Y,et al.Antigenic analysis of monoclonal antibodies against different epitopes ofσB protein of avian reovirus[J].PLoSOne,2003,8(11):e81533.
[17] 陈海鹏.新型番鸭呼肠孤病毒σC蛋白抗体间接ELISA检测方法的建立及应用[D].泰安:山东农业大学,2014.
[18] 毕庄莉,朱英奇,陈宗艳,等.新型鸭呼肠孤病毒σC蛋白的原核表达及其多克隆抗体制备[J].浙江农业学报,2015,45(5):882-886.
[19] 朱二鹏,崔龙萍,吕小婷,等.番鸭呼肠孤病毒σNS蛋白的原核表达及其多克隆抗体的制备[J].中国兽医科学,2014,26(4):474-480.
[20] 陈爱春,彭 伟,汪生鹏.亲和标签在重组蛋白表达与纯化中的应用[J].中国生物工程杂志,2012,12:93-103.
(责任编辑 晋大鹏)
Prokaryotic Expression and Polyclonal Antibody Preparation ofσB Protein of New-type Duck Reovirus
MEI Min-min,LIANG Guo-zhi,HUANG Wen-jing,LI Xiao-wen,HUANG Shu-jian*
(CollegeofLifeScience,FoshanUniversity,Foshan528231,China)
To prepare polyclonal antibodies againstσB protein of new-type duck reovirus(NDRV)XX strain,the encoding sequence ofσBgene of NDRV XX strain was amplified by RT-PCR and successfully inserted to expression plasmid pET-32a(+),and transformed inEscherichiacoliBL21(DE3).The His-σB recombinant protein was achieved with IPTG induction.SDS-PAGE result showed that the molecular weight of the expression on fusion protein was about 55ku,was major insoluble fractions.IPTG induced time and concentration were 3hand 0.25mmol/L,respectively.The solubleσB recombinant protein was highly purified which was purified using Ni2+affinity chromatography and verified by Western blotting and protein mass spectrometry.Then the polyclonal antibodies could be obtained from the rabbits which had immunized by the purifiedσB recombinant protein with the reasonable procedure.The Western blotting result showed that they had the specific reaction.The results built a foundation of the further study of the NDRVσB protein function and the research of genetic engineering vaccine.
new-type duck reovirus;σB protein;prokaryotic expression;polyclonal antibody
S852.65+9.4
A
1671-7236(2016)12-3149-07
10.16431/j.cnki.1671-7236.2016.12.010
2016-05-23
广东省家禽重大传染病控制技术研究(2012A020100001)
梅敏敏(1993-),女,湖南郴州人,硕士,研究方向:禽传染病学,E-mail:15899840301@163.com
*通信作者:黄淑坚(1966-),男,广东梅州人,博士,教授,研究方向:畜禽传染病学,E-mail:sjhuang.foshan@163.com

