CMC-TAT蛋白转导肽纳米载体体外转染效果评估
唐朝颖韩维举邓雄威王方园袁硕龙杨仕明吴南
1中国人民解放军总医院耳鼻咽喉头颈外科聋病教育部重点实验室(北京100853)
2中国科学院国家纳米科学中心(北京100190)
·基础研究·
CMC-TAT蛋白转导肽纳米载体体外转染效果评估
唐朝颖1韩维举1邓雄威2王方园1袁硕龙1杨仕明1吴南1
1中国人民解放军总医院耳鼻咽喉头颈外科聋病教育部重点实验室(北京100853)
2中国科学院国家纳米科学中心(北京100190)
目的构建羧甲基壳聚糖-TAT蛋白转导肽纳米载体(CTNs),探究CTNs介导miR96转染293细胞和耳蜗基底膜的效率及安全性,为miR96在内耳的功能研究奠定基础。方法应用羧甲基化的壳聚糖(CMC)与TAT蛋白转导肽合成CTNs,携带标记花青染料荧光(cy3)的miR96模拟物(miR96 mimics),转染293细胞和耳蜗基底膜,利用激光共聚焦荧光显微镜对293细胞和耳蜗基底膜铺片进行荧光阳性细胞计数,以阳离子脂质体作为对照,评价转染效率,采用MTT试验评价CTNs的安全性。结果成功制备了CTNs,纳米颗粒平均直径约186.6nm,粒径分布集中,无明显聚集现象;CTNs-miR96-cy3转染293细胞的平均阳性细胞率为32.6%,转染耳蜗基底膜毛细胞的平均阳性细胞率为24.4%,均低于阳离子脂质体-miR96-cy3;MTT试验示CTNs细胞毒性低于阳离子脂质体。结论CTNs作为一种新型的纳米载体,可携带miR96成功转染耳蜗基底膜,提示了纳米载体作为miRNA载体的可行性,并且安全性较高,但转染效率不足。
羧甲基壳聚糖-TAT蛋白转导肽纳米载体;miRNA;miR96;内耳转染
National High-tech R&D Program of China for Young Scientists(2014AA020510),National Natural Science Foundation of China (81470683),Innovation and drive power engineering project of China association for science and technology(2016CXQD01),National Basic Research Program of China(973 Program)(2012CB967900,It's Branch programs 2012CB967901,2012CB967903).
Declaration of interest:The authors report no conflicts of interest.
随着基因技术的发展,研究发现多种miRNA在小鼠耳蜗中高表达,其中miR96被证实与耳蜗毛细胞的分化、发育及人类听力损失密切相关[1-5]。选择合适的载体将miR96递送至内耳是实现其外源性干预的关键。最常用的载体为病毒载体和非病毒载体。病毒载体有诱发免疫反应、潜在致癌等风险,使其体内应用受限。近年来,非病毒载体逐渐成为研究热点,其中,纳米载体以其无免疫原性、可生物降解性及生物相容性等优势,成为较理想的miRNA载体。
羧甲基壳聚糖-TAT蛋白转导肽纳米载体(CTNs),是由羧甲基化的壳聚糖(CMC)与TAT蛋白转导肽通过自组装方式合成的纳米颗粒[6]。CMC具有良好的生物相容性及几乎无毒性,产物无毒、可被生物体吸收,且可溶于水的聚合材料[7-8]。TAT蛋白转导肽是人类免疫缺陷病毒1型编码的带正电荷多肽,能够转导不同的外源生物大分子通过生物膜和生理屏障,达到高转染率[9-10]。尽管CTNs已成功用于miRNA转染肿瘤细胞,并能够实现相应的功能调控[6],但其用于内耳递送miRNA研究未见报道。本研究以乳鼠耳蜗基底膜为研究对象,以CTNs为miR96载体,评价标记花青染料荧光(cy3)的miR96 mimics的转染效率,探索非病毒载体携带miR96内耳转染的可行性并为其在耳聋基因治疗研究中的应用奠定基础。
1 材料与方法
1.1 293细胞培养
293细胞(解放军总医院泌尿外科实验室)是一种贴壁生长细胞,将293细胞置于含10%胎牛血清(FBS,Gibco)的DMEM培养基(Gibco)中,于37℃、5% CO2条件的培养箱中培养。每日换液,细胞生长融合约80%时可传代。
1.2 耳蜗基底膜培养
将出生3天的乳鼠(军事医学科学院)消毒,显微镜下于L-15培养液(Gibco)中剥离耳蜗基底膜;将离体基底膜转移至10ul DMEM/F-12培养液(Gibco)中,铺平;将平铺的基底膜放入37℃、5%CO2条件下的培养箱5分钟,至基底膜完全吸附在培养皿玻底上,加入2mL DMEM/F-12培养液,于37℃、5%CO2条件下的培养箱培养,每日换液。
1.3 CTNs-miR96-cy3复合物的制备和表征
①CTNs-miR96-cy3复合物的制备(国家纳米科学中心)将0.02mg miR96 mimics(广州锐博生物科技有限公司)溶于100uL去核酸酶水中,与1mL 1.5mg/mL羧甲基壳聚糖水溶液混合;将1mL 1mg/mL的TAT蛋白转导肽水溶液逐滴加入1mL浓度不等(0.25-4.0mg/mL)的miR96/羧甲基壳聚糖水溶液中,室温下磁力搅拌器搅拌,室温孵育20分钟,纳米复合物形成后,溶液变浑浊,将2mL混合物移至微量离心管中,离心(12000g)10分钟将纳米颗粒收集于管底;弃去上层液体,将纳米颗粒重悬于去核酸酶水中,备用。
②CTNs-miR96-cy3复合物表征测定 应用激光粒度仪(Malvern Instruments Ltd,Malvern,UK)测定纳米颗粒直径大小及Zeta电位。取1mL CTNs-miR96-cy3复合物水溶液样品,在室温25℃,633nm激光波长,恒定温度90o条件下测定,每个样品重复3次。用透射电子显微镜以200KV激发电压观察样品形态[6]。
1.4 293细胞的转染
将处于对数生长期的293细胞消化,传代于玻底24孔板中,接种密度约为3×105个,每孔加入无血清的DMEM培养基0.5mL,培养至细胞长满约70%左右,备转染。设对照组、阳离子脂质体-miR96-cy3复合物组、CTNs-miR96-cy3复合物组(miR96转染浓度为150nM)。阳离子脂质体-miR96-cy3复合物制备方法参照LipofectamineTM3000(invitrogen)转染试剂说明书,转染后于37℃、5%CO2条件下的培养箱中培养8小时,用4%多聚甲醛溶液固定细胞10分钟,免疫组化备用。激光共聚焦显微镜(Carl Zeiss)下,采用计数的方式,取5个视野每100个细胞分别计数cy3荧光阳性细胞数,计算阳性率。
1.5 耳蜗基底膜的转染
耳蜗基底膜培养24小时,有成纤维细胞生长,无污染的情况下可进行转染。设对照组、阳离子脂质体-miR96-cy3复合物组、CTNs-miR96-cy3复合物组(miR96转染浓度为150nM)。转染后于37℃、5%CO2条件下的培养箱中培养8小时,用4%多聚甲醛溶液固定细胞2小时,免疫组化备用。计数方法同293细胞,计数耳蜗基底膜毛细胞。
1.6 293细胞/耳蜗基底膜的免疫组化染色
固定过的293细胞/耳蜗基底膜,磷酸盐缓冲液(PBS)冲洗3遍;用0.25%TritonX-100溶液透膜,15分钟后PBS冲洗3遍;加入100nM鬼笔环肽(cytoskel⁃eton)工作液200ul,避光染色30分钟后PBS冲液冲洗3遍;加入适量DAPI(雷根生物技术有限公司)工作液,染色10分钟,PBS冲洗3遍;加入适量PBS,至覆盖293细胞/耳蜗基底膜,激光共聚焦显微镜观察cy3荧光情况。
1.7 MTT细胞毒性试验
将处于对数生长期的293细胞传代于96孔板,每孔3×103个细胞,培养24小时。阳性对照组和实验组加入运载150nM miR96的阳离子脂质体和CTNs空载体,设空白对照组,每组重复6孔,37℃、5%CO2条件下的培养箱中培养24小时后,向每孔加入10微升MTT溶液(5mg/ml,碧云天生物技术研究所),继续培养4小时。每孔加100微升Formanzan溶解液,继续孵育。至显微镜下观察formazan全部溶解。于570nm测定光密度值(OD),OD值越大表示细胞毒性越小。
1.8 统计学方法
实验数据采用SPSS 17.0进行统计分析,以均数±标准差(±s)表示。转染效率的研究,计算阳离子脂质体、CTNs转染293细胞和耳蜗基底膜的阳性率,数据采用独立样本t检验。载体安全性方面研究,对阳离子脂质体、CTNs、对照组进行MTT试验,对OD值进行独立样本t检验,P<0.05差异有统计学意义。
2 结果
2.1 CTNs的表征
将CMC和TAT按1.5mg/1mg(1.5:1)质量比混合后,可获得粒径大小约为186.6nm,zeta电位为-30.9mV的纳米颗粒。电镜示纳米颗粒外观呈均一球形,分散均匀,无明显聚集现象,动态散射光下粒径分布集中,如图1所示。电镜下及动态光散射测得CTNs-miR96-cy3复合物的直径和表面电荷与CTNs无明显差别,说明纳米颗粒包封miR96不会改变纳米颗粒的理化特性。
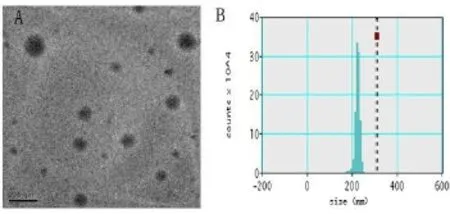
图1 CTNs的表征Fig.1 Characterization of CTNsA:纳米颗粒的透射电镜图 B:纳米颗粒的粒径分布图A:TEM image of CTNs B:Particle size distribution of CTNs
2.2 阳离子脂质体-miR96-cy3复合物与CTNS-miR 96-cy3复合物体外转染293细胞荧光观察
如图2,阳离子脂质体-miR96-cy3复合物组和CTNs-miR96-cy3复合物组293细胞内均可见cy3红色荧光,阳离子脂质体-miR96-cy3复合物组胞质内荧光较强,呈点状分布于胞核周围,两组细胞形态良好,对照组胞质内未见红色荧光。阳离子脂质体-miR96-cy3复合物组和CTNs-miR96-cy3复合物组平均阳性细胞率分别为87.4±1.82%、32.6±2.97% (见表1),差异具有统计学意义(t=-31.19,P=0.000)。
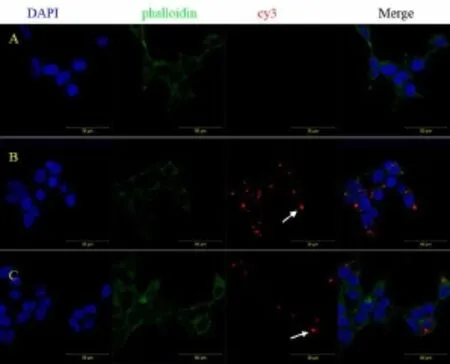
图2 不同载体转染293细胞的荧光情况 箭头示293细胞中miR96-cy3红色荧光(60)Fig.2 Red fluorescence in 293 cells of different carriers White arrows show the red fluorescence of miR96-cy3 in 293 cells(60)A:对照组 B:阳离子脂质体-miR96-cy3复合物组 C:CTNs-miR96-cy3复合物组A:Control group B:Lipofectamine--miR96-cy3 complexes group C:CTNs-miR96-cy3 complexes group
2.3 阳离子脂质体-miR96-cy3复合物与CTNs-miR 96-cy3复合物体外转染耳蜗基底膜荧光观察
如图3,阳离子脂质体-miR96-cy3复合物组和CTNs-miR96-cy3复合物组耳蜗基底膜均可见cy3红色荧光,阳离子脂质体-miR96-cy3复合物组荧光较强,两组荧光在内耳毛细胞内呈均匀分布,在内毛细胞中荧光略增强,两组基底膜形态良好,对照组胞质内未见红色荧光。毛细胞中,阳离子脂质体-miR96-cy3复合物组和CTNs-miR96-cy3复合物组平均阳性细胞率分别为56.6±2.70%、24.4±1.82%(见表1),差异具有统计学意义(t=22.12,P=0.000)。
表1阳离子脂质体和CTNs转染不同细胞的转染效率比较(**P<0.01)
Table1 Comparasion of miR96 mimics transduction efficiency between lipofectamine and CTNs(±s,%) Cell style 293 cells Hair cells
Carrier Lipofectamine 87.4±1.82% 56.6±2.70% CTNs
32.6 ±2.97%**
24.4 ±1.82%**
2.4 阳离子脂质体与CTNs的安全性评估
MTT试验测定阳离子脂质体与CTNs的安全性,以OD值作为评估标准。如图4,对照组、阳离子脂质体和CTNs三组的平均OD值为1.334±0.092、1.095± 0.017、1.227±0.071。CTNs组OD值高于阳离子脂质体组(t=-4.436,P=0.005),空白对照组OD值高于阳离子脂质体组(t=6.297,P=0.001)。
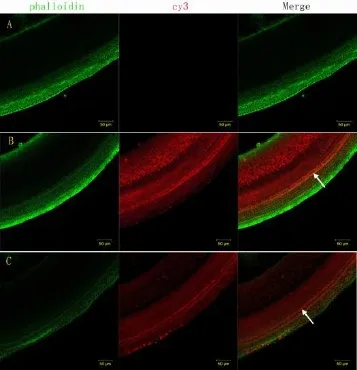
图3 不同载体转染耳蜗基底膜的荧光情况 箭头示毛细胞中miR96-cy3红色荧光Fig.3 Red fluorescence in cochlear basilar membrane of different carriers White arrows show the red fluorescence of miR96-cy3 in hair cellsA:对照组 B:阳离子脂质体-miR96-cy3复合物组 C:CTNs-miR96-cy3复合物组A:Control group B:Lipofectamine--miR96-cy3 complexes group C:CTNs-miR96-cy3 complexes group
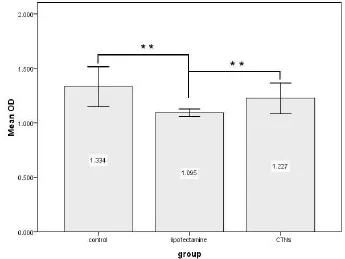
图4 MTT试验测定阳离子脂质体与CTNs的细胞毒性,**P<0.01Fig.4 Comparasion of cytotoxicity between lipofectanmine and CTNs by MTT assay**P<0.01
3 讨论
miRNA是一种长度约21个核苷酸的非编码序列,抑制mRNA翻译或断裂靶mRNA,抑制基因表达[11]。miRNA是一种至关重要的转录后调控因子,在哺乳动物中,调控约30%的蛋白编码基因,几乎参与所有细胞的增殖、分化、生长发育等过程[12]。miR96的突变可能与人类渐进性非综合征性感音神经性耳聋有关[3-4]。因此,通过miRNA外源干预技术调控miR96可能为治疗感音神经性耳聋的突破点,本研究选用的miR96 mimics与天然成熟miRNA作用方式相同,具有相同的抑制基因表达的作用[13],miRNA不稳定的特性及耳蜗的特殊解剖结构,为其高效靶向性的进入耳蜗作用部位增加了难度。
纳米材料做为载体递送基因或药物以广泛应用于生物医学领域,但应用纳米载体向内耳递送miRNA仍处于初级阶段。TAT蛋白转导肽是一种带有正电荷的细胞膜穿透肽,通过共价结合或静电作用结合核酸,可以通过几乎所有磷脂双分子层,但TAT蛋白转导肽通过内吞作用介导的基因跨膜转导基因调控效率较低,可能与其无法内含体逃逸有关,并且易被体内蛋白酶降解,因此体内应用效率低[6]。羧甲基壳聚糖是一种壳聚糖羧衍生物,通过在-OH基团导入-CH2COOH基团,形成衍生物羧甲基壳聚糖,具有良好的水溶性[7]。将羧甲基壳聚糖与TAT蛋白转导肽通过自组装的方法合成的纳米颗粒,作为miRNA载体转染率高,并且可在血液循环中稳定存在[6,14]。本研究成功制备了直径约为186.6nm的CTNs,呈均一球形,分散均匀,无明显聚集现象,符合纳米载体转染细胞的最佳粒径条件,稳定性好,可避免被免疫系统识别、吞噬。
本研究中用阳离子脂质体作为对照评价CTNs作为miR96载体的转染率和安全性。本研究结果显示CTNs作为miR96载体的体外转染效率明显低于阳离子脂质体,可能与TAT蛋白转导肽结合壳聚糖后,导致其理化特性和表面电荷改变有关。TAT可以无选择性的高效通过所有生物膜,包括血脑屏障[10],TAT结合壳聚糖对TAT的暴露程度影响较大,暴露差导致其转导活性降低。有研究证实,适当长度的生物大分子与TAT结合,可是使TAT暴露程度达到最佳,从而高效的介导生物大分子进入细胞[15]。另外,与生物大分子结合的TAT的密度对其跨膜转导效率有影响,但不能确定TAT密度与转导效率的量效关系[16]。将CMC和TAT按1.5mg/1mg(1.5:1)质量比混合,虽然可以获得较高的合成效率,但可能TAT的暴露不是适合于耳蜗感觉细胞的最佳比例或密度,因此,降低了复合物的转染率,应用于内耳转染的最佳比例仍需进一步优化。另外,TAT结合壳聚糖导致其表面正电荷的减少,影响其与带负电荷的细胞膜结合,从而降低其转导活性。关于CTNs的安全性方面,本研究示携带相同浓度miR96的CTNs的细胞毒性明显低于阳离子脂质体,细胞相容性良好,为CTNs的体内研究提供了基础依据。
综上所述,本研究以CTNs为载体携带miR96成功转染耳蜗基底膜,且细胞毒性较低,提示了CTNs作为miRNA载体的可行性。但其未来的应用仍需进一步优化构建条件以提高转染效率。另外,全身用药治疗耳蜗疾病的最大障碍是药物无法通过血-迷路屏障,TAT可介导外源性物质通过血-脑屏障,对其是否能介导跨血-迷路屏障转运的进一步研究,有可能为耳蜗疾病的治疗提供新的思路。
1 Weston M D,Pierce M L,Rocha-Sanchez S,et al.MicroRNA gene expression in the mouse inner ear[J].Brain Res,2006,1111(1): 95-104.
2 Li H,Kloosterman W,Fekete D M.MicroRNA-183 family members regulate sensorineural fates in the inner ear[J].J Neurosci,2010,30 (9):3254-3263.
3 Mencia A,Modamio-Hoybjor S,Redshaw N,et al.Mutations in the seed region of human miR-96 are responsible for nonsyndromic pro⁃gressive hearing loss[J].Nat Genet,2009,41(5):609-613.
4 Solda G,Robusto M,Primignani P,et al.A novel mutation within the MIR96 gene causes non-syndromic inherited hearing loss in an Ital⁃ian family by altering pre-miRNA processing[J].Hum Mol Genet, 2012,21(3):577-585.
5 Guo W,Yuan Y,Hou Z,et al.Profiles of the auditory epithelia relat⁃ed microRNA expression in neonatal and adult rats[J].Eur J Med Res,2014,19:48.
6 Deng X,Wang Y,Zhang F,et al.Acidic pH-induced charge-rever⁃sal nanoparticles for accelerated endosomal escape and enhanced microRNA modulation in cancer cells[J].Chem Commun(Camb), 2016,52(15):3243-3246.
7 Senel S,Mcclure S J.Potential applications of chitosan in veterinary medicine[J].Adv Drug Deliv Rev,2004,56(10):1467-1480.
8 Sinha V R,Singla A K,Wadhawan S,et al.Chitosan microspheres as a potential carrier for drugs[J].Int J Pharm,2004,274(1-2):1-33.
9 来利华,姜启英,陈丹等.TAT短肽修饰的聚乙烯亚胺-β-环糊精基因载体[J].浙江大学学报(医学版),2009,(01):15-23.
Lai LH,Jiang QY,Chen D,et al.Peptide TAT modified polyethyleni⁃mine--cyclodextrin for gene delivery[J].JOURNAL OF ZHEJIANG UNIVERSITY(MEDICAL SCIENCES),2009,38(01):15-23.
10 Brasseur R,Divita G.Happy birthday cell penetrating peptides:al⁃ready 20 years[J].Biochim Biophys Acta,2010,1798(12): 2177-2181.
11 Lai E C.Micro RNAs are complementary to 3'UTR sequence motifs that mediate negative post-transcriptional regulation[J].Nat Genet, 2002,30(4):363-364.
12 Filipowicz W,Bhattacharyya S N,Sonenberg N.Mechanisms of post-transcriptional regulation by microRNAs:are the answers in sight?[J].Nat Rev Genet,2008,9(2):102-114.
13 周琼芝,王玉明,段勇.miRNA载体构建方法的研究进展[J].现代检验医学杂志,2012,27(5):149-151.
Zhou QZ,Wang YM,Duan Y.Research of progress of miRNA and its carrier construct methods[J].J Mod Lab Med,2012,27(5):149-151.
14 Song Y,Li Y,Liu Z,et al.A novel ultrasensitive carboxymethyl chito⁃san-quantum dot-based fluorescence"turn on-off"nanosensor for lysozyme detection[J].Biosens Bioelectron,2014,61:9-13.
15 Torchilin V P,Rammohan R,Weissig V,et al.TAT peptide on the surface of liposomes affords their efficient intracellular delivery even at low temperature and in the presence of metabolic inhibitors [J].Proc Natl Acad Sci U S A,2001,98(15):8786-8791.
16 Fawell S,Seery J,Daikh Y,et al.Tat-mediated delivery of heterolo⁃gous proteins into cells[J].Proc Natl Acad Sci U S A,1994,91(2): 664-668.
Transduction efficiency and cytotoxicity evaluation of CMC-TAT nanocarriers in vitro
TANG Chaoying1,HAN Weiju1,DENG Xiongwei2,WANG Fangyuan1,YUAN Shuolong1,YANG Shiming1,WU Nan1
1 Department of Otorhinolaryngology,Head and Neck Surgery,Chinese PLA General Hospital, The Key Laboratory of Deaf Disease,Ministry of Education,Beijing 100853,China
2 National Nanotechnology Center of Chinese Academy of Science,Beijing 100190,China
ObjectiveTo construct O-carboxymethy chitosan-TAT nanoparticles(CTNs),and to explore the efficiency and security of CTNs for miR96 by transfect 293 cells and cochlear basilar membrane.MethodThe CTNs were generated with the optimal weight ratio of 1.5:1(CMC:TAT),which were used for the incorporation with miR-96 mimisc marked cy3. Transfect 293 cells and cochlear basilar membrane with Lipofectamine-miR96-cy3 and CTNs-miR96-cy3 at the concentration of 150nM with control.The red fluorescence positive cells were counted to evaluate the efficiency of CTNs.The security of CTNs was evaluated by MTT assay.ResultCTNs with a size of 186.8 nm and a zeta potential of-30.9 mV were successfully prepared.The transduction efficiency of CTNs-miR96-cy3 was lower than that of Lipofectamine-miR96-cy3 in both 293 cells and cochlear basilar membrane.MTT assay showed that the cytotoxicity of CTNs was significantly lower than that of Lipofectamine.ConclusionCTNs can successfully transduct miR96 in vitro,which reveals the feasibility and security of CTNs as delivery vector for miRNAin cochlea,however,it’s transduction efficiency is low.
O-carboxymethy chitosan-TAT Nanocarriers;miRNA;miR96;Transfection in cochlea
R764.35
A
1672-2922(2016)06-793-5
2016-12-12审核人:翟所强)
10.3969/j.issn.1672-2922.2016.06.018
国家863青年科学家项目(2014AA020510),国家自然科学基金面上项目(81470683),中国科协创新驱动助力工程(2016CX⁃QD01),国家973计划重大科学研究计划干细胞项目(2012CB967900,其子课题:2012CB967901,2012CB967903)。
唐朝颖,博士研究生,研究方向:耳科学
唐朝颖和韩维举为并列第一作者
吴南,Email:maxpanda1979@126.com

