吲哚生物碱生物合成研究进展*
陈 越,张青磊,黄玉香,谭何新,刁 勇,张 磊**
(1. 华侨大学生物医学学院 泉州 362021;2. 第二军医大学药学院 上海 200433)
吲哚生物碱生物合成研究进展*
陈 越1,2,张青磊1,2,黄玉香1,2,谭何新2,刁 勇1**,张 磊2**
(1. 华侨大学生物医学学院 泉州 362021;2. 第二军医大学药学院 上海 200433)
生物碱种类繁多,吲哚类生物碱是迄今为止发现最多的一类,是许多药用植物的药效成分,具有多样的生物活性。随着代谢组学技术的发展,研究药效物质的生物合成途径对阐明植物体内代谢的分子机制以及代谢调控机理具有重要意义,对进一步研究提高药效物质的生物合成产量具有指导意义。本文按照吲哚生物碱结构进行分类,对数种吲哚生物碱的生物合成途径研究进展进行综述,以期为吲哚生物碱的生物合成机制的进一步研究奠定基础,为其他吲哚生物碱类成分的生物合成研究提供参考依据。
吲哚生物碱 萜类吲哚生物碱 生物合成 长春碱 吲哚-3-乙酸
生物碱是一类主要存在于植物中的含氮且多呈碱性的有机化合物,是一些中药的重要有效成分之一。根据其结构,生物碱可分为吡咯烷类、莨菪烷类、哌啶类、喹唑酮类、喹啉类、异喹啉类、咪唑类、吲哚类、嘌呤类、甾体类和二萜类等[1],其中吲哚类生物碱是迄今为止发现最多的一种类型,包括4 100多种已知化合物。本文根据其结构类型,分别对吲哚-3-乙酸、靛玉红、麦角碱、阿吗碱、文朵灵、长春新碱等具有代表性的吲哚生物碱的生物合成途径进行综述。
1 吲哚生物碱的分类与主要生物学活性
按照结构进行分类,吲哚生物碱可分为简单吲哚类和萜类吲哚生物碱。其中,萜类部分又分为半萜类、单萜类等,亦包含双吲哚类生物碱。吲哚类生物碱的临床应用十分广泛,其生物学活性多样,因其抗肿瘤作用疗效明显,使之成为研究者关注的热点,具体包括:①简单吲哚类生物碱:吲哚-3-乙酸(Indole-3-acetic Acid,IAA)为植物生长素,在植物生长发育过程中起着重要调控作用;靛玉红(Indirubin)为中药青黛和板蓝根中含量最高的药效成分[2],来源于植物马蓝Baphicacanthus cusia(Nees) Bremek、蓼蓝Polygonumtinctorium Lour或菘蓝Isatis indigotica Fort,是抗白血病的有效成分,对治疗慢性粒细胞白血病具有显著疗效[3]。②半萜吲哚类生物碱:麦角碱是麦角菌属(Claviceps)侵害多种禾本科植物后产生的生物碱类毒素[4],具有子宫收缩、调节血压、退热以及抑制呕吐的作用[5]。③单萜吲哚类生物碱:阿吗碱(Ajmaline)为萝芙木Rauvolfia verticillate中的药效成分,研究表明其具有抗炎和降血压的疗效[6]。文朵灵(Vindoline)和长春质碱(Catharanthine)为长春花Catharanthus roseus (L.) G. Don中的活性成分[7]。④双吲哚类生物碱:长春碱(Vinblastine)、长春新碱(Vincristine)为长春花的主要活性成分[7],具有抗癌作用[8,9];长春碱对何杰金病、绒毛上皮癌、淋巴肉瘤、卵巢癌及白血病等均有一定的疗效,长春新碱主要用于急性淋巴细胞白血病的治疗[10]。
2 吲哚生物碱的生物合成
植物药效成分的生物合成途径研究,是充分利用植物代谢产物进行医药工程生产及天然产物开发研究的前提和基础。对植物中药效成分的生物合成途径进行研究,不仅可以揭示不同化学成分在植物体中形成、转化及相互关系的本质规律,而且对进一步研究提高药效物质生物合成产量具有指导意义[11]。
吲哚类生物碱的骨架结构为吲哚杂环,来自植物代谢的莽草酸途径(Shikimic Acid Pathway)[12](图1)。其代谢过程为:4-磷酸赤藓糖(Erythrose-4-phosphate)和磷酸烯醇式丙酮酸(Phosphoenol Pyruvic Acid)经多步酶促反应产生莽草酸,莽草酸在莽草酸激酶(Shikimate Kinase,KS)催化下产生3-磷酸莽草酸(Shikimic Acid-3-phosphate),然后3-磷酸莽草酸经一系列酶促反应生成分支酸(Chorismic Acid),分支酸经邻氨基苯甲酸合成酶A(Anthranilic Acid Synthase α,ASα)催化生成邻氨基苯甲酸(Anthranilic Acid),再通过中间产物N-(5,-磷酸核糖)-氨基苯甲酸、烯醇式1-(O-羧基苯氨基)-1-脱氧核酮糖-5-磷酸产生吲哚的前体物质—3-吲哚磷酸甘油,3-吲哚磷酸甘油然后在色氨酸合酶α(Tryptamine Synthase α,TSA)催化下生成吲哚(Indole),接着吲哚在色氨酸合成酶β(Tryptamine Synthase β,TSB)催化下与L-丝氨酸(L-serine)生成L-色氨酸(L-tryptophan),L-色氨酸为大多数萜类吲哚生物碱的前体[13-15]。
2.1 简单吲哚类生物碱生物合成
目前研究发现IAA的生物合成途径有两种,其上游合成途径都是通过莽草酸途径生成色氨酸,而后通过色氨酸依赖型途径(Trp-dependent Pathway)(图2)和非色氨酸依赖型途径(Trp-independent Pathway)合成IAA[16],其中非色氨酸依赖型途径尚不明确。
色氨酸依赖型途径中从色氨酸合成IAA的途径有多条,按照中间产物不同可划分为吲哚-3-乙醛 肟(Indole-3-acetaldoxime,IAOx)途 径、色 胺(Tryptamin,TAM)途径、吲哚-3-乙酰胺(Indole-3-acetamide,IAM)途径以及吲哚-3-丙酮酸(Indole-3-pyruvic Acid,IPA)途径。具体途径如下:①吲哚乙醛肟途径:首先色氨酸在细胞色素P450单加氧酶(Cytochrome P450 Mono-oxygenase)CYP79B2和CYP79B3催化下生成吲哚-3-乙醛肟,然后转化成吲哚-3-乙腈(Indole-3-acetonitrile)和吲哚乙醛(indole-3-acetaldehyde), 而后分别在腈水解酶(Nitrilase)和醛氧化酶(Aldehyde Oxidase)催化下生成IAA;②吲哚丙酮酸途径:中间产物吲哚丙酮酸在吲哚丙酮酸脱羧酶(Indolepyruvate Decarboxylase,IPD)作用下脱羧形成吲哚乙醛,然后经氧化生成IAA;③色胺途径首先是色氨酸经色氨酸合成酶β催化生成色胺,然后经过中间产物吲哚乙醛生成IAA。④吲哚乙酰胺途径中目前尚未发现色氨酸直接转化为吲哚-3-乙酰胺的调控基因,吲哚-3-乙酰胺经水解生成IAA。虽然合成IAA具有多种合成途径,但他们之间是相互交织而不是独立作用的[17]。而对于IAA非色氨酸依赖型途径的生物合成途径还需进一步的研究。
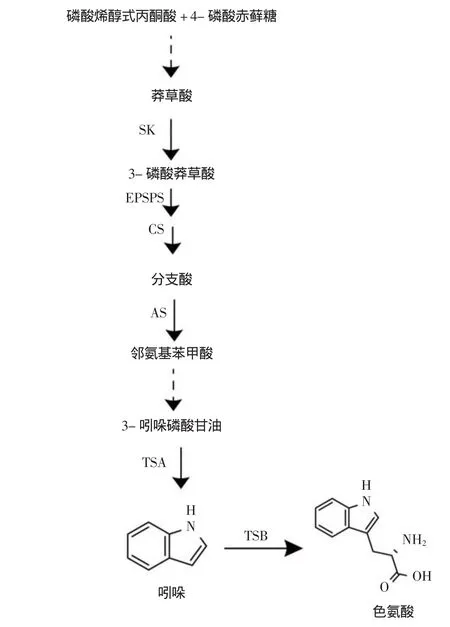
图1 莽草酸途径(虚线表示多步反应)
靛玉红与靛蓝互为同分异构体,由两个吲哚母核结构直接相连组成,故本文将其归为简单类吲哚生物碱。目前的研究认为,靛蓝、靛玉红的前体物质为靛红烷A(indoxyl-3-O-6’-O-malony-β-D-ribohexo-3-ulopyranoside)、靛红烷B(indoxyl-5-ketogluconate)、靛 红烷C(Dixindole Ester)和吲哚苷(Indican)[18]。研究表明,吲哚苷和靛红烷B的前体物质是吲哚,而不是色氨酸[19]。首先,由前体物质吲哚发生羟基化生成3-羟基吲哚(3-hydroxyindole),该步反应机理尚不清楚;然后,尿苷二磷酸葡萄糖(Uridine Diphosphate Glucose,UDPG)在羟基吲哚糖基转移酶催化下将糖基转移给吲哚酚生成吲哚苷,吲哚苷在酶解或化学水解作用下生成吲哚酚(Indoxyle),然后自发发生氧化、双聚生成靛蓝、靛玉红[20],整体合成途径见图3[21]。
2.2 萜类吲哚生物碱生物合成
在各种萜类吲哚生物碱的生物合成途径中,异胡豆苷被公认为是所有萜类吲哚生物碱的核心前体物,其合成由吲哚途径产生的色胺和类萜途径产生的裂环马钱子苷(Secologaline)由异胡豆苷合成酶(Strictosidine Synthase,STR)催化偶合形成。类萜途径包括甲羟戊酸途 径(Mevalonate Pathway,MVA)和甲基磷酸赤藓糖 途 径(Methyl Erythritol Phosphate,MEP),由 其 产生基本的五碳通用前体异戊 烯 焦 磷 酸(Isopentenyl Diphosphate,IPP)和二甲基丙烯基焦磷酸(Dimethylallyl Diphosphate,DMAPP),而后经香叶基焦磷酸合成酶催化反应生成10-羟基香叶醇(10-hydroxy geraniol),再经环烯醚萜途径生成裂环马钱子苷[22,23](图4)。
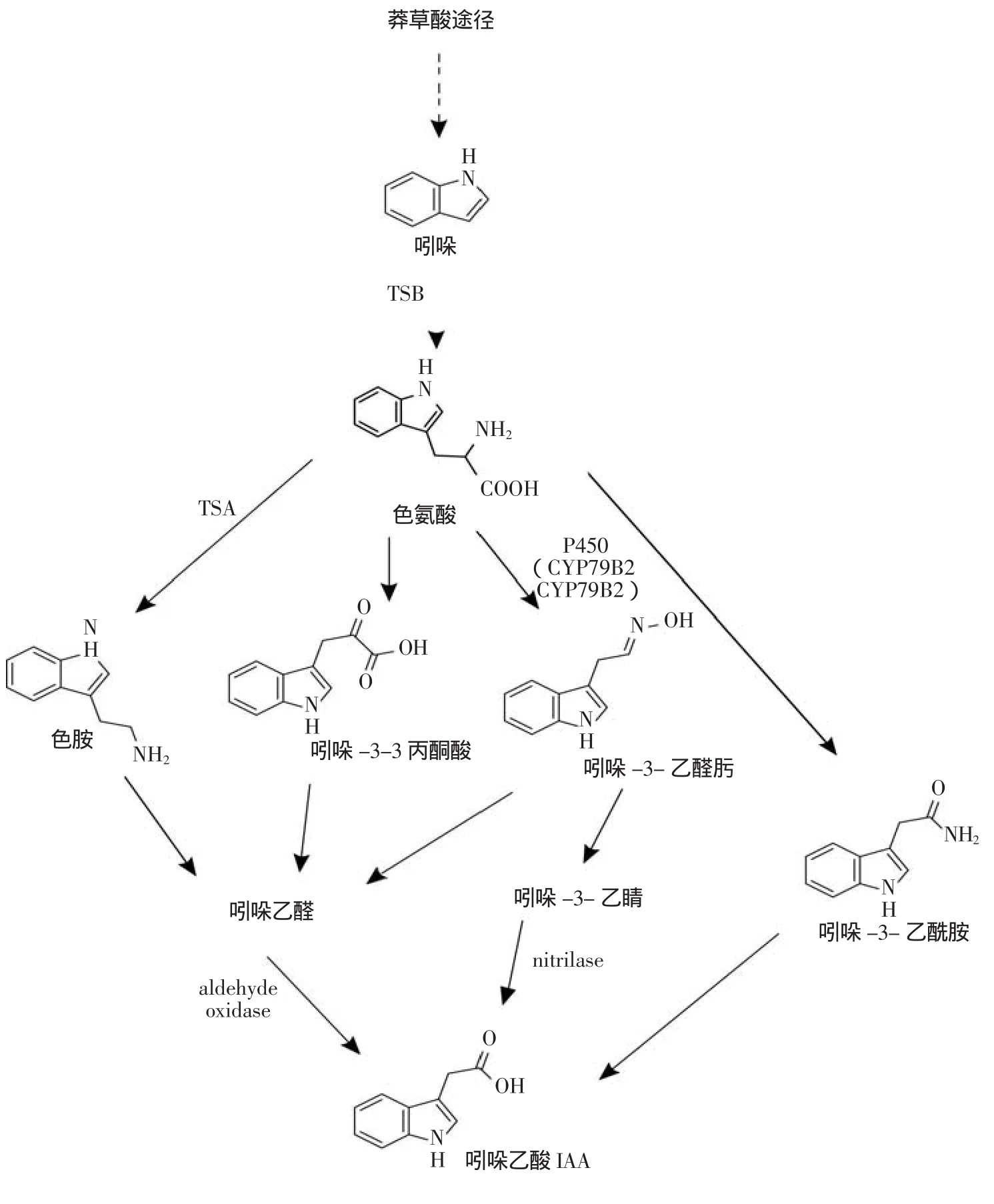
图2 依赖色氨酸的吲哚-3-乙酸生物合成途径
MVA和MEP存在于植物细胞质中,合成IPP的MVA途径首先由两分子乙酰辅酶A(Acetyl-CoA)经乙酰乙酰辅酶A酰基转移酶(Acetyl-CoA Acyltransferase,AACT)催化偶联生成乙酰乙酰辅酶A(Acetoacetyl-coenzyme A),接着在羟甲基戊二酸单酰辅酶A合酶(HMG-CoA Synthase,HMGS)催化下与另一分子乙酰乙酰辅酶A缩合生成3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methyl-glutaryl-CoA,HMG-COA),HMG-COA在还原酶催化下生成甲羟戊酸(Mevalonate),然后经甲羟戊酸酶(Mevalonate Kinase,MVAK)和5-二磷酸甲羟戊激酶(5-diphosphomevalonate Kinase,MVAPK)催化发生磷酸化生成5-二磷酸甲羟戊酸(5-diphosphomevalonate),接着在5-焦磷酸脱羧酶(Mevalonate-5-phosphate Decarboxylase,MVD)催化下脱羧生成IPP。MEP途径存在于植物质体中,第一步由丙酮酸(Pyruvic Acid)和3-磷酸甘油醛(Glyceraldehyde-3-phosphate,G3P)在脱氧木酮糖-5-磷酸合酶(1-deoxy-Dxylulose-5-phosphate Synthase,DCPS)的缩合作用下生成5-磷酸脱氧木酮糖(1-deoxy-D-xylulose-5-phosphate,DXP);第二步,DXP被DXP还原异构酶催化成MEP,最后在异戊烯基单磷酸激酶(Isolpentenyl Monophosphate Kinase,IPK)作用下由异戊烯基单磷酸生成IPP, IPP在 IPP异 构 酶(IPP Isomerase,IPI)催化下生成异构体DMAPP[24]。
环烯醚萜途径中,香叶醇首先在细胞色素P450激酶香叶醇-10羟化酶催化下发生羟基化形成10-羟基香叶醇,然后在NAD+或NADP+作用下氧化成10-香叶酮,后经环化生成环烯醚萜,然后形成马钱子苷酸,马钱苷酸在马钱苷酸甲基转移酶(Loganic Acid Methyltransferase,LAMT)催化下形成甲基马钱子苷,最后甲基马钱子苷由马钱子 苷 合 成 酶(Secologanin Synthase,SLS)催化环戊烷环裂开生成裂环马钱子苷[25]。至此为萜类吲哚生物碱生物合成的上游部分,然而不同萜类吲哚生物碱植物的下游合成途径各异,下文针对不同植物中萜类吲哚生物碱合成进行综述。
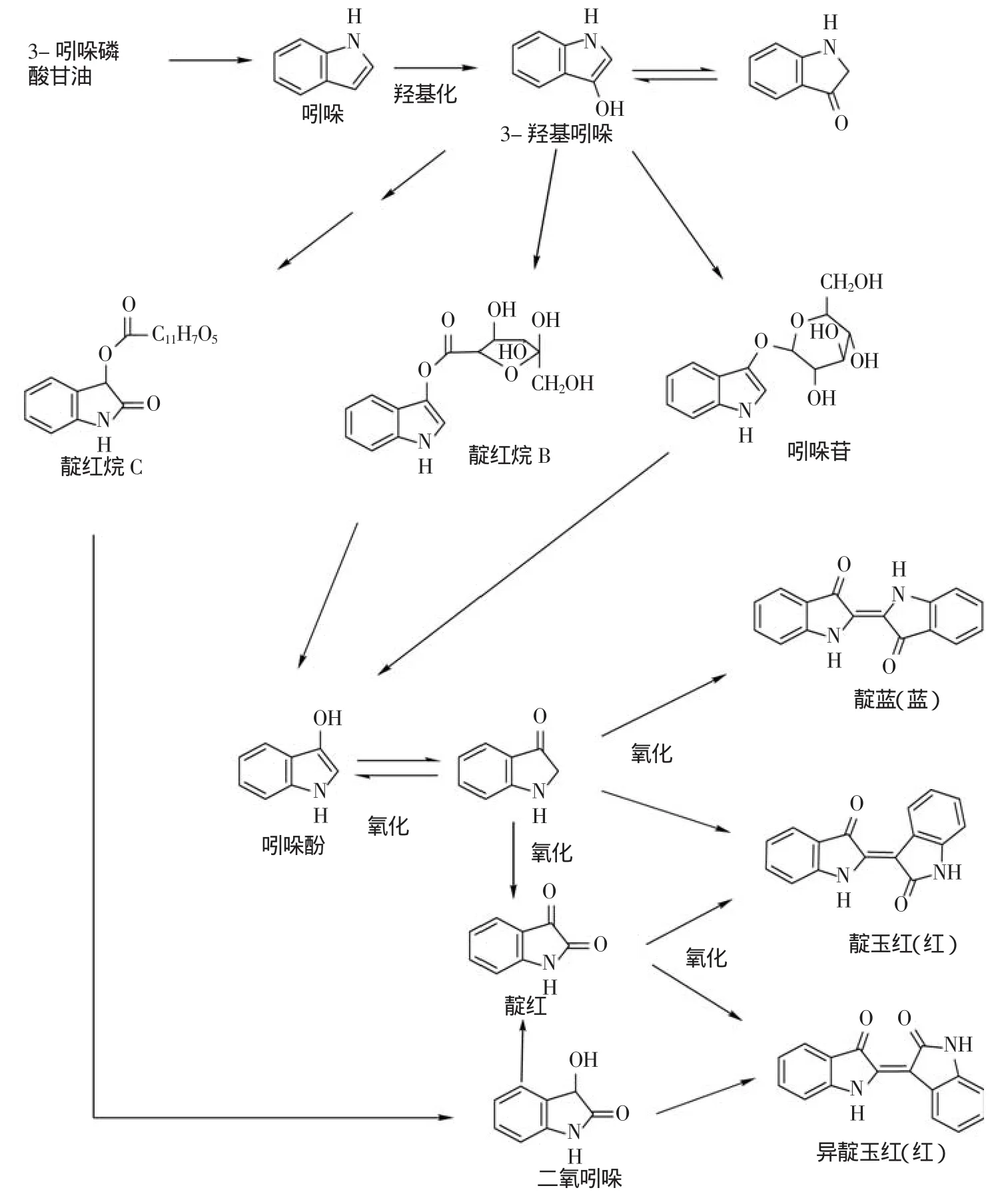
图3 靛蓝、靛玉红生物合成途径
2.2.1 半萜吲哚类生物碱
麦角碱的特征骨架结构为四环的麦角灵,麦角灵前体饲喂实验表明,L-色氨酸和DMAPP是前体物质[25,26]。麦角生物合成首先是麦角灵环的合成,由二甲基丙烯基焦磷酸在异戊烯基转移酶二甲烯丙基色氨酸合酶(Dimethylallytrytophan Synthase,DMATS) 催化下与L-色氨酸发生反应得到二甲烯丙基色氨酸(Dimethylallytrytophan,DMAT)[27,28]。DMAT与腺苷甲硫氨酸作用在N-甲基转移酶催化下发生N-甲基化形成4-DMA-L-abrine[29],之后脱羧并氧化形成裸麦角碱,然后经短链还原酶EasD催化发生氧化成醛,而后在不同的菌种中合成不同中间产物,在A. fumigatus菌种中生成羊茅麦角碱,在P.commune菌种中生成焦麦角碱,在C. purpurea菌种中生成田麦角碱[30]。田麦角碱在田麦角碱单加氧酶催化下形成野麦角碱,而后经野麦角碱-17-单加氧酶作用形成雀稗草酸,雀稗草酸可自发地异构化成D-麦角酸,至此已完成麦角灵环的生物合成。在 C. fusiformis 菌株中,生物合成途径在形成 D-麦角酸之前终止,其终产物为棒麦角碱类,多为田麦角碱和野麦角碱及其衍生物。而雀稗麦角菌和黑麦麦角菌的生物碱合成途径则以D-麦角酸继续合成麦角酰胺类或麦角肽碱[31]。
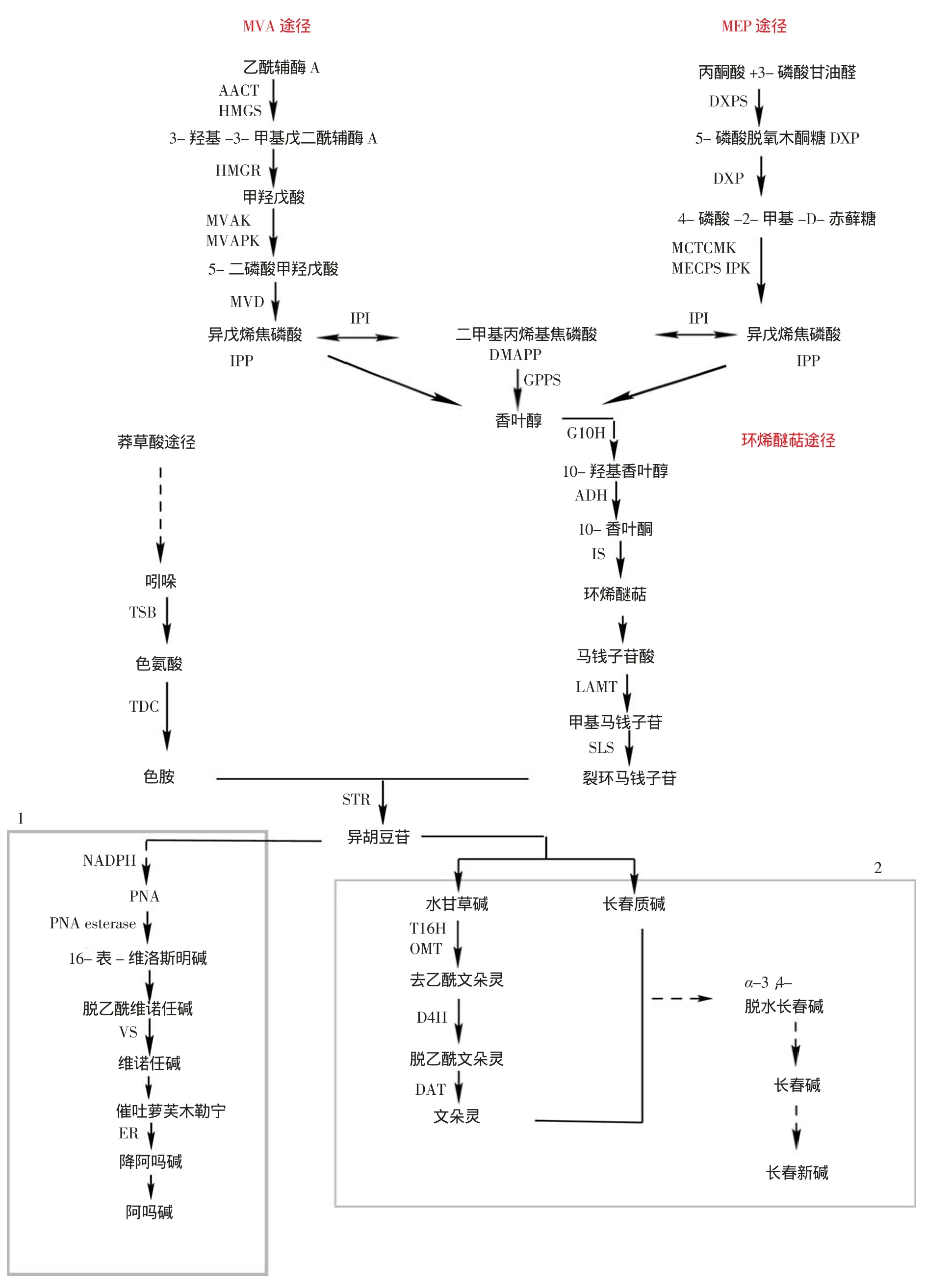
图4 萜类吲哚生物碱生物合成途径
2.2.2 单萜吲哚类和双吲哚类生物碱
阿吗碱的生物合成途径为前体化合物异胡豆苷在还原型辅酶NADPH多步酶促反应生成Polyneudidine Aldehyde(PNA),生 成 的 PNA在PNA酯酶催化下发生脱酯化生成16-表-维洛斯明碱(16-epi-vellosimine),而后转化为脱乙酰维诺任碱,接着在乙酰辅酶A、维诺任碱合酶(Vinorine Synthase,VS)作用下合成维诺任碱,然后经羟基合酶作用发生羟基化生成催吐萝芙木勒宁,催吐萝芙木勒宁在脱酯还原酶(Esterase Reductase,ER)、NADPH催化下脱酯生成降阿吗碱,接着发生甲基转移生成阿吗碱[32]。
长春碱的生物合成首先是长春花中单萜类成分的生成,由萜类生物碱共同的前体化合物3α(S)-异胡豆苷合成水甘草碱后,水甘草碱在水甘草 碱 -16-羟 化 酶(Tabersonine 16-hydroxylase, T16H)催化下发生芳烃羟化,然后在甲氧基酶(O-methyltransferase,OMT)作用下发生甲氧基化,再依次发生羟基化、氮甲基化、甲基转移化一系列反应生成去乙酰文朵灵,去乙酰文朵灵在脱羧酶(Desacetoxyvindoline-4-hydroxylase,D4H)催化下发生脱羧反应生成脱乙酰文朵灵,最后在乙酰转移酶(Deacetylvindoline-4-O-acetyltransferase,DAT)作用下反应生成文朵灵;而长春碱和长春新碱类双吲哚类生物碱可由单萜类长春质碱和文朵灵偶合产生,经过中间产物α-3,4-脱水长春碱后转化为长春碱,由长春碱再生成长春新碱[33]。
3 结语
吲哚类生物碱的合成途径主要是通过莽草酸途径生成色氨酸这一重要中间产物后经过次生代谢得到。迄今为止,植物体内许多药效成分的生物合成途径研究尚不够深入,许多代谢产物的合成途径仍不够清晰,代谢酶的发现还不完全。由于不同植物中的次生代谢不同,以及生物的多样性以及植物次生代谢自身的复杂性,次生代谢研究仍处于探索阶段。本文对几种吲哚类生物碱的生物合成途径研究进展进行了综述,为进一步机理研究奠定基础,也对其他吲哚类药效物质的生物合成研究提供一定的参考。
1 杨秀伟. 生物碱. 北京:化学工业出版社, 2005.
2 罗巍伟,贺英菊,王凌,等. HPLC测定板蓝根提取物中靛蓝和靛玉红的含量. 华西药学杂志,2004,19(6):455-456.
3 高淑香. 靛玉红治疗慢性粒细胞白血病26例临床分析. 中国社区医师:医学专业, 2011, 13(9):49.
4 胡晨曦,杨金玲,程克棣,等. 麦角碱生物合成途径中酶学及相关基因研究进展. 西北植物学报,2005,25(4):819-828.
5 何惠霞,朱平,岳德超. 麦角碱的类型、药理活性及临床应用. 中国药学杂志,1992,27(4):198-201.
6 卢春霞,王洪新. 麦角生物碱的研究进展. 食品科学,2010,31(11):282-288.
7 杨莹莹,张广晶,徐雅娟,等. 长春花化学成分研究进展. 世界中医药, 2014,7:955-957.
8 习利平,宋新波,张丽娟. 长春碱类抗肿瘤药的研究进展. 药物评价研究,2011,34(1):59-62.
9 代鲁平,宋春霞,邵先祥,等. 抗癌药物喜树碱类衍生物的研究进展. 中国药学杂志, 2010,45(23):1813-1815.
10 祖元刚,罗猛,牟璠松,等. 长春花生物碱成分及其药理作用研究进展. 天然产物研究与开发,2006,18(2):325-329.
11 方从兵,宛晓春,江昌俊. 黄酮类化合物生物合成的研究进展(综述). 安徽农业大学学报, 2005,32(4):498-504.
12 Herrmann K M. The shikimate pathway:early steps in the biosynthesis of aromatic compounds. Plant Cell, 1995, 7(7):907-919.
13 Huang Y, Tan H, Guo Z, et al. The biosynthesis and genetic engineering of bioactive indole alkaloids in plants. J Plant Biol, 2016, 59(3):203-214.
14 欧阳剑,李家洋. 拟南芥色氨酸与吲哚乙酸生物合成的研究进展.中国生物工程杂志,1998,18(2):2-11.
15 Radwanski E R, Barczak A J, Last R L. Characterization of tryptophan synthase alpha subunit mutants of Arabidopsis thaliana. Mol Gen Genet, 1996, 253(3):353-361.
16 Ljun K, Hull A K, Kowalczyk M, et al. Biosynthesis, conjugation, catabolism and homeostasis of indole-3-acetic acid in Arabidopsis thaliana. Plant Mol Biol, 2002, 50(2):309-332.
17 王家利,刘冬成,郭小丽,等. 生长素合成途径的研究进展. 植物学报,2012,47(3):292-301.
18 杨明,刘泽玉,苏柘僮,等. “蓝”类植物中的前体物质转化为“靛”的机制探讨. 中国中药杂志,2010,35(7):928-931.
19 Marcinek H, Weyler W, Deus-Neumann B, et al. Indoxyl-UDPG-glucosyltransferase from Baphicacanthus cusia. Phytochemistry, 2000, 53(2):201-207.
20 Xia Zhi-Qiang, Zenk Meinhart H. Biosynthesis of indigo precursors in higher plants. Phytochemistry, 1992, 31(8):2695-2697.
21 Maugard T, Enaud E, Choisy P, et al. Identification of an indigo precursor from leaves of Isatis tinctoria (Woad). Phytochemistry, 2001, 58(6):897-904.
22 皮妍,蒋科技,乔守怡,等. 喜树碱的生物合成途径和代谢调控.植物生理学报,2009,45 (11):1051-1060.
23 邢世海,王荃,潘琪芳,等. 长春花萜类吲哚生物碱的生物合成途径. 西北植物学报, 2012,32(9):1917-1927.
24 El-Sayed M, Verpoorte R. Catharanthus terpenoid indole alkaloids:biosynthesis and regulation. Phytochem Rev, 2007, 6(2):277-305.
25 Li S M, Unsöld I A. Post-genome research on the biosynthesis of ergot alkaloids. Planta Med, 2006, 72(12):1117-1120.
26 Williams R M, Stocking E M, Sanz-Cervera J F. Biosynthesis of prenylated alkaloids derived from tryptophan. Springer Berlin Heidelberg, 2000:97-173.
27 Lee S L, Floss H G, Heinstein P. Purification and properties of dimethylallylpyrophosphate:tryptopharm dimethylallyl transferase, the first enzyme of ergot alkaloid biosynthesis in Claviceps. sp. SD 58. Arch Biochem Biophys, 1976, 177(1):84-94.
28 Unsöld I A, Li S M. Overproduction, purification and characterization of FgaPT2, a dimethylallyltryptophan synthase from Aspergillus fumigatus. Microbiology, 2005,151(Pt 5):1499-1505.
29 Rigbers O, Li S M. Ergot alkaloid biosynthesis in Aspergillus fumigatus. Over production and biochemical characterization of a 4-dimethylallyltryptophan N-methyltransferase. J Biol Chem, 2008,283(40): 26859-26868.
30 Matuschek M, Wallwey C, Wollinsky B, et al. In vitro conversion of chanoclavine-I aldehyde to the stereoisomers festuclavine and pyroclavine controlled by the second reduction step. RSC Adv, 2012, 2(9):3662-3669.
31 朱平. 麦角生物碱生物合成研究进展. 药学学报,2000,35(8):630-634.
32 Su Y, Guo D. Recent progress in biosynthesis of Rauwolfia alkaloids. J Chin Pharm Sci, 2000, 9(1):50-56.
33 Zhu X, Zeng X, Sun C, et al. Biosynthetic pathway of terpenoid indole alkaloids in Catharanthus roseus. Front Med, 2014, 8(3):285-293.
A Research Progress on the Biosynthetic Pathways of Indole Alkaloids
Chen Yue1,2, Zhang Qinglei1,2, Huang Yuxiang1,2, Tan Hexin2, Diao Yong1, Zhang Lei2
(1. School of Biomedical Sciences, Huaqiao University, Quanzhou 362021, China; 2.School of Pharmacy, Second Military Medical University, Shanghai 200433, China)
Indole alkaloid family has been the biggest so far among the various alkaloids, which contains pharmaceutical and effective constituents of various plants featuring diverse biological activities. Thanks to the development of metabonomics, to reveal the biosynthetic pathway of active components for the molecular mechanism of indole alkaloids and the regulation research of plant metabolism present a growing importance and significantly direct the researches of improving biological production. This paper reviewed the biosynthetic pathways of some indole alkaloids in accordance with the structure classification of indole alkaloids to lay a foundation for the further studies on the biosynthetic pathways of indole alkaloids and provide a reference for the biosynthetic pathways of other indole alkaloids.
Indole alkaloids, terpenoid indole alkaloids, biosynthesis, vincaleukoblastine, indole-3-acetaldehyde
10.11842/wst.2016.11.013
R931.6
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-10-27
修回日期:2016-11-02
* 国家自然科学基金委促进海峡两岸科技合作联合基金资助项目(U1405215):马蓝药效物质形成分子机制的阐释及优异种质创新研究,负责人:刁勇。
** 通讯作者:刁勇,教授,博士生导师,主要研究方向:中药现代化;张磊,副教授,硕士生导师,主要研究方向:基于药效物质的中药品质调控。

