近红外光谱吲哚菁绿成像系统在关节炎小鼠淋巴回流功能检测中的应用*
徐 浩,王腾腾,齐晓凤,王 琼,张 利,邢联平,施 杞,王拥军,4,梁倩倩**
(1.上海中医药大学附属龙华医院 上海 200032;2.上海中医药大学脊柱病研究所 上海 200032;3.美国罗切斯特大学医学中心 美国 14623;4.上海中医药大学康复医学院 上海 200120)
近红外光谱吲哚菁绿成像系统在关节炎小鼠淋巴回流功能检测中的应用*
徐 浩1,2,王腾腾1,2,齐晓凤1,2,王 琼1,2,张 利1,2,邢联平3,施 杞1,2,王拥军1,2,4,梁倩倩1,2**
(1.上海中医药大学附属龙华医院 上海 200032;2.上海中医药大学脊柱病研究所 上海 200032;3.美国罗切斯特大学医学中心 美国 14623;4.上海中医药大学康复医学院 上海 200120)
目的:本文建立了近红外光谱吲哚菁绿(Indocyanine Green,ICG)成像技术平台,通过类风湿关节炎TNF-Tg小鼠模型和手术诱导骨性关节炎小鼠模型,验证了技术平台检测淋巴回流功能的成像质量与稳定性,为筛选中药复方与中药单体调控淋巴回流功能防治关节炎的动物体内研究提供技术平台。方法:采用TNF-tg小鼠和手术诱导骨性关节炎小鼠模型,采用近红外光谱ICG成像系统检测类风湿关节炎小鼠模型的下肢淋巴回流功能,手术诱导骨性关节炎小鼠模型的膝关节淋巴回流功能。结果:淋巴回流功能检测显示,与Control组相比,TNF-Tg组的下肢淋巴回流清除率明显下降;Control组小鼠下肢淋巴管收缩脉冲值为1.12±0.27个/min,与之相比,TNF-Tg组检测不到明显的收缩脉冲值;与Sham组相比,OA组的膝关节淋巴回流清除率明显下降。结论:本文建立的近红外光谱-ICG成像系统可以为评价动物体内淋巴回流功能实验研究,筛选治疗关节炎有效的中药复方,小分子化合物提供良好的工作平台。
近红外光谱成像 吲哚菁绿 淋巴回流系统 关节炎
ICG是一种带负电,具有水溶性的三碳菁染料,分子量是776 Da[1,2],在1957年美国梅奥诊所将ICG这种青色染料引入到临床医学的诊断和治疗过程中,它用来检测心脏输出功能[3]、眼部血管造影[4]、外科手术[5]、类风湿关节炎诊断与疗效评价[6]等方面。ICG在体内不被肠粘膜吸收,只是经由肝脏与胆管排出,生产厂商提供的数据说明ICG的过敏率非常低(1:10 000),被认为是安全低毒药物[7,8],体内使用浓度是0.1-0.5 mg·kg-1[9]。ICG的激发光波长大概是780 nm,吸收光谱波长峰值在800-830 nm(水中810 nm,体液中830 nm)。这段波长可以被近红外光谱仪检测[10]。本文主要关注ICG在类风湿关节炎诊断与疗效评价中的应用。
类风湿性关节炎是一种临床常见以关节病变为主的慢性全身自身免疫性疾病,主要临床表现为:小关节滑膜所致的关节肿痛,继而软骨破坏、关节间隙变窄,晚期因严重骨质破坏、吸收导致关节僵直、畸形、功能障碍,严重影响患者的工作能力和生活质量[2]。类风湿性关节炎病理状态下,过多的液体会从增生的血管中积流到组织间隙中[3],而这些积液中又包含了大量的促进关节炎组织损伤的细胞因子和炎症因子[4],目前仍然缺乏有效的治疗类风湿关节炎药物[5]。
淋巴回流系统包括毛细淋巴管、集合淋巴管、淋巴结,具有回输组织中蛋白与液体,运输全身免疫细胞的作用,淋巴回流系统维持机体的正常生理功能。在类风湿关节炎回流的淋巴液中含有大量的与炎症相关的细胞因子和化学因子[11]。类风湿关节炎患者滑膜组织中的淋巴管生成数量对比正常人滑膜组织增加明显[12],并且在类风湿关节炎动物模型TNFTg转基因小鼠中也发现了同样的表现[13]。本课题组前期研究发现,关节局部的淋巴管形成和淋巴回流与关节病变呈正比关系[6],关节内注射血管内皮生长因子C(Vascular Endothelial Growth Factor-C,VEGF-C)腺病毒相关载体(AAV-VEGF-C virus)可以促进类风湿关节炎小鼠关节周围淋巴管生成,促进淋巴回流功能,延缓关节退变,减少关节周围炎症反应程度[7],从而证明促进淋巴回流功能可以作为治疗类风湿关节炎的手段与靶点。在后续的研究中,我们逐渐发现了淋巴回流系统参与类风湿关节炎病理发展进程的机制:淋巴回流系统将炎症关节周围的细胞因子、化学因子等炎症相关因子回输集合淋巴管,以减轻由于炎症因子蓄积关节腔中导致的关节病变加重;在这个过程中,肿瘤坏死因子与白细胞介素1引起淋巴管内皮细胞炎症反应,诱导性一氧化氮合酶表达增加,并且产生大量的一氧化氮(Nitric Oxide,NO),NO降低了淋巴管平滑肌细胞功能相关蛋白的基因与蛋白表达,从而降低了淋巴管平滑肌的收缩功能,对于淋巴回流功能产生的负效应[14]。
相继发现中药复方(独活寄生汤等[14])与中药单体(阿魏酸[15]与三七总皂苷[16]等)可以通过促进淋巴回流功能延缓类风湿关节炎的病理进展过程[8,9]。
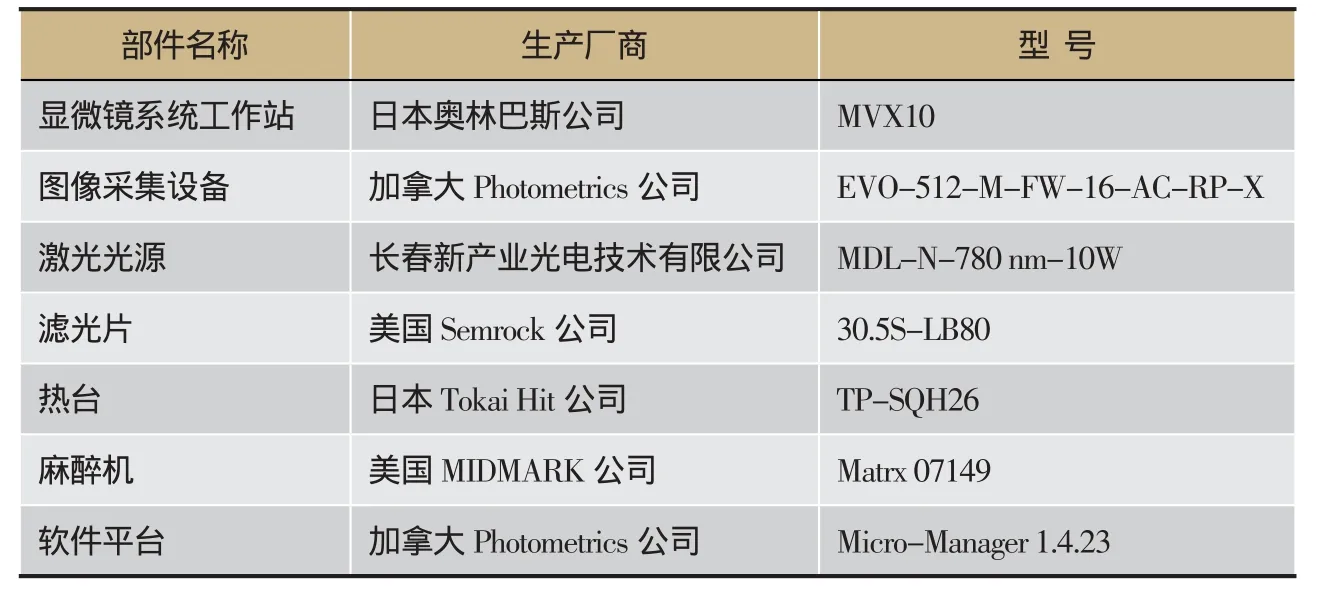
表1 ICG-近红外光谱成像系统配件
1 材料与方法
1.1 仪器与试剂
ICG-近红外光谱成像系统(如图1A、1B):仪器组装配件清单如表1。微量注射器:美国Hamilton公司,货号:80601(如图1C)。注射用ICG(如图1D):美国Akorn公司,货号:17478-701-02。组织提取与DNA抽提(美国Sigma公司,批号:051M8617V、SLBB1424V、041M6349),琼脂糖(批 号:G-10111860),DNA Marker(美 国Promega公司),引物购自上海百力格生物技术有限公司。
1.2 实验动物
C57BL/6Slac小鼠,SPF级,雄性,10周龄,上海斯莱克实验动物公司购买。TNF转基因小鼠(line 3647)携带一个人的TNF拷贝基因,自发慢性、进展性关节炎,及WT同窝对照小鼠,获赠于美国罗切斯特大学医学中心,饲养于上海模式动物中心。
1.3 方法
1.3.1 检测小鼠足底ICG 24 h清除率
首先,利用Matrx麻醉机(图1B)呼吸麻醉小鼠,使用VEET脱毛剂和温水,清除小鼠下肢小腿部分的体毛,注意保护小鼠皮肤,将小鼠置于热台上,热台温度保持在28℃,给予小鼠面罩气体麻醉。用微量注射器,30G针头,吸取10 μL 0.1 g·mL-1浓度的ICG,注射于小鼠足底皮下。注射后6 h拍摄足底照片,注射后24 h后再次拍摄足底照片,取足底ROI(Region of Interest,图2A、2B),利用软件Image J对ROI区域分析,得到数据代入公式(图2C),得到的结果是小鼠足底ICG清除率,其代表淋巴回流功能。
1.3.2 检测小鼠腘窝淋巴结到达ICG最大充盈度的时间(Tmax)与亮度值(Smax)
麻醉,脱毛,注射ICG操作如上,在注射后记录影像1 h,选择腘窝淋巴结作为ROI(图2D、2E),利用软件Image J对ROI区域分析,得到信号亮度最大值作为Smax,而此时的时间点作为信号强度达到最大值时的时间Tmax。Smax与Tmax均可作为淋巴系统回流功能的指标。
1.3.3 检测小鼠足踝关节至腘窝淋巴结之间淋巴管传输ICG的脉冲频率
麻醉,脱毛,注射ICG操作如“1.3.2”。在注射后记录影像1 h,选择小鼠足踝关节至腘窝淋巴结之间清晰的淋巴管作为ROI(图2E,兰色矩形),利用软件Image J对ROI区域分析,得到ROI区域内信号亮度500 s内的数值波动变化,从而得到淋巴管收缩传输ICG的频率,淋巴管收缩脉冲频率是呈现淋巴系统回流功能非常重要的指标。
1.3.4 检测小鼠膝关节内ICG的清除率
开启麻醉机Matrx麻醉小鼠,使用VEET脱毛剂和温水,清除小鼠膝关节周围的体毛,注意保护小鼠皮肤,将小鼠置于热台上,热台温度保持在28℃,给予小鼠面罩气体麻醉。用微量注射器,30G针头,吸取6 μL 0.1 g·mL-1浓度的ICG,注射于小鼠膝关节腔内。注射后3 h拍摄膝关节照片(图2F),注射后6 h后再次拍摄膝关节照片(图2G),取膝关节ROI(Region of Interest),利用软件Image J对ROI区域分析,得到数据代入公式(图2H),得到的结果是小鼠膝关节的ICG清除率,其可以代表膝关节腔内的淋巴回流功能。1.3.5 TNF转基因小鼠基因型鉴定方法

图1 ICG-近红外光谱检测仪及相关实验用品
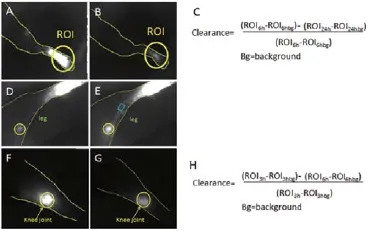
图2 近红外光谱检测方法与计算分析
对3周龄小鼠剪尾,进行基因组DNA抽提。每个样本加入提取液25 μL,制备液6.25 μL,25℃ 5 min→ 95℃ 10 min→ 25℃ 5 min,加入25 μL中和液混匀,室温放置5 min。引物序列 F:5’-TACCCCCTCCTTCAGACACC-3’;R:5’-GCCCTTCATAATATCCCCCA-3’。PCR反应体系20 μL:Bioteke PCR mix 7 μL,水10 μL,DNA抽提产物1 μL,上下游引物各1 μL。94℃ 3 min,94℃30 s→60℃ 35 s→72℃ 1.5 min,30个循环,72℃7 min,4℃保存。配制2%的琼脂糖胶,上样10 μL,电压110 V,40 min。阳性条带200-300 bp之间。
1.3.6 骨性关节炎小鼠模型建立方法
腹腔注射氯胺酮麻醉小鼠(20 mg·kg-1),使用VEET脱毛膏清除小鼠双侧膝关节部位的体毛,碘伏酒精消毒。OA组:手术刀在右膝关节内侧中线处开1 cm切口,显露内侧副韧带,使用30G针头切断内侧副韧带,打开内侧膝关节囊,显露内侧半月板,使用显微手术弹簧剪切去内侧半月板的内侧三分之一,直接缝合皮肤切口;Sham组:手术刀在左膝关节内侧中线处开1 cm切口,直接缝合皮肤切口。切口处涂些许新霉素眼膏,放回笼内,等待小鼠苏醒。
1.3.7 统计方法
采用SPSS 17.0软件进行统计分析。统计结果用平均值±标准差描述,组间比较均用t检验,P<0.05认为存在显著性差异。
2 结果与分析
2.1 小鼠足底部淋巴回流清除率检测与分析
在小鼠足底部注射ICG,然后利用近红外仪器分别在注射后1 h和24 h检测,与Control组(77.4%±3.46%)相比,TNF-Tg类风湿关节炎模型组小鼠的足底淋巴回流清除率明显下降(36.80%±6.70%,P<0.05)。详见图3。
2.2 小鼠膝关节淋巴回流清除率检测与分析
在小鼠膝关节腔中注射ICG,然后利用近红外仪器分别在注射后3 h和6 h检测,与Sham组(71.60%±6.38%) 相比,膝骨性关节炎组膝关节的清除率明显下降(47.84%±5.21%,P<0.05)。详见图4。
2.3 小鼠下肢淋巴管Pulse检测与分析
小鼠足底部注射ICG注射后1 h后,检测500 s内淋巴管的信号强度变化情况。我们把峰值与谷值的变化次数转化为脉冲个数,如图5。Control组小鼠脉冲为1.12±0.27个/min,与之相比,TNF-Tg组检测不到明显的脉冲。

图3 小鼠足底淋巴回流清除率检测与分析(n=8)

图4 膝关节淋巴回流清除率检测与分析(n=8)
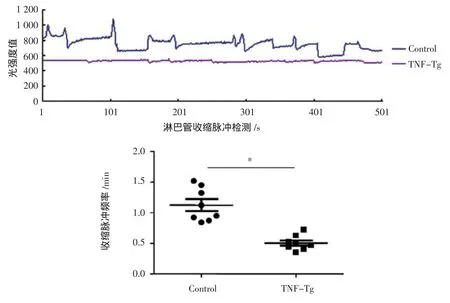
图5 小鼠下肢集合淋巴管收缩脉冲检测与分析(n=8)
3 讨论
3.1 ICG在临床医学中的应用
ICG染料影像学属性的优势是它在近红外光谱检测下具有很高的信号背景比,自发光较低,发射波长峰值较长,可以增加组织的“穿透力”,使目标组织的影像在观察过程中显得非常明亮。ICG是为数不多的已经通过美国食品药品监督局(Food and Drug Administration,FDA)认证的可以应用于临床治疗过程的照影剂,因此它被广泛地应用在临床各科,包括泌尿科[17,19]、眼科[20-22]、妇科[21,23]、儿科[24,25]等。目前ICG-近红外光谱成像技术不但用于多个临床专科的开放性肿瘤手术作为影像引导,还用于增强术野影像分辨率的一些内镜治疗术[26,27],医生从而得以在高分辨率的影像引导下更加彻底地清除肿瘤组织,提高了肿瘤切除术后的预后效果。由于肿瘤的种类区别,ICG在用于肿瘤外科临床治疗过程中暴露出了它的局限性——ICG染料本身没有靶向性。在这样的背景下,具有改进光学性能的IRDye 800CW被开发出来,它是更加理想的具有靶向性的荧光探针;通过加工,它可以结合到不同的特定配体,然后与不同肿瘤的细胞表面靶标结合,达到对于肿瘤更加精准的治疗效果,此研究已经在动物体内实验成功实现[28-30],但是将以上实验结果转化到临床前研究需要很多基础工作铺垫。
3.2 ICG在基础研究中的发展
对于ICG的应用性研究,科学家们一方面在试图改进ICG在体内的成像效果和“穿透力”;一方面在试图扩大它的适用性或者应用范畴。Tan等[31]利用纳米技术得到新的粒子结构ICG-lactosomes,并将其应用于类风湿关节炎小鼠模型,他们将ICG-lactosomes经由小鼠尾静脉注射入模型体内,通过Xenogen IVIS spectrum成像系统观察,发现与对照组的正常小鼠关节相比,这种新的粒子可以在类风湿关节炎关节周围蓄积,而且在体内的蓄积时间延长,这个研究结果的创新性在于,这种可视化的新型粒子在结合相关治疗类风湿关节炎药物后,可以为此类药物干预类风湿关节炎的治疗过程提供更精准的药物疗效分析数据,也可能为未来类风湿关节炎的治疗提供更高效的递药体系。尽管ICG在近红外光谱照射下具有很好的“穿透性”,但是在皮肤肌肉等较厚组织的遮挡下,其在用于动物体内实验检测观察时,仍就很难提供令人满意的图像效果。Watanabe等[32]将生物材料与有机材料整合,构建了一种类似纳米球结构的病毒载体,这种载体中包裹了ICG染料,他们把这种含有ICG染料的载体输入小鼠体内,然后用激光与超声相结合的光声系统检测,发现这种包裹了ICG染料的载体在小鼠体内深层部位的成像信号强于单纯的ICG染料。
3.3 建立近红外光谱成像系统为开展小动物关节淋巴回流功能检测,筛选治疗关节炎有效的药物提供技术平台
目前,市售用于临床研究的近外红光谱检测仪商品包括日本滨松光学公司的Photodynamic Eye(PDE),加拿大Novadaq科技公司的SPY system,法国Fluoptics公司的Fluobeam。但是,这些针对临床研究开发的市售仪器设计的应用对像是人群,对于小动物实验研究具有一定的局限性,本课题组建立的近红外光谱检测仪器更适合小动物体内实验研究。奥林巴斯MVX10体式显微镜作为仪器的主要框架为检测结果提供了更好的可重复性,连续性和稳定性;Tokai Hit热台维持麻醉后小动物的正常体温为得到稳定的体内实验数据提供保障;图像采集系统我们选用的是更加敏锐的EMCCD相机,它细腻高敏的成像效果保证淋巴管的成像更加清晰,检测结果更加精准。近年来,中医药精准医疗理念为中医药科学研究指明了方向[33],本课题组未来的研究主要聚焦于筛选治疗类风湿关节炎有效的中药单体,为开启类风湿关节炎新药研究奠定基础。
综上所述,我们建立的近红外光谱-ICG成像系统可以为评价动物体内淋巴回流功能实验研究,筛选治疗关节炎有效的中药复方,小分子化合物提供良好的工作平台。
1 Moody E D, Viskari P J, Colyer C L. Non-covalent labeling of human serum albumin with indocyanine green: a study by capillary electrophoresis with diode laser-induced fluorescence detection. J Chromatogr B Biomed Sci Appl, 1999, 729:55-64.
2 Ogawa M, Kosaka N, Choyke P L, et al. In vivo molecular imaging of cancer with a quenching near-infrared fluorescent probe using conjugates of monoclonal antibodies and indocyanine green. Cancer Res, 2009, 69:1268-1272.
3 Maarek J M, Rubinstein E H, Guo Y, et al. Measurement of cardiac output and blood volume during hemodialysis with fluorescent dye dilution technique. Ann Biomed Eng, 2016.
4 Klufas M A, Yannuzzi N A, Pang C E, et al. Feasibility and clinical utility of ultra-widefield indocyanine green angiography. Retina, 2015, 35(3):508-520.
5 Ishizawa T, Saiura A, Kokudo N. Clinical application of indocyanine green-fluorescence imaging during hepatectomy. Hepatobiliary Surg Nutr, 2016, 5(4):322-328.
6 Mohajerani P, Meier R, Noel P B, et al. Spatiotemporal analysis forindocyanine green-aided imaging of rheumatoid arthritis in hand joints. J Biomed Opt, 2013, 18(9):097004.
7 Landsman M L, Kwant G, Mook G A. Light-absorbing properties, stability, and spectral stabilization of indocyanine green. J Appl Physiol, 1976, 40(4):575-583.
8 Alford R, Simpson H M, Duberman J, et al. Toxicity of organic fluorophores used in molecular imaging: literature review. Mol Imaging, 2009, 8(6):341-354.
9 Speich R, Saesseli B, Hoffmann U, et al. Anaphylactoid reactions after indocyanine-green administration. Ann Intern Med, 1988, 109(4):345-346.
10 Shimizu S, Kamiike W, Hatanaka N, et al. New method for measuring ICG Rmax with a clearance meter. World J Surg, 1995, 19(1):113-118.
11 Bergman M J. Social and economic impact of inflammatory arthritis. Postgrad Med, 2006.
12 Koch A E. Review: angiogenesis: implications for rheumatoid arthritis. Arthritis Rheum, 1998, 41(6):951-962.
13 Firestein G S. Evolving concepts of rheumatoid arthritis. Nature, 2003, 423(6937):356-361.
14 Olszewski W L, Pazdur J, Kubasiewicz E, et al. Lymph draining from foot joints in rheumatoid arthritis provides insight into local cytokine and chemokine production and transport to lymph nodes. Arthritis Rheum, 2001, 44(3):541-549.
15 Colebatch A N, Marks J L, Edwards C J. Safety of non-steroidal antiinflammatory drugs, including aspirin and paracetamol (acetaminophen) in people receiving methotrexate for inflammatory arthritis (rheumatoid arthritis, ankylosing spondylitis, psoriatic arthritis, other spondyloarthritis). Cochrane Database Syst Rev, 2011:CD008872.
16 Wauke K, Nagashima M, Ishiwata T, et al. Expression and localization of vascular endothelial growth factor-C in rheumatoid arthritis synovial tissue. J Rheumatol, 2002, 29(1):34-38.
17 Polzer K, Baeten D, Soleiman A, et al. Tumour necrosis factor blockade increases lymphangiogenesis in murine and human arthritic joints. Ann Rheum Dis, 2008, 67(11):1610-1616.
18 Li J, Zhou Q, Wood R W, et al. CD23(+)/CD21(hi) B-cell translocation and ipsilateral lymph node collapse is associated with asymmetric arthritic flare in TNF-Tg mice. Arthritis Res Ther, 2011, 13(4):R138.
19 Zhou Q, Guo R, Wood R, et al. Vascular endothelial growth factor C attenuates joint damage in chronic inflammatory arthritis by accelerating local lymphatic drainage in mice. Arthritis Rheum, 2011, 63(8):2318-2328.
20 Liang Q, Ju Y, Chen Y, et al. Lymphatic endothelial cells efferent to inflamed joints produce iNOS and inhibit lymphatic vessel contraction and drainage in TNF-induced arthritis in mice. Arthritis Res Ther, 2016, 18:62.
21 Chen Y, Li J, Li Q, et al. Du-Huo-Ji-Sheng-Tang attenuates inflammation of TNF-Tg mice related to promoting lymphatic drainage function. Evid Based Complement Alternat Med, 2016:7067691.
22 Li J, Chen Y, Zhang L, et al. Total saponins of panaxnotoginseng promotes lymphangiogenesis by activation VEGF-C expression of lymphatic endothelial cells. J Ethnopharmacol, 2016, 193:293-302.
23 Liang Q, Ju Y, Chen Y, et al. Lymphatic endothelial cells efferent to inflamed joints produce iNOS and inhibit lymphatic vessel contraction and drainage in TNF-induced arthritis in mice. Arthritis Res Ther, 2015, 18:62.
24 Polom W, Markuszewski M, Rho Y S, et al. Use of invisible near infrared light fluorescence with indocyanine green and methylene blue in urology. Part 2. Cent European J Urol, 2014, 67(3):310-313.
25 Borofsky M S, Gill I S, Hemal A K, et al. Near-infrared fluorescence imaging to facilitate super-selective arterial clamping during zeroischaemia robotic partial nephrectomy. BJU Int, 2013, 111(4):604-610.
26 Sim D A, Chu C J, Selvam S, et al. A simple method for in vivo labelling of infiltrating leukocytes in the mouse retina using indocyanine green dye. Dis Model Mech, 2015, 8(11):1479-1487.
27 Yoshitake S, Murakami T, Uji A, et al. Association between cystoid spaces on indocyanine green hyperfluorescence and optical coherence tomography after vitrectomy for diabetic macular oedema. Eye (Lond), 2014, 28(4):439-448.
28 Choi H J, Kim T J, Lee Y Y, et al. Time-lapse imaging of sentinel lymph node using indocyanine green with near-infrared fluorescence imaging in early endometrial cancer. J Gynecol Oncol, 2016, 27(3):e27.
29 Tummers Q R, Hoogstins C E, Peters A A, et al. The value of intraoperative near-infrared fluorescence imaging based on enhanced permeability and retention of indocyanine green: feasibility and falsepositives in ovarian cancer. PLoS One, 2015, 10(6):e0129766.
30 Piyawattanametha W, Ra H, Qiu Z, et al. In vivo near-infrared dualaxis confocal microendoscopy in the human lower gastrointestinal tract. J Biomed Opt, 2012, 17(2):021102.
31 Tan I C, Balaguru D, Rasmussen J C, et al. Investigational lymphatic imaging at the bedside in a pediatric postoperative chylothorax patient. Pediatr Cardiol, 2014, 35(7):1295-1300.
32 Watanabe M, Tsunoda A, Narita K, et al. Colonic tattooing using fluorescence imaging with light-emitting diode-activated indocyanine green: a feasibility study. Surg Today, 2009, 39(3):214-218.
33 陈健,陈启龙,苏式兵.中医药精准医疗的思考与探索.世界科学技术-中医药现代化,2016,18(4):557-562.
Application of Near Infrared-Indocyanine Green Imaging System to the Detection of Lymphatic Draining Function in Arthritic Mice
Xu Hao1,2, Wang Tengteng1,2, Qi Xiaofeng1,2, Wang Qiong1,2, Zhang Li1,2, Xing Lianping3, Shi Qi1,2, Wang Yongjun1,2,4, Liang Qianqian1,2
(1. Longhua Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China; 2. Institute of Spine Disease, Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China; 3. University of Rochester Medical Center, New York 14623, U.S.A.; 4. School of Rehabilitation Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200120, China)
This study aimed at establishing near infrared (NIR)-indocyanine green (ICG) imaging system to validate the imaging quality and stability of the imaging system by testing the ICG clearance of the footpads of mice with rheumatoid arthritis (RA) and knee joints of those with osteoarthritis (OA). The joint clearances of TNF-Tg mice and surgery-induced knee osteoarthritis (KOA) mice were detected using the imaging system in this study. As a result, it was found that the ICG clearance of the footpads of TNF-Tg mice decreased (36.80%±6.70%) compared with those of the control group (77.4%±3.46%, P < 0.05). The pulse number of lower limb lymphatic vessels in TNF-Tg mice was unavailable to detect, while the pulse number of the control group was 1.12±0.27 pulses per minute. The ICG clearance in the knee joints of the KOA mice alse decreased (47.84%±5.21%) compared with those of the sham group (71.60%±6.38%, P < 0.05). In conclusion, the NIR-ICG imaging system provided desirable technology platform for evaluating in vivo lymphatic draining function and screening formula or monomer of traditional Chinese medicine as the administration of arthritis.
Near infrared imaging, indocyanine green, arthritis, lymphatic drainage function
10.11842/wst.2016.11.005
R274
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-11-20
修回日期:2016-11-20
* 国家自然科学基金委重点项目(81330085):痰瘀型类风湿性关节炎与淋巴关系的基础研究,负责人:施杞;国家自然科学基金委重大国际合作项目(81220108027):益气祛湿法调控淋巴系统对炎症性关节炎的影响,负责人:王拥军;教育部高等学校全国优秀博士学位论文作者专项资金资助项目(201276):负责人:梁倩倩;上海市龙华医院龙医创新团队(LYCX-01):祛瘀化瘀防治颈痛和炎性关节炎的基础研究,负责人:梁倩倩;国家自然科学基金委青年基金项目(81403418):TNF-α介导NF-κB信号通路活化在骨性关节炎形成中的作用及蠲痹汤防治的机制研究,负责人:徐浩;上海市长宁区卫生与计划生育委员会“光华卓越PI工程”项目(2016-01),负责人:施杞;筋骨理论与治法教育部重点实验室,负责人:王拥军。
** 通讯作者:梁倩倩,副研究员,硕士生导师,主要研究方向:中医药防治慢性骨与关节疾病。

