多发性骨髓瘤患者血清IL-6与β2-MG水平的变化及临床意义
郑建洵
(福建中医药大学附属人民医院检验科福州 350004)
多发性骨髓瘤患者血清IL-6与β2-MG水平的变化及临床意义
郑建洵
(福建中医药大学附属人民医院检验科福州 350004)
目的:探讨多发性骨髓瘤患者血清IL-6与β2-MG的变化及临床意义。方法:以本院2013年6月~2015年6月收治的60例多发性骨髓瘤患者为研究对象,以本院同期40例健康志愿者为对照组,用RIA法检测各组血清中IL-6与β2-MG表达水平,并随访观察。结果:MM组患者血清IL-6、β2-MG水平均显著高于对照组,差异均具有统计学意义(P<0.05)。ISSⅢ期患者IL-6、β2-MG水平均高于ISSⅠ期和ISSⅡ期患者(P<0.05)。MM患者初治组与复发难治组血清中IL-6、β2-MG的表达水平均明显高于对照组,差异有统计学意义(P<0.05)。与初治组相比,MM患者治疗有效组IL-6、β2-MG表达水平显著降低,差异有统计学意义(P<0.05)。MM患者复发难治组血清中IL-6、β2-MG的表达水平均明显高于初治组,差异有统计学意义(P<0.05)。结论:IL-6、β2-MG在多发性骨髓瘤的发生发展中起着重要作用,IL-6、β2-MG水平的升高与患者预后密切相关,可将IL-6、β2-MG作为判断多发性骨髓瘤病情评估、治疗效果和预后监测的重要指标。
多发性骨髓瘤;白介素-6;β2-微球蛋白;预后;影响因素
多发性骨髓瘤(Multiple Myeloma,MM)也称为浆细胞骨髓瘤,是由于具有合成和分泌免疫球蛋白的浆细胞发生恶变,大量单克隆的恶变浆细胞增生引起的血液系统恶性肿瘤。肿瘤多侵犯骨质和骨髓,产生溶骨性病变,出现以骨痛、骨骼变形、骨折、贫血出血、继发感染、肾功能损害、高黏滞综合征和淀粉样变等各种临床表现症状[1~2]。病因目前尚未明确,且至今仍无法治愈。易造成误诊而延误治疗,因此应用各项辅助诊断指标对其早期发现与明确诊断具有重要意义。白介素-6(IL-6)是一种炎性因子,是支持浆细胞增殖分化的关键因子,对MM的发生与发展相关的重要免疫调控因子[3]。β2-微球蛋白(β2-microglobulin,β2-MG)是相对分子量为11 800的单链多肽,位于所有有核细胞的细胞膜上,是人类白细胞抗原(HLA)轻链蛋白,β2-MG以相对稳定的速率合成并由细胞膜上释放,β2-MG易被肾小球滤过,在近端肾小管重吸收并完全分解。与MM的肾功能损害具有相关性[3]。骨髓瘤细胞分泌大量M蛋白和多肽链可引起肾功能障碍。本研究通过检测MM患者血清中IL-6与β2-MG表达水平变化,来探讨它们与该疾病严重程度、临床分期、进展及预后的关系。现报道如下:
1 资料与方法
1.1 一般资料以本院血液科2013年6月~2015年6月收治的60例多发性骨髓瘤患者为研究对象,其中男36例,女24例;平均年龄(53.50±9.32)岁;ISS分期:Ⅰ期10例,Ⅱ期17例,Ⅲ期33例;分型:IgG 31例,IgA 18例,轻链型11例;初治者26例,治疗有效者18例,复发难治者16例。严格按照修订的R-ISS国际预后分期诊断标准纳入。50例患者接受化疗,其中30例接受VAD化疗(长春新碱、阿霉素、地塞米松)和20例患者接受BD化疗(硼替佐米、地塞米松),10例患者行自体干细胞移植治疗。以本院同期40例健康志愿者为对照组,对照组男25例,女15例;平均年龄(52.80±8.24)岁。两组间性别和年龄差异均无统计学意义,具有可比性。所有入选对象均无炎症性疾病、急性感染或自身免疫性疾病及恶性肿瘤病史等其他可能干扰诊断的疾病。上述标本采集前均已征得患者本人同意并签署知情同意书。
1.2 方法
1.2.1 仪器和试剂IL-6与β2-MG采用放射免疫分析法测定,由合肥中国科技大学GC-1500γ放射免疫计数仪完成,试剂盒购自北京北方生物技术研究所有限公司。
1.2.2 标本采集标本采集:清晨空腹时抽血3 ml,置于非抗凝试管中,静置30 min,2 500 r/min离心10 min,分离血清,-80℃冰箱保存备用。具体操作方法严格按试剂盒说明书进行。
1.2.3 统计处理应用SPSS19.0统计软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,采用t检验;如不符合正态分布或方差不齐采用非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 健康对照组和MM患者不同ISS分期IL-6、β2-MG指标比较MM组患者血清IL-6、β2-MG水平均显著高于健康对照组,其差异均具有统计学意义,P<0.05;MM患者ISSⅡ期IL-6、β2-MG水平显著高于ISSⅠ期,差异均具有统计学意义,P<0.05;MM患者ISSⅢ期IL-6、β2-MG水平显著高于ISSⅠ期和ISSⅡ期患者,差异均具有统计学意义,P<0.05。见表1。
表1 MM患者不同ISS分期IL-6、β2-MG检测结果比较(±s)

表1 MM患者不同ISS分期IL-6、β2-MG检测结果比较(±s)
2.2 MM患者各治疗组IL-6与β2-MG水平变化比较与健康对照组相比,MM患者初治组与复发难治组血清中IL-6、β2-MG的水平均显著高于对照组,差异有统计学意义(P<0.05);治疗有效组与健康对照组相比,差异无统计学意义(P>0.05)。与初治组相比,MM患者治疗有效组IL-6、β2-MG表达水平显著降低,差异有统计学意义(P<0.05);而MM患者复发难治组血清中IL-6、β2-MG的表达水平均明显高于初治组,差异有统计学意义(P< 0.05)。见表2。
表2 MM患者各治疗组IL-6与β2-MG水平变化比较(±s)
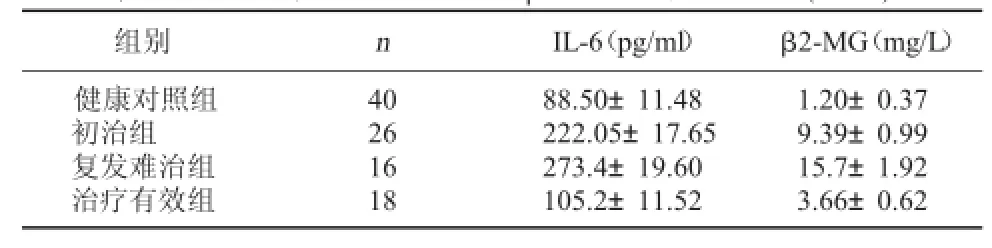
表2 MM患者各治疗组IL-6与β2-MG水平变化比较(±s)
3 讨论
多发性骨髓瘤是一种常见的恶性肿瘤,以骨髓浆细胞异常增生为特征的恶性血液系统疾病。约占人类全部恶性肿瘤的1%,占血液系统恶性肿瘤的10%~15%[4~5]。骨髓瘤细胞起源于骨髓中的前B细胞,进入淋巴结阶段受到抗原刺激后,其增殖产生记忆B细胞,在淋巴结中完成免疫球蛋白类别转换,可变成为浆细胞瘤细胞,瘤细胞至骨髓定居。本病多发生于40~70岁中年及老年人,98%患者的发病年龄>40岁,其病因迄今未十分明确,至今仍不能治愈,MM发病机制异常复杂,其疾病发展涉及到骨髓微环境与骨髓瘤的相互作用[6~7],近年来发病率显著上升,早期明确诊断,以便及时治疗具有非常重要的临床意义。
IL-6是由机体活化的免疫细胞及基质细胞分泌小分子蛋白质,通过结合细胞表面的相应受体IL-6受体发挥生物学效应。主要是介导和调节免疫应答及炎症反应。IL-6是支持浆细胞增殖分化的关键因子,所以浆细胞瘤细胞的持续增殖应当有IL-6的持续高水平存在,在多种疾病如炎症、病毒感染、肿瘤和自身免疫性疾病中发挥作用[8~9]。IL-6可通过自分泌或旁分泌的方式作用于多发性骨髓瘤患者,在此基础上产生互相应答效应,从而影响MM细胞的增殖[6]。本研究中,多发性骨髓瘤患者血清IL-6水平显著高于对照组,ISS分期越高,IL-6水平亦越高,提示IL-6水平可评估疾病严重程度且作为临床分期的重要依据。研究还发现,将MM患者分为初治组、治疗有效组、复发难治组进行比较后,我们发现治疗有效组MM患者的IL-6水平较初治组MM患者明显下降,其原因可能是治疗后患者的体液免疫功能由原有受到抑制到有所恢复,治疗有效后原有表达异常细胞得到了部分抑制。我们同时发现,治疗有效组患者较复发难治组患者IL-6水平下降显著,提示IL-6细胞与MM细胞浸润程度呈正相关,与患者的疗效密切相关,IL-6是促使B细胞分化成浆细胞主要细胞因子。总之,多发性骨髓瘤患者高表达IL-6,可作为评估病情、治疗效果和预后的重要指标[10~11]。
本研究中,IL-6水平的变化与β2-MG水平变化一致[12],而β2-MG同样是反映肿瘤负荷和预后的指标。研究表明,多发性骨髓瘤β2-MG水平可反映MM细胞的增殖情况,且能作为多发性骨髓瘤患者预后的独立预测因素。β2-MG是一种内源性低分子量血清蛋白质,由淋巴细胞和其它大多数的有核细胞分泌。它存在于尿、血浆、脑脊液及淋巴细胞、多核中性粒细胞及血小板的表面,量极微。血清β2-MG极易通过肾小球滤过膜,滤过的β2-MG 99.9%被近曲小管细胞重吸收和降解,不再返流入血。正常人β2-MG的合成速度和细胞膜释放的量是非常恒定的,从而使β2-MG含量保持稳定水平。而许多疾病,肝炎、肾炎、类风湿关节炎,以及恶性肿瘤、免疫性疾病等,均可使血β2-MG升高。MM患者体内肾功能损害严重,浆细胞分泌β2-MG明显增多,如果出现骨髓瘤肾病,β2-MG的排出也会增多,所以MM患者血清中存在高水平β2-MG。目前认为β2-MG除了可独立预测预后外,β2-MG也是MM患者鉴别诊断、临床分期、病情判断、疗效监测的重要参数之一。本研究发现MM患者β2-MG水平增高的同时伴有IL-6细胞比例的上升,两者呈明显相关性。
综上所述,提示IL-6与β2-MG均可作为辅助指标反映肿瘤负荷状态,IL-6、β2-MG在多发性骨髓瘤的发生发展中起着重要作用,可将IL-6、β2-MG作为判断多发性骨髓瘤病情发展和预后的重要指标。
[1]Qin SF,Liu L.Effect and safety of CIK cell infusion on peripheral blood immune eell level in the elderly patients with multiple myeloma[J].JournalofExperi-mentaIHematology,2016,24(2):482-486
[2]Smirnova OV,Manchuk VT,Agilova YN.Clinical and immunological features of infectious complications in patients with multiple myeloma[J].VestnRoss Akad Med Nauk,2015,10(5):534-540
[3]Wang Y,Lewis DF,GU Y,et a1.Elevated maternal solahle Gpl30 and IL-6 levels and reduced Gpl30 and SOCS-3 expressions in women complicated with preeclampsia[J].Hypertension,2011,57(2):336-342
[4]Woodrick RS,Ruderman EM.Interleukin 6 inhibition-RA and beyond [J].Bull NYU Hosp Jt Dis,2011,69(3):225-229
[5]Loffler D,Brocke-Heidrich K,Pfeifer G,et a1.Interleukin-6 dependent survival of multiple myeloma cellsinvolves the Stat3-mediated induction of micro RNA-21 through a highly conserved enhancer[J]. Blood,2007,110(4):1330-1333
[6]Hutani M,Shahid Z,Schnebelen A,et a1.Cutaneous manifestations of multiple myeloma and other plasma cell proliferative disorders[J]. Semin Oncol,2016,43(3):395-400
[7]李瑛,李军.多发性骨髓瘤患者血清中IL-6与IL-27水平监测的临床应用[J].现代检验医学杂志,2016,31(4):87-89
[8]Mauer J,Denson JL,Bruning JC.Versatile functions for IL-6 in metabolism and cancer[J].Trends Immunol,2015,36(2):92-101
[9]Bedewy AM,El-Maghraby SM.Do baseline Cereblon gene expression andIL-6receptorexpressiondeterminetheresponseto thalidomide-dexamethasone treatment in multiple myeloma patients [J].Eur J Haematol,2014,92(1):13-18
[10]Lust JA,Lacy MQ,Zeldenrust SR,et al.Reduction in Creactive protein indicates successful targeting of the IL-1/IL-6 axis resulting in improved survival in early stage multiple myeloma[J].Am J Hematol,2016,91(6):571-574
[11]Mailankody S,Korde N,Lesokhin AM,et al.Minimal residual disease in multiple myeloma:bringing the bench to the bedside[J].Nat Rev Clin Oncol,2015,12(5):286-295
[12]Al-Shanti N,Stewart CE.Inhibitory effects of IL-6 on IGF-1 activity in skeletal myoblasts could be mediated by the activation of SOCS-3 [J].J Cell Biochem,2012,113(3):923-933(收稿日期:2016-10-03)
Changes of serum Interleukin-6、β2-MG Levels in Patients with Multiple Myeloma and Its Clinical Significance
ZHENG Jian-xun
(Department of Clinical Laboratory,the Affiliated Hospital of Fujian University of Traditional Chinese Medicine,Fuzhou350004)
Objective:To investigate the changes of serum IL-6、β2-MG in patients with multiple myeloma and its clinical significance.Methods:Sixty patients with multiple myeloma were enrolled from June 2008 to June 2015 in our hospital.Forty healthy volunteers were selected as control group.The levels of IL-6 and β2-MG were measured by Radioimmunoassy(RIA).Results:The levels of IL-6 and β2-MG in the MM group were significantly higher than those in the control group(P<0.05).The levels of IL-6 and β2-MG which were higher than those of ISSⅠand ISSⅡ(P<0.05).Serum IL-6 and β2-MG expression levels in first-treated group and recurrence group of paients with MM were significantly higher than those of control group,and the difference was statistically significant (P<0.05).Compared with first-treated group,the IL-6 and β2-MG expression level of alleviated group were significantly lower than in the early treated group,and the difference was statistically significant(P<0.05),the IL-6 and β2-MG expression levels in recurrence group were significantly higher than those of first-treated group(P<0.05).Conclusion:IL-6 and β2-MG play an important role in the development and progression of multiple myeloma,elevation of IL-6 and β2-MG are closely related to the prognosis of patients,IL-6 and β2-MG can be used as an important index to judge the development and prognosis of multiple myeloma.
Multiple myeloma;Interleukin-6;β2-microglobulin;Prognosis;Influencing factors
R733.3
B
10.13638/j.issn.1671-4040.2016.11.006

