一种评价医用敷料对创面黏附性能的体外试验方法
张丽梅 孙海鹏 刘万宗 山东省医疗器械产品质量检验中心 (山东 济南 250101)
一种评价医用敷料对创面黏附性能的体外试验方法
张丽梅 孙海鹏 刘万宗 山东省医疗器械产品质量检验中心 (山东 济南 250101)
本文采用一个独特的体外定量模型,即用生物基质模拟伤口与医用敷料的黏附作用。用纤维蛋白凝块提供创面黏着,通过测量从纤维蛋白凝块上去除敷料材料所需的力,来评价敷料对创面的黏附性。本试验可用于不同敷料对创面的潜在黏附性的横向比较,4种敷料剥离力值分别为:0.150N、0.225N、0.445N、2.760N,试验结果说明带防粘连层的新型敷料比传统型敷料潜在黏附性明显降低。本试验重复性较好,可用来替代目前的动物体内试验。
医用敷料 纤维蛋白凝块 黏附性
敷料可根据材质分为传统敷料如脱脂棉纱、生物敷料和合成敷料等。由于敷料材料及结构的不同,其性能有较大的差异。在临床上,敷料与创面发生粘连可导致敷料更换困难并导致二次创伤,不仅给患者带来痛苦,还延缓了创面愈合进程;也有敷料材料纤维与伤口产生黏附,导致纤维残留在伤口创面,从而产生炎性反应而导致伤口感染的不良反应报道。因此降低敷料的潜在黏附性以减少纤维在伤口表面残留的数量,可以促进伤口愈合的进程。本试验方法采用体外试验方法,可用来评价不同敷料间潜在黏附性,以进行横向比较,可替代目前的动物体内试验。
1.资料与方法
1.1 一般资料
试验试剂:牛血清白蛋白(BSA)、纤维蛋白原、凝血酶、磷酸盐缓冲液(PBS)、氯化钠溶液。
试验仪器:拉力试验机、恒温恒湿箱、干燥箱、六孔细胞培养板。
样品:打孔膜伤口敷贴(1#)、去除打孔膜的伤口敷贴(2#)、藻酸盐敷料(3#)、纱布块(4#)。
1.2 方法
将纤维蛋白原、磷酸盐缓冲液、生理盐水放入(37±2)˚C干燥箱内预热2h;精确称取1.0g牛血清白蛋白(BSA),充分溶于100mL磷酸盐缓冲液(PBS)中,形成溶液A;精确称取3.0g纤维蛋白原,使其充分溶于溶液A中,形成溶液B;将凝血酶溶解于适量9g/L氯化钠溶液中,使其浓度约为300U/mL,形成溶液C;
将六孔细胞培养板中每孔先加10mL溶液B,再加入1mL溶液C,迅速搅拌均匀。然后将培养板盖紧,置于37˚C下培养24h,取出后室温冷却1h,使形成纤维蛋白凝块。
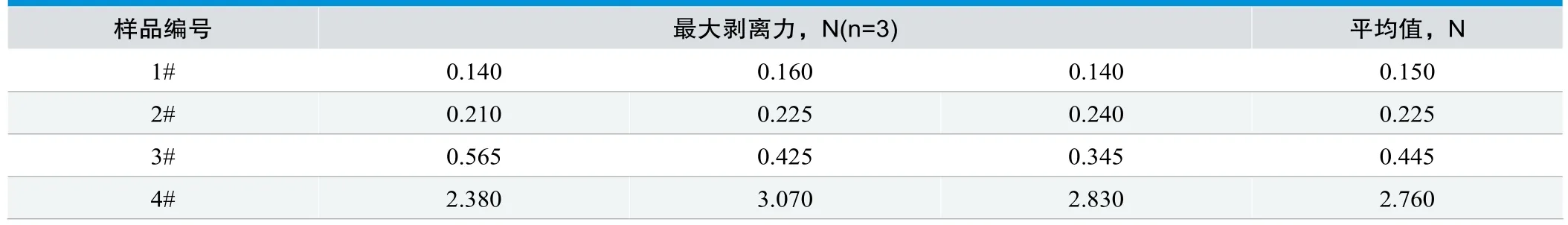
表1. 四种敷料拉力测定结果
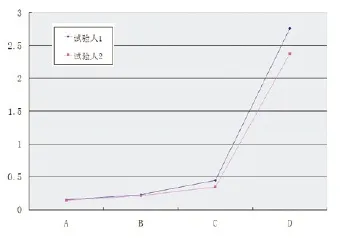
图1 重复性试验结果
将敷料样品裁剪成适宜宽度,将纤维蛋白凝块完整取出并置于两试样之间,施加一定负载并转移到37˚C恒温恒箱内继续培养适宜的时间。然后在37˚C下干燥3~4h,以敷料外表面干燥为宜。
将干燥好的敷料与纤维蛋白凝块组合体安装于拉伸试验机的夹具上,以100mm/min的速率拉伸,直至敷料完全与纤维蛋白凝块剥离,试验过程可用手轻扶组合体,但注意不要施加额外力。
2.结果
2.1 不同敷料横向比较结果
分别选取拉伸试验过程记录的最大力值。4种敷料与纤维蛋白凝块剥离所需拉伸力值见表1。
由表1可以看出,在敷料与模拟创面纤维蛋白凝块剥离的过程中,4#传统型纱布块敷料所需剥离力值最大,1#、2#、3#新型功能性敷料所需剥离力值较小;2#去除打孔膜的敷贴比添加了1#打孔膜防粘连层的敷贴所用力值大。试验结果与实际临床使用过程中揭除敷料所有力值不是等同的,但所需力值大小趋势情况是一致的,且同种敷料间数值离散程度很小,说明本试验得出的数据真实可靠,不同敷料之间的性能差别明确且稳定。
2.2 重复性试验
在不同时间由2位操作者用本方法对4种敷料分别进行了2次试验,以验证方法的可重复性。图1示出了重复性试验结果的。从图1可看出,本方法所得数据稳定,平行性较好,说明试验重复性较好。
3.讨论
本方法的原理是基于纤维蛋白的产生,是止血栓的基础材料,凝血级联反应的最终产物。血液凝固的机理是溶胶状态的纤维蛋白原转变为凝胶状态的纤维蛋白,催化此反应的主要是凝血酶。通过凝血酶使纤维蛋白原裂解产生纤维蛋白。纤维蛋白聚合物与白蛋白结合,形成纤维蛋白凝块,以此来模拟创面环境[1]。
本文是对不同敷料与创面的潜在黏附性的进行了横向比较,试验结果离散性小、重复性较好,可用来替代目前的动物体内试验。本试验方法也可用于产品开发及工艺改进过程中对伤口敷料材料的选择及同一敷料间的纵向比较,如带打孔膜防粘连层的敷贴,可采用本试验测试打孔膜防粘连层上的打孔的数量和开孔面积大小差异对产品黏附性的影响[2]。
因试剂的来源与敷料材质存在差异,对纤维蛋白原和凝血酶浓度、培养时间、干燥时间几个试验变量应进行验证,以确定适宜参数值。
敷料的材料类型不同,临床预期用途不同,其潜在粘连性也会存在较大差异。如果用相同评价方法(包括试验方法和试验参数)对不同敷料的潜在粘连性进行评价,结果存在一定不合理性。因此,应根据敷料的材质、预期用途及预计的潜在粘连性的大小等设计一适宜的评价方法,宜根据试剂的来源与敷料材质存在的差异,对纤维蛋白原和凝血酶浓度、培养时间、干燥时间几个试验变量应进行验证,确定适宜试验参数值。可根据敷料类型及临床预期使用剥离力大小等选择适宜样品夹持方式,如0˚无支持、90˚用手支持以及180˚用板支持等来模拟实际剥离可能的状态,以得出合理的评价结果[3]。
[1] R Clark, M Delbono, SA Stephens, et al. Development of an in vitro model to evaluate the potential for adherence of wound healing dressings[J]. Wound Repair & Regeneration, 2009,17(2):A30-A30
[2] SJ Valey, SE Barnett. A Study of wound dressing adhesion [J]. Clinical Materials, 1986,1(1):37–57.
[3] YY/T 0681.2-2010.无菌医疗器械包装试验方法第2部分:软性屏障材料的密封强度 [S]. 国家食品药品监督管理局, 2010,12,27.
In Vitro Test Method for Adhesion Properties Evaluation of Dressings to Wound
ZHANG Li-mei SUN Hai-peng LIU Wan-zong Shandong Quality Inspection Center for Medical Devices (Shandong Jinan 250101)
This paper uses a unique quantitative model in vitro, with biological matrix to simulate the adhesion function of medical dressing to wound With fbrin clot provide wound adhesive, Measuring the force required to peel the dressing from the fbrin clot to evaluate the adhesion properties of non-adhesive wound dressings. This test can be applied to transverse comparison potential adhesivion of different dressings with the wound. Maximum force to remove the dressing material from the clot of four dressings are: 0.150N, 0.225N, 0.445N, 2.760N, It can validate that potential adhesion of new type dressing with anti adhesion layer is better signifcantly lower than that of the traditional dressings. This in vitro test is repeatability and can be used to substitute the current animal in vivo tests.
medical dressing, fbrin protein clot, adhesion properties
1006-6586(2016)08-0001-02
R197.39
A

