盆花文心兰丛生芽组培快繁技术研究
叶秀仙,黄敏玲*,罗远华,林榕燕,钟淮钦
(1.福建省农业科学院作物研究所,福建 福州 350013;2.福建省农业科学院花卉研究中心,福建 福州 350013; 3.福建省特色花卉工程技术研究中心,福建 福州 350013)
盆花文心兰丛生芽组培快繁技术研究
叶秀仙1,2,3,黄敏玲1,2,3*,罗远华1,2,3,林榕燕1,2,3,钟淮钦1,2,3
(1.福建省农业科学院作物研究所,福建 福州 350013;2.福建省农业科学院花卉研究中心,福建 福州 350013; 3.福建省特色花卉工程技术研究中心,福建 福州 350013)
以文心兰‘豹斑宝石’花梗为外植体,采用丛生芽诱导途径,利用正交设计法,探讨基本培养基(MS、花宝1号、改良1号、改良2号、改良3号)、植物生长调节剂(6-BA、NAA、IBA)、水解酪蛋白(CH)等对其丛生芽诱导、增殖、生根等关键环节的影响,以期建立文心兰‘豹斑宝石’丛生芽组培快繁技术。结果表明:各试验因素对文心兰丛生芽增殖影响的主次关系为6-BA>基本培养基>NAA>CH;筛选出丛生芽适宜的增殖培养基配方为改良1号 + 6-BA 3.0 mg·L-1+ NAA 0.1 mg·L-1+CH 0.5 g·L-1+白糖30 g·L-1+琼脂粉5.0 g·L-1,50 d平均增殖系数达5.8;筛选出适宜生根的培养基配方为改良3号+ IBA 0.5 mg·L-1+活性碳0.5 g·L-1+白糖20 g·L-1+琼脂粉3.6 g·L-1+卡拉胶3.6 g·L-1,生根率为100.0%;试管苗移栽6个月成活率达96.8%。
文心兰;丛生芽;正交设计;组织培养
文心兰为兰科文心兰属Oncidium植物,是大宗商品兰花,在台湾产业仅次于蝴蝶兰。在台湾企业的带动下,福建省文心兰产业迅速崛起,成为全国主要种植基地之一。盆花文心兰适栽范围广,种质资源丰富,花色、花型多样,观赏期长、部分种质更具香味,开发利用前景良好。文心兰同其他兰科植物一样,按照传统的分株繁殖法进行繁殖,繁殖系数较低,难以满足生产需要。因此其种苗繁殖可以通过组织培养技术来实现种苗工厂化生产[1-4]。
目前,国内关于文心兰组织培养研究报道,主要采用2种诱导途径,较多研究是选择原球茎诱导途径,即通过原球茎诱导、增殖及苗分化达到快速繁殖的目的,虽然繁殖系数比较高,但由于原球茎途径要经历脱分化再分化培养过程,仍存在历时较长、成苗率较低等问题,且还可能存在再生植株易出现变异的风险。而丛生芽诱导途径的优点是通过芽生芽达到快速繁殖的目的,可大大降低后代变异的可能性。近年来,本课题组在文心兰‘蜜糖’、‘小樱桃’等品种的种苗繁育方面实践证实了丛生芽途径的可行性[5-7]。目前,有关文心兰采用丛生芽诱导途径建立组培快繁技术的系统研究报道较少[5-8],且由于存在外植体部位、基因型等因素的差异, 其组培快繁关键技术环节中依然存在较多值得进一步研究的问题,包括如何通过基本培养基、植物生长调节剂、培养条件等诱导增殖与生根移栽关键因子的优化,构建一套适用于文心兰种苗繁育的生产技术,来满足市场对优质种苗的需求。
文心兰‘豹斑宝石’系Cochlioda×Odontoglossum×Zelenkoa三属杂交而来的红花豹斑大花型新品种,花朵艳丽,开放整齐;叶片浓绿挺立,假鳞茎饱满,盆花商品价值高。目前,有关文心兰‘豹斑宝石’丛生芽组培快繁技术研究未见报道。本研究采用丛生芽诱导途径,探讨基本培养基、植物生长调节剂等对‘豹斑宝石’丛生芽诱导、增殖与生根培养等关键环节的影响,旨在探索文心兰优质种苗工厂化快繁技术,为提高其种苗商业化生产效率提供技术基础。
1 材料与方法
1.1 材料
文心兰‘豹斑宝石’ZelglossodaCalicoGem‘Green Valley #1’,台湾引进的盆花品种,选择健壮植株抽长的幼嫩花梗作为培养的外植体。试验在福建省特色花卉工程技术研究中心花卉育种实验室进行。
培养基花宝1号产地美国,其N、P、K质量比7∶6∶19;改良1、2、3号基本培养基参照MS调整N、P、K含量,其他元素含量不变,其中改良1、2号中大量元素KNO3、NH4NO3、KH2PO4、 MgSO4·7H2O调整为MS的1/2、 1/3, 并附加花宝1号1.5 g·L-1,改良3号大量元素NH4NO3、KH2PO4、 MgSO4·7H2O及CaCl2·2H2O调整为MS的1/2,并附加花宝1号0.8 g·L-1。所用试剂均为国药集团化学试剂有限公司生产的分析纯;白糖为厦门古龙牌优质白砂糖;琼脂粉、卡拉胶产地日本,强度1 400 g·cm-2。
1.2 方法
1.2.1 外植体消毒灭菌处理 从健康母株上选取幼嫩带腋芽的花梗,用自来水冲洗干净,然后分段并剥去腋芽芽鞘,在超净工作台上将外植体放入无菌容器中,先用75%的酒精浸泡30 s,随后转入0.1%升汞溶液中浸泡消毒6 min,更换升汞溶液,进行二次消毒5 min,取出用无菌水冲洗4~5次,再用无菌滤纸吸干水分,备用。
1.2.2 丛生芽诱导与增殖 切取带腋芽的节间部分接种到1/2MS+噻重氮苯基脲(TDZ)0.5 mg·L-1+NAA 0.1 mg·L-1+白糖30 g·L-1+琼脂粉5.0 g·L-1培养基中进行丛生芽诱导培养。获得的丛生芽作为增殖培养试验材料。
丛生芽增殖采用4因素4水平L16(44)正交设计,选择基本培养基(MS、花宝1号、改良1号、改良2号)、6-BA、NAA、水解酪蛋白(CH)为试验因素,代号分别为A、B、C、D,各设置4个水平,详见表1。各处理培养基均附加白糖30 g·L-1、琼脂粉5.0 g·L-1。16个处理,每处理接种5瓶,每瓶接种10团(每团带2~3个小芽),3 次重复。增殖培养45~50 d时统计丛生芽增殖系数。增殖系数=增殖芽数/接种芽数。
1.2.3 生根培养 以改良3号为基本培养基,添加不同浓度的NAA(0.2、0.5 m g·L-1)和IBA(0.2、0.5 m g·L-1)以及活性碳0.5 g·L-1,白糖20 g·L-1,琼脂粉3.6 g·L-1,卡拉胶3.6 g·L-1。6个处理,每处理接种6瓶,每瓶接种25株,3 次重复。生根培养75 d时统计生根情况。
1.2.4 炼苗移栽 当苗高8.0~11.0 cm、具5~7片叶时,将瓶苗放置于遮光率70%~80%的温室中炼苗,并进行移栽种植,定期观测移栽成活率及生长表现。
1.2.5 培养方式与培养条件 以650 mL的组培瓶为培养容器,采用固体培养基培养方式, pH值5.8,培养温度为(25±2)℃,光强为2 000~2 500 lx,光照时间为12 h·d-1。
1.3 数据统计
采用正交设计助手V3.1软件进行分析[9]。

表1 L16 (44 ) 因素及水平Table 1 L16 (44) factors and levels of orthogonal experimentation
2 结果与分析
2.1 丛生芽诱导与增殖
带腋芽的花梗切段接种在诱导培养基上,培养21 d 时,花梗芽逐渐萌动膨大,基部逐渐脱分化出生长点,逐渐形成突起,分化出丛生小芽,经3~5次继代转接,获得一定量的丛生芽作为下一步增殖培养试验材料。
芽的增殖是文心兰组培快繁的重要环节,增殖率影响繁殖效率。利用正交设计法[L16(44) ]研究了基本培养基、6-BA、NAA、水解酪蛋白(CH) 4 种因素对文心兰丛生芽增殖的影响,从而优化增殖培养条件以筛选出适宜的培养基配方。丛芽团接种21 d时,芽基部切口部位开始膨大,35 d时不同处理组陆续长出丛生芽。增殖培养50 d时统计丛生芽增殖系数(增殖系数= 增殖芽数/接种芽数),试验统计分析结果见表2、3。
表2结果表明,从k值大小可以看出, 在文心兰丛生芽增殖培养过程中, 以改良1号为基本培养基较好,6-BA浓度需求量较高, 适宜浓度为3.0 mg·L-1,NAA适宜浓度为0.1 mg·L-1,CH为0.5 g·L-1;从极差R值大小可以看出,不同因素对丛芽增殖影响的主次关系为B>A>C>D,这说明对文心兰丛芽增殖起主要作用是6-BA,其次是基本培养基,NAA、CH对增殖的影响较小。文心兰丛芽增殖最佳处理组合是A3B4C2D3,即改良1号 + 6-BA 3.0 mg·L-1+ NAA 0.1 mg·L-1+CH 0.5 g·L-1,50 d增殖系数达5.8。实现了种苗大量繁殖,为工厂化育苗提供了技术保障(图1)。
从表3可知,基本培养基、6-BA这2个因素均显著影响文心兰丛生芽增殖系数,但其影响程度的大小有较大差异,表现为6-BA>基本培养基, NAA和CH这2个因素无显著影响,与极差分析结果一致。

表2 ‘豹斑宝石’丛生芽增殖L16 (44 )正交试验设计与极差分析结果Table 2 Orthogonal experiment results
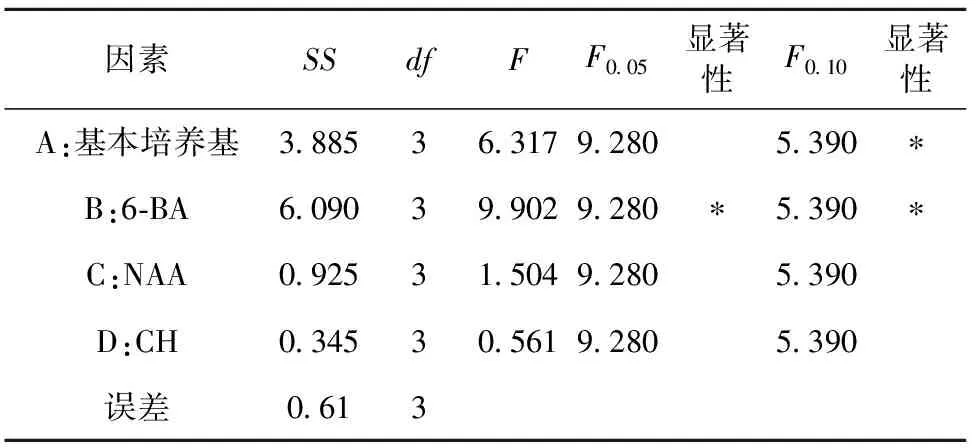
表3 ‘豹斑宝石’丛生芽增殖系数方差分析结果Table 3 Analysis of variance on propagation rate
2.2 生根培养
丛生芽增殖获得大部分芽可直接转入生根培养基进行培养,少量小芽可继续增殖或先转接到改良1号 +白糖30 g·L-1+ 琼脂粉3.0 g·L-1+ 卡拉胶3.0 g·L-1的培养基进行壮苗培养30~35 d,待苗长至2.0~3.0 cm时,再进行生根培养。
试管苗生长表现见表4,综合考虑生根率、发根数及根的质量,筛选出适宜生根的培养基配方为改良3号+ IBA 0.5 mg·L-1+活性碳0.5 g·L-1+白糖20 g·L-1+琼脂粉3.6 g·L-1+ 卡拉胶3.6 g·L-1,生根率为100.0%,平均生根数8.5条,平均根长3.6 cm(图2)。
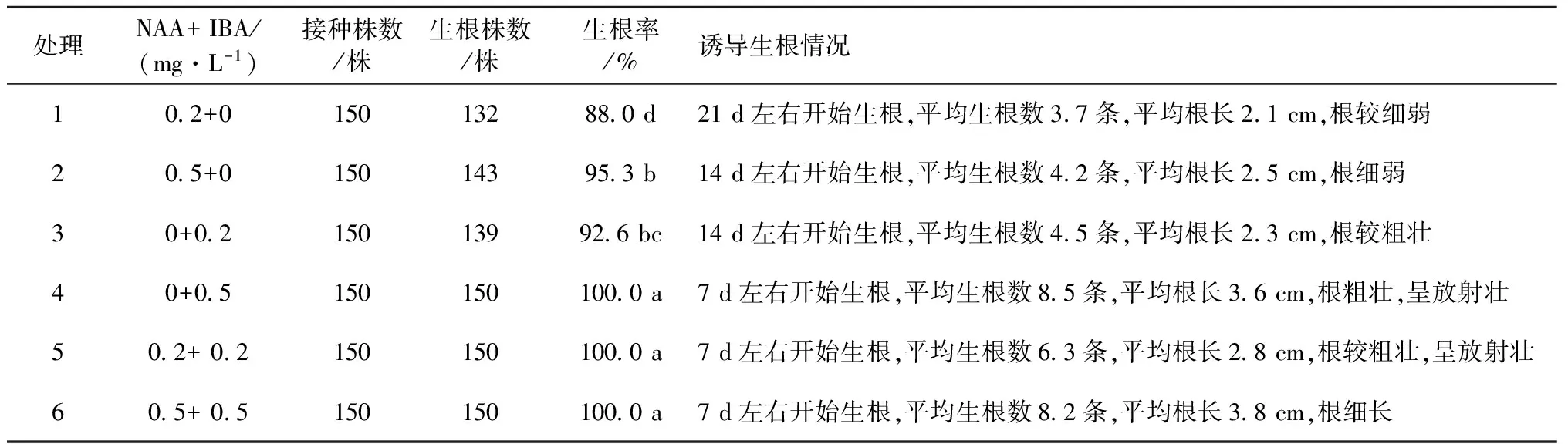
表4 不同浓度的NAA和IBA对试管苗生根培养的影响Table 4 Effect of NAA and IBA concentrations on plantlet rooting in test tube
2.3 炼苗及移栽
当文心兰苗高8.0~11.0 cm,具5~7片叶时,将瓶苗放置于遮光率70%~80%的温室中炼苗约15 d(闭口10 d、半敞口3 d、全敞口3 d),以提高瓶苗适应力(图3)。
炼苗后进行清水洗苗,洗净根部粘连的培养基,然后将苗置于1.0 g·L-1多菌灵或百菌清杀菌剂溶液浸泡消毒5 min,捞出晾干,及时剔除畸形、弱小植株,采用水苔(水苔需用清水浸泡8 h以上,沥干水分后,用清水冲洗一遍再挤干水分备用)包住根部植入直径5.0 cm育苗杯中,放置四槽托盘整齐摆放在温室层架上进行常规栽培管理(图4)。
移栽种植过程生长表现如表5所示,移栽6个月成活率达96.8%,且生长势强,根系生长良好(图5);在移栽6个月时,进行了直径11 cm育苗杯换盆种植,以树皮与椰壳组合(比例2∶1)为栽培基质,换盆后加强水肥管理,生长速度加快,形成的假鳞茎健壮、饱满,呈扁圆形生长,换盆种植6个月成活率达100.0%,且生长势强(图6)。

表5 文心兰试管苗移栽生长表现Table 5 Growth performance of transplanted plantlets from test tubes
3 讨论与结论
文心兰种苗繁育基本技术环节主要包括丛生芽诱导、丛生芽增殖、壮苗生根及炼苗移栽等,由于存在外植体基因型等因素的差异,其各环节关键技术在对特定基因型材料进行培养时,一定要进行反复试验, 才能寻找最适合特定基因型材料培养的专用培养基与培养方式。
本试验选择丛生芽途径直接诱导出苗,并利用正交试验设计方法,探索文心兰‘豹斑宝石’丛生芽增殖培养体系,筛选出适宜的增殖培养基配方是改良1号 + 6-BA 3.0 mg·L-1+ NAA 0.1 mg·L-1+CH 0.5 g·L-1+白糖30 g·L-1,50 d增殖系数达5.8,有效提高了其繁殖效率,为种苗工程化育苗提供了技术保障。筛选出适宜生根的培养基配方为改良3号+ IBA0.5 mg·L-1+活性碳0.5 g·L-1+白糖20 g·L-1+琼脂粉3.6 g·L-1+卡拉胶3.6 g·L-1,生根率为100.0%,平均生根数8.5条,平均根长3.6 cm,获得健壮生长的生根苗为移栽成活提供了基础保障,移栽6个月成活率可达96.8%,换盆种植6个月成活率达100.0%。可见其组培快繁的各个环节是紧密相扣的,保持一定增殖率的同时,诱导生根、炼苗移栽等环节也至关重要。
据有关报道,原球茎月增殖率高,可达332.5%,但采用原球茎诱导途径,其外植体经原球茎到成苗比丛生芽途径成苗要晚60 d以上,而且长成的苗大多纤细柔弱,必须经过壮苗培养阶段才能更好地生长,另外原球茎后代再生植株中有较高的变异率,难以保持母株的优良特性[10]。而本研究选用丛生芽途径,1个芽在50 d内增殖系数可达5.8,虽然增殖系数比原球茎低,但长成的苗大多健壮,无须壮苗培养就可直接进行生根培养,从而简化培养步骤,降低培养成本。因此,笔者认为采用丛生芽途径繁殖文心兰具有更大的应用价值,尤其适用于文心兰优良品种的种苗生产。
关于文心兰组培的文献报道较多[11-15],但不同研究者得出不尽相同的试验结果,这可能与所使用材料的基因型不同有一定关系,对特定基因型材料进行培养时, 必须考虑材料的基因型,确立适合于自身材料特点的培养条件与培养方案。本研究初步建立了文心兰‘豹斑宝石’丛生芽组培快繁技术,其中更优化的技术培养方案有待进一步试验探讨。
[1]何松林,十鸟三和子,孔德政,等. 基本培养基及凝固剂对文心兰试管苗生长发育的影响[J].北京林业大学学报,2001,(1):29-31.
[2]崔广荣,刘云兵,张俊长,等. 文心兰组织培养的研究 [J]. 园艺学报,2004,(2):253-255.
[3]黄萍萍,潘伟彬,廖福琴,等. 文心兰组织培养与快速繁殖 [J]. 闽西职业大学学报,2003,(4):67-68.
[4]何松林,孔德政,杨秋生,等. 碳源和有机添加物对文心兰原球茎增殖的影响[J]. 河南农业大学学报,2003,(2):154-157.
[5]叶秀仙,黄敏玲,吴建设等. 文心兰茎尖诱导丛生芽高频率植株再生[J]. 福建农业学报, 2009, 24(2) :126-137.
[6]叶秀仙,黄敏玲,钟淮钦,等. 文心兰离体再生体系建立及试管苗种质保存研究.中国观赏园艺研究进展2009[M]. 北京:中国林业出版社,2009:193-197.
[7]叶秀仙,黄敏玲,罗远华,等. 应用正交设计优化文心兰丛生芽增殖培养体系[J]. 福建农业学报, 2013, 28(9) :897-901.
[8]谷风,候卓捷,张志平,等. 文心兰丛生芽组培快繁研究初报 [J]. 中国农学通报,2007,(2):85-88.
[9]陈小桦,岑爱华,罗晓青. 正交试验设计方法在植物无性繁殖研究中的应用[J]. 园艺与种苗,2012,(9):1-3.
[10]丁兰,付庭治. 兰花生物工程研究进展[J]. 西北师范大学学报:自然科学版,2000, (3):111-116.
[11]崔广荣. 文心兰组织培养及转基因研究进展[J]. 草业学报,2010,19(4) :220-229.
[12]崔广荣,刘士勋,何玉华,等. 文心兰试管苗丛生芽高效增殖体系的建立[J]. 西北植物学报, 2005, 25(3) :562-567.
[13]崔广荣,刘云兵,何玉华,等.不 同细胞分裂素对文心兰试管苗增殖的影响[J].特产研究,2005,27(2):37-39.
[14]杨玉珍,雷呈,孙天洲,等. 文心兰组织培养激素选择及组培苗的移植管理技术[J]. 西部林业科学,2004,33(1):55-58.
[15]潘学锋,王日暖,莫海. 文心兰茎尖离体培养研究[J]. 热带林业,2001, 29(4):145-152.
(责任编辑:柯文辉)
Bud Tissue Culture and Rapid Propagation of Potted Flower,Oncidium
YE Xiu-xian1,2,3, HUANG Min-ling1,2,3*, LUO Yuan-hua1,2,3, LIN Rong-yan1,2,3, ZHONG Huai-qin1,2,3
(1.InstituteofCropSciences,FujianAcademyofAgriculturalSciences,Fuzhou,Fujian350013,China; 2.FlowersResearchCenter,FujianAcademyofAgriculturalSciences,Fuzhou,Fujian350013,China;
3.FujianEngineeringResearchCenterforCharacteristicFloriculture,Fuzhou,Fujian350013,China)
The peduncle axillary buds of Zelglossoda Calico Gem, Green Valley #1, were used as explants for the study. The bud clumps induction pathway was experimented with orthogonal design to study the effects of the key factors, such as culture medium (i.e., MS, Hyponex #1, Improvement #1, Improvement #2, and Improvement #3), phytohormone (i.e., 6-BA, NAA, and IBA), and CH, on the plant growth during the induction, propagation, and rooting stages. The results showed that the main factors affecting the bud multiplication included 6-BA, basic medium, NAA, and CH. The optimal growth was observed under the use of the combination of Improvement #1 medium, 6-BA 3.0 mg·L-1, NAA 0.1 mg·L-1, CH 0.5 g·L-1and agar powder 5.0 g·L-1to result in an averaged propagation coefficient of 5.8 in 50 days. For the rooting, Improvement #3 with added IBA 0.5 mg·L-1,AC 0.5 g·L-1, sugar 20 g·L-1,agar 3.6 g·L-1and carrageenan 3.6 g·L-1was the best with a 100.0% rooting rate. The survival rate of the plantlets in 6 months after transplanting from the test tubes was 96.8%.
Oncidium; bud clumps; orthogonal design; tissue culture
2016-07-02初稿;2016-08-14修改稿
叶秀仙(1977-),女,副研究员, 主要从事花卉组织培养技术研究 (E-mail:yxx7861@163.com) *通讯作者:黄敏玲(1960-),女, 研究员,主要从事花卉品种选育与生物技术研究(E-mail: huangml618@163.com)
福建省财政专项——福建省农业科学院科技创新团队PI项目(2016PI-39);福建省种业创新与产业化工程项目(2014S1477-14) ;福建省花卉苗木品种引进与研发创新项目(闽林种站[2013]42号)
S 68
:A
:1008-0384(2016)11-1198-06
叶秀仙,黄敏玲,罗远华,等.盆花文心兰丛生芽组培快繁技术研究[J].福建农业学报,2016,31(11):1198-1203.
YE X-X,HUANG M-L,LUO Y-H,et al.Bud Tissue Culture and Rapid Propagation of Potted Flower,Oncidium[J].FujianJournalofAgriculturalSciences,2016,31(11):1198-1203.

