盐度对口虾蛄仔虾摄食、存活和掘穴的影响
刘海映, 张 嵩, 邢 坤, 陈 雷, 张秀芹
(大连海洋大学 海洋科技与环境学院, 辽宁 大连 116023)
盐度对口虾蛄仔虾摄食、存活和掘穴的影响
刘海映, 张 嵩, 邢 坤, 陈 雷, 张秀芹
(大连海洋大学 海洋科技与环境学院, 辽宁 大连 116023)
为研究口虾蛄(Oratosquilla oratoria)仔虾在人工养殖条件下的盐度适应性, 作者分别实验分析了盐度突变和渐变对其累积存活率、摄食率和掘穴行为的影响。实验结果表明, 仔虾盐度耐受能力较强, 突变组的仔虾存活盐度为15~45, 渐变组的仔虾存活盐度为5~54; 仔虾的适宜盐度为21~33, 24 h存活率在80%以上; 盐度对口虾蛄的摄食影响较大, 突变盐度为21~33时, 仔虾摄食较为活跃, 低于18或高于42基本不摄食; 盐度渐变组摄食活跃范围为19~38, 低于9或高于50基本不摄食; 盐度突变对口虾蛄仔虾掘穴的影响显著, 盐度突变至21和33时, 掘穴时间极显著延长。本实验结果可以为口虾蛄的人工养殖和增殖放流提供参考和依据。
盐度; 口虾蛄(Oratosquilla oratoria); 仔虾; 摄食率; 存活率; 掘穴
口虾蛄(Oratosquilla oratoria), 俗称虾爬子、螳螂虾、琵琶虾等, 隶属节肢动物门(Arthropoda)、甲壳纲(Crustacea)、口足目(Stomatopoda)、虾蛄科(Squillidae)、口虾蛄属(Oratosquilla), 生活在水深5~60 m的水层中, 喜栖息于浅海泥底U型洞穴中或石砾、岩礁缝隙中, 在中国南北沿海都有分布, 是一种多年生的海产经济甲壳类动物。对于口虾蛄的研究,主要集中在日本和中国, Keita等[1-3]对日本沿岸的口虾蛄性腺发育、交配周期、交配模式、产卵量与幼虫的密度等方面进行了深入研究, Ohtomi等[4-5]对黑斑口虾蛄(Oratosquilla kempi)和口虾蛄幼体发育过程中形态变化和幼体在日本湾的空间分布变化进行了跟踪调查和深入研究。国内对口虾蛄的研究主要集中在形态学和繁育生物学的研究, 徐善良等[6]对口虾蛄的繁殖和摄食习性进行了初步研究, 刘海映等[7-10]对口虾蛄形态参数关系、繁殖周期、生殖细胞发育、胚胎发育、早期形态特征发育等方面进行了研究。
盐度作为一项重要环境因子, 对虾蟹类的生长发育有明显的影响作用。申玉春[11]对凡纳滨对虾(Litopenaeus vannamei)的研究表明, 盐度对对虾的蜕壳具有显著的影响, 盐度过高和过低都会使蜕壳率下降。路允良等[12]研究发现盐度显著地影响三疣梭子蟹(Portunus trituberculatus)的生长和幼蟹的蜕壳。韩晓琳等[13]的研究显示, 不同群体三疣梭子蟹幼体对盐度的适应能力不同。尹飞等[14]对黑斑口虾蛄幼体的温度和盐度耐受性进行了初步研究。口虾蛄成体终生生活在洞穴中, 掘穴是仔虾阶段才出现的重要生态特征, 目前, 多采用人工洞穴应用于口虾蛄成虾的繁育与行为学观察, 还未见对仔虾掘穴行为及胁迫条件下掘穴率的报道。本实验模拟研究了口虾蛄仔虾在不同盐度条件下的存活、摄食和掘穴情况, 以期为口虾蛄的人工养殖和增殖放流提供理论参考。
1 材料与方法
1.1 材料
1.1.1 实验对象
口虾蛄亲本来自盘锦海捕野生个体, 选取健壮个体于盘锦光合蟹业公司池塘中生态育苗, 亲虾抱卵孵化出假溞状幼体, 后经室内人工饲育至掘穴性仔虾阶段。取无损伤、活力好的初次蜕皮口虾蛄仔虾作为实验对象。
1.1.2 饵料
投喂饵料为鲜活黑褐新糠虾(Neomysis awatschensis),体长范围为5.19~8.91 mm, 平均湿质量为5.8 mg± 0.8 mg。
1.1.3 海水
实验用海水为砂滤海水, 经充分曝气, 盐度28, pH 6~7, 温度保持在23~24℃, 保持溶氧6 mg/L左右。
1.1.4 容器
实验用容器为长方形白色塑料盒(长280 mm×宽220 mm×高110 mm), 经高锰酸钾溶液消毒处理后使用。
1.1.5 底泥
选取盘锦光合蟹业公司养殖池塘底泥, 经海水浸泡充分后使用, 厚度为10 cm。
1.2 方法
1.2.1 盐度突变对口虾蛄仔虾摄食和存活的影响
实验设置盐度分别为9、12、15、18、21、24、27、30、33、36、39和42、45、48、51, 其中盐度27组为空白对照组, 每组设置3个平行, 分别用砂滤海水、曝气自来水或海盐配成相应盐度, 每个平行组中均加入10只仔虾和20只鲜活糠虾, 持续充气。每12 h观察、记录仔虾的摄食和存活情况, 并换水和重新加入鲜活饵料, 累计观察24 h。根据实验结果,计算各组24h内的平均摄食率。平均摄食率(%)= 100×(投喂总量-未摄食数量)/投喂总量, 其中糠虾剩余残体不足身体一半的视为完全摄食, 超过身体一半的视为未摄食。
1.2.2 盐度渐变对口虾蛄仔虾摄食和存活的影响
实验分为盐度升高组和降低组, 起始盐度分别为30和24, 每组设置3个平行, 用砂滤海水、海盐或蒸馏水配成相应盐度, 每个平行组中各加入10只仔虾和20只鲜活糠虾, 使之适应24 h之后开始实验, 其中盐度27组设为空白对照。实验开始后每12 h进行观察、记录其摄食和存活情况, 并且相应调整1个盐度和重新加入鲜活饵料, 直至口虾蛄个体全部死亡。
1.2.3 盐度突变对口虾蛄仔虾掘穴的影响
实验设置盐度分别为21、24、27、30、33, 其中盐度27组为空白对照组。将底泥均匀平铺于塑料盒底部, 用砂滤海水浸泡24 h以上, 使之充分浸泡,之后用砂滤海水、海盐或蒸馏水配成相应盐度的海水。每组设置3个平行, 每个平行组均加入10只仔虾和20只糠虾, 实验以仔虾个体整体进入洞穴为标准, 观测4 h内不同盐度突变口虾蛄仔虾的掘穴情况,并记录24 h内死亡率。
1.3 数据处理
使用Excel软件对实验数据进行初步处理后, 运用SPSS17.0进行显著差异性分析, 以 P<0.05 作为差异显著水平。
2 结果
2.1 盐度突变对口虾蛄仔虾存活和摄食的影响
2.1.1 盐度突变对口虾蛄仔虾存活的影响
实验结果如图1显示, 口虾蛄仔虾从盐度27放入盐度范围为21~33时, 12 h基本没有死亡现象, 24h只有少量死亡, 与对照组差异不显著(P>0.05);盐度18、36和39实验组, 24 h死亡率保持在50%左右, 与组差异显著(P<0.05); 盐度15、42和45实验组, 个体活力降低, 其运动受到影响, 蛰伏于水底, 12h内大量死亡, 24 h只有极少数存活, 与空白对照组差异极显著(P<0.01); 盐度<12或者>48时,口虾蛄个体在短时间内完全死亡。根据实验结果的显著性差异分析, 盐度21~30范围内口虾蛄仔虾的存活率较高, 为其最适盐度; 15~45为口虾蛄仔虾盐度突变的耐受范围, 口虾蛄仔虾的运动行为受到一定影响; 当盐度小于15或大于45时, 口虾蛄仔虾死亡。
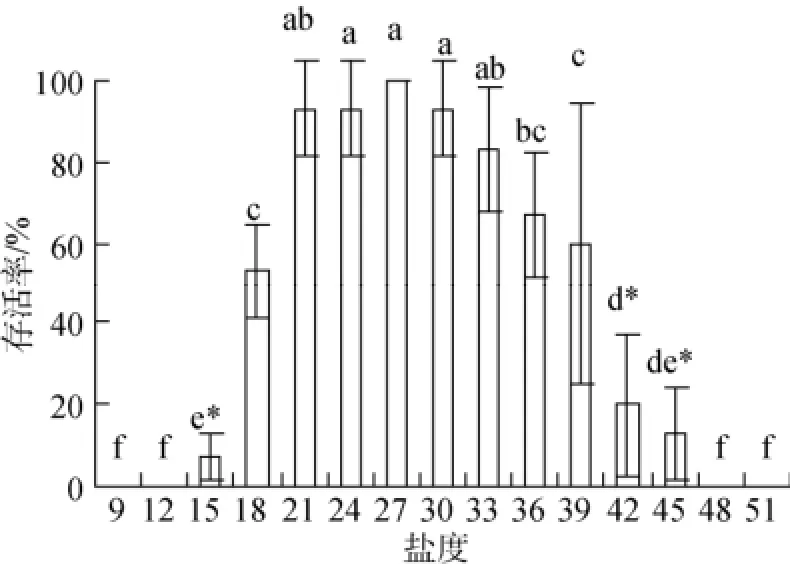
图1 盐度突变对口虾蛄仔虾的存活率的影响(24 h)Fig. 1 The survival of post-settlement mantis shrimp at sharply changed salinity group for 24 h
2.1.2 盐度突变对口虾蛄仔虾摄食的影响
实验结果如图2显示, 当盐度突变在21~33范围时, 口虾蛄仔虾的平均摄食率差异不显著(P>0.05), 此时的口虾蛄仔虾摄食欲望强烈, 摄食活跃; 盐度18和36实验组, 口虾蛄仔虾的平均摄食率显著降低(P<0.05), 此时盐度的突变对口虾蛄的摄食产生影响, 个体活跃度下降、摄食量减少;盐度15、39、42和45实验组, 口虾蛄仔虾的平均摄食率极明显降低; 此时口虾蛄仔虾匍匐于水底, 较少游泳和捕食; 盐度小于15或者高于45时, 口虾蛄仔虾基本不摄食, 个体濒临死亡, 对盐度突变极不适应。
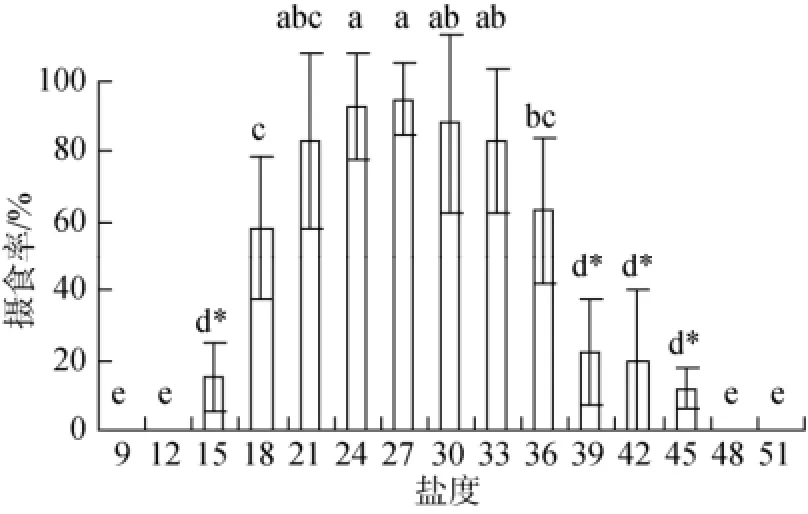
图2 盐度突变24h口虾蛄仔虾的平均摄食率的影响(24 h)Fig. 2 The food intake of post-settlement mantis shrimp at sharply changed salinity group for 24 h
2.2 盐度渐变对口虾蛄仔虾摄食和存活的影响
2.2.1 盐度渐变对口虾蛄仔虾存活的影响
实验结果如图3、图4显示, 在盐度升高组, 当盐度从30升高至36时, 口虾蛄仔虾的存活在保持较平稳状态, 活动基本不受影响; 当盐度从36变到42时, 出现较多个体死亡, 但存活率仍然超过80%; 当盐度超过44时, 个体活动减少, 死亡数量急剧增加;当盐度超过54时, 个体全部死亡。在盐度降低组, 盐度从24降至19, 虽然存活率一直降低, 但一直保持着较高的活率; 盐度19~11存活率降低的非常缓慢,说明在此盐度范围依旧在口虾蛄的耐受范围; 当盐度低于11时, 口虾蛄仔虾存活率急剧降低, 死亡数量激增; 在盐度低于5时, 口虾蛄仔虾个体全部死亡。结果表明在盐度渐变范围为11~44时, 口虾蛄仔虾能够进行一定的运动和摄食, 盐度5和54是口虾蛄仔虾所能适应的极限。
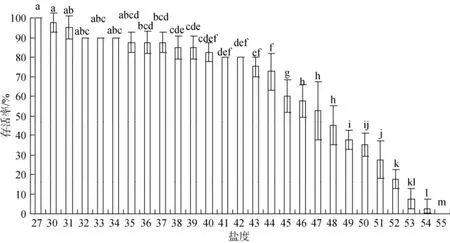
图3 盐度逐渐升高组口虾蛄仔虾的累积存活率的影响(24 h)Fig. 3 The cumulative survival of post-settlement mantis shrimp at gradually increased salinity group for 24 h
2.2.2 盐度渐变对口虾蛄仔虾摄食的影响
实验结果如图5、图6显示, 在盐度降低组, 在24~19范围内, 口虾蛄仔虾的摄食基本没有变化(P>0.05), 个体摄食欲望强烈, 摄食量大; 在盐度降至18以下时, 仔虾的摄食明显受到盐度变化的影响,摄食数量急剧减少(P<0.05); 在盐度降至8以下时,仔虾基本不摄食, 濒临死亡。在盐度升高组, 在30~ 33范围内, 口虾蛄仔虾的摄食不受影响, 摄食率没有明显变化(P>0.05); 随着盐度的升高, 仔虾的摄食率持续下降; 当盐度超过50时, 仔虾基本不摄食。
2.3 盐度突变对口虾蛄掘穴率和存活率的影响
实验观察结果显示, 空白对照组的口虾蛄仔虾立刻开始掘穴行为, 且在4 h内全部完成掘穴行为。实验结果如图7, 盐度的升高和降低均会影响仔虾的掘穴行为, 盐度突变至30时, 并没有对其掘穴产生显著影响, 但盐度降至24时, 则对其掘穴率和存活率均有显著影响(P<0.05), 盐度21和33时, 对口虾蛄仔虾的掘穴率和存活率均具极显著影响(P<0.01), 4 h后,约40%仔虾还未掘穴, 且24 h内 20%仔虾死亡, 与之前盐度突变对仔虾存活率的影响结果一致。
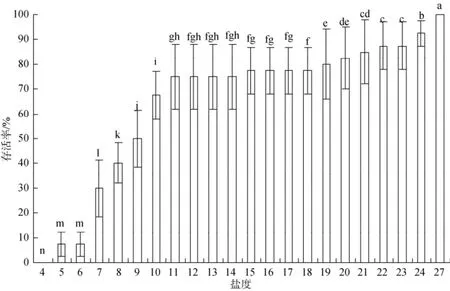
图4 盐度逐渐降低组口虾蛄仔虾的累积存活率的影响(24 h)Fig. 4 The cumulative survival of post-settlement mantis shrimp at gradually reduced salinity group for 24 h
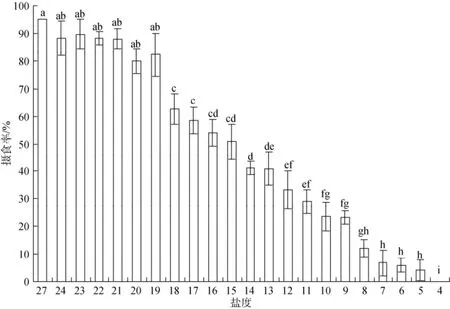
图5 盐度逐渐降低组口虾蛄仔虾平均摄食率的影响(24h)Fig. 5 The food intake of post-settlement mantis shrimp at the gradually reduced salinity group for 24 h
3 讨论
3.1 甲壳动物对盐度的适应
盐度对甲壳动物的影响主要是影响个体的渗透压, 依据对外界盐度变化的适应能力, 甲壳类动物可分为狭盐性甲壳动物和广盐性甲壳动物。狭盐性甲壳动物只能被动地去寻找与自身渗透压相同、盐度较稳定的环境生存, 广盐性甲壳动物可以通过调节自身渗透压水平, 来适应环境中盐度的变化[15]。实验结果可以看出, 口虾蛄仔虾的盐度耐受范围较广。口虾蛄在盐度渐变范围为33~19时, 摄食率未出现显著差异, 表明此时能量供给仍然处于动态平衡状态; 当盐度超过此范围后, 随着盐度的升高,摄食率下降明显, 虽然存活率较高, 但个体摄食主要用以维持内环境稳定。研究表明, 保持体内渗透压平衡的主要离子是Na+和Cl-, 甲壳动物鳃内薄层隔膜细胞内陷膜上的Na+-K+-ATPase可将细胞中的Na转运到血淋巴当中, 使细胞内Na+局部降低, 促使外界的Na+进如体内, 这一过程需要ATP释放能量, 以增加体内的代谢水平[16]。王顺昌等[17]的研究也显示, 当外界盐度变化时, 中华绒螯蟹(Eriocheir sinensis)的Na+/K+-ATPase的活性显著增加, 而且活力随时间的延长而上升。甲壳动物在调节体内的渗透压和离子平衡时, 需要消耗大量的能量, 体内营养物质的代谢增加。庄平[18]等的研究显示, 盐度的变化显著影响了中华绒螯蟹雌性亲蟹的耗氧率和排氨率, 个体渗透调节作用中的能源物质以脂肪供能为主。在盐度从27突变至21~33时, 口虾蛄仔虾的行动虽受到一定的影响, 但摄食率并无显著性差异, 表明此时口虾蛄个体在外界盐度骤变导致的体内渗透压变化时, 依旧可以通过维持摄食率来抵消一部分外界的影响。但当盐度变化超过此范围后,口虾蛄仔虾的存活率和摄食率急剧下降, 表明此时外界环境的骤变已经超过食物供能的阈值。王悦如等[19]研究也显示, 在急性盐度胁迫条件下, 机体优先分解糖类物质以获得所需的能量, 且盐度越高,体内葡萄糖的消耗越快, 对蛋白质类物质利用次之,主要是将蛋白质分解为游离氨基酸以维持渗透压平衡。
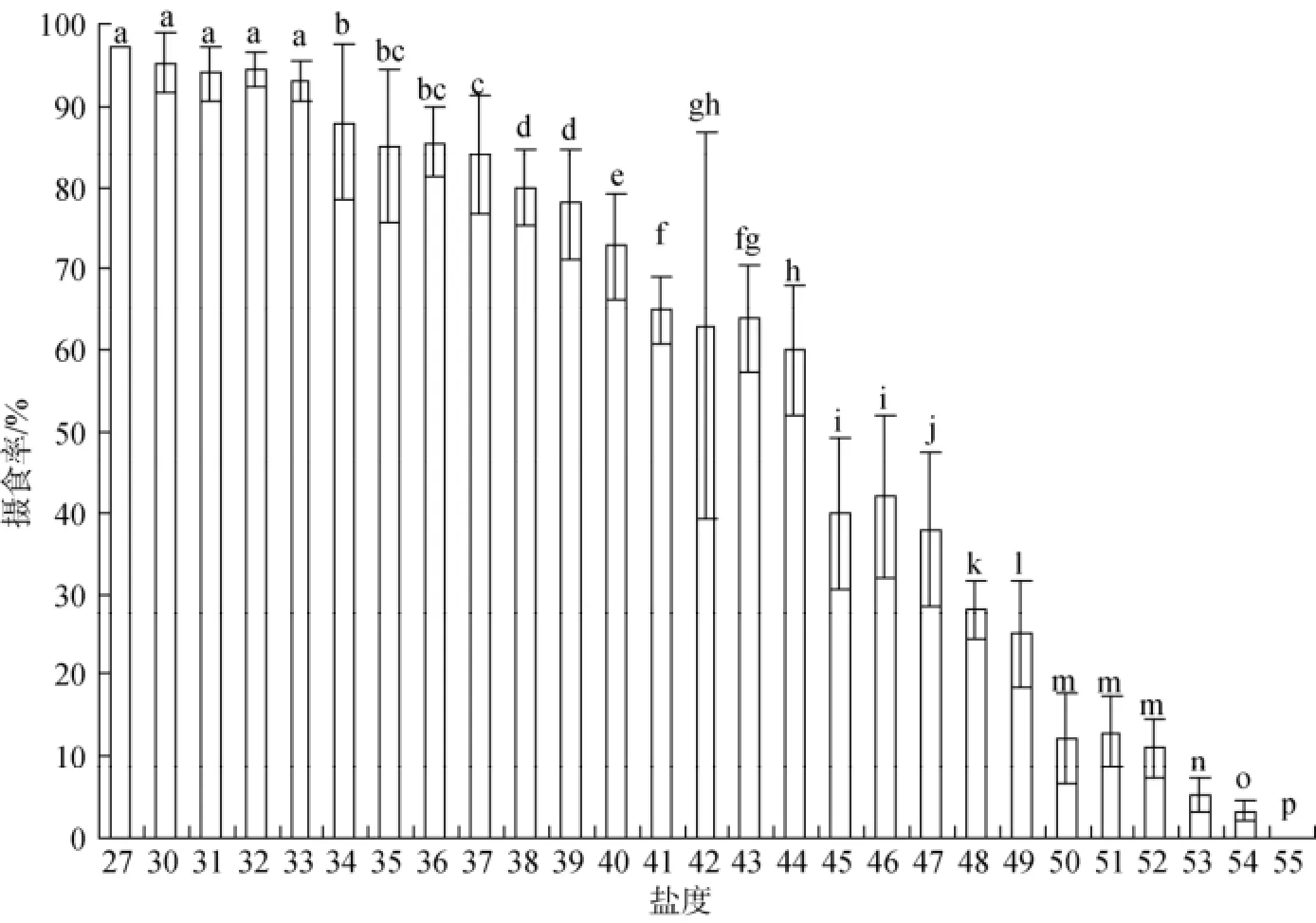
图6 盐度逐渐升高组口虾蛄仔虾平均摄食率的影响(24 h)Fig. 6 The food intake of post-settlement mantis shrimp at the gradually increased salinity group for 24 h
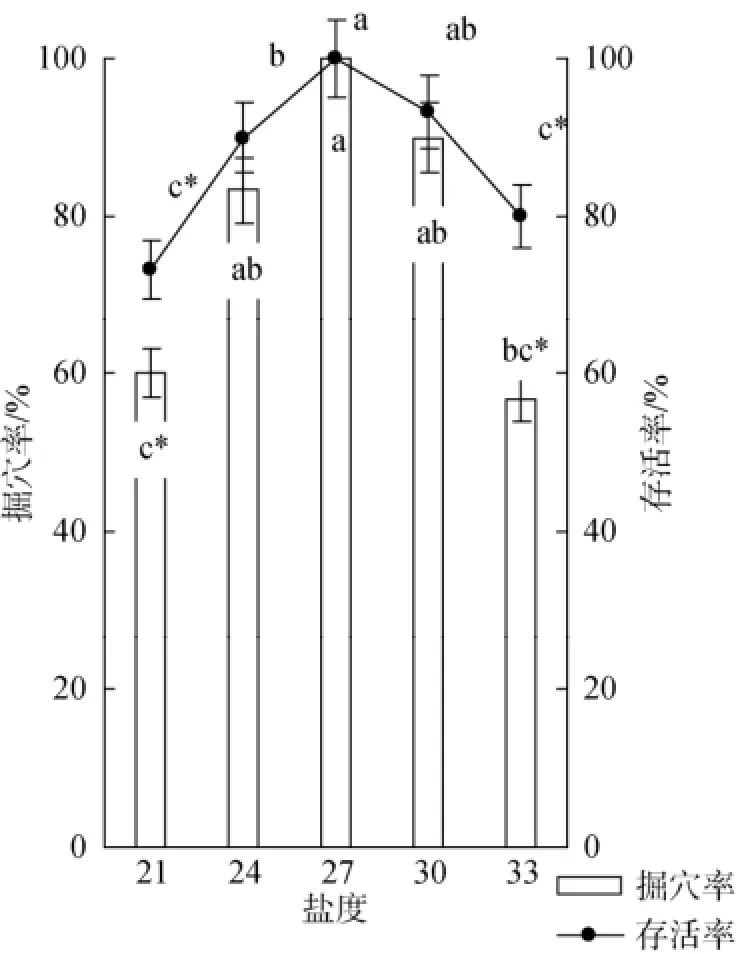
图7 盐度突变条件下口虾蛄仔虾的掘穴率和存活率的影响(24 h)Fig. 7 The burrowing rate of post-settlement mantis shrimp at sharply changed salinity group for 24 h
3.2 口虾蛄仔虾对盐度的适应范围更广
盐度作为重要的非生物因子, 对甲壳类动物个体的生命活动产生重要的影响。实验结果表明口虾蛄仔虾对盐度突变的耐受范围为15~45, 这与口虾蛄假溞状幼体的盐度适应范围相同[20], 而高于成体的耐受范围16~44[21]。口虾蛄幼体对盐度的耐受范围高于成体, 可能是由于口虾蛄成体的运动能力更强,更容易寻找到适宜生存的环境, 而非被动地适应环境, 所以其对外界环境的感知更为敏感。口虾蛄的成体在洞穴内生活, 洞穴对其起到很好的保护作用,假溞状幼体则进行浮游生活, 海水上层的盐度变化与海底相比变化幅度大, 故假状幼体的盐度耐受范围比成体宽。口虾蛄仔虾是由假溞状幼体蜕皮变态而来, 个体在变态初期保存了假状幼体的部分特性, 所以前期口虾蛄仔虾的盐度耐受范围与假溞状幼体相同。口虾蛄仔虾的渐变实验显示, 仔虾的耐受范围为5~54, 均宽于假溞状幼体的7~53[20]和成体的12~46[21]。口虾蛄仔虾由假溞状幼体变态发育而来,个体结构已经与成体相差无几, 与假状幼体相比,仔虾外表新生的硬壳可以很好的保护仔虾, 抵抗外界盐度变化对个体内环境的影响能力更强, 即仔虾对盐度变化具有更强的适应能力, 所以口虾蛄仔虾盐度的耐受范围比假溞状幼体广。而且口虾蛄仔虾是从浮游生活向底栖生活过渡的阶段, 个体所面临的生存环境更加的复杂, 这可能是其盐度适应范围更广的原因。郑美芬[22]在盐度突变对河蟹早期大眼幼体影响的研究也表明, 随着个体的发育, 河蟹大眼幼体对外界盐度变化的适应能力在逐渐增强, 魏国庆[23]等对中华虎头蟹(Orithyia sinica)状幼体的研究中也得到了相同的结论, 说明随着个体的发育,幼体自身的调节机制逐渐完善, 对外界盐度变化的适应能力逐渐增强。
3.3 不同盐度条件下口虾蛄仔虾的摄食
盐度主要通过影响渗透压而对虾蟹类生物产生影响, 虾蟹类一般通过调节自身渗透压来适应环境的变化, 调节过程需要消耗能量, 从而影响个体的摄食和生长[24]。在盐度突变的条件下, 仔虾的适宜摄食盐度范围为21~33, 在此范围内个体摄食活跃, 食欲旺盛, 盐度对个体的摄食影响不显著。随着盐度突变范围的扩大, 口虾蛄仔虾的摄食显著降低, 体内代谢更多的能量供给机体对外界盐度的抵抗作用,从而影响到个体的摄食行为, 而且大幅度的盐度变化对个体体内的酶等物质的活性产生影响, 个体代谢平衡被打破, 内环境的稳定被破坏, 也影响到了其摄食的行为。与突变相比较, 渐变实验中仔虾适宜摄食的盐度范围更广, 为19~38, 且摄食率均在80%以上, 说明仔虾蛄对于盐度渐变环境的适应性要强于突变。当外界盐度处于逐渐变化时, 口虾蛄仔虾能够较平稳地将能量用于抵抗盐度的变化, 与盐度突变相比, 对个体摄食的影响较为平缓。王冲等[24]在盐度对三疣梭子蟹幼蟹的摄食研究中显示, 盐度突变比盐度渐变更明显的影响幼蟹的摄食, 与本实验所得的结果相吻合。在相同实验地点和条件下, 与口虾蛄假状幼体的最佳摄食盐度27~33[20]相比, 仔虾的最佳摄食盐度范围(21~33)更广, 能更好地适应河口区低盐度环境, 对外界环境变化的抵抗力更强。
3.4 盐度变化对口虾蛄仔虾掘穴的影响
口足类动物浮游性幼体变态后成为仔虾, 开始掘穴或者利用天然洞穴进行捕食、交配和抱卵, 并终生底栖于洞穴中[25-26], 穴居生活对口虾蛄的生存至关重要。目前, 对虾蛄洞穴形态学的研究中, 国外学者采用了树脂浇铸法实地研究了虾蛄(Squilla mantis)洞穴形态特征[27], 与其类似, 口虾蛄仔虾洞穴也呈U形, 有大小不同两个孔。目前对口虾蛄野外环境下的包括掘穴在内的行为模式了解甚少, 室内观察结果表明, 正常盐度条件下, 仔虾蛄迅速掘穴; 盐度突变下, 增加底质并未提高仔虾存活率, 而且发现盐度21和33时, 近半数仔虾蛄不能正常掘穴, 因此盐度的突变对仔虾蛄的穴居生活具有显著影响。
综上所述, 盐度突变和渐变对口虾蛄仔虾的存活、摄食和掘穴具有显著影响, 为口虾蛄的人工养殖技术和增殖放流选择合适的盐度环境提供理论参考。
[1] Keita K, Hiroaki S, Masatoshi M, et al. Reproductive biology of the Japanese mantis shrimp Oratosquilla oratoria (Crustacea Stomatopoda): Annual cycle of gonadal development and copulation[J]. Marine Biology Research, 2009, 5(5): 415-426.
[2] Keita K, Takamichi S, Takashi Y, et al. Reproductive biology of the female Japanese mantis shrimp Oratosquilla oratoria (Stomatopoda) in relation to changes in the seasonal pattern of larval occurrence in Tokyo Bay, Japan[J]. Fisheries Science, 2004, 70(5): 734-745.
[3] Keita K, Masaaki O, Jeong H L. Interannual variation in quantitative relationships among egg production and densities of larvae and juveniles of the Japanese mantis shrimp Oratosquill aoratoria in Tokyo Bay, Japan[J].Fisheries Science, 2009, 75(4): 875-886.
[4] Ohtomi J, Kawazoe H, Furota T. Larval stage composition and morphological change during larval development of the Japanese mantis shrimp, Oratosquilla oratoria (De Haan, 1844) (Stomatopoda, Squillidae) in Tokyo Bay, Japan[J]. Crustaceana, 2005, 78(11): 1325-1337.
[5] Ohtomi J, Furota T, Kawazoe H. Change in spatial distribution with development for larval Japanese mantis shrimp Oratosquilla oratoria (Stomatopoda, Squillidae) in Tokyo Bay, Japan[J]. Nippon Suisan Gakkaishi, 2006, 72(3): 382-389.
[6] 徐善良, 王春林, 梅文骧, 等. 浙江北部海区口虾蛄繁殖和摄食习性的初步研究[J]. 浙江水产学院学报, 1995, 15(1): 30-36. Xu Shanliang, Wang Chunlin, Mei Wenxiang, et al. Preliminary studies on propagation and feeding habits of Oratosquilla Oratoria in northern Zhejiang Sea areas[J]. Journal of Zhejiang College of Fisheries, 1995, 15(1): 30-36.
[7] 刘海映, 谷德贤, 姜玉声, 等. 口虾蛄繁殖周期及生殖细胞发育的研究[J]. 大连海洋大学学报, 2013, 28(3): 269-272. Liu Haiying, Gu Dexian, Jiang Yusheng, et al. Annual reproductive cycle and grem cell development in mantis shrimp Oratosquilla oratoria[J]. Journal of Dalian Ocean University, 2013, 28(3): 269-272.
[8] 刘海映, 秦玉雪, 姜玉声, 等. 口虾蛄胚胎发育的研究[J]. 大连海洋大学学报, 2011, 26(5): 437-441. Liu Haiying, Qin Yuxue, Jiang Yusheng, et al. Embryonic development of the mantis shrimp Oratosquilla oratoria [J]. Journal of Dalian Ocean University, 2011, 26(5): 437-441.
[9] 刘海映, 谷德贤, 李君丰, 等. 口虾蛄幼体的早期形态发育特征[J] . 大连水产学院学报, 2009, 24(2): 100-103. Liu Haiying, Gu Dexian, Li Junfeng, et al. Larval development of the mantis shrimp Oratosquilla oratoria[J]. Journal of Dalian Fisheries University, 2009, 24(2): 100-103.
[10] 林月娇, 刘海映, 徐海龙, 等. 大连近海口虾蛄形态参数关系研究[J].大连水产学院学报, 2008, 23(3): 215-217. Lin Yuejiao, Liu Haiying, Xu Hailong, et al. Morphometry of mantis shrimp Oratosquilla oratoria in Dalian coast [J]. Journal of Dalian Fisheries University, 2008, 23(3): 215-217.
[11] 申玉春, 陈作洲, 刘丽, 等. 盐度和营养对凡纳滨对虾蜕壳和生长的影响[J].水产科学, 2012, 32(2): 290-299. Shen Yuchun, Chen Zuozhou, Liu Li, et al. The effect of salinity and nutrition on molt and growth of Litopenaeus vannamei[J]. Journal of Fisheries of china, 2012, 32(2): 290-299.
[12] 路允良, 王芳, 赵卓英, 等. 盐度对三疣梭子蟹生长、蜕壳及能量利用的影响[J]. 中国水产科学, 2012, 19(2): 237-245. Lu Yunliang, Wang Fang, Zhao Zhuoying, et al. Effects of salinity on growth, molt and energy utilization of juvenile swimming crab Portunus trituberculatus[J]. Journal of Fishery Sciences of China, 2012, 19(2): 237-245.
[13] 韩晓琳, 王好峰, 高保全, 等. 低盐度对不同三疣梭子蟹群体幼蟹发育的影响[J]. 大连海洋大学学报, 2014, 29(1): 31-34. Han Xiaolin, Wang Haofeng, Gao Baoquan, et al. Effects of low salinity on development of juveniles in different groups of swimming crab Portunus trituberculatus[J]. Journal of Dalian Ocean University, 2014, 29(1): 31-34.
[14] 尹飞, 王春林, 周帅, 等. 黑斑口虾蛄幼体不同发育阶段的温度、盐度耐受性研究[J]. 水产科学, 2005, 24(11): 4-6. Yin Fei, Wang Chunlin, Zhou Shuai, et al. Optimal salinity and temperature for different phases of mantis shrimp (Oratosquilla kempi) larvae[J]. Fisheries Science, 2005, 24(11): 4-6.
[15] 冯广鹏, 卢俊, 庄平, 等. 盐度对中华绒螯蟹雌性亲蟹渗透压调节和酶活性的影响[J]. 海洋渔业, 2013, 35(4): 468-473. Feng Guangpeng, Lu Jun, Zhuang Ping, et al. Effects of salinity on osmo-ionic regulation and enzyme activities in mature female Eriocheir sinensis[J]. Marine Fisheries, 2013, 35(4): 468-473.
[16] 王悦如, 李二超, 龙丽娜, 等. 中华绒螯蟹对盐度变化的适应及其渗透压调节的研究进展[J]. 海洋渔业, 2011, 33(3): 352-360. Wang Yueru, Li Erchao, Long Lina, et al. Review on the osmoregulation and adaptation to salinity changes of Chinese mitten crab Eriocheir sinensis[J]. Marine Fisheries, 2011, 33(3): 352-360.
[17] 王顺昌, 于敏. 中华绒螯蟹不同盐度下鳃Na+/K+-ATPase和ALP活性的变化[J]. 安徽技术师范学院学报, 2003, 17(2): 117-120. Wang Shunchang, Yu Min. Gill Na+/K+-ATPase and ALP activities of Chinese mitten crab, Eriocheir sinensis, adapting to different water salinity[J]. Journal of Anhui Technical Teachers College, 2003, 17(2): 117-120.
[18] 庄平, 贾小燕, 冯广鹏, 等. 盐度对中华绒螯蟹雌性亲蟹代谢的影响[J]. 中国水产科学, 2012, 19(2): 217-222. Zhuang Ping, Jia Xiaoyan, Feng Guangpeng, et al. Effect of salinity on the metabolism of female Chinese crabs, Eriocheir sinensis[J]. Journal of Fisheries Science of China, 2012, 19(2): 217-222.
[19] 王悦如, 李二超, 陈立侨, 等. 急性高渗胁迫对中华绒螯蟹雄蟹组织中可溶性蛋白质、血蓝蛋白、血糖与肝糖原含量的影响[J]. 水生生物学, 2012, 36(6): 1056-1062. Wang Yueru, Li Erchao, Chen Liqiao, et al. Effects ofacute salinity stress on soluble protein, hemocyanin, haemolymph glucose and hepatopancreas glycogen of Eriocheir sinensis[J]. Acta Hydrobiologica Sinica, 2012, 36(6): 1056-1062.
[20] 刘海映, 王冬雪, 姜玉声, 等. 盐度对口虾蛄假状幼体存活和摄食的影响[J]. 大连海洋大学学报, 2012, 27(4): 311-314. Liu Haiying, Wang Dongxue, Jiang Yusheng, et al. The effects of salinity on survival and food intake in mantis shrimp Oratosquilla oratoria larvae[J]. Journal of Dalian Ocean University, 2012, 27(4): 311-314.
[21] 刘海映, 徐海龙, 林月娇. 盐度对口虾蛄存活和生长的影响[J]. 大连水产学院学报, 2006, 21(2): 180-183. Liu Haiying, Xu Hailong, Lin Yuejiao. The effect of salinity on survival and growth of mantis shrimp (Oratosquilla oratoria) in Dalian coast[J]. Journal of Dalian Fisheries University, 2006, 21(2): 180-183.
[22] 郑美芬.河蟹早期大眼幼体对海水盐度突变的适应性研究[J]. 河北渔业, 1999, 107(5): 9-10. Zheng Meifen. Crab’s adaptability with salinity mutation at its early age[J]. Journal of Hebei Fisheries, 1999, 107(5): 9-10.
[23] 魏国庆, 李晓东, 曹琛, 等.盐度、温度对中华虎头蟹溞状幼体存活及变态的影响[J]. 水产科学, 2013, 32(12): 706-712. Wei Guoqing, Li Xiaodong, Cao Chen, et al. The effects of salinity and temperature on survival and metamorphosis in zoea of Chinese tiger crab Orithyia sinia [J]. Fisheries Science, 2013, 32(12): 706-712.
[24] 王冲, 姜令绪, 王仁杰, 等. 盐度骤变和渐变对三疣梭子蟹幼蟹发育和摄食的影响[J]. 水产科学, 2010, 29(9): 510-514. Wang Chong, Jiang Lingxu, Wang Renjie, et al. Effects of abrupt and gradual changes in salinity on development and feeding in juvenile swimming crab (Portunus trituberculatus)[J]. Fisheries Science, 2010, 29(9): 510-514.
[25] Mili S, Bouriga N, Missaoui H, et al. Morphometric, reproductive parameters and seasonal variations in fatty acid composition of the mantis shrimp Squilla mantis (Crustacea: Stomatopoda) in the Gulf of Gabes (Tunisia)[J]. Journal of Life Sciences, 5: 1058-1071.
[26] Reaka M, Manning R. The behavior of stomatopod Crustacea, and its relationship to rates of evolution[J]. Journal of Crustacean Biology, 1981, 1: 309-327.
[27] Atkinson R, Froglia C, Arneri E, et al. Observations on the burrows and burrowing behaviour of: Squilla mantis L. Crustacea: Stomatopoda[J]. Marine Ecology, 1997, 18(4): 337-359.
Received: Jun. 5, 2015
The effect of salinity on survival, food intake, and burrowing behavior in post-settlement mantis shrimp, Oratosquilla oratoria
LIU Hai-ying, ZHANG Song, XING Kun, CHEN Lei, ZHANG Xiu-qin
(College of Marine Science and Environment, Dalian Ocean University, Dalian 116023, China)
salinity; Oratosquilla oratoria; post-settlement mantis shrimp; food intake; survival; burrowing behavior
To study the adaptive behavior of the mantis shrimp Oratosquilla oratoria in an artificial cultured environment with special reference to salinity, the cumulative survival, food intake, and burrowing rate of post settlement mantis shrimp were monitored. Post-settlement mantis shrimp demonstrated a higher salinity tolerance compared to that in the larval stages. The survival rate was 15-45 in the sharply changed salinity group, and it can outreach 5-54 in the gradually changed groups. The optimal salinity was 21-33 wherein more than 80% of post-settlement mantis shrimp survived for 24 h. Feeding activity was significantly influenced by salinity. In the sharply changed salinity group, the post settlement mantis shrimp actively fed when salinity was within the range of 21-33 ; however, food intake was negligible when the salinity was less than 18 and higher than 42. The post-settlement mantis shrimps fed actively when the salinity was between 19 and 38; however, this activity was negligible when the salinity was less than 9 and higher than 50. Sharp changes in salinity had a significant effect on the burrowing rates, with the burrowing time elongated in the salinity range of 21-33. These results will provide useful information for aquaculture and stock enhancement in the future.
S966.1
A
1000-3096(2016)11-0121-08
10.11759//hykx20150605002
(本文编辑: 谭雪静)
2015-06-05;
2015-12-10
国家自然科学基金资助项目(41006079); 浙江省近岸水域生物资源开发与保护重点实验室开放基金(J2012009); 农业部北方海水增养殖重点实验室2014年开放课题(2014-MSENC-KF-17)
[Foundation: National Natural Science Foundation of China, No.41006079; Key Laboratory of Biological Resources Development and Protection of Coastal Waters Open Foundation of Zhejiang Province, No.J2012009; The Open Project of Key Laboratory of Mariculture and Stock Enhancement in North China, Ministry of Agriculture, 2014, No.2014-MSENC-KF-17]
刘海映(1957-), 男, 教授, 辽宁大连人, 主要从事渔业资源学研究, E-mail: hyliu@dlou.edu.cn; 邢坤, 通信作者, 电话: 0411-84762089, E-mail: xingkun@dlou.edu.cn
——皮皮虾

