低盐水体下摄食水平对斜带石斑鱼幼鱼生长及能量收支的影响
黄建盛, 王安利, 陈 刚, 张健东, 王忠良, 汤保贵
(1. 广东海洋大学 水产学院, 广东 湛江 524025; 2. 华南师范大学 生命科学学院, 广东 广州 510631)
低盐水体下摄食水平对斜带石斑鱼幼鱼生长及能量收支的影响
黄建盛1, 王安利2, 陈 刚1, 张健东1, 王忠良1, 汤保贵1
(1. 广东海洋大学 水产学院, 广东 湛江 524025; 2. 华南师范大学 生命科学学院, 广东 广州 510631)
为探讨斜带石斑鱼(Epinephelus coioides)在低盐水体下最适的摄食水平, 在水体盐度12、温度28℃±1℃的条件下, 作者投喂人工配合饲料, 研究了不同摄食水平(分别为体质量的2.36%、2.83%、3.31%、3.79%、4.25%及饱食)对斜带石斑鱼幼鱼(初始体质量为29.28 g±2.63 g)生长和能量收支的影响,并建立了生长-摄食关系和不同摄食水平下的能量收支方程。结果表明, 在低盐下幼鱼鱼体粗蛋白及灰分含量在各摄食水平组间无显著差异(P>0.05); 脂肪含量在3.79%、4.25%及饱食组显著高于其他摄食水平组(P<0.05); 干物质含量在4.25%、饱食组显著高于其他摄食水平组(P<0.05); 能量含量随摄食水平降低而下降。摄食水平对幼鱼摄食率有显著影响(P<0.05)且随摄食水平的降低而下降。幼鱼湿质量特定生长率、干质量特定生长率、蛋白特定生长率、能量特定生长率均随着摄食水平的增加而增加。特定生长率与摄食水平呈减速增长曲线关系, 可用对数方程描述。幼鱼饲料湿质量转化效率、饲料干质量转化效率、饲料蛋白转化效率均随摄食水平的增加先增大后减少的变化, 在3.79%组达到最大值,饲料能量转化效率随摄食水平的增加呈一直增加, 在饱食组达到最大值。随着摄食水平的增加, 生长能(G)呈先升后降的变化, 在3.79%组有最大值, 与摄食水平之间可用一元二次方程表述; 排粪能(F)与排泄能(U)呈一直增大的变化, 在饱食组有最大值, 与摄食水平之间均可用线性方程表述; 代谢能(R)则呈降低并逐渐趋于平稳的变化。在3.79%组, 幼鱼获得最佳的能量收支方程为: 100.00C= 12.29F+13.73U+31.33R+42.65G。综合考虑认为, 斜带石斑鱼幼鱼在低盐水体下最适的摄食水平为体质量的3.79%。
摄食水平; 斜带石斑鱼(Epinephelus coioides); 生长; 能量收支; 低盐水体
在鱼类生物能量学研究中, 摄食水平因子一直都是研究热门的因子之一。摄食水平与鱼类的种类、大小、食性及饲料质量有关, 一般肉食性鱼类的摄食量低于杂食性和草食性, 并随着鱼类的生长阶段不同, 其摄食水平也会不断地发生改变[1]。因此确定养殖鱼类的最佳摄食水平成为鱼类营养学和鱼类生态学的研究重点之一。
根据文献报道的研究结果, 鱼类的生长与摄食水平的关系, 主要有两种模型: 一种呈线性关系[2-5];另一种是减速增长曲线关系[6-9]。对于某一种养殖鱼类, 确定其生长-摄食的模型, 具有重要的生产实践意义。若生长-摄食模型为线性关系的鱼类, 其最大的摄食率就是其最佳投喂水平; 若是减速增长曲线上升关系的鱼类, 其最佳投喂水平应在接近最大摄食率的摄食水平, 这样可以避免浪费饲料, 减少养殖成本, 并减轻对养殖环境的污染。从养殖业的角度来看, 目的就是尽可能多的食物能转化为生产能,提高饲料利用率, 降低代谢消耗, 从而提高养殖的经济效益和减少对养殖环境的破坏。
关于石斑鱼属(Epinephelus)的生物能量学的研究报道较少, 彭树锋等[10]研究了体质量对斜带石斑鱼(Epinephelus coioides)能量收支的影响; 周晖等[11]研究了3种蛋白替代鱼粉对褐点石斑鱼(Epinephelusfuscoguttatus)能量收支的影响。斜带石斑鱼是广东、海南、福建等地区的海水网箱养殖的主要品种之一,然而, 近年来养殖业者为了避免沿海地区的恶劣环境因素对生产造成的风险, 逐渐发展池塘低盐度水体养殖并取得成功。然而尚未见有在低盐水体下斜带石斑鱼幼鱼摄食水平研究相关报道。为此, 本实验开展摄食水平对斜带石斑鱼幼鱼在低盐水体下生长及能量收支的影响, 所得资料可进一步丰富斜带石斑鱼能量学方面的研究内容并为其在低盐水体下养殖中投喂模式的优化提供一定的科学依据。
1 材料与方法
1.1 实验用鱼来源与驯化
实验鱼为广东海洋大学鱼类实验室当年繁育的幼鱼, 选取健康、活力好的幼鱼1 000尾暂养于室内水泥池(4 m×3 m×1.2 m), 1周后开始分组。暂养期间,持续充气, 自然光照, 每天上下午饱食投喂2次。溶解氧保持在6 mg/L以上, pH7.8~8.3, 氨氮<0.01 mg/L, 自然海水的盐度为28~31。
幼鱼饥饿2 d, 从暂养水泥池中随机取出健康、活力好的、个体大小相近的幼鱼540尾, 随机放入18个养殖水槽(70 cm×50 cm×60 cm)中, 充气, 自然光照, 适应1周后开始逐渐降低盐度。每天用曝气后的自来水调节盐度, 每天降低2~4盐度至盐度12左右, 并在此盐度下养殖2周后开始正式实验。在此期间估算幼鱼最大投喂量, 为正式实验中设计不同的摄食水平提供依据。在适应阶段, 每天饱食投喂2次(8: 00和16: 00)。实验所用的饲料为广东越群海洋生物研究开发有限公司生产的石斑鱼专用配合饲料(型号: 东丸C6, 营养成分为: 水分9.01%、粗蛋白52.94%、粗脂肪12.21%、粗灰分14.51%)。
1.2 实验设计与管理
实验在广东海洋大学海洋生物研究基地进行。选择体质量相近的健康、活力好的个体, 平均体质量为29.28 g±2.63 g, 体长为10.59 cm±0.83 cm, 各组初始体质量和体长无显著差异(P>0.05)。采用随机分组试验, 共设置6个处理组, 分别为最大投喂量(饱食)、90%饱食、80%饱食、70%饱食、60%饱食和50%饱食, 修正为以摄食水平表示则分别为4.75%(饱食)、4.25%、3.79%、3.31%、2.83%和2.36%(百分比为每日投喂量占初始试验鱼湿质量的质量百分比)。每个处理3个重复, 每个重复放养30尾鱼。每天8: 00和16: 00各投喂1次, 试验期内每隔2周测量一次各组鱼体质量, 相应调整其投喂量。另外称质量150 g饲料, 分成3份投入水中30 min后回收, 烘干、称质量计算残饵损失率, 以此来校正摄食量。每天每缸记录投喂量, 并在投喂后30 min用虹吸移出残饵, 烘干并称质量记录; 并在投喂1、3 h及投喂前用虹吸移出粪便, 在同一水槽收集集中在一起置于70℃下烘干至恒质量。实验期间, 连续充气, 每天换水量50%, 温度为28℃±1℃, 溶解氧保持在6 mg/L以上, pH7.8, 自然光照。
实验开始前, 幼鱼饥饿2 d, 从暂养池中随机取30尾鱼用丁香酚(100 mg/L)麻醉后称质量, 作为幼鱼初始的体质量值, 随机分成3份作为初始分析样本, 70℃下烘干, 用以估算实验开始时鱼体的生化成分及其能值。实验周期历时56 d。实验结束后, 实验鱼饥饿2 d, 用丁香酚(100 mg/L)快速麻醉后, 每缸鱼逐尾称质量, 并每缸随机选取10尾, 用于实验后鱼体成分分析。
1.3 样品测定
水分的测定为105℃烘干恒质量法; 粗蛋白的测定为凯氏定氮法(N×6.25, FOSS Kjeltec System 2300, Sweden); 脂肪的测定为索氏抽提法(Extraction System B-811, Switzerland); 粗灰分的测定为箱式电阻炉550℃灼烧法; 能量含量采用IKAC200型热量仪测定。
1.4 计算方法
1.4.1 摄食和生长指标
摄食率(%)=FI/[(Wt+W0)/2×t]×100
湿质量特定生长率(%/d)=(lnWt-lnW0)/t×100
干质量特定生长率(%/d)=[ln(Wt×CDt)-ln(W0× CD0)]/ t×100
蛋白特定生长率(%/d)=[ln(Wt×CPt)-ln(W0×CP0)]/ t×100
能量特定生长率(%/d)=[ln(Wt×CEt)-ln(W0×CE0)]/ t×100
饲料湿质量转化效率(%)=(Wt-W0)/FI×100
饲料干质量转化效率(%)=(Wt×CDt-W0×CD0)/ (FI×CD)×100
饲料蛋白转化效率(%)=(Wt×CPt-W0×CP0)/(FI× CP)×100
饲料能量转化效率(%)=(Wt×CEt-W0×CE0)/(FI× CE)×100
上述公式中, FI(g)为平均每尾鱼摄食饲料总量,Wt、W0(g)分别为鱼体终末和初始湿质量, CDt、CD0(%)分别为终末和初始鱼样平均干物质含量, CPt、CP0(%)分别为终末和初始鱼体的平均蛋白质含量, CEt、CE0(kJ/g)分别为终末和初始鱼体平均能量含量, CD、CP(%)和CE(kJ/g)分别为饲料的干物质、蛋白质和能量含量, t为实验天数。
1.4.2 能量收支指标
能量在鱼体内转换基本模型[12]: C=F+U+R+G,摄食能(C)=摄入饲料的干质量×饲料的能量含量;排粪能(F)=粪便干质量×粪便的能量含量; 排泄能(U)依据氮收支平衡式计算[13]: U=(CN-FN-GN) ×24.8,式中, CN为食物中获取的氮; FN为粪便中损失的氮; GN为鱼体中积累的氮; 24.8为每克氨氮的能值(KJ)。这里假定氨是唯一的氮排泄物。生长能(G)=实验结束时鱼体能量-实验开始时鱼体能量。代谢能(R)根据能量收支式R=C-F-U-G计算, 同化能(A)= C-F-U。
1.5 数据分析
数据通过 SPSS统计软件进行分析, 采用One-way ANOVA过程来检验摄食水平对测定指标影响的显著性, 用Ducan检验法进行多重比较, 描述性统计值使用平均值±标准差 (Mean±SD) 表示, P<0.05为显著性差异。
2 结果
2.1 鱼体生化成分
初始鱼样和不同摄食水平饲养56 d后斜带石斑鱼幼鱼鱼体干物质、粗蛋白、粗脂肪、灰分和能量含量结果见表1。实验结果表明, 4.25%和饱食组幼鱼干物质含量显著高于其他摄食水平组(P<0.05), 3.79%、3.31%、2.83%和2.36%组之间无显著性差异(P>0.05);摄食水平对鱼体粗蛋白含量和灰分含量无显著性影响(P>0.05)。随摄食水平增加, 粗脂肪含量和能量含量呈下降趋势, 摄食水平对两者有显著影响(P<0.05)。
2.2 生长及饲料转化效率
低盐水体下斜带石斑鱼幼鱼在不同摄食水平的摄食率见表2。由表中的数据显示, 随着摄食水平的降低, 摄食率呈下降的趋势, 统计分析表明, 摄食水平对幼鱼的摄食率有显著性差异(P<0.05)。
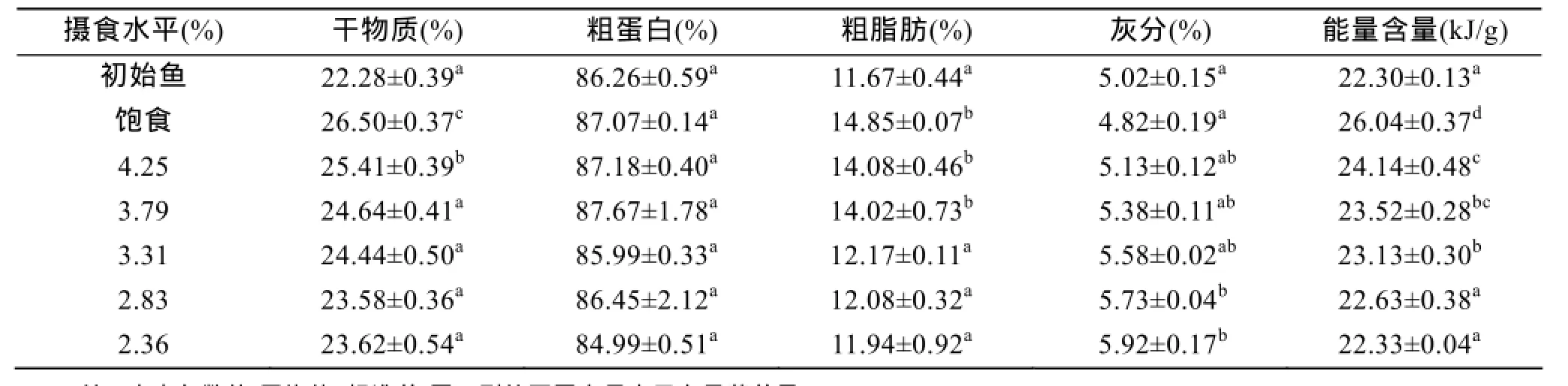
表1 摄食水平对低盐水体下斜带石斑鱼幼鱼鱼体生化成分和能量含量的影响Tab. 1 Effect of different feeding levels on the body composition of juvenile E. coioides cultured in low-salt water at the beginning and end of the growth experiment
斜带石斑鱼在6个摄食水平的特定生长率测定数据见表2。结果表明, 湿质量特定生长率、干质量特定生长率、蛋白特定生长率及能量特定生长率均随着摄食水平的增加而增加。特定生长率与摄食水平呈减速增长曲线关系, 可用对数方程来描述(表3)。令特定生长率=0, 由各回归方程可得, 斜带石斑鱼在本实验条件下湿质量、干质量、蛋白和能量维持日粮水平分别为0.93%、1.06%、1.09%和1.27%。
不同摄食水平下斜带石斑鱼饲料转化效率如表2所示, 饲料湿质量转化效率、饲料干质量转化效率、饲料蛋白转化效率均随摄食水平增加呈先上升后下降的变化趋势, 在3.79%组有最大值。饲料能量转化效率随摄食水平的增加呈一直增加, 在饱食组达到最大值。
2.3 能量收支
不同摄食水平下的斜带石斑鱼能量收支各组分测定数据见表4所示, 表中数据显示, 随着摄食水平的增加, 生长能比例呈增加的趋势, 到3.79%组时最高, 之后呈下降的趋势, 方差分析表明, 摄食水平对生长能比例有显著影响(P<0.05), 其中3.79%、4.25%及饱食组组间无显著差异(P>0.05), 生长能比例与摄食水平两者可用一元二次方程来表述(表5)。排粪能比例和排泄能比例均随摄食水平增加而增加, 方差分析表明, 摄食水平对排粪能比例、排泄能比例有显著影响(P<0.05), 两者之间呈线性关系。代谢能比例随摄食水平的增加而降低, 到3.79%组逐渐趋于平稳(3.79%、4.25%及饱食组组间无显著性差异)。当能量收支以占同化能比例表示时, 生长能占同化能比值随摄食水平增加而增加, 在3.79%组达到最大值,能量收支方程为:
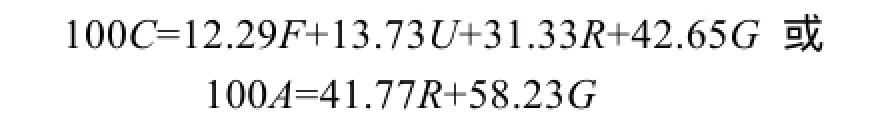
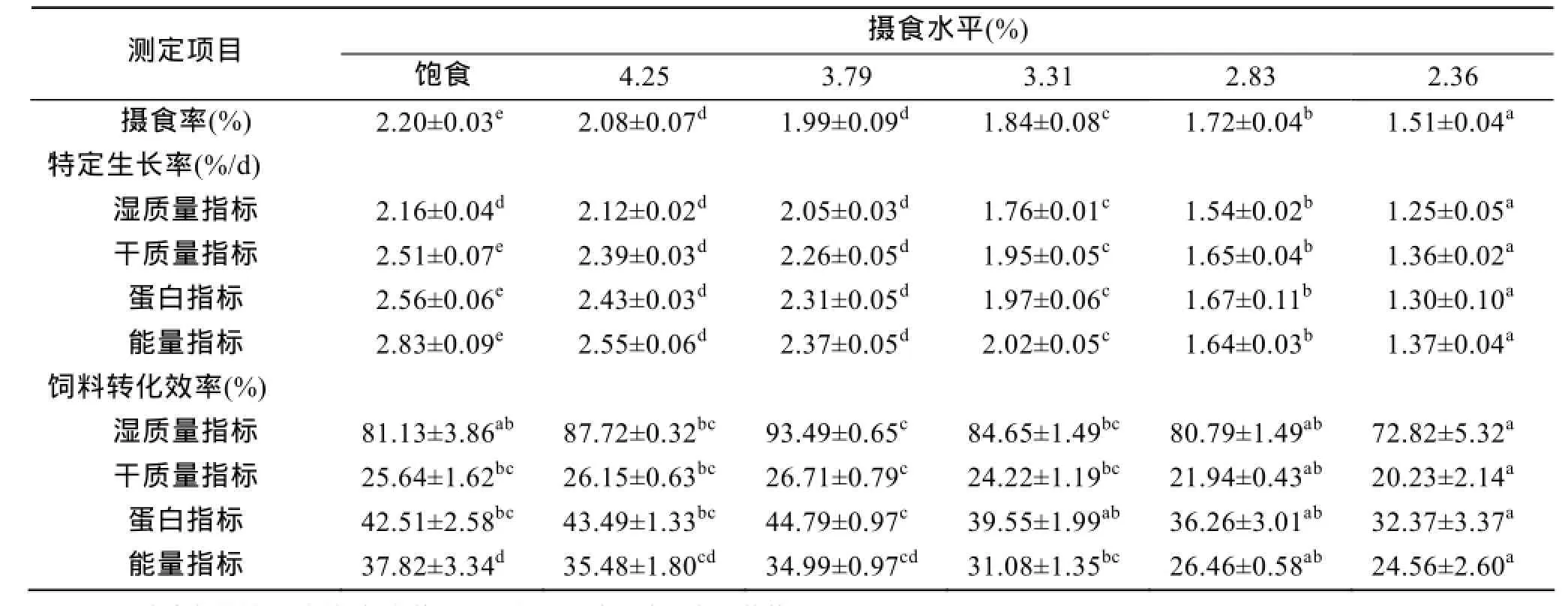
表2 摄食水平对低盐水体下斜带石斑鱼幼鱼生长及饲料转化效率的影响Tab. 2 Effect of different feeding levels on the growth and feed conversion efficiency of juvenile E. coioides cultured in low-salt water
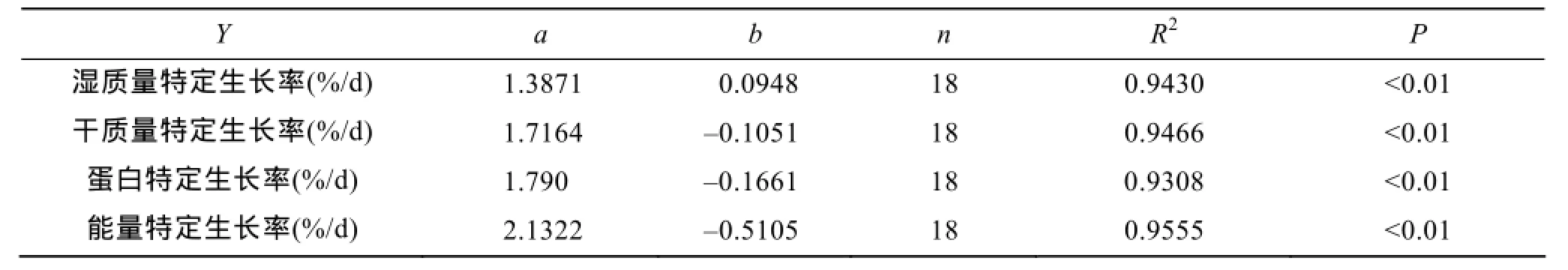
表3 低盐水体下斜带石斑鱼幼鱼特定生长率(RSG)与摄食水平(FL)关系的回归方程(RSG=aLn(FL)+b)的系数Tab.3 Coefficients for the regression model (RSG= aLn(FL + b)) relating specific growth rate (RSG) to the feeding levels (FLs) of juvenile E. coioides cultured in low-salt water
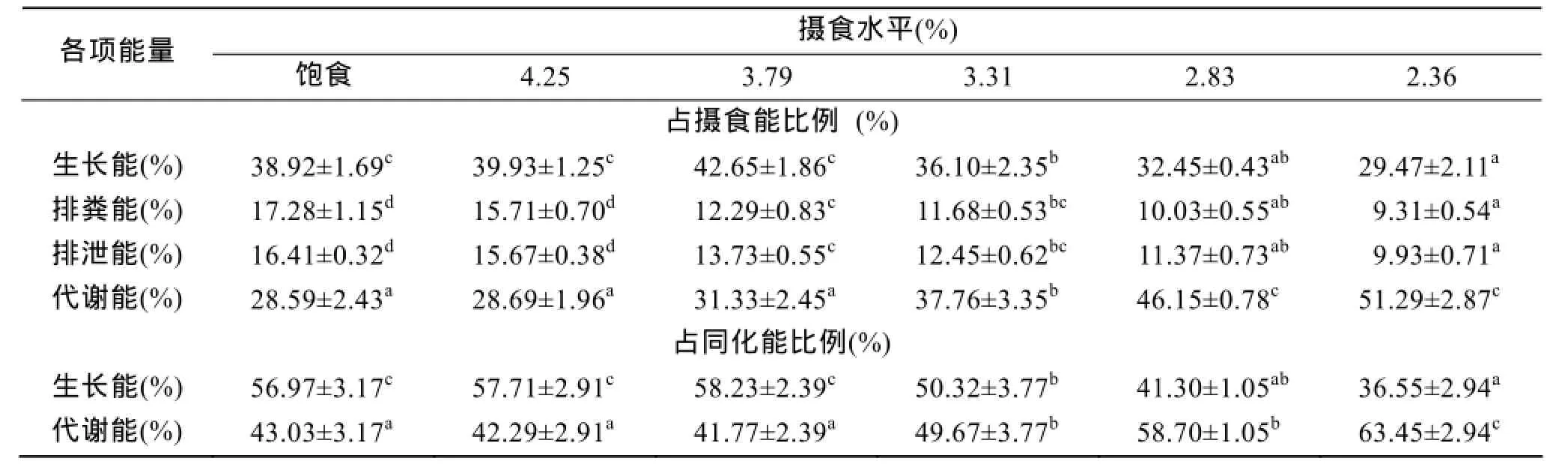
表4 摄食水平对低盐水体下斜带石斑鱼幼鱼能量收支的影响Tab. 4 Effect of different feeding levels on the energy budgets of juvenile E. coioides cultured in low-salt water

表5 摄食水平与生长能比例的回归方程(Y=aFL2+bFL+c)系数; 与排粪能比例、排泄能比例和代谢能比例的回归方程(Y=aFL+b)系数Tab. 5 Coefficients of the regression equation (Y = aFL2+ bFL + c) relating to the growth energy content and feeding levels and those of the regression equation (Y = aFL + b) relating to the feces energy content, excretion energy content, metabolism energy content, and feeding levels
3 讨论
3.1 鱼体成分及能值
根据文献的报道, 鱼体成分受到摄食水平的影响[2,14-16]。之前很多的研究结果指出, 鱼体的蛋白质含量与摄食水平无显著关系, 而鱼体的干物质含量、脂肪含量及能值含量受到摄食水平的显著影响, 均随着摄食水平的增加而增加, 灰分含量随摄食水平的增加而减少[1,14-16]。本研究结果表明, 在低盐水体下斜带石斑鱼幼鱼鱼体蛋白含量与摄食水平的关系无显著关系, 鱼体脂肪含量随投喂水平增加而增加,而鱼体灰分含量则相反, 研究结果与其他研究结果相类似[2,15-16]。分析其原因就是食物促进鱼类的生长,同时高的摄食水平, 使得更多的食物能量转化为鱼体脂肪, 这是一个普遍的现象, 而鱼体灰分含量与摄食水平呈负相关, 可能是骨骼生长相对较缓慢的原因[17]。
3.2 生长-摄食的关系
文献报道关于生长-摄食的关系模型主要的两种类型, 一种是简单的直线关系, 采用线性方程来表述[2-5], 另一种是减速增长曲线, 采用对数方程来表述[6-9,17]。本实验中在无饥饿组的情况下, 研究结果表明斜带石斑鱼幼鱼在低盐水体的生长随着摄食水平的上升呈减速增长曲线关系, 生长-摄食的关系模型可用对数方程来表示。
确定鱼类生长-摄食关系是直线还是曲线, 对鱼类养殖有重要的意义[18]。当这一关系直线时, 生长率和食物利用率均在最大摄食水平是最高, 最大摄食水平即为最佳摄食水平; 当这一关系为曲线时, 在较高的摄食水平时生长率增加缓慢, 食物利用率相对减少, 因此最佳的饲料投喂水平应该低于最大摄食水平。在养殖实践中, 要重视生长-摄食的关系, 为了达到最佳的经济效益, 应该选择最佳的投喂水平。但往往在实际中还要考虑其他的因素计算所需要的投喂水平, 比如斜带石斑鱼幼鱼在池塘或海上网箱无法过冬, 需要移到室内水泥池进行人工加温越冬,此期间主要考虑因子是海水升温成本很高, 因此加温不能过高, 只要在高于其适宜生长温度下限就可以, 同时换水量不宜太大, 因此在越冬期间不能投喂太多, 否则会引起水质恶化而导致增加换水量,这就需要具体实际情况从能量学的角度综合生长、摄食水平、水温、生产成本等各种因素来分析以达到最佳效果。另一个例子, 当斜带石斑鱼市场价格低迷, 养殖户不愿出售已达商品规格的成品鱼, 多数养殖户选择等待节假日时间出售, 因此在等待价格回升的期间, 如果按最佳摄食水平投喂则难于承受饲料成本, 很多养殖户选择降低投喂水平, 但是要降到什么程度并不一致, 需要从能量学的知识结合经济承受能力才能作出更好的安排, 以达到好的效果。另外, 鱼类生长-摄食关系受到诸多因子的影响,如温度[19-20]、体质量[21]、饵料种类[7]等, 因此, 有必要进一步开展低盐水体下斜带石斑鱼的生物能量学研究, 探讨环境因子对其生长-摄食的影响, 尤其应关注因子间的互作效应。Montgomery[22]指出在因子互作效应存在的情况下, 往往比因子主效应更重要。在尼罗罗非鱼(Oreochromis niloticus)[23]、大菱鲆(Scophthalmus maximus)[24]、犬齿牙鲆(Paralichthys dentatus)[25]、花狼鱼(Anarhichas minor)[26]等研究中证实环境因子对鱼类生长有明显的互作效应。孙丽华等[21]通过研究摄食水平和温度对军曹鱼生长及氮收支的影响, 预测摄食水平和温度对鱼类氮排泄存在一定的交互作用。本研究中, 生长-摄食关系是在室内可控环境下进行的, 实验室环境和生产实践的室外池塘养殖环境、工厂化养殖环境存在一定的差距, 如: 换水量、养殖密度、养殖规模等。因此, 为使得研究结果更好地为生产实践提供依据, 有必要进一步开展调查研究。
3.3 能量收支方程
本实验结果显示, 随摄食水平增加, 低盐水体下斜带石斑鱼鱼体活动代谢降低, 分析其原因可能是在摄食水平较低的情况, 有限的食物资源使得鱼类必须依靠持续的游动以增加捕食机会, 因此会导致活动能量的上升, 但高摄食水平情况下, 鱼类摄食后特殊动力作用耗能上升, 由于这两部分能量上的平衡, 使得代谢能比例随投喂水平的增加而降低并逐渐趋于平稳。在低盐环境下的斜带石斑鱼粪便能比例和排泄能比例随着摄食水平的增加而增加。这一结果与文献报道梭鱼(Mulletliza haematocheila)[27]的结果一致。分析其原因是随着摄食水平的增加, 摄食食物增多, 斜带石斑鱼不能完全消化吸收, 多余的部分被排出体外, 导致粪便增高。当摄食的食物增多时,斜带石斑鱼摄入体内的蛋白质相对增加, 可能是在低盐条件下动用一部分蛋白质作为能源物质, 氨基酸代谢进而加强, 氨氮排泄升高。关于摄食水平与粪便能、排泄能的关系, 有些资料结果表明, 粪便能、排泄能随着摄食水平增加而减少[8,28], 而有些资料结果表明粪便能、排泄能随着摄食水平的增加变化不大[2,27], 这种差异反映了种间差异和实验方法不同。
能量收支方程给出一定环境条件下能量收支各组分的定量关系。基于已发表的14种鱼类能量分配的数据上, 总结了最大摄食条件下鱼类的能量收支,得出平均收支式: 100A=60R+40G[29](A为同化能)。在本研究中, 在低盐水体下斜带石斑鱼幼鱼饱食条件下能量收支方程为: 100A=43.03R+56.97G, 与如上平均分配模式比较发现, 斜带石斑鱼的生长能比例高于平均水平, 与褐牙鲆(Paralichthys olivaceus)[30]、梭鱼(Mulletliza haematocheila)[27]相类似。斜带石斑鱼为底层定居鱼类, 生态习性为喜欢栖息在岩礁、珊瑚礁底, 在实验过程观察到其除了摄食, 大部分时间静卧在缸底或四周角落, 因此生态习性决定其代谢和排泄所消耗能量较少, 而分配于生长的能量相对较多。然而, 在研究鱼类的能量收支时, 影响的因素比较多, 比如鱼类的品种、实验对象的体质量、饵料种类、饲料配方、投喂次数、实验方法以及实验条件等会导致各研究结果存在很大的差异。因此, 鱼类能量分配模式存在很大的差异, 很难总结出鱼类能量收支的一般形式, 而在一定温度范围内, 最大摄食水平时能量收支可以相互比较, 前提条件是能量收支在这一温度范围内不随温度而变化[29], 斜带石斑鱼在低盐水体下是否存在这一现象以及温度范围的大小, 有待进一步研究。
[1] 崔奕波. 鱼类生物能量学的理论与方法[J]. 水生生物学报, 1989, 13(4): 369-383. Cui Yibo. Bioenergetics of fishes: theory and methods[J]. Acta Hydrobiologica Sinica, 1989, 13(4): 369-383.
[2] 朱晓鸣, 解绥启, 崔奕波. 摄食水平对异育银鲫生长及能量收支的影响[J]. 海洋与湖沼, 2000, 31(5): 471-479. Zhu Xiaoming, Xie Shouqi, Cui Yibo. Effect of ration level on growth and energy budget of the gibel carp Carassius Auratus Gibelio[J]. Oceanologia Et Limnologia Sinica, 2000, 31(5): 471-479.
[3] Paul A, Paul J, Smith R. Energy and ration requirements of juvenile Pacific halibut (Hippoglossus stenolepis) based on energy consumption and growth rates[J]. Journal of Fish Biology, 1994, 44(6): 1023-1031.
[4] Cui Y, Hung S, Zhu X. Effect of ration and body size on the energy budget of juvenile white sturgeon[J]. Journal of Fish Biology, 1996, 49(5): 863-876.
[5] Sun L, Chen H, Huang L, et al. Growth, faecal production, nitrogenous excretion and energy budget of juvenile cobia (Rachycentron canadum) relative to feed type and ration level[J]. Aquaculture, 2006, 259(1): 211-221.
[6] Cui Y, Wootton R. Bioenergetics of growth of a cyprinid, Phoxinus phoxinus: the effect of ration, temperature and body size on food consumption, faecal production and nitrogenous excretion[J]. Journal of Fish Biology, 1988, 33(3): 431-443.
[7] 孙丽华, 陈浩如, 黄洪辉, 等. 摄食水平和饵料种类对军曹鱼幼鱼生长及氮收支的影响[J]. 热带海洋学报, 2010, 29(4): 94-101. Sun Lihua, Chen Haoru, Huang Honghui, et al. Effects of ration level and feed type on growth and nitrogen budget of young cobia (Rachycentron canadum)[J]. Journal of Tropical Oceanography, 2010, 29(4): 94-101.
[8] 黄建盛, 陈刚, 张健东, 等. 摄食水平对卵形鲳鲹幼鱼的生长和能量收支的影响[J]. 广东海洋大学学报, 2010, 30(1): 18-23. Huang Jiansheng, Chen Gang, Zhang Jiandong, et al. Effect of ration of level on growth and energy budget of Trachinotus ovatus juveniles[J]. Journal of Guangdong Ocean University, 2010, 30(1): 18-23.
[9] Makinen T. Effect of temperature and feed ration on energy utilization in large rainbow trout, Oncorhynchus mykiss (Walbaum)[J]. Aquaculture Research, 1994, 25(2): 213-232.
[10] 彭树锋, 王云新, 叶富良, 等. 体重对斜带石斑鱼能量收支的影响[J]. 水生生物学报, 2008, 6(6): 934-940. Peng Shufeng, Wang Yunxin, Ye Fuliang, et al. Effects of body weight on energy budget of Epinephelus coioides[J]. Acta Hydrobiologica Sinica, 2008, 6(6): 934-940.
[11] 周晖, 陈刚, 纪多亮, 等. 3 种蛋白替代鱼粉对褐点石斑鱼生长, 体成分及能量收支的影响[J]. 广东海洋大学学报, 2013, 32(6): 10-16. Zhou Hui, Chen Gang, Ji Duoliang, et al. The effects of partial replacement of fish meal by three protein sources on growth performance approximate compositions and energy budget of juvenile brown-marbled grouper (Epinephelus fuscoguttatus)[J]. Journal of Guangdong Ocean University, 2013, 32(6): 10-16.
[12] Warren C E, Davis G E. Laboratory studies on the feeding bioenergetics and growth of fishes[M]. Oxford: Blackwell Scientific Publication, 1967: 175-214.
[13] Cui Y, Liu X, Wang S, et al. Growth and energy budget in young grass carp, Ctenopharyngodon idella Val., fed plant and animal diets[J]. Journal of Fish Biology, 1992, 41(2): 231-238.
[14] EI-Saidy D M S D, Gaber M M A. Effect of dietary protein levels and feeding rates on growth performance, production traits and body composition of Nile tilapia, Oreochromis niloticus (L.) cultured in concrete tanks[J]. Aquaculture Research, 2005, 36(2): 163-171.
[15] Ng W K, Lu K S, Hashim R, et al. Effects of feeding rate on growth, feed utilizationand body composition of a tropical bagrid catfish[J]. Aquaculture International, 2000, 8(1): 19-29.
[16] Cho S H, Lee S M, Park B H, et al. Effect of feeding ratio on growth and body composition of juvenile olive flounder Paralichthys olivaceu fed extruded pellets during the summer season[J]. Aquaculture, 2006, 251(1): 78-84.
[17] Han D, Xie S, Lei W, et al. Effect of ration on the growth and energy budget of Chinese longsnout catfish, Leiocassis longirostris Günther[J]. Aquaculture Research, 2004, 35(9): 866-873.
[18] 崔奕波, 解绶启. 鱼类生长变异的生物能量学机制[J].中国科学院院刊, 1998, 6: 453-455. Cui Yibo, Xie Shouqi.Biological energetics mechanism of growth variation in fish[J]. Bulletin of Chinese Academy of Sciences, 1998, 6: 453-455.
[19] 周洪琪, 潘兆龙, 李世钦, 等.摄食和温度对草鱼氮排泄影响的初步研究[J]. 上海水产大学学报, 1999, 8(4): 293-297. Zhou Hongqi, Pan Zhaolong, Li Shiqin, et al. Effect of feeding and temperature on nitrogenous excretion of grass carp, Ctenopharygodon Indells[J]. Joural of Shanghai Fisheries University, 1999, 8(4): 293-297.
[20] 孙丽华, 陈浩如. 温度和体质量对军曹鱼生长及氮收支的影响[J]. 水产学报, 2013, 37(10): 1527-1534. Sun Lihua, Chen Haoru.Effects of water temperature and fish size on growth and nitrogen budget of cobia (Rachycentron canadum)[J]. Journal of Fisheries of China, 2013, 37(10): 1527-1534.
[21] 孙丽华, 陈浩如. 摄食水平和温度对军曹鱼幼鱼生长及氮收支的影响[J]. 热带海洋学报, 2014, 33(2): 37-44. Sun Lihua, Chen Haoru. Effects of ration and temperature on growth and nitrogen budget of young cobia (Rachycentron canadum)[J]. Journal of Tropical Oceanography, 2014, 33(2): 37-44.
[22] Montgomery D C. Design and analysis of experiments[M]. New York: John Wiley & Sons, 2008.
[23] 王辉, 强俊, 王海贞, 等. 温度与盐度对吉富品系尼罗罗非鱼幼鱼能量代谢的联合效应[J]. 中国水产科学, 2012, 19(1): 51-61. Wang Hui, Qiang Jun, Wang Haizhen, et al. Combined effect of temperature and salinity on energy metabolism of GIFT Nile tilapia (Oreochromis niloticus) juveniles[J]. Journal of Fishery Sciences of China, 2012, 19(1): 51-61.
[24] Imsland A K, Foss A, Gunnarsson S, et al. The interaction of temperature and salinity on growth and food conversion in juvenile turbot (Scophthalmus maximus)[J]. Aquaculture, 2001, 198(3): 353-367.
[25] Malloy K D, Targett T E. Feeding, growth and survival of juvenile summer flounder Paralichthys dentatus: experimental analysis of the effects of temperature and salinity[J]. Marine Ecology Progress Series, 1991, 72(3): 213-223.
[26] Magnussen A B, Imsland A K, Foss A. Interactive effects of different temperatures and salinities on growth, feed conversion efficiency, and blood physiology in juvenile spotted wolffish, Anarhichas minor Olafsen[J]. Journal of the World Aquaculture Society, 2008, 39(6): 804-811.
[27] 线薇薇, 朱鑫华. 摄食水平对梭鱼的生长和能量收支的影响 [J]. 海洋与湖沼, 2001, 32(6): 612-620. Xian Weiwei, Zhu Xinhua. Effect of ration size on the growth and energy budget of the mullet Liza haematocheila (T. et S.)[J]. Oceanologia Et Limnologia Sinica, 2001, 32(6): 612-620.
[28] 陈晶, 吴立新, 吴玉波, 等. 不同摄食水平对牙鲆幼鱼生长及能量收支的影响[J]. 水产科学, 2012, 31(1): 1-6. Chen Jing, Wu Lixin, Wu Yubo, et al. Effects of ration levels on growth and energy budgets of juvenile japanese flounder, Paralichthys olivaceus[J]. Fisheries Science, 2012, 31(1): 1-6.
[29] Cui Y, Liu J. Comparison of energy budget among six teleosts-III. Growth rate and energy budget[J]. Comparative Biochemistry and Physiology A, Comparative Physiology, 1990, 97(3): 381-384.
[30] 线薇薇, 朱鑫华. 摄食水平对褐牙鲆幼鱼能量收支的影响 [J]. 青岛海洋大学学报, 2001, 31(5): 695-700. Xian Weiwei, Zhu Xinhua. Effect of ration on energy budget of juvenile bastard halibut Paralichthys olivaceus[J]. Journal of Ocean University of Qingdao, 2001, 31(5): 695-700.
Received: Nov. 6, 2015
Effect of feeding level on the growth and energy budgets of Epinephelus coioides juveniles cultured in low-salt water
HUANG Jian-sheng1, WANG An-li2, CHEN Gang1, ZHANG Jian-dong1, WANG Zhong-liang1, TANG Bao-gui1
(1. Fishery College, Guangdong Ocean University, Zhanjiang 524025, China; 2. College of Life Science, South China Normal University, Guangzhou 510631, China)
Feeding levels; Epinephelus coioides; growth; energy budget; low-salt water
In this paper, we investigate the optimal feeding level of E. coioides juveniles cultured in low-salt water. We observed the effects of feeding levels (satiation, 4.25%, 3.79%, 3.31%, 2.83%, and 2.36%) on the growth and energy budget of these E. coioides juveniles (initial body weight 29.28 ± 2.63 g) cultured in low-salt water (salinity 12) at a temperature of 28 ±1℃; we fed them a formula diet and established the relationship between specific growth rate (SGR), feeding levels, and the energy budget. The results reveal that there was no significant difference in crude protein and ash contents in the groups of juveniles with P > 0.05. The lipid contents of 3.79%, 4.25%, and satiation were significantly higher than those in the other feeding levels (P < 0.05) after culturing for 56 d. The dry matter contents in the 4.25% and satiation groups were higher than those in the other groups. The energy content decreased significantly with a decrease in feeding levels. The feeding ratio of the juveniles was significantly affected by the feeding levels (P < 0.05), and it decreased with a decrease in feeding levels. The specific growth rate in wet weight, dry weight, protein weight, and energy weight increased significantly with feeding levels. We found a logarithmic relationship between SGR and feeding levels. The feed conversion efficiency in wet weight, dry weight, and protein weight first increased and then decreased as feeding levels increased, and the maximum values were observed in the 3.79% group. However, the feed conversion efficiency in energy weight increased with feeding levels, and the maximum value was observed in the satiation group. With increasing feeding levels, the growth energy content (G) of the juveniles first increased and then decreased, and a quadratic relationship was found between G and the feeding levels. With increasing feeding levels, feces energy content (F) and excretion energy content (U) increased, and the maximum values were observed in the satiation group. There was a linear relationship between F, U, and the feeding levels. As the feeding levels increased, the metabolism energy content (R) of the juveniles decreased and tended toward stability. The maximum G was observed in the 3.79% group, and the optimal energy equation was 100.00 C = 12.29 F + 13.73 U + 31.33 R + 42.65 G. We consider the optimal feeding level to be 3.79% of the body weight of E. coioides juveniles cultured in low-salt water.
Q955
A
1000-3096(2016)11-0113-08
10.11759//hykx 20151106003
(本文编辑: 谭雪静)
2015-11-06;
2016-01-26
广东高校优秀青年创新人才培养计划项目(2013LYM0038);广东省海洋与渔业科技项目(A2009-08D03、A2010-08D04); 广东海洋大学“创新强校工程”项目(GDOU2016050251); 广东海洋大学科研启动费项目(E15183)
[Foundation: Supported by Foundation for Distinguished Young Talents in Higher Education of Guangdong, China, No. 2013LYM0038; Project of Marine and Fishery Science Technology of Guangdong Province, No.A2009-08D03, No. A2010-08D04; Project of Enhancing School with Innovation of Guangdong Ocean University, No.GDOU2016050251; Scientiwfic Research Project of Guangdong Ocean University, No.E15183]
黄建盛(1981-), 男, 广东湛江人, 讲师, 博士, 主要从事海水鱼类生理生态学研究, 电话: 0759-2382462, E-mail: huangjs@ gdou.edu.cn; 陈刚, 通信作者, 教授, E-mail: cheng@gdou.edu.cn

