不同碳源对溶藻弧菌黏附相关表型的影响初探及Hfq对其的调控
邓益琴, 赵 哲 刘松林, 陈 偿
(1. 中国科学院 南海海洋研究所, 中国科学院 热带海洋生物资源与生态重点实验室, 广东 广州 510301; 2. 中国科学院 南海海洋研究所, 广东省应用海洋生物学重点实验室, 广东 广州 510301; 3. 中国科学院 南海海洋研究所, 西沙、南沙深海海洋环境观测研究站, 广东 广州 510301; 4. 中国科学院大学, 北京100049)
不同碳源对溶藻弧菌黏附相关表型的影响初探及Hfq对其的调控
邓益琴1,2,4, 赵 哲1,2, 刘松林1,4, 陈 偿1,2,3
(1. 中国科学院 南海海洋研究所, 中国科学院 热带海洋生物资源与生态重点实验室, 广东 广州 510301; 2. 中国科学院 南海海洋研究所, 广东省应用海洋生物学重点实验室, 广东 广州 510301; 3. 中国科学院 南海海洋研究所, 西沙、南沙深海海洋环境观测研究站, 广东 广州 510301; 4. 中国科学院大学, 北京100049)
为探讨不同碳源对溶藻弧菌(Vibrio alginolyticus)黏附相关表型的影响及Hfq对其的调控作用,研究了D-葡萄糖、D-麦芽糖、D-海藻糖和D-果糖对溶藻弧菌ZJ-T野生株、hfq缺失株及回补株的运动性、菌落形态、鞭毛、胞外多糖及生物膜合成的影响。研究结果显示, 4种碳源均使溶藻弧菌群集运动(swarmming)显著增强(P<0.001), 并受Hfq正调控; 游动性(swimming)显著减弱(P<0.01), 但不受Hfq调控; 菌落变得褶皱, 并受Hfq负调控; 4种碳源不影响溶藻弧菌鞭毛及胞外多糖合成, 但D-果糖使其生物膜合成减少, 并受Hfq负调控。实验分析表明: 4种碳源可能通过调控溶藻弧菌黏性阻力及能量代谢来调控其运动性; 并可能通过调控胞外多糖分子结构及理化性质影响其菌落形态; 另外, D-果糖在调控生物膜形成过程中具有重要作用; 因此, 添加不同碳源会影响溶藻弧菌黏附相关表型, 可能影响其致病性, 但具体调控机制需进一步研究。
碳源; 溶藻弧菌; Hfq; 黏附相关表型
溶藻弧菌(Vibrio alginolyticus)致病过程包括黏附、侵袭、体内增殖及产生毒素等一系列过程。其中, 溶藻弧菌的黏附力是决定其致病性的关键环节,而细菌的黏附性与其运动性、胞外多糖合成以及生物膜形成密切相关[1-3]。
海洋细菌的侧生鞭毛和端生鞭毛的动力分别来自质子(H+)动力和钠离子(Na+)依赖性动力, 这与细菌的能量代谢尤其是碳源代谢密切相关[4]。碳源是合成细菌胞外多糖必需的营养元素, 不同碳源可能使其合成的多糖在分子结构、理化性质等方面有所差异, 进而对多糖生物活性产生影响, 如黏度, 抗氧化能力等[5-8]。生物膜的主要成分是多糖, 因此胞外多糖在生物膜的形成过程中具有重要作用[9]。例如胞外多糖参与前期黏附过程, 使得细菌更加紧密的黏附到固体表面; 增加细胞间的距离, 稳定生物膜结构; 并参与细胞营养运输过程等[10-11]。此外,细菌运动性也影响生物膜形成前期对固体表面的黏附[12]。研究表明, 分子伴侣Hfq缺失导致细菌对葡萄糖、果糖等重要碳水化合物的利用减弱, 胞外多糖合成改变、运动能力和生物膜形成能力降低、毒性减弱甚至消失等[13-17]。因此, Hfq很可能通过调控细菌对不同碳源的利用, 从而调控其运动性、胞外多糖合成以及生物膜形成, 进而调控细菌黏附性而影响其致病性。
目前已有不少关于不同碳源对细菌胞外多糖、生物膜形成调控的研究, 如发酵乳杆菌、奇异变形杆菌、海洋假单胞菌等[1,18-20], 但相关研究在溶藻弧菌还未见报道。本研究基于细菌黏附致病性, 研究不同碳源对致病性溶藻弧菌运动性、胞外多糖合成、生物膜形成的影响及分子伴侣Hfq在此过程中的调控作用, 以期初探不同碳源对溶藻弧菌黏附相关表型的调控, 进而为探究碳源对溶藻弧菌的生理调控尤其是致病性调控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株
实验所用菌株: 溶藻弧菌野生株ZJ-T, hfq突变株Δhfq-T, hfq回补株hfq+-T见表1。
1.1.2 主要试剂
结晶紫、甲醇、醋酸, 以及M63培养基各组分(3 g/LKH2PO4, 7 g/L K2HPO4, 2 g/L (NH4)2SO4, 0.5× 10-3g/L FeSO4, 30 g/L NaCl, 2×10-3mol/L MgSO4, 5×10-3g/L维生素B1, 添加0.4%浓度不同碳源: D-葡萄糖、D-麦芽糖、D-海藻糖、D-果糖作为碳源)等生化试剂购自广州威佳公司。

表1 实验所用菌株Tab. 1 Strains used in this study
1.1.3 主要培养基
LBS(3%NaCL)培养基的组分蛋白胨、酵母粉和琼脂粉购自广东环凯公司。
1.2 方法1.2.1 群集运动(swarmming)测定及其菌落形态观测
将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基, 于30℃ 200 r/min 振摇培养过夜; 调整培养液浓度至相同吸光度(OD600nm= 1.0), 取5 μL平行3次点样到LBS及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的固体平板上测试其群集运动, 30℃静置培养48 h, 测量菌斑直径, 同时观察菌落形态。
1.2.2 游动性(swimming)测定
将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基, 于30℃ 200 r/min 振摇培养过夜; 调整培养液浓度至相同吸光度(OD600nm= 1.0), 取5 μL平行3次点样到LBS及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的0.3%琼脂半固体平板上测试其游动性, 30℃静置培养16 h, 测量菌斑直径。
1.2.3 细菌鞭毛的透射电镜观测
将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基, 于30℃ 200 r/min 振摇培养过夜; 按1︰1000重新接菌于LBS及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的新鲜液体培养基中, 30℃ 200 r/min振摇培养10 h后进行负染, 用日本日立公司H-7650型透射电镜拍摄细菌鞭毛。
1.2.4 细菌胞外多糖(Extracellular polysaccharide, ECPs)的定量分析
将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基, 于30 200 ℃r/min振摇培养过夜。取5 μL平行3次点样到LBS及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的固体平板上, 30℃静置培养48 h后将菌落刮取至4 mmol/L EDTA中, 重悬并调整培养液浓度至相同OD600nm吸光度, 并用阿尔新蓝法定量细菌胞外多糖OD620nm[21], 最后胞外多糖分泌量归一化为OD620nm/OD600nm。
1.2.5 生物膜形成实验
将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基, 于30℃ 200 r/min 振摇培养过夜, 6000 r/min 3 min离心收集细菌细胞, 用无碳源的M63培养基洗涤两次后重悬, 并调整细菌浓度至相同吸光度(OD600nm=1.0)。按1 mL/孔用量于24孔培养板中加入不同碳源作为碳源的M63 培养基, 同一菌株平行3次分别将10 μL调试菌液加到1 mL培养基中, 30℃静置培养。于4, 8, 12, 24, 36, 48 h取样, 利用结晶紫染色法定量测定生物膜生成量OD590nm。结晶紫染色法操作参见CHEN等[22]。
1.2.6 数据处理与分析
所有试验重复3次以上, 使用统计分析软件IBM SPSS Statistics 19进行单因素方差LDS分析, P<0.05被认为显著差异。
2 结果与分析
2.1 不同碳源对溶藻弧菌群集运动及菌落形态的调控
在LBS及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的固体平板上, hfq缺失均造成溶藻弧菌群集运动能力显著下降(P<0.001); 在hfq+-T中, 运动能力的缺失得到回补(图1A, 1B)。此外, LBS平板中添加所测试的不同碳源后, 野生株及回补株群集运动能力相对于LBS平板呈现显著上升(P<0.001), 而hfq缺失株群集运动能力变化不显著(P>0.05)(图1A, 1B)。结果说明, 所测试的不同碳源正调控溶藻弧菌的群集运动, 并且这种调控作用受到Hfq的促进。
在LBS平板上分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖后, 均使hfq缺失株Δhfq-T菌落变得褶皱, 相对其他碳源的菌落发生褶皱时间为48 h, 添加0.4%D-果糖后褶皱出现更快为24 h, 而野生株ZJ-T及hfq回补株hfq+-T的菌落形态不变, 与LBS平板上表现一致, 菌落光滑透明(图2)。这说明所测试的不同碳源调控溶藻弧菌的菌落形态, 并且这种调控作用受到Hfq的抑制。
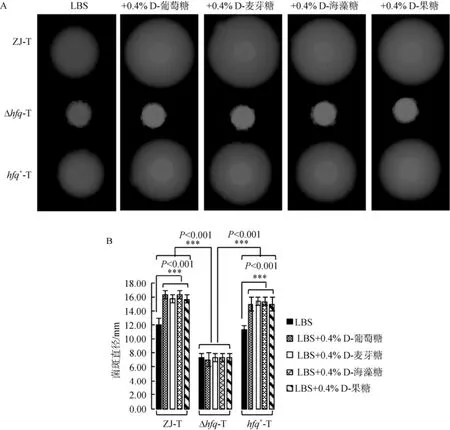
图1 溶藻弧菌ZJ-T、Δhfq-T和 hfq+-T在LBS, 以及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖固体平板上的群集运动(A)及统计分析(B)Fig. 1 Swarming of ZJ-T, Δhfq-T, and hfq+-T on LBS and LBS plus 0.4% D-Glucose, 0.4% D-Maltose, 0.4% D-Trehalose or 0.4% D-Fructose agar plates (A) and statistical analysis (B)
2.2 不同碳源对溶藻弧菌游动性的调控
在LBS及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的0.3%琼脂半固体平板上, hfq缺失均造成溶藻弧菌游动能力显著下降(P<0.001); 在hfq+-T中, 运动能力的缺失得到回补(图3A, 3B)。此外, LBS 0.3%琼脂半固体平板中添加所测试的不同碳源后, 野生株ZJ-T、hfq缺失株Δhfq-T及回补株hfq+-T游动能力相对于LBS 0.3%琼脂半固体均呈现显著下降(P<0.01)(图3A, 3B)。以上结果说明, 所测试的不同碳源负调控溶藻弧菌的游动性, 但这种调控作用不受Hfq的影响。
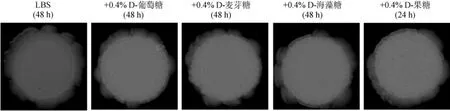
图2 溶藻弧菌hfq缺失株Δhfq-T在LBS, 以及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖固体平板上的菌落形态(300%缩放比例)Fig. 2 Colony morphology of Vibrio alginolyticus hfq mutant strain Δhfq-T on LBS and LBS plus 0.4% D-Glucose, 0.4% D-Maltose, 0.4% D-Trehalose, or 0.4% D-Fructose agar plates. (Scale: 300%)
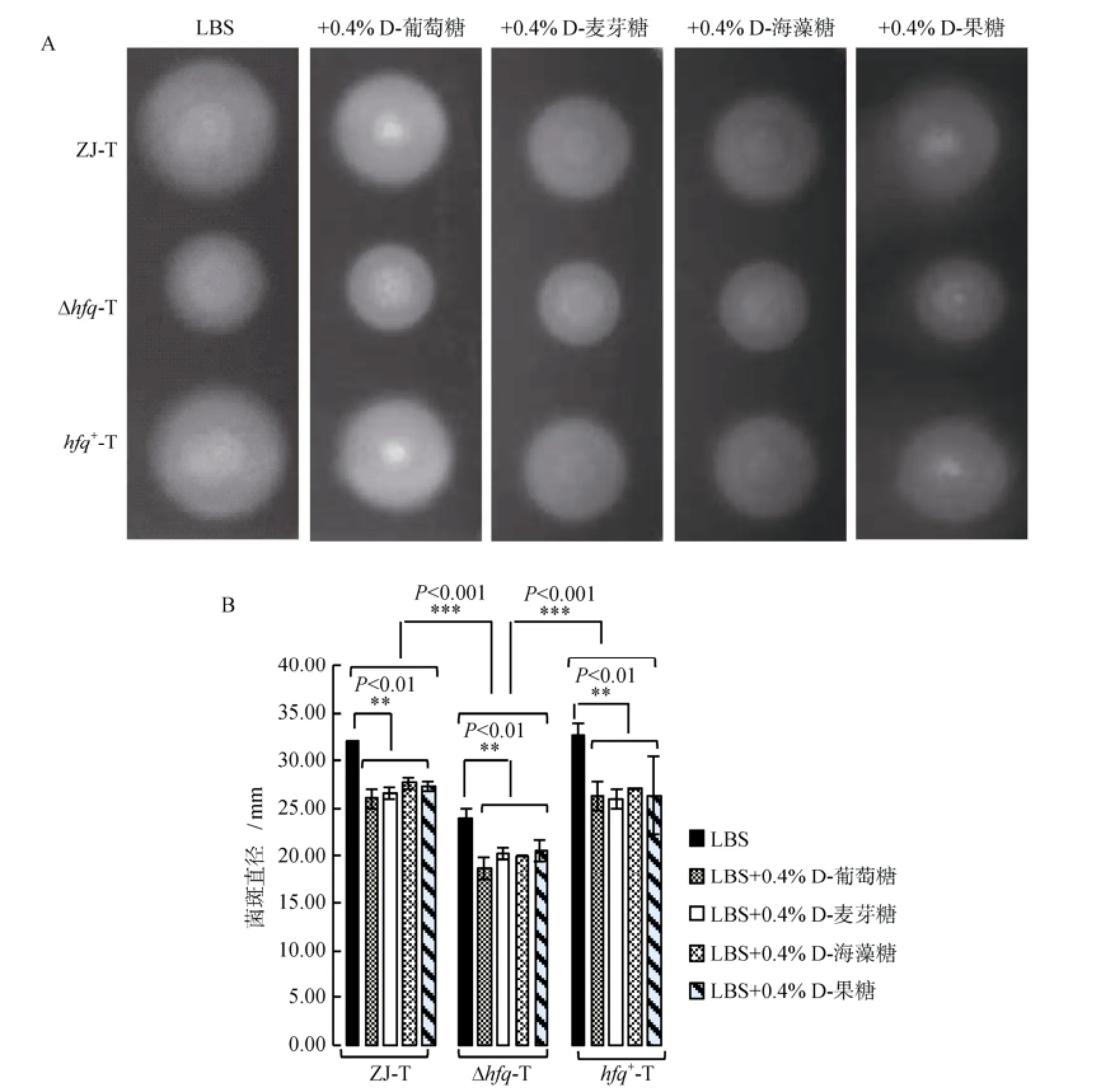
图3 溶藻弧菌ZJ-T、Δhfq-T和 hfq+-T在LBS, 以及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖固体平板上的游动性(A)及统计分析(B)Fig. 3 Swimming of ZJ-T, Δhfq-T, and hfq+-T on LBS and LBS plus 0.4% D-Glucose, 0.4% D-Maltose, 0.4% D-Trehalose or 0.4% D-Fructose agar plates (A) and statistical analysis (B)
2.3 不同碳源对溶藻弧菌鞭毛合成的调控
透射电镜观察发现(图4), 溶藻弧菌野生株ZJ-T、hfq缺失株Δhfq-T及回补株hfq+-T在LBS及LBS分别添加0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的液体培养基中, 均具有端生鞭毛, 且细胞大小形态差异较小, 均短小并弯曲成弧形。这说明在溶藻弧菌中, 所测试的碳源并不直接调控鞭毛合成的相关基因, 溶藻弧菌的运动性表型的调控可能涉及多个因子的参与。
2.4 不同碳源对溶藻弧菌胞外多糖合成的调控
从图5中可见, hfq缺失后使得细菌胞外多糖的合成显著增加, 约为野生株ZJ-T及回补株hfq+-T的两倍; 但在LBS添加不同碳源: 0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的固体平板中, 30℃静置培养48 h后, 这种增加的趋势没有改变, 且同一菌株在不同培养基中胞外多糖合成量也几乎不变。这说明在溶藻弧菌中, 所测试的碳源并不直接调控细菌胞外多糖的合成。
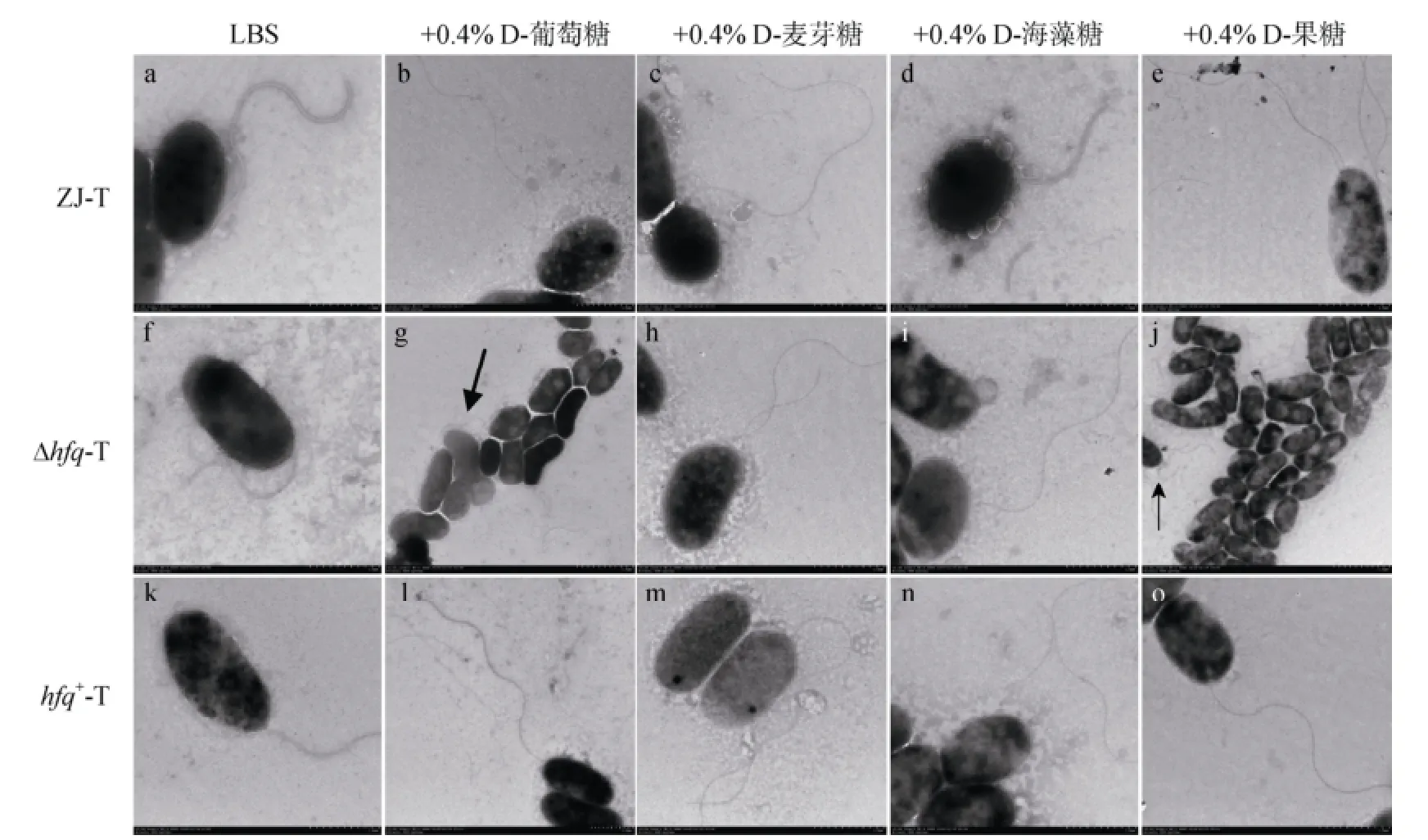
图4 不同培养基中溶藻弧菌ZJ-T、Δhfq-T和 hfq+-T端生鞭毛的透射电镜观测(ZJ-T: a-e, a: 5.0K, b: 4.0K, c: 5.0K, d: 5.0K, e: 5.0K; Δhfq-T: f-j, f: 5.0K, g: 2.0K, h: 5.0K, i: 5.0K, j: 2.0K; hfq+-T: k-o, k: 5.0K, l: 3.0K, m: 5.0K, n: 5.0K, o: 5.0K; 1.0K=放大1000倍)Fig. 4 Observation of polar flagella by a Hitachi H-7650 TEM in ZJ-T, Δhfq-T, and hfq+-T in different media. (ZJ-T: a-e, a: 5.0 K, b: 4.0 K, c: 5.0 K, d: 5.0 K , e: 5.0 K; Δhfq-T: f-j, f: 5.0 K, g: 2.0 K, h: 5.0 K, i: 5.0 K , j: 2.0 K; hfq+-T: k-o, k: 5.0 K, l: 3.0 K, m: 5.0 K, n: 5.0 K , o: 5.0 K; 1.0 K = 1000 magnification)
2.5 不同碳源对溶藻弧菌生物膜合成的调控
在细菌生物膜形成的动态曲线中, 可见hfq缺失后并不影响生物膜成熟的时间, 仍可在M63添加不同碳源: 0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖、0.4%D-果糖的培养基中, 30℃静置培养12 h后到达顶峰,但hfq的缺失使得成熟期生物膜生成量显著下降, 且其前期的合成速度以及后期的解离速度均下降(图6)。此外, hfq缺失株Δhfq-T在以0.4%D-果糖为碳源的M63培养基中成熟期的生物膜生成量较以0.4%D-葡萄糖、0.4%D-麦芽糖、0.4%D-海藻糖为碳源时低; 而单独的野生株ZJ-T或者hfq缺失株Δhfq-T, 在4种碳源分别存在时, 成熟期生物膜生成量、前期合成速度及后期解离速度都基本不变(图7)。
以上结果说明, D-果糖可能参与调控溶藻弧菌生物膜的合成, 并且这种调控作用受Hfq抑制。
3 讨论
所测试的四种不同碳源: D-葡萄糖、D-麦芽糖、D-海藻糖、D-果糖均使得溶藻弧菌野生株游动性显著下降(P<0.001)并不受Hfq的调控, 而群集运动显著增加(P<0.01)并受Hfq的促进性调控, 而在任意同一培养基中, hfq缺失后使得溶藻弧菌游动性和群集运动均显著下降。运动能力是细菌尤其是病原菌趋化作用、黏附和侵入的必要条件, 细菌运动能力主要由鞭毛驱动, 且质子(H+)动力和钠离子(Na+)依赖性动力等均可影响细菌的运动能力[4]。溶藻弧菌在半固体环境中其运动性表现为游动性, 而在固体环境中表现为群集运动, 且群集运动耐受黏度环境的能力比游动性强[23]。这里所测试的4种碳源并没有影响其鞭毛的合成, 因此, 在半固体环境且钠离子(Na+)不改变的情况下, 所测试的碳源可能主要通过增加细菌表面黏性阻力从而减弱其游动性[23-25]; 而在固体环境下则主要通过增强细菌能量代谢从而提高其质子(H+)动力来增强其群集运动[4]。此外, 根据笔者实验室已有研究, hfq缺失后, 导致包括4个拷贝的fliC(flagellin)基因, 3个拷贝的mcp(methyl-accepting chemotaxis protein)基因, 马达蛋白基因motA/motB以及趋化蛋白基因cheB/cheM等11个运动相关基因的下调表达, 因此Hfq很可能通过调控动力基因表达, 而不影响鞭毛组装来调控溶藻弧菌运动性; 且Hfq还可通过调控碳运输和代谢等过程相关基因的表达进而起到促进作用, 这与根瘤农杆菌(Agrobacterium tumefaciens)和恶臭假单胞菌(Pseudomonas putida)的研究结果相似[15-16]; 因此, 从运动性角度出发, 4种碳源可能参与了溶藻弧菌的致病性调控, 且Hfq体现了其辅助调控作用。
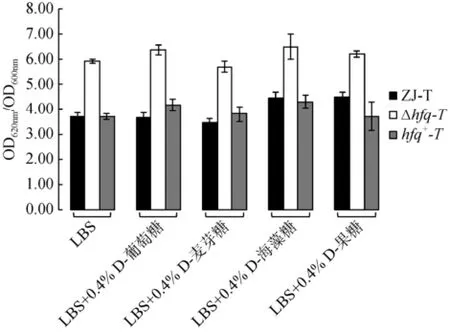
图5 溶藻弧菌ZJ-T、Δhfq-T和hfq+-T在不同培养基中细菌胞外多糖的合成Fig. 5 Extracellular polysaccharide synthesis of ZJ-T, Δhfq-T, and hfq+-T in different media
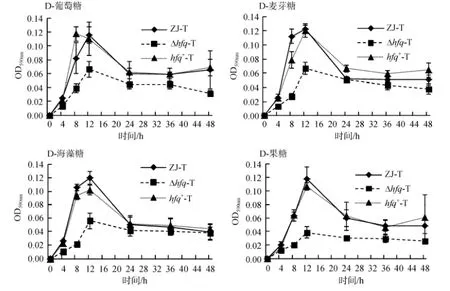
图6 溶藻弧菌ZJ-T、Δhfq-T和 hfq+-T细胞在不同培养基中的细菌生物膜形成动态曲线Fig. 6 Kinetic biofilm formation of ZJ-T, Δhfq-T, and hfq+-T in different media
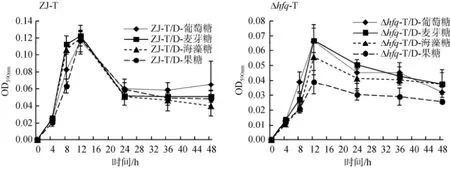
图7 不同碳源存在情况下, 溶藻弧菌ZJ-T、Δhfq-T细胞生物膜形成动态曲线Fig. 7 Kinetic biofilm formation of ZJ-T and Δhfq-T with different carbon sources
hfq缺失后, 4种碳源的存在使得溶藻弧菌在固体平板上菌落变得褶皱, 这种褶皱表型被认为与胞外多糖密切相关[26]。根据笔者实验室已有研究, hfq缺失后, 溶藻弧菌在LB(1%NaCL)平板上菌落变得褶皱, 且胞外多糖合成减少; 这里在LBS(3%NaCL)平板上, hfq缺失后菌落并未变得褶皱, 且胞外多糖合成增加, 因此, 盐度会影响胞外多糖合成量, 进而影响菌落表型[6]。该研究显示, 在D-葡萄糖、D-麦芽糖、D-海藻糖、D-果糖存在情况下, 溶藻弧菌胞外多糖的合成量并没有显著变化, 因此, 该研究中菌落褶皱并非由胞外多糖量变引起。REZENDE 等的研究表明, 褶皱表型表现出更强的附着能力[27]。FUKUDA、陈晓红等的研究结果表明不同碳源培养得到的细菌胞外多糖分子组成与分子质量等存在差异, 而这与胞外多糖黏度变化有着一定联系, 一般分子质量越大, 多糖黏度越大[6-7], 并在乳酸杆菌中发现, 以果糖为碳源时合成的胞外多糖分子质量相对葡萄糖和麦芽糖更大[6], 该研究发现添加D-果糖后, 细菌菌落褶皱发生时间仅为添加其他碳源的1/2,这可能与合成的胞外多糖分子质量更大, 进而导致黏度更大相关。因此, 所测试的4种碳源可能通过改变胞外多糖的分子结构和理化性质, 影响其黏度,从而致使溶藻弧菌菌落表现褶皱[27], 这可能调控其致病性。
运动性和胞外多糖都参与调控细菌生物膜形成前期对固体表面的黏附, 并且胞外多糖还通过增加细胞间距离以稳定生物膜结构而参与生物膜成熟过程, 且这些过程与细菌的致病性密切相关[10-11,28-29]。研究表明, ZJ-T或者Δhfq-T, 在4种碳源分别存在时,成熟期生物膜生成量、前期合成速度及后期解离速度都基本不变; 而任何一种碳源存在情况下, hfq缺失株成熟期生物膜生成量、前期合成速度和后期解离速度相对野生株ZJ-T均下降。因此, hfq缺失造成细胞运动能力下降从而很可能影响细胞前期的附着,而细胞附着后的生物膜成熟过程, 还需要细菌分泌的胞外多糖等生物膜基质组分参与。此外, 最后的细菌脱离即生物膜解离阶段, 是单个细菌细胞或多细胞团脱离到环境中, 并在新的固体表面开始附着的过程[2]。长时间的聚集导致营养物的匮乏和代谢废物的累积, 将激发生物膜内的细菌产生解离因子, 通过释放单个细胞或小块生物膜可获得更多的营养[12,30]。根据笔者实验室已有研究, hfq缺失后, 溶藻弧菌在不同碳源培养基中, 相对野生菌株生长潜伏期延长、对数期生长速率减慢, 且稳定期细胞密度降低。因此,相对野生菌株, hfq缺失株出现营养缺乏的时间延长,且相关解离因子的形成能力减弱, 从而很可能导致其后期生物膜解离速度下降。另外, 在以0.4%D-果糖为碳源的情况下, hfq缺失后, 其成熟期生物膜生成量减少最多, 因此D-果糖在Hfq抑制作用下减少了溶藻弧菌生物膜的合成, 从而很有可能参与调控溶藻弧菌的致病性。
4 结论
D-葡萄糖、D-麦芽糖、D-海藻糖、D-果糖通过增加溶藻弧菌表面黏附阻力从而减弱其游动性; 增强能量代谢进而提高其群集运动; 并且很可能通过改变胞外多糖的分子结构和理化性质, 如分子质量,进而改变其黏度, 使得细菌菌落表现褶皱; D-果糖还有可能通过减少溶藻弧菌生物膜的合成而参与调控其致病性。分子伴侣Hfq也在其中体现了其多效性的调控作用。具体调控机制需要进一步研究, 并在基因水平深入探讨。该研究为进一步探讨其它碳源对溶藻弧菌的生理调控尤其是致病性调控提供了理论指导。
[1] Moryl M, Kaleta A, Strzelecki K, et al. Effect of nutrient and stress factors on polysaccharides synthesis in Proteus mirabilis biofilm[J]. Acta Biochimica Polonica, 2014, 61(1): 133-139.
[2] 干霞芳, 李蒙英. 生物膜和生物膜形成菌的研究 [J].安徽大学学报 (自然科学版), 2007, 31(6): 91-94. Gan Xiafang, Li Mengying. Research progress on biofilm and biofilm-forming bacterium[J]. Journal of Anhui University (Natural Science Edition), 2007, 31(6): 91-94.
[3] 陈强, 鄢庆枇, 马甡. 溶藻弧菌致病性研究进展[J].海洋科学, 2006, 30(8): 83-89. Chen Qiang, Yan Qingpi, Ma Shen. Progress on pathogenicity research of Vibrio alginolyticus[J]. MarineSciences, 2006, 30(8): 83-89.
[4] 邓国宏, 徐启旺, 刘俊康, 等. 细菌鞭毛马达——种卓越的分子机器[J]. 生物化学与生物物理进展, 2000, 27(6): 612-615. Deng Guohong, Xu Qiwang, Liu Junkang, et al. Bacterial Flagellar Motor: A Splendid Molecular Motor[J]. Progress In Biochemistry and Biophysics, 2000, 27(6): 612-615.
[5] Rao Y M, Suresh, A K, Suraishkumar G K. Free radical aspects of Xanthomonas campestris cultivation with liquid phase oxygen supply strategy[J]. Process Biochemistry, 2003, 38(9): 1301-1310.
[6] 陈晓红, 董明盛, 黄文利, 等. 不同碳源对 Lactococcus FML02-8 合成胞外多糖的影响[J]. 无锡轻工业大学学报: 食品与生物技术, 2004, 23(6): 13-17. Chen Xiaohong, Dong Mingsheng, Huang Wenli, et al. Effect of Carbon Sources on Exopolysaccharides Produced by Lactococcus FML02-8 [J]. Journal of Wuxi University of Light Industry, 2004, 23(6): 13-17.
[7] Fukuda K, Shi T, Nagami K, et al. Effects of carbohydrate source on physicochemical properties of the exopolysaccharide produced by Lactobacillus fermentum TDS030603 in a chemically defined medium [J]. Carbohydrate Polymers, 2010, 79(4): 1040-1045.
[8] 孙海红, 毛文君, 钱叶苗, 等. 海洋微生物活性胞外多糖的研究进展[J]. 海洋科学, 2011, 35(11): 134-138. Sun Haihong, Mao Wenjun, Qian Yemiao, et al. Advances on the characteristics and bioactivities of exopolysaccharides from marine microorganism[J]. Marine Sciences, 2011, 35(11): 134-138.
[9] 李江, 陈靠山, 郝林华, 等. 细菌胞外多糖的研究进展[J]. 海洋科学, 2006, 30(4): 74-77. Li Jiang, Chen Kaoshan, Hao Linhua, et al. The progress on extracellular polysaccharide of bacteria[J]. Marine Sciences, 2006, 30(4): 74-77.
[10] Sutherland I W. Biofilm exopolysaccharides: a strong and sticky framework[J]. Microbiology, 2001, 147(1): 3-9.
[11] Nwodo U U, Green E, Okoh A I. Bacterial exopolysaccharides: functionality and prospects[J]. International Journal of Molecular Sciences, 2012, 13(11): 14002-14015.
[12] Davey M E, O'toole G A. Microbial biofilms: from ecology to molecular genetics [J]. Microbiology and Molecular Biology Reviews, 2000, 64(4): 847-867.
[13] Chiang M K, Lu M C, Liu L C, et al. Impact of Hfq on global gene expression and virulence in Klebsiella pneumoniae [J]. PloS One, 2011, 6(7): e22248.
[14] Cui M, Wang T, Xu J, et al. Impact of Hfq on global gene expression and intracellular survival in Brucella melitensis[J]. PloS One, 2013, 8(8): e71933.(doi: 10.1371/journal.pone.0071933)
[15] Möller P, Overlöper A, Förstner K U, et al. Profound impact of Hfq on nutrient acquisition, metabolism and motility in the plant pathogen Agrobacterium tumefaciens[J]. PLoS One, 2014, 9(10): e110427. (doi: 10.1371/ journal.pone.0110427)
[16] Arce-rodríguez A, Calles B, Nikel P I, et al. The RNA chaperone Hfq enables the environmental stress tolerance super-phenotype of Pseudomonas putida [J]. Environmental Microbiology, 2015. (doi: 10.1111/1462-2920.13052)
[17] Liu H, Wang Q, Liu Q, et al. Roles of Hfq in the stress adaptation and virulence in fish pathogen Vibrio alginolyticus and its potential application as a target for live attenuated vaccine [J]. Applied Microbiology and Biotechnology, 2011, 91(2): 353-364.
[18] 辛跃强, 梁荣荣, 王瑞明. 低聚半乳糖对肠道益生菌产胞外多糖作用的研究[J]. 生物技术通报, 2015, 31(6): 144-150. Xin Yueqiang, Liang Rongrong, Wang Ruiming. Effects of Galactooligosaccharide on Exopolysaccharide Produced by Intestinal Probiotics[J]. Biotechnology Bulletin, 2015, 31(6): 144-150.
[19] 张萃逸, 张培帅, 朱骏, 等. 基于不同碳源的生物膜特性分析[J]. 上海师范大学学报(自然科学版), 2012, 41(2): 186-195. Zhang Cuiyi, Zhang Peishuai, Zhu Jun, et al. Analysis on biofilm property based on different carbon source[J]. Journal of Shanghai Normal University (Natural Sciences), 2012, 41(2): 186-195.
[20] 张佳佳, 屈菲, 万慧萍, 等. 不同碳源对海洋假单胞菌 PT-8 合成胞外多糖的抗氧化性的影响 [J]. 大连工业大学学报, 2013, 32(6): 413-416. Zhang Jiajia, Qu Fei, Wan Huiping, et al. Effect of different carbon sources on oxidation of the Pseudomonas PT-8 extracellular polysaccharide[J]. Journal of Dalian Polytechnic University, 2013, 32(6): 413-416.
[21] Croxatto A, Lauritz J, Chen C, et al. Vibrio anguillarum colonization of rainbow trout integument requires a DNA locus involved in exopolysaccharide transport and biosynthesis[J]. Environmental Microbiology, 2007, 9(2): 370-382.
[22] Chen C, Jie J, Hu C Q. Phenotypic and genetic differences between opaque and translucent colonies of Vibrio alginolyticus[J]. Biofouling, 2009, 25(6): 525-531.
[23] Atsumi T, Maekawa Y, Yamada T, et al. Effect of viscosity on swimming by the lateral and polar flagella of Vibrio alginolyticus[J]. Journal of Bacteriology, 1996, 178(16): 5024-5026.
[24] Magariyama Y, Sugiyama S, Muramoto K, et al. Simultaneous measurement of bacterial flagellar rotation rate and swimming speed[J]. Biophysical Journal, 1995, 69(5): 2154-2162.
[25] Kawagishi I, Imagawa M, Imae Y, et al. The so-dium-driven polar flagellar motor of marine Vibrio as the mechanosensor that regulates lateral flagellar expression[J]. Molecular Microbiology, 1996, 20(4): 693-699.
[26] Yildiz fh, Liu X S, Heydorn A, et al. Molecular analysis of rugosity in a Vibrio cholerae O1 El Tor phase variant[J]. Molecular Microbiology, 2004, 53(2): 497-515.
[27] De rezende C E, Anriany Y, Carr L E, et al. Capsular polysaccharide surrounds smooth and rugose types of Salmonella enterica serovar Typhimurium DT104[J]. Applied and Environmental Microbiology, 2005, 71(11): 7345-7351.
[28] 滕勇勇, 王琪, 吴雷, 等. 致病性弧菌的生物学特性和致病因子研究进展[J]. 热带医学杂志, 2014, 14(010): 1396-1398. Teng Yongyong, Wang Qi, Wu Lei, et al. The progress of biological characteristics and virulence factors of pathogenic Vibrios[J]. Journal of Tropical Medicine, 2014, 14(010): 1396-1398.
[29] Wyckoff E E, Allred B E, Raymond K N, et al. Catechol Siderophore Transport by Vibrio cholerae[J]. Journal of Bacteriology, 2015, 197(17): 2840-2849.
[30] 欧美珍, 凌均棨. D-型氨基酸对细菌生物膜解离分散的作用[J]. 国际口腔医学杂志, 2015, 42(2): 203-205. Ou Meizhen, Ling Junqi. Effects of D-type amino acids on biofilm dissociation[J]. International Journal of Stomatology, 2015, 42(2): 203-205.
Received: Feb. 25, 2016
Preliminary research of effect of different carbon sources on adhesion-related phenotypes in Vibrio alginolyticus
DENG Yi-qin1,2,4, ZHAO Zhe1,2, LIU Song-lin1,4, CHEN Chang1,2,3
(1. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China; 2. Guangdong Provincial Key Laboratory of Applied Marine Biology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China; 3. Xisha/Nansha Ocean Observation and Research Station, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China; 4. University of Chinese Academy of Sciences, Beijing 100049, China)
carbon sources; Vibrio alginolyticus; Hfq; adhesion related phenotypes
To gain insight into regulation by different carbon sources and Hfq on adhesion-related phenotypes in Vibrio alginolyticus, we studied the effects of D-Glucose, D-Maltose, D-Trehalsoe, and D-Fructose on the motility, colony morphology, flagella, extracellular polysaccharides (ECPs), and synthesis of biofilm in V. alginolyticus wild type ZJ-T and hfq mutant and complementary strains. The results show that the addition of each of these four carbon sources may significantly increase swarming ability (P < 0.001), which was also positively regulated by Hfq; significantly reduce swimming ability (P < 0.01), which was not affected by Hfq; and wrinkle the colony, which was negatively regulated by Hfq. These four carbon sources did not affect the synthesis of flagella and ECPs but D-Fructose decreased the synthesis of biofilm that was negatively regulated by Hfq. Our study indicates that these four carbon sources regulate the motility of V. alginolyticus possibly by regulating their viscous resistance and energy metabolism. They also affect colony morphology possibly by regulating the molecular structure and physicochemical properties of ECPs. Furthermore, D-Frutose plays an important role in the synthesis of biofilm. Simultaneously, these four carbon sources regulate adhesion-related phenotypes in V. alginolyticus and are speculated to affect its virulence. The regulation mechanisms should be further studied.
Q939.99
A
1000-3096(2016)11-0099-09
10.11759/hykx20160225001
(本文编辑: 康亦兼)
2016-02-25;
2016-05-09
国家自然科学基金(31272697, 41276163); 广州市珠江科技新星项目(2013J2200094); 广东省省级科技计划项目(2014B030301064) [Foundation: National Natural Science Foundation of China, No.31272697, No.41276163; Project of Science and Technology New Star of Zhujiang in Guangzhou city, No.2013J2200094; Science and Technology Planning Project of Guangdong Province, China, No.2014B030301064]
邓益琴(1990-), 女, 江西抚州人, 博士研究生, 主要从事海洋微生物研究, 电话: 020-89023216, E-mail: yiqindd@163.com; 陈偿, 通信作者, 研究员, 主要从事海洋微生物研, 电话: 020-89235772, E-mail: chen.chang@scsio.ac.cn

