硫酸浸提对磷矿石物性变化影响
郑凌志1, 窦 焰1, 孙祥斌1, 沈 浩2, 郑之银2, 刘 荣2, 崔 鹏1
(1. 合肥工业大学 化学与化工学院, 安徽 合肥 230009;
2. 安徽六国化工有限公司, 安徽 铜陵 244000)
硫酸浸提对磷矿石物性变化影响
郑凌志1, 窦 焰1, 孙祥斌1, 沈 浩2, 郑之银2, 刘 荣2, 崔 鹏1
(1. 合肥工业大学 化学与化工学院, 安徽 合肥 230009;
2. 安徽六国化工有限公司, 安徽 铜陵 244000)
以硫酸浸提磷矿石的反应过程为研究对象,在反应温度80℃,搅拌速率300 r·min-1,反应时间180 min的反应条件下,对硫酸浸提体系进行研究。通过原子吸收、扫描电镜、X射线电子衍射、比表面积与粒径分布等测量及表征。结果表明:磷矿浸提反应120 min内大部分磷矿石转变为CaSO4·2H2O晶体,反应过程中,CaSO4·2H2O晶体首先在磷矿表面产生,在磷矿表面堆叠。随着反应进行,晶体长大后脱落,矿石结构坍塌。由此导致矿物平均粒径先增大后减小,孔性能的N2等温吸附曲线滞回环由H3型转变为H4型。
磷酸生产;二水硫酸钙;结晶;化学过程
1 前 言
湿法磷酸是获取磷酸的重要方法。通常工艺为为硫酸和磷酸的混酸分解磷矿,浸提制取磷酸。
湿法磷酸的研究,主要集中在对其结构,酸解率,动力学等方面。黄芳等[1,2]分析了高镁磷尾矿的矿石结构以及矿物组成,并研究了磷镁的赋存状态。Gilbert等[3]分析了不同粒径,不同浓度的磷硫混酸,不同温度下的磷矿酸解率。研究了不同工艺条件对磷矿酸解的影响。Taner Tekin[4]研究了在超声影响下盐酸分解磷矿过程,表明超声波有助于提高磷矿的分解率以及分解速率。
Zafar等[5,6],Gharabaghi等[7],Economou等[8]研究了有机酸分解磷矿时的选择性及其浸出动力学。Lassis[9]以阿尔及利亚两种磷矿为原料,研究了不同硫酸浓度,粒径大小,反应时间以及转速对磷酸浸出率的影响。Antar[10]以突尼斯磷矿为原料,研究其在不同温度下的浸出动力学。罗洪波[11]以瓮福磷矿为原料,对硫酸脲分解磷矿的反应机理进行了初步探索。
李成蓉等[12]对金河磷矿在磷硫混酸的情况下进行了酸解动力学的研究,并考察了矿石粒度、硫酸浓度以及反应温度对酸解过程的影响。刘代俊等[13,14]研究了以磷酸与具有丰富内孔隙的磷矿颗粒为代表的液固两相反应的机理和反应动力学模型。严永华[15]以云南上蒜磷矿为原料,研究磷酸浸提磷矿时动力学过程并给出动力学模型。
至今为止,对磷矿石酸解浸提过程及产物的研究,主要集中于酸解以及溶解度方面,关于磷矿石在酸解浸提过程中矿石结构物性以及产物变化的研究鲜有报道。
本文针对磷硫混酸酸解磷矿石浸提制酸过程,以湖北宜昌某磷矿为对象研究酸解过程中矿相的化学组成及含量、物理结构的变化。从磷矿石在浸提中物性变化入手,力图阐明磷矿石在整个浸提过程发生的物理及化学性质发生的变化,对工业生产实际具有指导作用。
2 实验(材料与方法)
2.1 实验原料与试剂
磷矿石原矿:取自湖北宜昌,粉碎为平均粒径178 μm的磷矿粉备用,其主要组成见表1。

表1 磷矿石主要化学组成Table 1 Main compositions of the phosphate ore
磷酸、硫酸、硝酸、盐酸、钼酸铵、抗坏血酸与氯化钡,AR,国药集团药业股份有限公司。
Ca、Mg、Fe单元素标准溶液,国家有色金属及电子材料分析测试中心。
2.2 酸解浸提过程
本方法在Gilbert R L[3]的文献基础上进行优化所得(浸出率98%),具体方法如下。准确称取一定量的磷矿石粉置于250 mL三口烧瓶中,加入适量水连续搅拌,待矿浆达到预定温度后,加入按比例配制的磷硫混酸(磷酸:硫酸摩尔比为:1:10),在80℃下以转速300 r·min-1(搅拌桨为双叶片聚四氟乙烯搅拌桨,叶展直径65 mm)反应180 min。反应过程中定时取样(采用注射器定量移出反应物至大量水中稀释,然后快速过滤),反应结束后采用大量水稀释,真空抽滤分离,固相数次用去离子水和乙醇洗涤,45℃真空烘干。
2.3 分析与表征方法
P2O5含量测定采用磷钼酸喹啉质量法[GB/T 1871.1-1995];
CaO、Fe2O3与MgO含量的测定采用原子吸收分光光度法(AA-6300C,日本岛津制作所);
比表面积与孔径分布测定采用比表面分析仪(SA3100,美国贝克曼库尔特有限公司);
微观形貌表征及EDS分析采用扫描电子显微镜(JSM-6490LV,日本电子株式会社);
粒径分布测定采用激光粒度仪(MS-2000,英国马尔文仪器有限公司);晶型表征采用X射线衍射仪(X'Pert PRO MPD,荷兰帕纳科有限公司)。


图1 酸浸提过程中磷矿SEM图Fig.1 SEM micrographs of phosphate ore during leaching a. 0 min b. 1 min c. 10 min d. 30 min e. 60 min f. 120 min g. 180 min
3 结果与讨论
3.1 表面形貌与结构
从图1可见,未反应的磷矿矿粉颗粒表面具有深浅不一的坑丘。在反应时间1 min时,可以观察到片状晶体附着于磷矿表面。随着反应的进行,磷矿颗粒表面逐渐被晶体所覆盖,并堆叠在颗粒表面。在60 min时已有部分晶体开始脱落,随着包覆的晶体厚度增加,颗粒结构强度开始减弱,同时反应中有HF气体产生[16],导致了部分晶体开始脱落。120 min时颗粒结构完全坍塌,图1f中只可观察到片状和棒状晶体。随着反应时间增加,晶体继续长大,180 min时晶体颗粒形貌变得更为粗大、规整。
以上分析可知,当颗粒结构未坍塌时,选用图2所示的收缩未反应芯来分析此过程比较恰当。在反应过程中主要有以下几种反应[17,18]
(1) 磷硫混酸中的 H+通过磷矿颗粒外面的液膜层扩散至颗粒的外表面;
(2) H+由矿粉颗粒外表面通过固体产物层扩散至未反应的磷矿颗粒表面;
(3) H+与磷矿发生反应;
(4) 反应产物通过固体产物层向外表面传输;
步骤(1)发生在图2中的II-III区,此区为反应残核区,由酸难溶的硅酸盐骨架和反应产物构成[19]。反应生成的晶体包裹在颗粒表面,使磷矿继续分解受到阻力,这种阻力会减慢混酸分解速度[16]。同时,由于反应界面中发生了局部的浓度变化,Ca2+与SO42-相互碰撞结合形成缔合体,促进了晶体的形成[18]。步骤(2) (3) (4)主要发生在图2中的III区,此区为反应区,反应产物不断传递到表面,在表面形成堆积,如图1d。反应至120 min时,颗粒骨架结构无法支撑反应残核区,颗粒结构出现坍塌。
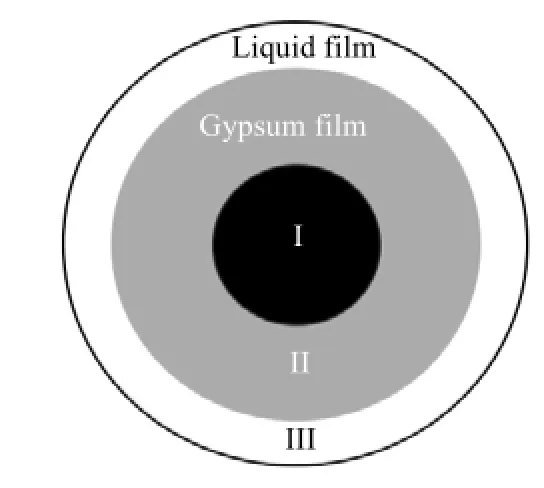
图2 磷矿颗粒收缩未反应芯模型Fig.2 Shrinking core model of a phosphate ore particle I. unreacted particle core II-III. reaction residue III. reaction zone
3.2 主要化学成分与含量
在磷酸浸提工艺条件下,研究浸提过程中磷矿固相与浸提液中化学组成与含量变化,结果见图3。

图3 磷矿石酸解浸提过程中主要化学组成变化 / %(wt)Fig.3 Variation of main chemical components of phosphate ore during leaching
从磷含量的变化可以发现固相P2O5含量在0~10 min下降速度较快,10~120 min P2O5含量稳定下降,120~180 min含量基本不变,据此,可以将磷矿浸提反应分为三个阶段:快速反应阶段、稳定反应阶段和反应终止阶段。快速反应阶段是化学反应速度是反应控制步骤,以化学反应为主,其表现为磷矿表面发生反应。此阶段对应图1中的a~c阶段,图2反应模型中的固体产物层正在形成。稳定反应阶段是扩散速度为反应控制步骤,反应特性符合图2中的反应模型。在此时间达到最大的结晶速度,溶液中的溶质迅速下降。此阶段对应图1中的d~e阶段。在反应终止阶段,晶核已经不再生成,晶体开始逐渐生长。
酸浸提过程中CaO含量在反应时间120 min后基本保持不变。未反应的磷矿中CaO的存在形式主要是Ca5(PO4)3F和少量的CaCO3,浸提制酸后CaO的存在形式主要是CaSO4·2H2O以及微量的未反应的Ca5(PO4)3F和少量溶于浸提液中。所以CaO含量下降的主要原因是其在固相中的存在形式发生了MgO与Fe2O3含量在快速反应阶段下降较快,在10 min时反应基本结束。
浸提过程中未检测出Al2O3、K2O和Na2O含量的变化。
对酸浸提反应0~180 min过程中,对固相进行能谱分析,其主要化学元素及含量见表2。

表2 化学组分相对含量(原子比)Table 2 Relative contents of different chemical elements (atomic ratio)
在快速反应阶段,晶体未完全覆盖磷矿颗粒表面,能谱中可以检测磷元素存在,10 min时已经无法检测到磷元素。钙元素在0至10 min时含量快速下降,说明矿粉颗粒表面CaO的存在形式发生转变,硫酸钙已经完成对矿粉颗粒的覆盖。10 min后各元素含量基本保持稳定,反应进入稳定反应阶段。
由表3可知在快速反应阶段反应较为复杂,即存在Ca5F(PO4)3与H+分解反应也存在磷矿中其他成分与H+发生反应。而到了稳定反应阶段,主要反应仅为Ca5F(PO4)3的分解反应。

表3 不同阶段主要反应Table 3 Main reactions happened during different reaction phases
3.3 晶型结构
随着浸提过程的进行,定时取样分析反应固相的晶型,其XRD图谱见图4。

图4 酸浸提过程晶型转变XRD衍射Fig.4 XRD patterns of phase transformation during leaching
从XRD衍射图中可以看出随着反应的进行,CaSO4·2H2O的衍射峰强度逐渐增强,说明其含量逐渐增加,衍射强度最强的三个衍射峰的晶面分别为(020),(021)以及(041)。其中衍射强度最大峰为(020)晶面衍射峰。
SiO2在2θ= 26.243°处出峰,为(011)晶面的衍射峰,在反应不同时间,该衍射峰的强度变化不大。
如图4(b)所示,可以观察到Ca5F(PO4)3在40.040°的特征衍射峰强度逐渐减弱,表示其含量逐渐降低,60 min时衍射峰基本消失。CaSO4·2H2O在40.624°的特征衍射峰逐渐强度增强。
3.4 粒径尺寸
不同反应时间下粒径分布相对含量如表4所示。
从0 min的粒径分布可知磷矿矿粉粒径主要分布在II区间,10 min时II区间粒径分布比例达到最大,反应开始进入稳定反应阶段。0~30 min时,粒径分布主要集中于II区间内,CaSO4·2H2O在矿石表面生长。随后该区间含量开始下降,与图1e对应,说明CaSO4·2H2O晶体开始脱落。反应至120 min时,酸解反应基本完成,结合图2分析可知磷矿结构坍塌,此后晶体开始逐渐生长。
120 min时,粒径分布主要集中于I区间,说明反应进入终止阶段,晶核已经不再生成,晶体开始逐渐生长,溶液的过饱和度降低,残留的溶质沉积到已有的晶体表面,使晶体形貌变得较为规整。由此,结合图1中f和g可知I区间是脱落的二水CaSO4·2H2O晶体粒径分布区。由粒径分布分析结果可知,图2模型中的固体产物层在10~30 min较为稳定,随后随着反应界面进一步向内部推进,固体产物层的CaSO4·2H2O晶体开始出现脱落。
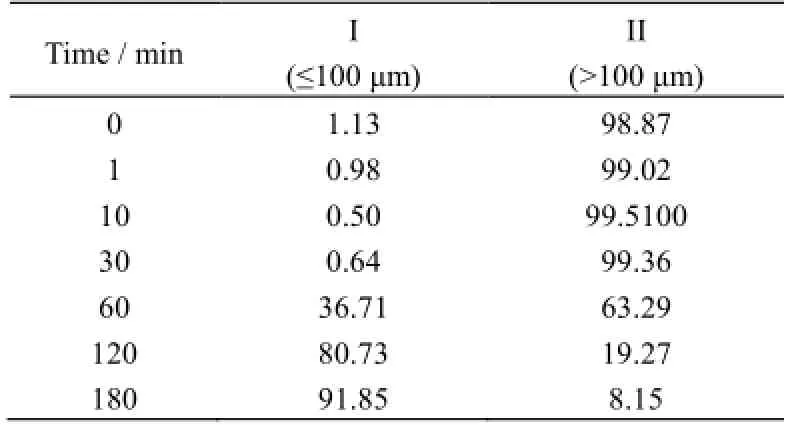
表4 粒径分布区间相对含量/ %(V)Table 4 Relative contents of samples at differentparticle size ranges / %(V)
3.5 孔性能结构表征
对磷矿不同反应时间下进行孔性能表征,结果见图5。
从图5可以看出,N2等温吸附曲线按IUPAC分类属于IV型,说明材料与氮有较强作用力。从图中可以看出,吸附量在低压端平缓增加,在相对压力大于0.4时出现滞回环,其中原矿属于H4型滞回环,浸提过程产物为H3型滞回环。

图5 酸浸提过程孔结构变化图Fig.5 Profiles of pore structure change during leaching
随着反应的进行,吸附脱附等温线逐渐增高,形成的滞回环先增大后减小。说明磷矿石颗粒除了微孔,还存在介孔结构,介孔结构在增多后减小。从形貌分析可知,滞回环由H3型转变为H4型的原因是由于浸提过程中,片状CaSO4·2H2O晶体在磷矿表面堆叠,使滞回环发生的转变[20]。结合3.1节SEM图可知CaSO4·2H2O晶体形成了固体产物层。CaSO4·2H2O晶体的堆叠使磷矿表面产生了许多介孔,随着反应进行,堆叠程度的加大,介孔结构开始增加。反应终止阶段,CaSO4·2H2O晶体开始脱落,介孔结构开始减少。
4 结 论
磷矿石酸浸提经历快速反应向稳定反应的变化,反应进行120 min时磷矿石大部分转化为CaSO4·2H2O晶体,液相中磷酸为主体;Fe2O3与MgO在快速反应阶段反应基本完成;Al2O3、K2O和Na2O含量不发生变化。
磷矿石酸浸提反应过程中,CaSO4晶体首先在磷矿表面产生,在磷矿表面堆叠。随着反应进行,晶体长大后脱落,矿石结构坍塌,导致颗粒平均粒径先增大后减小。
参考文献:
[1] HUANG Fang (黄芳), LIU Shi-rong (刘世荣), WANG Hua (王华), et al. Research on ore structures and mineral composition of phosphate tailings with high magnesium content (高镁磷尾矿的矿石结构与矿物组成) [J]. Acta Mineralogica Sinica (矿物学报), 2010, 30(1): 130-135.
[2] HUANG Fang (黄芳), LIU Shi-rong (刘世荣), LI Jun-qi (李军旗), et al. A study on P and Mg existing states and their mineral characteristics in phosphate tailings (磷尾矿中磷镁赋存状态及其矿物特征研究) [J]. Acta Mineralogica Sinica (矿物学报), 2010, 30(2): 257-261.
[3] Gilbert R L, Moreno E C. Dissolution of phosphate rock by mixtures of sulfuric and phosphoric acids [J]. Industrial & Engineering Chemistry Process Design & Development, 2002, 4(4): 368-371.
[4] Tekin T. Use of ultrasound in the dissolution kinetics of phosphate rock in HCl [J]. Hydrometallurgy, 2002, 64(3): 187-192.
[5] Zafar Z I, Anwar M M, Pritchard D W. Selective leaching of calcareous phosphate rock in formic acid: optimisation of operating conditions [J], Minerals Engineering. 2006, 19(14): 1459-1461.
[6] Zafar Z I, Ashraf M. Selective leaching kinetics of calcareous phosphate rock in lactic acid [J]. Chemical Engineering Journal, 2007, 131(1): 41-48.
[7] Gharabaghi M, Noaparast M, Irannajad M. Selective leaching kinetics of low-grade calcareous phosphate ore in acetic acid [J]. Hydrometallurgy, 2009, 95(s3-4): 341-345.
[8] Economou E D, Vaimakis T C, Papamichael E M. The kinetics of dissolution of the carbonate minerals of phosphate ores using dilute acetic acid solutions: the case of pH range from 3.96 to 6.40. [J]. Journal of Colloid & Interface Science, 2002, 245(1): 133-141.
[9] Lassis M, Mizane A, Dadda N, et al. Dissolution of Djebel Onk phosphate ore using sulfuric acid [J]. Environmental Nanotechnology Monitoring & Management, 2015, 4: 12-16.
[10] Antar K, Jemal M. Kinetics and thermodynamics of the attack of a phosphate ore by acid solutions at different temperatures[J]. Thermochimica Acta, 2008, 474(s 1-2): 32-35.
[11] LUO Hong-bo (罗洪波), JIANG Shao-zhi (姜绍志), ZHONG Ben-he (钟本和), et al. An investigation on the reaction mechanism of decomposing phosphate ore with urea sulfate (硫酸脲分解磷矿反应机理探讨) [J]. Journal of Chemical Engineering of Chinese Universities (高校化学工程学报), 2003, 17(6): 673-678.
[12] LI Cheng-rong (李成蓉), ZHONG Ben-he (钟本和), ZHANG Yun-xiang (张允湘). Dissolution kinetics of Jinhe phosphate rock in mixture of sulfuric and phosphoric acids (金河磷矿在硫、磷混酸中的溶解动力学) [J]. Journal of C hemical Industr y an d Engineering (化工学报), 1998, 49(3): 335-341.
[13] LIU Dai-jun (刘代俊), ZHONG Ben-he (钟本和), ZHANG Yun-xiang (张允湘). Liquid and solid phase reaction kinetics of phosphoric acid complex system (I) diffusion and reaction mechanism in fractal media (磷酸复杂系统液固相反应动力学(I) 分形介质中的扩散与反应机理) [J]. Journal of Chemical Industry and Engineering (化工学报), 2000, 51(5): 620-625.
[14] LIU Dai-jun (刘代俊), ZHONG Ben-he (钟本和), ZHANG Yun-xiang (张允湘). Reaction kinetics of phosphoric acid complex system (II) experimental study on digestion kinetics of phhosphate ore particle system (磷酸复杂系统液固相反应动力学()Ⅱ磷矿颗粒系统酸解动力学实验研究) [J]. Journal of Chemical Industry and Engineering (化工学报), 2001, 52(1): 28-34.
[15] YAN Yong-hua (严永华), LIU Qi-chong (刘期崇), XIA Dai-kuan (夏代宽), et al. Reaction kinetics of phosphate ore in phosphoric acid (磷酸分解磷矿石的动力学) [J]. Journal of Chem ical En gineering of Chine se Uni versities (高校化学工程学报), 1998, 12(3): 265-270.
[16] GONG Chang-sheng (贡长生), MEI Yi (梅毅), HE Hao-ming (何浩明), et al. Techology and application of advanced phosphorus chemical engineering (现代磷化工技术和应用) [M]. Beijing (北京): Chemical Industry Press (化学工业出版社), 2013.
[17] TU Min-rui (涂敏瑞), ZHOU Jin (周进). Kinetics of acidulation of phosphate rock with a mixture of phosphoric and sulfuric acids (硫磷混酸分解磷矿反应动力学研究) [J]. Chemical Engineering(China) (化学工程), 1995, 23(1): 62-66.
[18] WU Pei-zhi (吴佩芝). Wet-process phosphoric acid (湿法磷酸) [M]. Beijing (北京): Chemical Industry Press (化学工业出版社), 1987.
[19] Hunan Province geological testing institute (湖南省矿产测试利用研究所). Analysis of phosphate rock (磷矿石分析) [M]. Beijing (北京): Geological Publishing House (地质出版社), 1995.
[20] Sing K S W. Reporting physisorption data for gas/solid systems – with special reference to the determination of surface area and porosity, International Union of Pure and Applied Chemistry (IUPAC) [J]. Pure & Applied Chemistry, 1982, 54(11): 2201-2218.
Effects of Sulfuric Acid Leaching on Physical Properties of Phosphate Ore
ZHENG Ling-zhi1, DOU Yan1, SUN Xiang-bin1, SHEN Hao2, ZHENG Zhi-yin2, LIU Rong2, CUI Peng1
(1. School of Chemistry and Chemical Engineering, Hefei University of Technology, Hefei 230009, China;2. Anhui Liuguo Chemical Co., Ltd., Tongling 244000, China)
Sulfuric acid leaching of phosphoric ore was investigated under conditions of reaction temperature 80℃, stirring speed 300 r·min-1and reaction time 180 min. SEM, XRD, EDS, BET and particle size analysis were used to characterize the resultant crystals. Atomic absorption spectrophotometer (AAS) was employed to determine ion concentrations. The results show that phosphate ore is almost decomposed and changed to CaSO4·2H2O grain after 120 min. The crystals of CaSO4·H2O grow on the surface of phosphate ore at the beginning, which peel off from the surface after reaching to certain limit with ore structure collapsed. The average particle size increases first and then decreases. The hysteresis loop of nitrogen adsorption isotherms changes from H3 into H4.
phosphoric acid production; calcium sulphate dehydrate; crystallization; chemical processes
TQ126.3
A
10.3969/j.issn.1003-9015.2016.06.019
1003-9015(2016)06-1366-06
2016-03-21;
:2016-06-14。
安徽省创新环境建设专项 (1606a1003040)。
郑凌志(1994-),男,安徽六安人,合肥工业大学硕士生。
:崔鹏,E-mail:cuipeng@hfut.edu.cn

