现行欧盟医疗器械指令及与新法规对比浅谈
付 强
上海理工大学,上海市,200093
现行欧盟医疗器械指令及与新法规对比浅谈
【作 者】付 强
上海理工大学,上海市,200093
该文主要介绍了现行欧盟医疗器械指令MDD(93/42/EEC),并与提案中的欧盟医疗器械新法规做了简要对比。
欧盟;医疗器械;指令;法规
0 引言
当前,我国医疗器械发展十分迅速,许多医疗器械制造商已不满足于仅在本国销售产品,而是希望在世界范围内打造“中国制造”的品牌。医疗器械产品进入欧盟市场之前需要符合相应的欧盟医疗器械指令,并根据符合性评估流程进行ce认证。一个带有ce标识的医疗器械产品,才可以合法进入包含28个成员国的欧盟市场并自由流通。而许多非欧盟国家的医疗器械法规,同样会把医疗器械是否获得ce认证作为是否准入的前提之一。因此,了解欧盟医疗器械指令对于我国医疗器械进入国际市场十分必要。
1 欧盟医疗器械指令介绍
1.1 指令介绍
欧盟至今为止在医疗器械领域有以下三个指令:有源植入医疗器械指令(council Directive 90/385/ eec),简称aIMD。有源植入医疗器械是指任何可以通过内、外科方式,全部或部分植入人体,或者用医疗手段插入人体孔道,并旨在经此过程后留在人体内的有源医疗器械。适用于心脏起搏器,可植入的胰岛素泵等,已于1993年1月1日生效,于1995年1月1日强制实施[1]。
医疗器械指令(ec-Directive 93/42/eec),简称MDD。该指令针对的是所有医疗器械及附件,包括有源器械、无源植入器械、外科器械、无菌器械等。已于1995年1月1日生效,1998年6月14日强制实施。
体外诊断器械指令(ec-Directive 98/79/ec),简称IVDD。该指令适用于生化分析仪、血液分析仪和血细胞计数器等体外诊断医疗器械及附件,已于1998年12月7日生效,于2003年12月7日强制实施。
1.2 医疗器械的定义与分类
1.2.1 定义
医疗器械是指单独或者组合使用于人体的任何仪器、设备、器具、材料或其他物品,包括为其正常使用所需的软件;其作用于人体体表或体内的主要效用不是通过药理学、免疫学或者代谢的手段获得,但可能有这些手段参与并起一定的辅助作用;旨在达到下列预期目的:疾病的诊断、预防、监护、治疗或缓解;损伤或者残疾的诊断、监护、治疗、缓解或修补;解剖学和生理过程的探查、替代或调节;妊娠的控制[2]。
1.2.2 分类
在MDD(93/42/eec)的第9章节中,医疗器械产品根据附录IX分为I,IIa,IIb和III类。从广义上说,低风险医疗器械产品属于I类,中等风险医疗器械产品属于IIa类和IIb类,高风险医疗器械产品属于III类。其中,I类分为I类(非灭菌并不具有测量功能的器械)、Is类和Im类。其中Is类指灭菌的器械,Im类指具有测量功能的器械。另外,根据产品接触的时间长短,分为短暂(少于60 min),短期(大于60 min,小于30 d)和长期(大于30 d)。更详细的分类类别,可以参考附录IX里的18条分类规则。
1.3 上市前的符合性评估流程
欧盟医疗器械产品在上市前都必须经过评估和审批。制造商可根据医疗器械的分类选择合适的符合性评估流程来证明其符合欧盟医疗器械指令。
I类器械,通过附录VII进行符合性评估流程。而Is类和Im类的器械,第一种途径是通过附录II(不包括附录II中的第4部分),第二种途径是通过附录VII和附录IV,或附录VII和附录V,或附录VII和附录VI进行认证。
IIa类器械,第一种途径是通过附录II(不包括附录II中的第4部分)进行符合性评估流程,第二种途径是通过附录VII和附录IV,或附录VII和附录V,或附录VII和附录VI进行认证。
IIb类器械,第一种途径是通过附录II(不包括附录II中的第4部分)进行符合性评估流程,第二种途径是通过附录III和附录IV,或附录III和附录V,或附录III和附录VI进行认证。
III类器械,第一种途径是通过附录II(包括附录II中的第4部分)进行符合性评估流程,第二种途径是通过附录III和附录IV,或附录III和附录V进行认证[3]。
1.4 技术文档(STED)
在ce认证中,技术文档是十分重要的。2008年2月21日由全球协调工作组(Global Harmonization Task Force)即GHTF发布了技术文档的最终文件。在这份文件中,包含了制造商编写的技术文档应涵盖的所有内容。通常技术文档可以无限次地更新或修改,但每次更新或修改后的版本必须注明。技术文档更新或修改后,以新的版本为准。欧盟法规要求欧盟主管机构处保留的技术文档必须是最新版本,因此制造商必须及时将最新版本的技术文档交给欧盟授权代表处或公告机构,其目的是要求制造商准备充分的技术资料和证明供欧盟主管机构抽查。如果是植入器械,技术文档需在欧盟主管机构至少存放15年。制造商应在技术文档中明确医疗器械产品的各种信息,以便公告机构(或欧盟代表处)审核和了解,同时也便于欧盟主管机构核查。对于制造商和审核员来说,技术文档并不要求拘泥于格式,仅需保证内容即可。
1.4.1 器械描述和产品规格参数、附件
器械描述需要包含以下描述性信息:预期用途;预期患者群体和诊断的医疗条件;工作原理;适用的分类;任何新特征的解释;对附件以及预期与附件结合使用的其他医疗器械或者非医疗器械的描述。产品规格参数包括医疗器械特征、尺寸和性能的清单等。还需要含有参考同类和前代器械的综述或概况。
1.4.2 标识
技术文档要包含一套完整的标识,其应按照GHTF的指导原则中关于医疗器械标识方面的要求进行描述,标识应包含所有将要上市的国家的语言。标识上要有如下信息:在器械和包装上的标签、用户手册、宣传资料等。
1.4.3 设计和生产信息
技术文档应明确设计和生产地址。质量管理体系证书或者等同的证书必须附在技术文档内。
1.4.4 基本要求检查表
基本要求检查表是技术文档中最重要的部分,其中主要包含下列要求:
(1) 通用要求 包括一般安全要求和风险分析;安全设计、降低风险;产品性能;稳定性与有效期;运输与储存;合格评定与临床评估等。
(2) 关于设计和制造的要求 包括化学、物理和生物性能;感染和微生物污染;制造和环境因素;带有测量功能的器械;辐射防护;与带能量的医疗器械相连接的要求和制造商提供的操作信息等。
制造商需填写基本要求检查表中每一项的适用性(若不适用,写明不适用的理由和解释)以及适用的标准和条款并提供受控文件作为依据。
1.4.5 风险管理分析控制
技术文档包含在风险分析过程中风险识别的总结和如何控制这些风险到一个可接受的水平。这些风险分析最好是基于公认标准,并且是制造商风险管理计划的一部分。
1.4.6 验证和确认
(1) 产品的验证和确认
(2) 生物相容性
包含所有直接或间接与患者或使用者接触的材料清单。生物相容性测试应在最终产品或已灭菌器械上进行。具体可依据ISo 10993(eN ISo 10993)系列的标准执行。根据接触时间可分为短期(≤24 h),长期(>24 h~30 d)和持久(>30 d)。根据人体接触性质的分类有表面器械,外部接入器械和植入器械。接触部位分黏膜、血路、组织、骨等[5]。
(3) 药用物质
如果医疗器械包含药用物质,技术文档应提供关于其特性和来源详细的信息,还有其存在的目的和原因以及其安全性和有效性。
(4) 生物安全
(5) 灭菌
包含初始污染菌确认、菌落试验、热原试验、灭菌剂残留(如适用)和包装确认。详细的灭菌确认信息应包含使用方法、无菌保证水平、适用标准和按标准制定的灭菌方案及结论总结。
(6) 软件的验证和确认
(7) 动物试验
(8) 临床证据[4]
1.4.7 自我符合性声明
自我符合性声明并不是技术文档的一部分,但完成符合性评估后,自我符合性声明要附在技术文档内。可根据GHTF/SG1/N40:2006来编写自我符合性声明[6]。
2 ce认证和国内注册的不同之处
ce认证和国内注册在产品分类和注册流程都有许多区别。产品举例如下:
例一:硬性光学腹腔内窥镜。该产品在欧盟的分类为IIa类,制造商向公告机构提出首次申请后,由公告机构进行审核,审核通过后,公告机构将资料交至欧盟主管机构处存档,接着由制造商完成自我符合性声明,最后颁发ce证书并在产品上加贴带有公告机构代码的ce 标识。而该产品在中国的分类为III类,根据《医疗器械监督管理条例》和《医疗器械注册管理办法》,首次注册时应先由国家食品药品监督管理局认可的检测中心对产品进行型式检验,拿到检验报告后,根据免于进行临床试验的第三类医疗器械目录,此产品在临床豁免清单中,因此直接将申报文件交到国家食品药品监督管理局相关部门进行技术审评和质量体系考核以及行政审批,最后取得注册证。
例二:口垫。该产品在欧盟的分类为I类,由制造商完成技术文档再交至欧盟代表处,最后交到欧盟主管机构处存档,再由制造商完成自我符合性声明,并在产品上加贴没有公告机构代码的ce标识。该产品在中国的分类为I类,根据《医疗器械监督管理条例》和《医疗器械注册管理办法》,制造商向所在地设区的市级食品药品监督管理部门提交备案资料,食品药品监督管理部门应当按照相关要求的格式制作备案凭证。
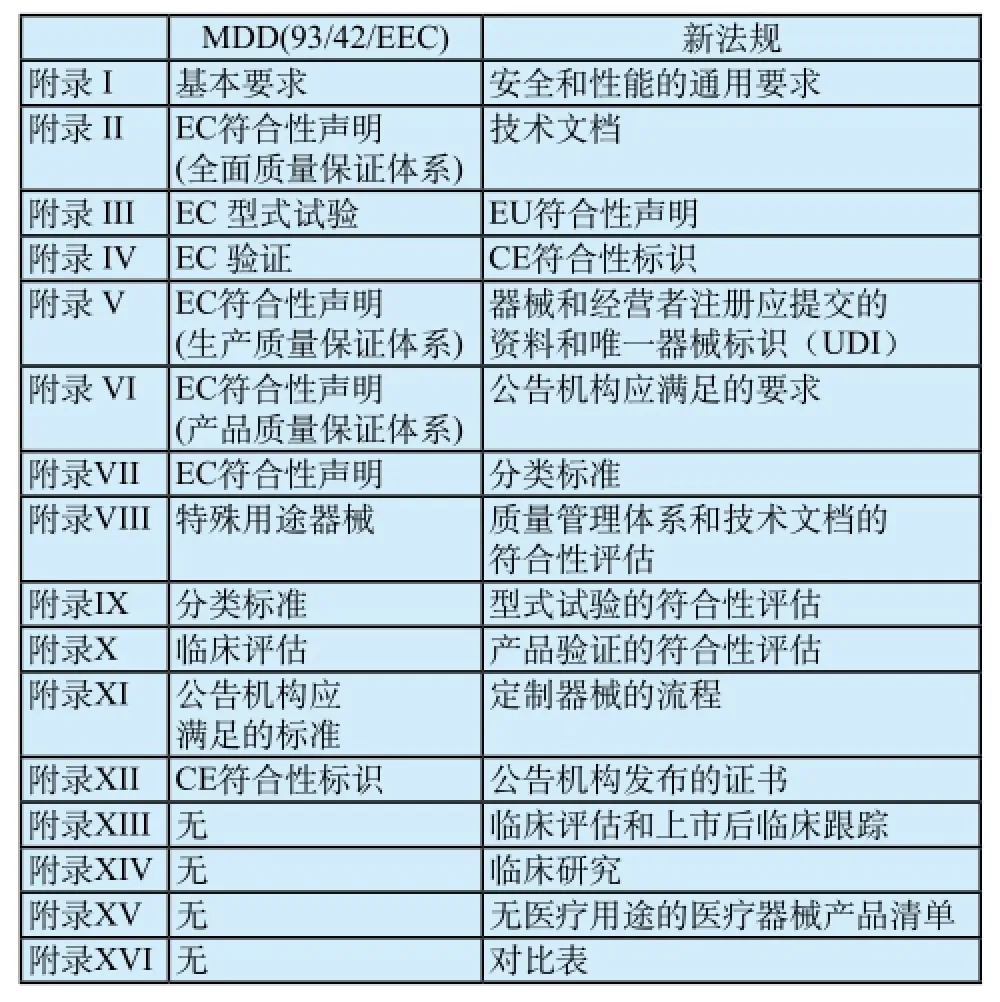
表1 现行医疗器械指令与新法规中附录对比Tab.1 The annex of MDD (93/42/eec) compared with new regulation
3 新法规要点分析
2012年9月26日欧盟医疗器械新法规提案公布,2015年9月21日再次发布修订后的最新提案,2015年10月5日欧盟理事会专家组在医疗器械的一般方法上达成一致,但是新法规至今仍未正式发布,今年欧盟委员会,欧盟理事会和欧洲议会将继续举行三方会议讨论新法规的进展。
新法规中用 “法规”一词代替了“指令”,医疗器械指令MDD (93/42/eec)和有源植入医疗器械指令aMID (90/385/eec)将合并成一个法规。新法规内容更加具体,增加和修改了多处内容,上文所述的技术文档被加入到新法规的附录中。
3.1 结构的变化
新法规分为章节I到章节X以及附录I到附录XVI,每个章节再分成若干条款。与现行医疗器械指令相比,新法规对附录的顺序进行了修改,并新增了4个附录(附录XIII-XVI)。此外,新法规中条款的数量由现行指令的23个增加为97个。
3.2 定义和分类规则的修改
3.2.1 定义的修改和补充
新法规对医疗器械的定义进行了修改,新定义如下:是指单独或者组合使用于人体的任何仪器、设备、器具、软件、植入物、试剂、材料或其他物品;其作用于人体体表或体内的主要效用不是通过药理学、免疫学或者代谢的手段获得,但可能有这些手段参与并起一定的辅助作用;旨在达到下列一个或多个目的:疾病的诊断、预防、监护、治疗或缓解;损伤或者残疾的诊断、监护、治疗、缓解或修补;解剖学和生理或病理过程或状态的探查、替代或调节;来自器官、血液和组织捐献的人体标本体外检验数据的提供;专门用于对医疗器械清洗、消毒或灭菌和对妊娠的控制和支持的器械应被认为是医疗器械。
新的医疗器械定义将符合要求的“植入物和试剂”列为医疗器械范围,并增加了以“病理过程和状态的探查、替代或调节”、“人体标本体外检验数据的提供”、“对医疗器械清洗、消毒或灭菌”和“妊娠支持”为目的的器械。
此外,新法规补充了唯一器械标识(UDI)、用户手册、欧盟授权代表、经营者、医疗机构、召回、协调标准等新定义。
3.2.2 分类规则的主要变化
(1) 修改了非侵入性器械的分类范围
规则2:增加血袋属于IIb类。
规则3:增加由一种或几种物质混合而成,其预期用于直接在体外接触已从人体或人体胚胎中取出且还未被植入人体的细胞、组织或器官的非侵入性器械属于III类。
规则4:对“伤口”的描述细化为“受损伤的皮肤和粘膜”,此规则同样适用于接触到受损伤粘膜的侵入性器械。
(2) 修改了侵入性器械的分类范围
规则6:修改可重复使用的手术器械属于IIa类;增加专门用于直接接触心脏或中央循环系统的短暂使用型侵入性手术器械属于III类。
规则7:增加专门用于直接接触心脏或中央循环系统的短期使用型侵入性手术器械属于III类。
规则8:增加有源植入器械或其附件属于III类;乳房假体属于III类;全关节或部分关节置换物(除钉、楔、板和工具等辅助组件外)属于III类;除钉、楔、板和工具等组件外的植入性椎间盘替代物和接触脊柱的植入器械属于III类。
(3) 修改了有源器械的分类范围
规则9:增加预期用于为治疗目的而发射电离辐射的有源器械,以及控制、监控这些器械或直接影响这些器械性能的有源器械属于IIb类;预期用于控制、监视或直接影响有有源植入器械性能的有源器械属于III类。
(4) 修改了部分特殊规则
规则15:修改专门用于消毒或灭菌的器械属于IIa类,除非它们是专门用于消毒侵入性器械的消毒液或清洗消毒机,这种器械属于IIb类。
规则17:修改由人体或动物的组织或细胞,或其无活性或使其无活性的衍生物合成或组成的器械属于III类。
废除了规则18。
新增了规则19:所有由纳米材料合成或组成的器械都属于III类,除非在其预期用途下使用时,纳米材料被密封或以类似的方式而不能被释放到患者或操作者的身体。
新增了规则21:预期通过人体孔道或皮肤涂抹摄入人体,被人体吸收或扩散在人体局部的由药物组成或合成的器械:
——如果它们或它们的代谢产物被身体吸收而达到其预期目的,这些器械属于III类。
——如果它们预期用于通过消化道摄入,并且它们或他们的代谢产物被身体吸收,这些器械属于III类。
——除通过皮肤涂抹而摄入人体的器械属于IIa类外,其他所有情况属于IIb类。
新增了规则22:除侵入性手术器械外,其他通过人体孔道吸入来用药的侵入性器械属于IIa类,除非它们的作用方式对用药的安全性和有效性有至关重要的影响或用于治疗危及生命的条件,在这种情况下它们属于IIb类。
新增了规则23:集成或包含能够显著影响患者管理诊断的有源治疗器械属于III类,例如闭环系统或自动体外除颤仪[7]。
3.3 新增对公告机构的监管
新法规增加了大量对公告机构监管的相关内容。在第IV章节中的第28~35条款中提到:对公告机构的选定和监管有统一的标准来实践。欧盟成员国如果打算指定一个符合性评估机构作为公告机构,或指定一个公告机构在本法规下执行符合性评估活动,则应当任命一个部门为符合性评估机构在评估、指定、公告行为中建立和执行必要流程的负责,同时负责对公告机构的监督,包括其分包方及子公司。此部门可在国家法律范围内由各自的实体单位组成。
建立、组织和经营对公告机构负责的国家主管部门,应维护其活动的客观性和公正性,并避免与符合性评估机构的利益冲突。此部门的组织结构应条理清晰,使其每一项与指定和通告相关的决定不能由那些执行符合性评估的人员做出。它不得从事任何与公告机构在商业或竞争方面相关的活动。国家主管部门应对公告机构获得的资料保密,不过它可以与其他欧盟成员国和欧盟委员会交换公告机构的资料,必要时也可与其他监管部门交换。国家主管部门应有足够的主管人员履行其工作职责,并确保其相关受权。此外,它还需参加同行评审活动。
欧盟成员国应公开关于符合性评估机构的评估、指定和公告所规定的基本信息,以及公告机构的监督情况和对上述工作有重大影响的变化情况[8]。
3.4 唯一器械标识——UDI(unique device identifcation)和可追溯性
2013年3月,在欧盟范围内建议使用唯一器械标识体系。带有UDI的医疗器械产品具有可追溯性。在新法规提案章节III中的第24条款中提到:除定制器械和临床试用器械外,一个UDI系统包括器械标识(即UDI-DI,其针对的是新法规附录V的B部分中关于制造商和器械的资料)、生产标识(即UDI-PI,其是指新法规附录V的c部分中关于器械生产的资料),也包括器械或其包装上的标签以及UDI数据库等[8]。
3.5 新法规中的符合性评估流程
在新法规中,同样需要制造商按照符合性评估流程来评估产品,其认可途径根据其第V章节中第42条款可总结如图1所示。

图1 新法规中的符合性评估流程[9]Fig.1 conformity assessment procedure under the new regulation[9]
3.6 欧盟医疗器械数据库——Eudamed(European databank on medical devices)
新法规提案第III章节第27条款中提到:可以通过eudamed追溯欧盟上市的医疗器械,公众可以通过其查询指定机构颁发的证书和临床研究数据,欧盟成员国主管部门和欧盟委员会可也可通过eudamed加强合作。
eudamed可查询以下内容:UDI、器械和经营者的注册、符合性评估的申请和证书信息、安全和临床性能总结、临床研究、警戒及上市后监管、市场监管等[8]。
4 结束语
现行欧盟医疗器械指令为医疗器械的监管提供了良好的技术指导但也逐渐体现出其缺陷与不足,2010年3月法国PIP公司劣质乳房植入物的丑闻曝光后,医疗器械相关法规的修改包括产品上市后的监管或是公告机构的责任都被提出了更高的要求。本文介绍了现行欧盟医疗器械指令及与新法规的部分对比,各医疗器械公司应密切关注欧盟医疗器械法规的修订动态,以便更加便捷地使产品获得国际市场的认可。
[1] council Directive of 90/385/eec 20 June 1990 on the approximation of the laws of the Member States relating to active implantable medical devices [eB/oL]. http://eur-lex.europa.eu/ legal-content/eN/TXT/?uri=ceLeX:01990L0385-20071011.
[2] council Directive 93/42/eec of 14 June 1993 concerning Medical Devices [eB/oL]. http://eur-lex.europa.eu/legal-content/eN/ TXT/?uri=ceLeX: 01993L0042-20071011.
[3] MeDIcaL DeVIceS: Guidance document - classification of medical devices June 2010[eB/oL]. http://ec.europa.eu/growth/ sectors/medical-devices/guidance/index_en.htm.
[4] GHTF/SGlINoll:2008[R/oL]. http://www.imdrf.org/docs/ghtf/ final/sg1/technical-docs/ghtf-sg1-n011-2008-principles-safetyperformance-medical-devices-080221.pdf#search="ghtf sg1 no11".
[5] eN ISo 10933-1:2009.Biological evaluation of medical devices Part 1: evaluation and testing within a risk management process [S].
[6] GHTF/SG1/N40:2006[R/oL]. http://www.imdrf.org/docs/ghtf/ fnal/sg1/technical-docs/ghtf-sg1-n40-2006-guidance-ca-principles-060626.pdf#search="GHTF SG1 N40 65306; 2006".
[7] Proposal for a regulation of the european parliament and of the council 12040/15 aDD 1[eB/oL]. http://data.consilium.europa.eu/ doc/document/ST-12040-2015-aDD-1/en/pdf.
[8] Proposal for a regulation of the european parliament and of the council 12040/1/15 ReV 1[eB/oL]. http://data.consilium.europa. eu/doc/document/ST-12040-2015-ReV-1/en/pdf.
[9] 刘波. 欧盟最新医疗器械法规要点浅析[J]. 中国医疗器械信息, 2013, 19(9): 37-38, 45.
Current Medical Device Directive in EU and Brief Comparison with the New Regulation
【 Writer 】FU Qiang
University of Shanghai for Science and Technology, Shanghai, 200093
European Union, medical device, directive, regulation
F203
A
10.3969/j.issn.1671-7104.2016.03.012
1671-7104(2016)03-0202-05
2016-01-18
付强,e-mail: 03190115@163.com
【 Abstract 】This paper describes current European Union(EU) Medical Device Directive(MDD), which is 93/42/EEC, it also briefy compares with proposal for a new regulation.

