锌胁迫对长药景天光合特性和保护酶活性的影响
王 莹,刘 晶,纪善博,杨国亭,关 旸,*
1 东北林业大学林学院生态研究中心, 哈尔滨 150000 2 哈尔滨师范大学黑龙江省普通高等学校植物生物学重点实验室, 哈尔滨 150025 3 黑龙江省林业厅, 哈尔滨 150000
锌胁迫对长药景天光合特性和保护酶活性的影响
王 莹1,2,刘 晶2,纪善博2,杨国亭3,关 旸2,*
1 东北林业大学林学院生态研究中心, 哈尔滨 150000 2 哈尔滨师范大学黑龙江省普通高等学校植物生物学重点实验室, 哈尔滨 150025 3 黑龙江省林业厅, 哈尔滨 150000
以园林植物长药景天(Hylotelephiumspectabile)为研究对象,探讨了不同浓度ZnSO4胁迫对长药景天光合特性和保护酶活性的影响。结果表明:长药景天的质膜相对透性、丙二醛含量、过氧化物酶和过氧化氢酶活性随ZnSO4胁迫强度的增加而升高,净光合速率、胞间二氧化碳浓度、气孔导度和蒸腾速率则降低,叶绿素含量先升高后降低,超氧化物歧化酶活性变化不大。长药景天在抵御锌胁迫的过程中,通过保护酶活性的升高、气孔关闭降低水分流失等方式降低了锌的毒害作用,使其具有很强的抵抗锌胁迫的能力。
长药景天(Hylotelephiumspectabile);锌胁迫;光合特性;保护酶活性
锌是自然界分布较广的元素之一[1],根据2014年《全国土壤污染状况调查公告》显示,我国土壤锌元素的点位超标较为严重[2]。因此,解决锌污染的问题十分紧迫。
长药景天为景天科(Crassulaceae)八宝属(Hylotelephium)宿根肉质草本植物[3],园林绿化中常用来布置花坛,也可以用作地被植物,是花坛、花境和点缀草坪、岩石园的好材料[4-5]。长药景天在锌污染矿区生长良好,这为重金属Zn污染区的环境起到积极的绿化美化作用。本论文以长药景天(Hylotelephiumspectabile)为研究对象,探讨其抗氧化酶系统和光合特性在植物应对锌污染过程中的响应,为揭示锌污染对植物的伤害及植物耐受锌的机理提供理论依据,从而为探讨该植物在污染环境治理、修复中的应用提供参考,具有一定的理论价值和现实意义。
1 材料与方法
1.1 试验材料
长药景天(Hylotelephiumspectabile)采自牡丹江镜泊湖,移栽到哈尔滨师范大学生命科学与技术学院试验田内培养,然后选择健康的长势一致的植株移栽到温室内,盆钵直径20 cm、盆高25cm,7 d适应性培养后,用ZnSO4·7H2O对植株进行胁迫处理,同时设置空白对照(CK)。Zn 以水溶液形式施于土壤中,使土壤中Zn 浓度分别达到40、80、160、320、800 mg/kg和1600 mg/kg,每个处理设3个重复,每隔7 d用不含重金属的去离子水喷洒植株1次,喷洒时水不能从盆底流出,以减少实验误差。于35 d在相同部位选取功能叶片,用去离子水冲洗,滤纸吸干水分,用于各生理指标的测定,每个指标重复3次。
1.2 测定方法
过氧化氢酶(CAT)活性的测定参考《植物生理实验》[6]采用紫外吸收法测定,其余各项生理指标参考《现代植物生理学实验指南》[7]进行。
光合参数测定:在锌胁迫下,叶片出现明显症状的第35天进行收获。收获当日9:00,选择每株苗从第1片展开叶向下数第7、8 两片成熟叶,利用Li-6400 (LI-COR,USA) 便携式光合测定仪采用开放式气路测定净光合速率、气孔导度、蒸腾速率、细胞间隙CO2浓度等参数。每次测定3 次重复。测定时各项仪器指标设置一致,光照强度均为1000 μmol m-2s-1,CO2浓度为380 μmol/mol,温度为25℃。
2 结果与分析
2.1 锌胁迫对长药景天膜系统影响
锌浓度低于160 mg/kg时,长药景天的质膜相对透性变化不大,各浓度间差异不显著。超过160 mg/kg后,长药景天的质膜相对透性随锌浓度升高而增加,在1600 mg/kg时达到最大值,是对照组的3.6倍。320 mg/kg及以上锌浓度下,长药景天的质膜相对透性与对照组差异显著(图1)。
长药景天的MDA含量在锌浓度低于80 mg/kg时几乎没有变化,之后则呈现随锌浓度增加而显著升高的趋势,1600 mg/kg达到最大值,是对照组的3.59倍(图2)。

图1 锌胁迫对长药景天质膜相对透性的影响Fig.1 The effects of Zinc Stress on relative plasma membrane permeability of Hylotelephium spectabile
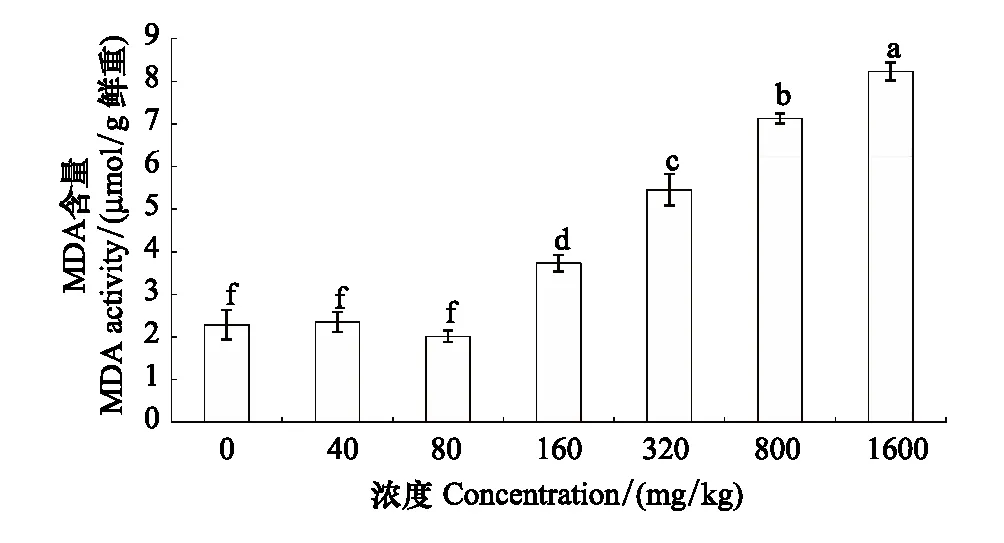
图2 锌胁迫对长药景天MDA含量的影响Fig.2 The effects of Zinc Stress on MDA content of Hylotelephium spectabile
2.2 锌胁迫对长药景天保护酶系统活性的影响
长药景天SOD活性呈先上升后下降的趋势,在320 mg/kg达到最大值,是对照组的1.57倍。除160 mg/kg与1600 mg/kg差异不显著外,各浓度均达到差异显著水平(图3)。
长药景天POD活性呈先上升后下降的趋势,在320 mg/kg和800 mg/kg时达到最大值,是对照组的5.88倍。除40 mg/kg浓度与对照组差异不显著,320 mg/kg与800 mg/kg差异不显著外,其余各浓度均达到差异显著水平(图4)。

图3 锌胁迫对长药景天SOD的影响Fig.3 The effects of Zinc Stress on SOD activity of Hylotelephium spectabile
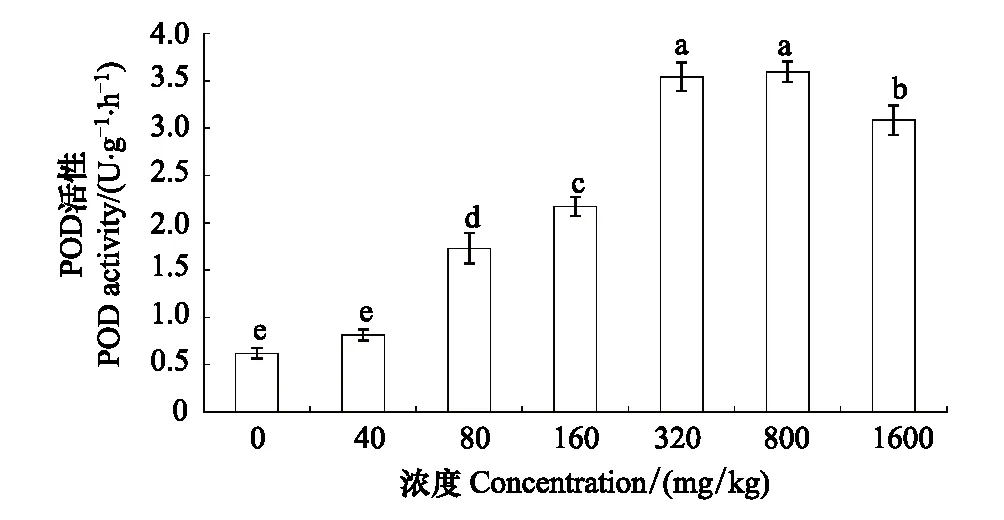
图4 锌胁迫对长药景天POD的影响Fig.4 The effects of Zinc Stress on POD activity of Hylotelephium spectabile
长药景天CAT活性呈先上升后下降的趋势,在800 mg/kg达到最大值,是对照组的2.15倍。各浓度之间均达到差异显著水平(图5)。
2.3 不同浓度重金属锌污染对长药景天叶绿素含量影响
长药景天叶绿素含量呈先上升后下降的趋势,80—160 mg/kg逐渐上升,160 mg/kg达到最大值,后逐渐下降。40 mg/kg和800 mg/kg及对照之间差异不显著,80 mg/kg和320 mg/kg之间差异不显著,800 mg/kg和1600 mg/kg之间差异不显著,其余各组之间差异显著(图6)。
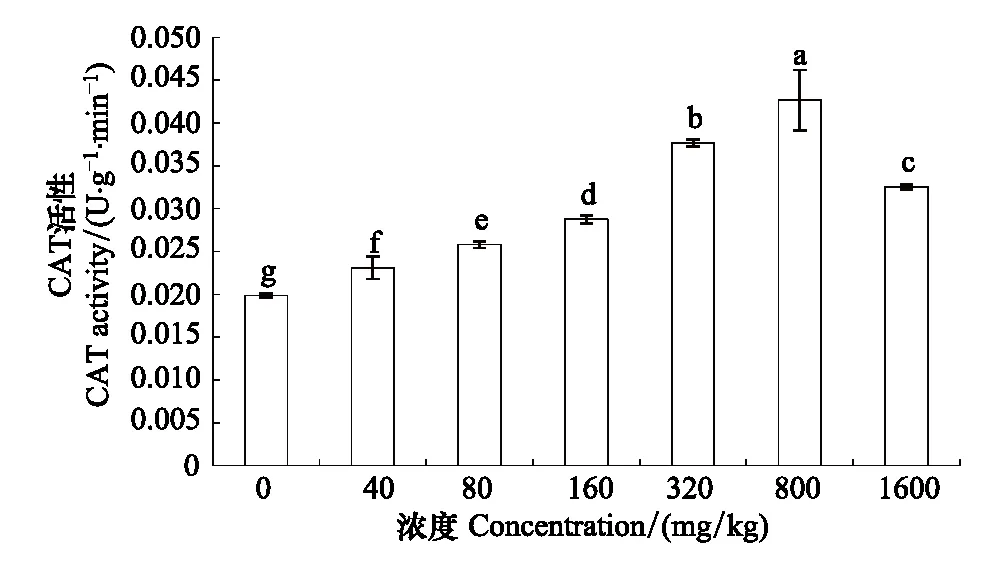
图5 锌胁迫对长药景天CAT的影响Fig.5 The effects of Zinc Stress on CAT activity of Hylotelephium spectabile
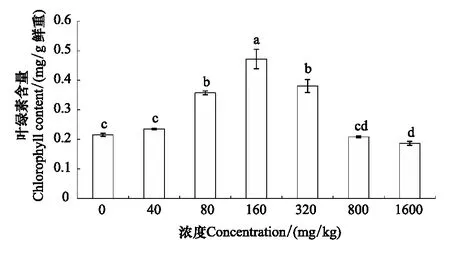
图6 锌胁迫对长药景天叶绿素含量的影响Fig.6 The effects of Zinc Stress on chlorophyll content of Hylotelephium spectabile
2.4 锌胁迫对长药景天光合参数的影响
2.4.1 锌胁迫对长药景天净光合速率的影响
长药景天净光合速率呈逐渐下降的趋势,在1600 mg/kg达到最低值,是对照组的4%。40 mg/kg和80 mg/kg、160 mg/kg和320 mg/kg、320 mg/kg和800 mg/kg之间差异不显著,其余各组间差异显著(图7)。
2.4.2 锌胁迫对长药景天胞间CO2浓度的影响
胞间CO2浓度随着锌浓度的增加而降低。1600 mg/kg达到最小值,浓度40 mg/kg比对照组减少21.4%;1600 mg/kg比对照组减少37.5%。各处理组与对照差异显著,40—160 mg/kg,320—1600 mg/kg各组间差异不显著。各浓度处理间的差异未达到极显著水平(P<0.01)(图8)。
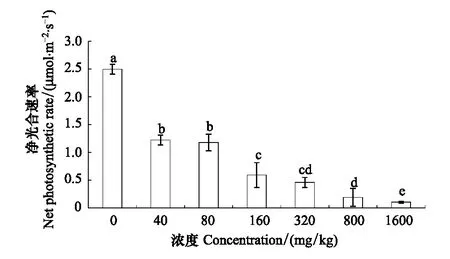
图7 锌胁迫对长药景天净光合速率的影响Fig.7 The effects of Zinc Stress on net photosynthetic rate of Hylotelephium spectabile
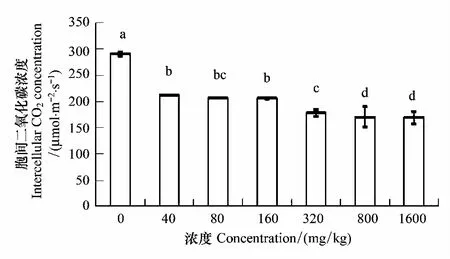
图8 锌胁迫对长药景天胞间CO2浓度的影响Fig.8 The effects of Zinc Stress on intercellular CO2 concentration of Hylotelephium spectabile
2.4.3 锌胁迫对长药景天叶片气孔导度的影响
长药景天幼苗气孔导度呈逐渐下降的趋势,在1600 mg/kg浓度时达到最低值,是对照组的5.9%。其中160 mg/kg浓度和320 mg/kg浓度之间差异不显著,其余各组间差异显著(图9)。
长药景天蒸腾速率呈逐渐下降的趋势,在1600 mg/kg浓度时达到最低值,是对照组的6.5%。其中40 mg/kg浓度和对照之间差异不显著,80 mg/kg浓度和160 mg/kg浓度之间差异不显著,800 mg/kg浓度和1600 mg/kg浓度之间差异不显著,其余各组间差异显著(图10)。
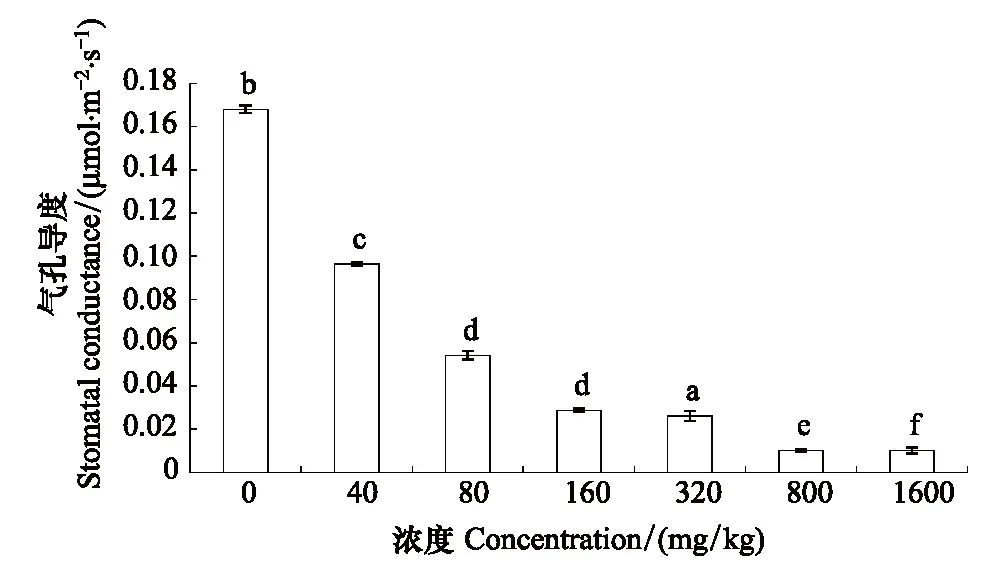
图9 锌胁迫对长药景天叶片气孔导度的影响Fig.9 The effects of Zinc Stress on stomatal conductance of leaf of Hylotelephium spectabile
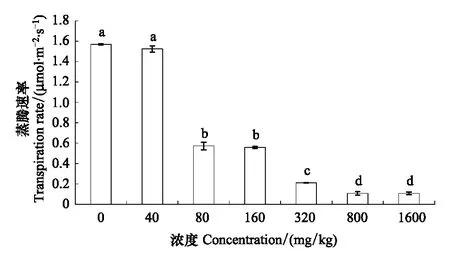
图10 锌胁迫对长药景天叶片蒸腾速率的影响Fig.10 The effects of Zinc Stress on transpiration rate of leaf of Hylotelephium spectabile
3 结论与讨论
SOD、POD、CAT活性的维持和提高被认为是植物耐受重金属胁迫的物质基础之一[8]。本文的实验结果显示,随着Zn胁迫浓度的增加,SOD、POD和CAT都是先上升后下降,在低浓度处理下3种保护酶活性均升高,这种现象解释为低浓度重金属对植物的积极的“刺激作用”[9],在本研究中SOD、POD活性在320 mg/kg达到最大值,CAT在800 mg/kg达到最大值,表明此时保护酶系统对锌的清除能力已接近最大值,锌浓度继续上升时,3种酶的活性开始下降。很多研究也表明锌含量进一步上升则会导致植物体内保护酶活性的下降[10-11]。
细胞质膜透性和MDA含量能反映出细胞的受伤害程度,MDA作为过氧化产物,它能与蛋白质、核酸、氨基酸等活性物质交联,形成不溶性的化合物(脂褐素)沉积,从而干扰细胞内正常的生命活动与透性[12]。本文中,在锌浓度为40—160 mg/kg时,细胞质膜透性与MDA含量变化不明显,表明长药景天对锌有一定的耐受性,从320 mg/kg时开始,细胞质膜透性和MDA含量开始上升,但在800 mg/kg浓度锌胁迫下,质膜透性也未超过50%,根据相对电导率50%的半致死标准[13]可以推测在此浓度下长药景天仍然具有很强的耐性。
叶绿素含量是植物重要的生理指标,其含量的多少决定着植物光合作用能力的大小,叶绿素含量的变化可反映重金属对植物的损害程度。重金属胁迫下,叶绿素含量降低是重金属对植物毒害的普遍现象[14]。一些研究表明锌污染均明显降低了植物体内叶绿素的含量[15-17],还有研究表明Zn在一定浓度范围内能促进叶绿素的合成和植物生长发育[18],本研究中叶绿素含量在0—320 mg/kg之间呈随浓度增加而增加的趋势,800—1600 mg/kg虽然有所下降,但二者差异不显著,800 mg/kg与对照组差异也不显著,说明锌胁迫未对其叶绿素的合成产生较大影响。所以本研究中,叶绿素含量不是引起锌胁迫下长药景天光合速率降低的因素。
光合作用是植物体重要的生理生化过程,它的强弱对植物正常生长及抗逆性都具有十分重要的影响,在逆境胁迫下,引起植物叶片光合速率降低的植物自身因素主要有气孔的部分关闭导致的气孔限制和叶肉细胞光合活性的下降导致的非气孔限制两类[19]。若胞间CO2浓度、气孔导度同时下降时,气孔因素是主要的[20],否则非气孔因素是主导因素[21]。在本研究中,随着锌胁迫浓度增加,长药景天净光合速率、胞间CO2浓度、气孔导度、蒸腾速率均显著下降,但胞间CO2浓度降低幅度较小,各浓度处理间的差异未达到极显著水平(P<0.01),这说明净光合速率的降低是由非气孔因素引起的[21-22]。有研究认为植物净光合速率的降低是由非气孔因素引起的[23]。与本研究结果一致[23]。净光合速率对气孔导度和蒸腾速率具有指示调节作用,在外界环境有利于光合时促进气孔导度增大,不利时则导致气孔导度减小[22]。本文锌胁迫导致长药景天净光合速率显著下降,为防止水分和气体的流失,气孔大部分关闭,气孔导度降低。气孔是蒸腾作用的主要途径,气孔关闭导致蒸腾速率也显著减弱,减少植物体水分散失,避免进一步生理干旱。
总之,长药景天在抵御锌胁迫的过程中,通过保护酶活性的升高,气孔关闭降低水分流失等方式降低了锌的毒害作用,使其具有很强的抵抗锌胁迫的能力。
[1] 杜锁军, 戴艳, 谢东俊, 戈丹红. 土壤Zn污染及其治理措施评述. 污染防治技术, 2009, 22(3): 87-90.
[2] 环境保护部, 国土资源部. 全国土壤污染状况调查公报. (2014-04-17)[2016-05-25]. http://www.sdpc.gov.cn/fzgggz/ncjj/zhdt/201404/t20140418_607888.html.
[3] 吴征镒. 中国植物志. 北京: 科学出版社, 1984.
[4] 李佳琳, 罗志文. 药用植物长药景天的开发利用与栽培技术研究. 园艺与种苗, 2011, (4): 46-48.
[5] 胡莹冰. 景天科多肉植物应用调查研究[D]. 长沙: 中南林业科技大学, 2013.
[6] 郝再彬, 苍晶, 徐仲. 植物生理实验. 哈尔滨: 哈尔滨工业大学出版社, 2004: 113-115.
[7] 中国科学院上海植物生理研究所, 上海市植物生理学会. 现代植物生理学实验指南. 北京:科学出版社, 2004: 302-303, 305-306, 314-315, 316.
[8] 杨居荣, 贺建群, 张国祥, 毛显强. 不同耐性作物中几种酶活性对Cd胁迫的反应. 中国环境科学, 1996, 16(2): 113-117.
[9] Patra J, Panda B B. Tolerance and co-tolerance of the grassChlorisbarbataSw.tomercury,cadmiumandzinc.NewPhytologist, 1994, 128(1): 165-171.
[10] 袁敏, 铁柏清, 唐美珍. 土壤重金属污染的植物修复及其组合技术的应用. 中南林学院学报, 2005, 25(1): 81-85.
[11] 徐勤松, 施国新, 王学, 吴国荣. 镉、铜和锌胁迫下黑藻活性氧的产生及抗氧化酶活性的变化研究. 水生生物学报, 2006, 30(1): 107-112.
[12] Thompson J E. Evidence for the accumulation of peroxidized lipids in membranes of senescing cotyledons. Plant Physiology, 1984, 75(4): 1152-1157.
[13] Sukumaran N P, Weiser C J. An excised leaflet test for evaluating potato frost tolerance. Hort Science, 1972, 7(5): 467-468.
[14] 周启星, 高拯民. 土壤-水稻系统Cd-Zn的复合污染及其衡量指标的研究. 土壤学报, 1995, 32(4): 430-436.
[15] 雷桅, 王双明, 孙敏. Fe2+, Cu2+, Zn2+对植物生理特性影响的比较分析. 广西植物, 2007, 27(5): 770-774.
[16] 丁海东, 齐乃敏, 朱为民, 万延慧. 镉、锌胁迫对番茄幼苗生长及其脯氨酸与谷胱甘肽含量的影响. 中国生态农业学报, 2006, 14(2): 53-55.
[17] 徐卫红, 王宏信, 王正银, 熊治庭. 重金属富集植物黑麦草对锌、镉复合污染的响应. 中国农学通报, 2006, 22(6): 365-368.
[18] 李铮铮, 伍钧, 唐亚, 杨刚. 铅、锌及其交互作用对鱼腥草(Houttuyniacordata)叶绿素含量及抗氧化酶系统的影响. 生态学报, 2007, 27(12): 5441-5446.
[19] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Plang Biology, 1982, 33(33):317-345.
[20] 赵博生, 衣艳君, 刘家尧. 外源甜菜碱对干旱/盐胁迫下的小麦幼苗生长和光合功能的改善. 植物学报, 2001, 18(3): 378-380, 366.
[21] 寇伟锋, 刘兆普, 陈铭达, 郑青松, 赵耕毛. 不同浓度海水对油葵幼苗光合作用和叶绿素荧光特性的影响. 西北植物学报, 2006, 26(1): 73-77.
[22] 许大全. 气孔的不均匀关闭与光合作用的非气孔限制. 植物生理学通讯, 1995, 31(4): 246-252.
[23] 张英, 魏安智, 杨途熙, 帅焕丽, 张亚转. 锌胁迫对灰杨幼苗生长和光合特性的影响. 东北林业大学学报, 2011, 39(3): 19-21.
Effects on photosynthetic characteristics and protective enzyme activity ofHylotelephium spectabile to zinc stress
WANG Ying1,2, LIU Jing2, JI Shanbo2, YANG Guoting3, GUAN Yang2,*
1EcologicalResearchCentre,SchoolofForestry,NortheastForestryUniversity,Harbin150000,China2HarbinNormalUniversity,KeyLaboratoryofPlantBiology,CollegeofHeilongjiangProvince,Harbin150025,China3ForestryBureauofHeilongjiangProvince,Harbin150000,China
Landscape plantHylotelephiumspectabileis a species of flowering plant in the stonecrop family Crassulaceae, which is native to China and Korea. The plant was used as an experimental material to investigate photosynthetic characteristics and antioxidant enzyme activity after treatment with different zinc sulfate concentrations. When the seedlings ofH.spectabilewere 15 cm high, they were transplanted to plastic pots (20 cm in diameter and 25 cm in height) filled with sand and watered daily. The culture condition was (26±4)℃, photoperiod 16 h light/8 h darkness, RH 50%—60%, and PPFD 500 mmol/m2S. After 7 days of culture, the seedlings were divided into seven groups for different treatments, including control group, 40, 80, 160, 320, 800, and 1600 mg/kg zinc stress treatment. ZnSO4was dissolved in DD water, and plants were watered weekly. After 35 days of ZnSO4treatment, three plants per treatment were collected for analysis. Relative plasma membrane permeability, MDA, SOD, POD, CAT, and chlorophyll content were measured in the present study. MDA is a final decomposition product of lipid peroxidation induced by oxidative stress and has been used as an indicator of lipid peroxidation. MDA content was determined by thiobarbituric acid (TBA) reaction to determine superoxide dismutase (SOD, EC 1.15.1.1), catalase (CAT, EC 1.11.1.6), and peroxidase (POD, EC 1.11.1.7) activities, and 0.3 g of fresh leaf tissue was ground to a fine powder in liquid nitrogen and homogenized in 2 mL and 59 mM phosphate buffer (pH 7.8) containing 0.1 mM ethylenediaminetetraacetic acid (EDTA) and 4% polyvinypolypyrrolidone (PVPP). After centrifugation at 15000g, 4℃ for 20 min, the supernatants were used for enzyme activity assays. SOD activity was determined by inhibiting the photochemical reduction of nitroblue tetrazolium (NBT) at 560 nm. The amount of enzyme needed to inhibit 50% of NBT photoreduction was defined as one unit of SOD activity. The CAT and POD activities were monitored by measuring H2O2consumption at 240 nm and guaiacol oxidation at 470 mm respectively. The CAT and POD activities were calculated as described previously. Three biological replicates of each treatment were independently performed. The net photosynthetic rate (PN), stomatal conductance (GS), transpiration rate (E), and intercellular CO2concentration (Ci) of leaves were determined at 09:00 AM using a portable open flow gas exchange photosynthesis system LI-6400. The measurements were repeated six times for each blade from the same position of five plants in each treatment group, and the averages were recorded. The results show that relative plasma membrane permeability, MDA content, and POD and CAT activities increased with increasing ZnSO4concentration. However, thenet photosynthetic rate, intercellular CO2concentration, stomatal conductance, and transpiration rate decreased with increasing ZnSO4concentration. The chlorophyll content was decreased after a slight ZnSO4treatment and increased higher than the control after a high concentration ZnSO4treatment. The SOD activity did not vary significantly under zinc stress. This finding suggests that increased antioxidant enzyme activity and closed stoma to reduce water loss may be the main reasons for reducing the toxic effect of Zn, which may be explained by the strong ability ofH.spectabileto resist Zn stress.
Hylotelephiumspectabile;zinc stress ; photosynthetic characteristics;protective enzyme activity
黑龙江省自然科学基金资助项目(C200601)
2016- 05- 25;
2016- 09- 28
10.5846/stxb201605251011
*通讯作者Corresponding author.E-mail: guany0611@126.com
王莹,刘晶,纪善博,杨国亭,关旸.锌胁迫对长药景天光合特性和保护酶活性的影响.生态学报,2016,36(22):7422- 7427.
Wang Y, Liu J, Ji S B, Yang G T, Guan Y.Effects on photosynthetic characteristics and protective enzyme activity ofHylotelephiumspectabileto zinc stress.Acta Ecologica Sinica,2016,36(22):7422- 7427.

