锦鲤疱疹病毒ORF72基因克隆及结构功能分析
王世会,贾智英,李池陶,孙志鹏,石连玉
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
锦鲤疱疹病毒ORF72基因克隆及结构功能分析
王世会,贾智英,李池陶,孙志鹏,石连玉
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
于辽宁丹东采集感染锦鲤疱疹病毒的活鲤Cyprinus carpio样品,经DNA提取、PCR扩增、重组质粒构建步骤成功克隆锦鲤疱疹病毒ORF72基因,并利用生物信息学软件分析ORF72蛋白结构与功能,构建系统进化树。结果显示:ORF72基因开放阅读框共1113bp,编码蛋白由370个氨基酸组成,理论相对分子质量为40.5KD;ORF72蛋白主要由α螺旋、β折叠、无规则卷曲3种二级结构组成;N端35个氨基酸序列为信号肽序列。跨膜结构分析表明:ORF72蛋白无跨膜区,保守结构域预测表明ORF72含有一个保守结构域,抗原表位分析表明,抗原性较好。结构预测显示:ORF72氨基酸序列存在2个潜在的N-糖基化位点、1个潜在的O-糖基化位点、19个潜在的磷酸化位点。系统进化树分析发现,其与锦鲤疱疹病毒美国株、以色列株属同一分支。
锦鲤疱疹病毒;ORF72基因;结构功能分析
鲤Cyprinus carpio是全世界养殖最广泛的淡水鱼,养殖地区主要分布在亚洲、欧洲和中东地区,其中锦鲤Cyprinus carpio koi是重要的观赏性鱼类[1]。20世纪末开始爆发的锦鲤疱疹病毒病(koi herpes virus disease,KHVD)严重影响了鲤和锦鲤养殖业的发展[2]。该病传染性和致病性高,主要感染鲤和锦鲤[3],临床表现为行动缓慢,鳃出血并伴有大量坏死,尾鳍基部充血,皮肤疱疹性损伤与侵蚀[1]。在水温18~28℃时均可发病,其中22~24℃病毒感染力最强[4]。
1988年锦鲤疱疹病毒病首次在以色列发生,鲤和锦鲤的死亡率高达75%~95%[5],随后在全世界范围内迅速扩展,美国、德国、英国、日本、印度尼西亚、韩国等相继报道了该病[6]。2002年,我国广东省首次报道该病[7],同年12月台湾也报道了该病[8],并引起了世界动物卫生组织(OIE)和世界粮农组织(FAO)的高度关注。对锦鲤疱疹病毒的研究始于1997年美国建立的锦鲤鳍条细胞系KF[9]。随后以色列和美国科研人员成功获得了该病毒株并进行感染实验,证实这种病毒正是各国锦鲤死亡的主要诱因[10]。
锦鲤疱疹病毒(KHV)又称鲤疱疹病毒3型(CyHV-3),与鲤痘疮病毒(CyHV-1)和金鱼造血器官坏死病毒(CyHV-2)同为鲤疱疹病毒属Cyprinivirus[11]。KHV是单一线性双链 DNA病毒,直径约170~200nm,是鱼类最大的疱疹病毒[13],核酸被衣壳蛋白包裹,成熟病毒含有囊膜蛋白[12]。2007年,基因组测序全面完成,基因组大小约为295kb[14]。KHV具有156个开放阅读框(ORFs),至少包含5个家族基因:其中ORF2编码肿瘤坏死因子受体;ORF25、ORF26、ORF27、ORF65、ORF148和ORF149编码膜糖蛋白[1];ORF72编码衣壳蛋白;ORF81和ORF83编码囊膜蛋白,主要在细胞质中表达,可以诱导鱼体产生中和抗体[15]。
本研究从感染锦鲤疱疹病毒的活鲤中提取DNA,利用两对KHV特异性引物检测病毒DNA,应用PCR技术克隆ORF72基因,测序分析、比对,分析其生物学功能,为阐明病毒侵染鲤的机制,防治锦鲤疱疹病毒病提供参考。
1 材料与方法
1.1 材料
在辽宁丹东采集20尾感染锦鲤疱疹病毒的活鲤样品,用冰袋保存带回实验室,采集病鱼肝胰脏、肾、脾、脑、心、鳃、肌肉、肠等组织,液氮速冻后,-80℃冰箱中保存备用。pMD18-T载体、限制性内切酶EcoR I和Kpn I购自大连宝生物工程有限公司;Tryptone和Yeast Extract购自Oxoid公司;胶回收试剂盒和质粒提取试剂盒购自OMEGA公司;Escherichia coli DH5α购自北京全式金生物技术有限公司;PCR试剂购自北京康为世纪生物科技有限公司;其他试剂均为国产。
1.2 引物设计及合成
根据Gene Bank中登录号(NC_009127.1)获得锦鲤疱疹病毒美国株(KHV-U)的ORF72基因序列,用Primer 5.0软件设计引物,扩增ORF72基因开放阅读框序列(表1)。其中GGTACC为Kpn I酶切位点;GAATTC为EcoR I酶切位点。引物由上海生工生物工程技术服务有限公司合成。
1.3 KHV-DD株病毒DNA提取
采用磁珠法组织DNA提取试剂盒(MagPure Tissue DNA KF Kit)提取DNA,用琼脂糖凝胶电泳检测DNA的完整性,紫外分光光度计检测DNA的浓度和纯度。取出部分DNA稀释至50μg/mL,-20℃保存备用。
1.4 KHV-DD株ORF72基因的PCR扩增
PCR扩增在Biometra PCR仪上进行,反应体系为25μL,包括:2×ES Taq混合液12.5μL;正反向引物(10μmol/L)各1μL;DNA稀释液模板1μL;最后加ddH2O补充至25μL。PCR反应条件如下:首先94℃预变性2min;然后94℃变性30s,58℃退火30s,72℃延伸1min 30s,共25个循环;最后72℃延伸10min,4℃保存。PCR产物经琼脂糖凝胶电泳检测。
1.5 KHV-DD株ORF72基因PCR克隆及双酶切鉴定
ORF72基因PCR产物切胶回收,与pMD18-T载体连接,室温连接30min后,4℃冰箱中连接过夜。连接产物转化入E.coli DH5α感受态细胞中,涂到含有氨苄青霉素抗性的LB固体培养基(预先涂有X-gal和IPTG)上筛选菌落。挑选白色单菌落置于含有氨苄青霉素的LB液体培养基中,37℃160r/min摇床中过夜培养。经菌液PCR鉴定后,将含有目的条带的菌液扩大培养。利用OMEGA质粒提取试剂盒提取重组质粒,双酶切鉴定筛选出含有阳性重组质粒的菌液,送上海生工生物工程技术服务有限公司测序。
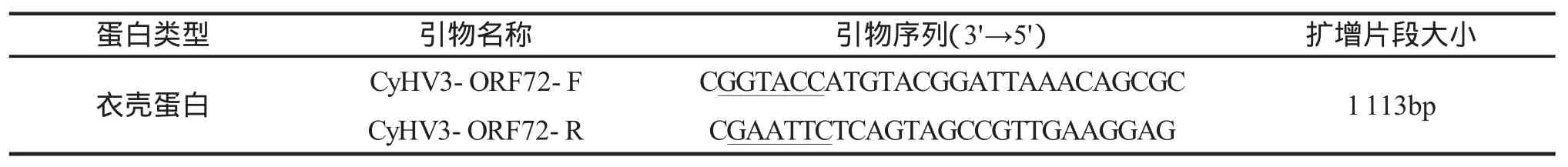
表1 引物序列信息Tab.1 The information on the primer sequences in the experiment
1.6 KHV-DD株ORF72基因编码蛋白的结构与功能分析
利用DNAStar(Editseq)软件翻译出ORF72基因的氨基酸序列,分析蛋白分子特征;利用DNAman 6.0软件预测蛋白质的二级结构;应用NCBI网站(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线预测蛋白质保守结构域;利用Signal P4.1在线软件(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白质信号肽序列[16];应用TMHMM Serverv.2.0(http: //www.cbs.dtu.dk/services/TMHMM/)在线软件分析氨基酸跨膜区域[17];采用DNAStar 6.0(Protean)软件分析抗原表位;蛋白质翻译后修饰中N-糖基化位点和 O-糖基化位点预测利用 NetNGlyc1.0(http: //www.cbs.dtu.dk/services/NetNGlyc/)和NetOGlyc4.0(http://www.cbs.dtu.dk/services/NetOGlyc/)在线分析软件;磷酸化位点预测采用NetPhos 2.0(http://www. cbs.dtu.dk/services/NetPhos/)分析[18];利用MEGA6.0软件构建系统进化树,判断亲缘关系远近。
2 结果与分析
2.1 KHV-DD株ORF72基因PCR扩增

图1 锦鲤疱疹病毒ORF72基因的PCR扩增Fig.1 PCR amplification of koi herpes virus ORF72 gene
图2 菌液PCR检测结果Fig.2 The results of bacteria liquid PCR
图3 锦鲤疱疹病毒ORF72基因的双酶切鉴定Fig.3 The identification of koi herpes virus ORF72 gene using double restriction enzymes digestion
PCR扩增到与目的条带大小一致的1113bp的DNA片段(图1)。T-A克隆菌液PCR检测和重组质粒Kpn I、EcoR I双酶切鉴定的结果(图2、图3)说明,ORF72基因已成功连接到载体中。
2.2 KHV-DD株ORF72基因结构与功能分析
2.2.1 ORF72基因的序列测定和编码蛋白分子特征
测序结果经DNAStar(Editseq)软件分析可知,该基因开放阅读框长1 113bp,预测编码一个含有370个氨基酸(图4)、相对分子质量为40.5KD、等电点5.750的前体蛋白;蛋白中含有30个强碱性氨基酸(K、R),38个强酸性氨基酸(D、E),116个疏水性氨基酸(A、I、L、F、W、V),100个极性氨基酸(N、C、Q、S、T、Y)。

图4 ORF72基因核酸与氨基酸序列对应表Fig.4 Nucleic acid and amino acid sequences corresponding to ORF72 gene
2.2.2 ORF72蛋白二级结构特征
根据测序结果,应用DNAman 6.0软件预测ORF72蛋白中共有3种二级结构:α螺旋、β折叠和无规则卷曲。这3种结构分别位于以下氨基酸中(图5):α螺旋(Helix)位于第13~18、26~32、89~98、163~169、192~205、222~228、255~264、267~279、296~299、304~312、316~321位氨基酸上;β折叠(Strand)位于第45~49、54~57、66~69、84~86、99~101、108~114、133~136、149~151、178~181、208~212、232~244、329~333、343~348、362~366位氨基酸上;无规则卷曲(Coil)位于第1~12、19~25、33~44、50~53、58~65、70~83、87~88、102~107、115~132、137~148、152~162、170~177、182~191、206~207、213~221、229~231、245~254、265~266、290~295、300~303、313~315、322~328、334~342、349~361、367~370位氨基酸上。
2.2.3 ORF72蛋白保守结构域预测
利用NCBI网站中Conserved domains预测保守结构域,结果显示ORF72含有一个保守结构域,为PHA03260 super family(图6)。
2.2.4 信号肽分析
根据测序结果,采用http://www.cbs.dtu.dk/ser vices/SignalP网址进行在线分析,通过Singal P4.1在线预测信号肽切割位点。预测结果为N端35个氨基酸可能是信号肽切割位点,序列为MYGLNSAS GFLDTEWVEKQGMVTPPEEVAKMLNPH(图7)。
2.2.5 跨膜区分析
根据测序结果,经TMHMM Serverv.2.0(http: //www.cbs.dtu.dk/services/TMHMM/)在线软件分析,ORF72蛋白无跨膜区。
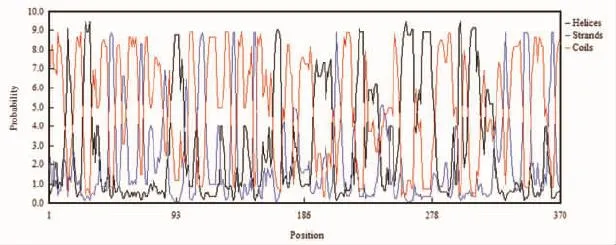
图5 ORF72蛋白二级结构特征Fig.5 Secondary structure features of ORF72 protein

图6 ORF72蛋白保守结构域预测Fig.6 The prediction of conserved domains in ORF72 protein
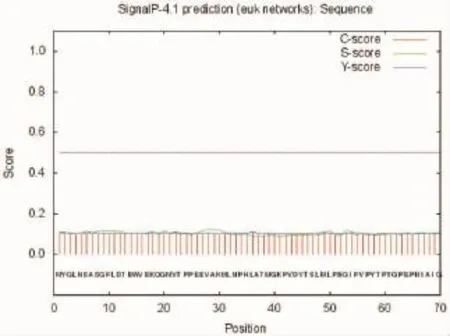
图7 ORF72蛋白信号肽预测结果Fig.7 The prediction of signal peptide in ORF72 protein of koi herpes virus
2.2.6 抗原表位分析
根据测序结果及DNAStar(Editseq)软件分析出的氨基酸序列,采用DNAStar6.0(Protean)软件分析抗原表位。结果表明:抗原表位主要集中在第14~30、37~45、55~70、73~94、113~122、130~145、148~164、171~181、185~195、214~222、229~240、280~292、330~343位氨基酸上(图8)。
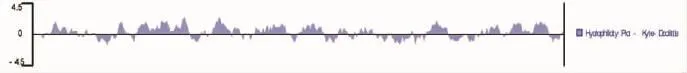
图8 ORF72蛋白抗原表位分析Fig.8 The prediction of the antigenic determinants of koi herpes virus ORF 72 protein
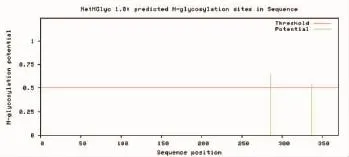
图9 ORF72蛋白N-糖基化位点预测Fig.9 The prediction of N-glycosylation site in ORF72 protein
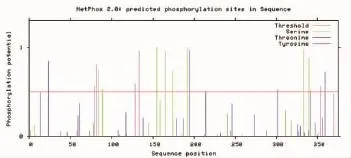
图10 ORF72蛋白磷酸化位点预测Fig.10 The prediction of phosphorylation sites in ORF72 protein
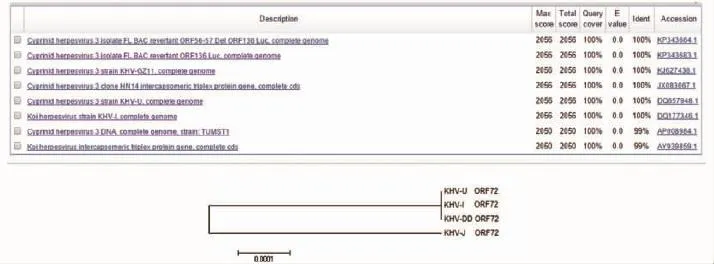
图11 锦鲤疱疹病毒丹东株ORF72基因比对结果和系统进化树构建结果Fig.11 The alignment and phylogenetic tree based on ORF72 gene in koi herpes virus-DD
2.2.7 糖基化及磷酸化位点的预测
应 用 NetNGlyc1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)和NetOGlyc4.0(http:∥www.cbs.dtu. dk/services/NetOGlyc/)预测锦鲤疱疹病毒ORF72的N-糖基化位点和O-糖基化位点,结果表明:其氨基酸序列存在2个潜在的N-糖基化位点(图9),1个潜在的O-糖基化位点。应用NetPhos 2.0(http: //www.cbs.dtu.dk/services/NetPhos/)在线分析软件预测磷酸化位点,结果表明:当阈值为0.5时,ORF72氨基酸序列中存在19个潜在的磷酸化位点(图10)。
2.2.8 系统进化树分析
在NCBI中对测序结果直接进行Blast分析(图11)。锦鲤疱疹病毒丹东株(KHV-DD)与广东株(KHV-GZ)、美国株(KHV-U)、以色列株(KHV-I)同源性均为 100%,与锦鲤疱疹病毒日本株(KHV-J)同源性为99%。根据比对结果构建的系统进化树显示,KHV-DD与KHV-I、KHV-U处于一个分支,而KHV-J处于另一个分支。
3 讨论
锦鲤疱疹病毒病是20世纪末确定的一种疾病,现已在全球范围内爆发,严重威胁鲤和锦鲤养殖产业安全,是世界动物卫生组织(OIE)规定必须申报的疾病,为我国二类疫病。目前对该病的防治已经取得了一些进展,以色列科学家曾通过细胞培养的方式获得传代细胞系和致病力弱的毒株[19,20],直接接种锦鲤和普通鲤,可以起到很好的免疫作用。而我国对该病的防治主要停留在使用抗生素阶段,治疗效果并不理想。大剂量抗生素的使用导致病毒产生耐药性和变异,从而更难彻底根除此病。因此研制对鱼体和食用者更安全、对环境更环保的病毒疫苗或病毒抗体是解决病毒病的关键[21]。锦鲤疱疹病毒衣壳蛋白是病毒的重要组成部分。Rosenkranz等[22]研究表明:部分表达衣壳蛋白的基因可作为检测或者免疫的候选基因。本文通过克隆锦鲤疱疹病毒衣壳蛋白基因ORF72,分析其蛋白结构与功能,为锦鲤疱疹病毒抗体制备提供基础。
本研究成功地获得锦鲤疱疹病毒衣壳蛋白ORF72基因开放阅读框序列,共1 113bp。应用DNAstar 6.0软件分析可知,其编码大小约40.5KD的前体蛋白,等电点为5.750。信号肽是引导新合成的蛋白质向分泌通路转移的短肽链,主要由疏水性氨基酸组成,对蛋白的转运具有重要作用[23]。因此,预测信号肽切割位点,能够为蛋白原核表达研究提供重要信息,信号肽位点对原核表达引物设计起提示性作用。应用SingalP4.1在线软件进行信号肽切割位点预测显示,蛋白质N端35个氨基酸很有可能是信号肽序列。应用 TMHMM Server v.2.0在线分析显示:衣壳蛋白ORF72无跨膜区域。DNAman软件预测蛋白质二级结构显示:ORF72蛋白由α螺旋、β折叠、无规则卷曲3种结构组成。蛋白质的功能部位与酶的活动中心通常由无规则卷曲充当,而α螺旋和β折叠一般只起支撑作用。因此预测蛋白质二级结构有助于分析蛋白功能和活动中心。保守结构域预测显示:ORF72含有一个保守结构域,为PHA03260 super family。抗原表位分析表明该蛋白的表面抗原决定簇分布区域广泛。抗原表位即抗原决定簇,是指由连续序列(蛋白质一级结构)组成或由不连续的蛋白质三维结构组成,决定抗原性的特殊化学基团。抗原表位是免疫细胞识别抗原分子的重要部位,因此有效地分析抗原表位有助于免疫干预治疗等[24]。蛋白质糖基化属于蛋白质翻译后修饰过程,对蛋白质功能具有重要影响[25]。根据Gunn等[26]研究成果可知,病毒的抗原性与N-糖基化作用位点密切相关。蛋白质磷酸化也是翻译后修饰的重要过程。
测序结果表明:锦鲤疱疹病毒丹东株与美国株、以色列株序列完全一致,与日本株只有一个碱基差异。系统进化树分析结果显示:锦鲤疱疹病毒丹东株与美国株、以色列株同源性100%,与日本株同源性99%。推测锦鲤疱疹病毒丹东株可能由美国或以色列等国家传播,也可能由日本株变异而来。
[1]Michel B,Fournier G,Lieffrig F,et al.Cyprinid herpes virus 3[J].Emerging Infectious Diseases,2010,16(12): 1835-1843.
[2]Kenneth A M.Review of the literature on cyprinid herpesvirus 3(CyHV-3)and its disease[M].Australia Invasive Animals CRC,2013:1-3.
[3]Reinertsen H and Haaland H.Sustainable fish farming in: proceedings of the first International Symposium on Sustainable Fish Farming[M].NorwayOslo,1994:28-31.
[4]Gray W L,Mullis L,Lapatra S E,et al.Detection of koi herpes virus DNA in tissues of infected fish[J].Journal Fish Disease,2002,25(3):171-178.
[5]Perelberg A,Smimov M,Hutoran M,et al.Epidemiological description of a new viral disease afflicting cultured Cyprinus carpio in Israel[J].The Israeli Journal of Aquaculture, 2003,55(1):5-12.
[6]Haenen O L M,Way K,Bergmann S M,et al.The emergence of koi herpesvirus and its significance to European aquaculture[J].Bulletin oftheEuropean Association ofFish Pathologists,2004,24(6):293-307.
[7]刘荭,史秀杰,高隆英,等.进口锦鲤爆发病病原的nested -PCR鉴定[J].华中农业大学学报,2002,21(5):414-418.
[8]徐达,涂坚,郑穹翔,等.锦鲤疱疹病毒传播媒介之探讨[J].台湾兽医志,2007,33(2):88-95.
[9]Hasegawa S,Somamoto T,Nakayasu C,et a1.A cell line(CFK)from fin of isogeneic ginbuna crusian carp[J].Fish Pathology,1997,32:127-128.
[10]Walster C.Clinical observations of severe mortality in koi carp,with gill disease[J].Fish VeterinaryJournal,1999,3(3):54-58.
[11]Davison A J,Kurobe T and Gatherer D.Comparative genomicsofcarp herpesviruses[J].JournalofVirology,2013, 87(5):2908-2922.
[12]Neukirch Mand Kunz U.Isolation and preliminary characterization of several viruses from koi(Cyprinus carpio)sufferinggill necrosis and mortality[J].Bulletin ofthe European Association of Fish Pathologists,2001,21(4): 125-135.
[13]Pikarsky E,Ronen A,Abramowitz J,et al.Pathogenesis of acute viral disease induced in fish by carp interstitial nephritisandgillnecrosisvirus[J].JournalofVirology,2004, 78(17):9544-9551.
[14]Aoki T,HironoI,Kurokawa K,et al.Genome sequences of three koi herpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide[J].Journal ofVirology,2007,81(10):5058-5065.
[15]朱霞,王好,李新伟,等.锦鲤疱疹病毒病的研究进展[J].中国兽医科学,2011,41(1):106-110.
[16]王世会,史雨红,陈炯.香鱼巨噬细胞炎性蛋白-2基因的克隆、序列分析及表达[J].生物技术通报,2014(7): 143-149.
[17]周井祥,李新伟,王好,等.锦鲤疱疹病毒-CJ株ORF81基因的克隆及生物信息学分析[J].水产学报,2011,35(12):1780-1786.
[18]周井祥,王好,吕文亮,等.锦鲤疱疹病毒-CJ株ORF124基因的克隆及生物信息学分析[J].中国兽药杂志,2013, 47(5):14-18.
[19]Ilouze M,Dishon A and Kotler M.Characterization of a novel virus causing a lethal disease in carp and koi[J]. Microbiology and Molecular Biology Reviews,2006,70(1):147-156.
[20]PerelbergA,Ronen A,Hutoran M,et al.Protection ofcultured Cyprinus carpio against a lethal viral disease by an attenuatedvirusvaccine[J].Vaccine,2005,23(26):3396-3403.
[21]周井祥,李新伟,朱霞,等.锦鲤疱疹病毒CJ株ORF25基因的克隆及生物信息学分析[J].中国兽药杂志,2012, 46(3):1-4.
[22]Rosenkranz D,Klupp B G,Teifke J P,et al.Identification of envelope protein pORF81 of koi herpesvirus[J].Journal ofGeneral Virology,2008,89(4):896-900.
[23]Schult Z U,Kock J,Schlich T H J,et al.Recombinant duck interferon:a newreagent to study the mode of interferonactionagainsthepatitisBvirus[J].Virology,1995,212(2):641-649.
[24]李海侠,毛旭虎.蛋白质抗原表位研究进展[J].微生物学免疫学进展,2007,35(1):54-58.
[25]Haagglund P,BunKenborg J,Elortza F,et al.A newstrategy for identification of N-glycosylated proteins and unambiguous assignment of their glycosylation sites using HILIC enrichment and partial deglycosylation[J].Journal ofProteome Research,2004,3(3):556-566.
[26]Gunn P,Sato F,Powell K,et al.Rotavirus neutralizing protein VP7:antigenic determinants investigated by sequence analysis and peptide synthesis[J].Journal of Virology,1985,54(3):791-797.
Cloning and Functional Analysis of ORF72 Gene in Koi Herpes Virus
WANG Shi-hui,JIA Zhi-ying,LI Chi-tao,SUN Zhi-peng,SHI Lian-yu
(Heilongjiang Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
The samples of common carp(Cyprinus carpio kio)infected with koi herpes virus were collected from Dandong area in Liaoning province,and ORF72 gene was successfully cloned by DNA extraction,PCR amplification,and plasmid recombination to analyze the structure and function of ORF72 gene and to construct a phylogenetic tree.The ORF72 was found to be composed of 1113 nucleotides encoding a protein of 370 amino acids with a molecular weight of 40.5 KD.The ORF72 secondary structure was primarily comprised of α helix,β strand,and random coil,and contained a conserved domain with N-terminal 35 residues as the signal peptides.Online analysis revealed that there was no transmembrane region in the ORF72 showing good antigenicity.The protein structure analysis indicated that there were two N-glycosylation sites,one O-glycosylation site and 19 phosphorylation sites.Phylogenetic analysis showed that ORF72 gene of KHV-DD was in the same branch with the USA and Israel strains.
Koi herpes virus;ORF72 gene;structure and function analysis
S917
A
1005-3832(2016)03-0009-07
2016-01-08
国家科技支撑计划(2012BAD26B01);现代农业产业技术体系建设专项资金资助(CARS-46-02);中央级公益性科研院所基本科研业务费专项(HSY201401).
王世会(1986-),男,研究实习员,硕士,从事水产动物遗传育种研究.E-mail:hrfriwsh@yeah.net
石连玉(1960-),男,研究员,从事水产动物遗传育种研究.E-mail:sly2552@aliyun.com

