马立克氏病病毒编码的miR-M12-5p对鸡HVCN1基因表达的靶向调控
李会珍,滕 蔓,党 露,冯丽丽,马圣明,赵 朴,罗 俊,,张改平(1.河南农业大学 牧医工程学院,河南 郑州 5000; .河南省农业科学院 动物免疫学重点实验室/农业部动物免疫学重点实验室/河南省动物免疫学重点实验室,河南 郑州5000; .河南省农业科学院 农业经济与信息研究所,河南 郑州5000; .河南科技大学 动物科学学院,河南 洛阳 7100)
马立克氏病病毒编码的miR-M12-5p对鸡HVCN1基因表达的靶向调控
李会珍1,2,滕 蔓2,党 露2,冯丽丽3,马圣明4,赵 朴2,罗 俊2,4,张改平1,2*
(1.河南农业大学 牧医工程学院,河南 郑州 450002; 2.河南省农业科学院 动物免疫学重点实验室/农业部动物免疫学重点实验室/河南省动物免疫学重点实验室,河南 郑州450002; 3.河南省农业科学院 农业经济与信息研究所,河南 郑州450002; 4.河南科技大学 动物科学学院,河南 洛阳 471003)
为研究miR-M12-5p在马立克氏病病毒(Marek’s disease virus,MDV)感染过程中的调控作用,利用生物信息学方法对其候选靶基因进行预测分析,发现4个miR-M12-5p的结合靶点。体外双荧光素酶报告试验结果表明,miR-M12-5p可结合宿主鸡的氢离子电压门控通道1(HVCN1) 基因mRNA的3′-UTR相应位点并发生特异性相互作用。实时荧光定量PCR分析进一步证实,miR-M12-5p能够在体内下调HVCN1基因的表达水平。上述结果表明,miR-M12-5p可以靶向调控宿主基因HVCN1的表达。
马立克氏病病毒; miRNA; miR-M12-5p; 靶基因;HVCN1基因
马立克氏病病毒(Marek’s disease virus,MDV)是双链DNA病毒,有囊膜,基因组大小约180 kb,在感染自然宿主鸡后可引发鸡马立克氏病(Marek’s disease,MD),临床上以实质器官恶性肿瘤为特征[1]。MD是第1个可用病毒疫苗免疫预防的肿瘤性疾病[2],因此,MDV感染对于研究肿瘤的发生发展机制提供了极好的动物模型[3]。MDV共有3个血清型:血清Ⅰ型(MDV-1)、血清Ⅱ型(MDV-2)、血清Ⅲ型(即火鸡疱疹病毒,herpesvirus of turkeys,HVT)[1]。疫苗免疫接种对该病的有效防控贡献巨大,但在过去几十年中,MDV-1流行毒株的毒力因免疫压力选择而逐渐增强。因此,深入研究MDV的致病致瘤机制对MD的防控具有非常重要的意义。
微RNA(microRNA,miRNA)是一类长度为22~25 nt的内源性小分子非编码RNA,存在于包括动物、植物、病毒在内的多种生物体中[4-6]。miRNA通过与mRNA相应的靶点结合抑制蛋白质翻译,从而发挥其转录后水平的基因调控作用[7-8]。此前研究表明,MDV编码的miRNA在病毒复制[9]、维持潜伏感染[10]、介导细胞凋亡[11]、激活原癌基因表达[12]等方面发挥重要调控作用。MDV-1基因组共编码26个病毒miRNA,这些miRNA在MDV致病及致瘤过程中可能发挥重要调控作用。此前,笔者所在课题组通过基因缺失Meq基因簇中各个miRNA单基因研究其与MDV致病表型的关系时发现,miR-M12-5p的前体基因缺失毒株与其亲本毒株GX0101相比,致肿瘤率显著降低,表明miR-M12-5p在调控MDV致瘤作用中可能发挥重要作用[13]。基于此,利用生物信息学方法对miR-M12-5p的宿主靶基因进行了预测和分析,并利用双荧光素酶报告试验(DLRA)和实时荧光定量PCR(qRT-pCR)对miR-M12-5p的候选靶基因进行了体内外试验验证,旨在为进一步揭示miR-M12-5p调控MDV致病致瘤的分子机制奠定基础。
1 材料和方法
1.1 病毒和细胞
MDV超强毒株GX0101,由山东农业大学崔治中教授馈赠;GX△miR-M12毒株(miR-M12-5p前体基因缺失的MDV毒株),由河南省农业科学院动物免疫学重点实验室构建并保存;HEK 293T细胞由河南省农业科学院动物免疫学重点实验室保存;鸡胚成纤维细胞(chicken embryoi broblast,CEF)取自7~9日龄SPF鸡胚。
1.2 试剂和载体
PremixTaqTM(TaKaRaTaqTMVersion 2.0)、DNA限制性内切酶XhoⅠ、NotⅠ和EcoRⅠ、PrimeScriptTMRT reagent Kit with gDNA Eraser、2×SYBR Premix ExTaq、DNA Ligation Kit Ver.2.1和pMD19-T(Simple) vector,均购自宝生物工程(大连)有限公司;Lipofectamine 2000和TRIzol Reagent,购自Invitrogen公司;DLRA系统购自Promega公司;Annealing Buffer for DNA Oligos (5×),购自碧云天生物技术公司;psiCHECK-2、pcDNA-6.2和pcDNA-miR-neg载体,由河南省农业科学院动物免疫学重点实验室保存;pcDNA6.2-miR-M12菌种及质粒,由河南省农业科学院动物免疫学重点实验室构建并保存。
1.3 引物设计与合成
本研究所使用的DNA引物均使用Premier Primer 5.0软件设计,由生工生物工程(上海)股份有限公司合成。引物名称、序列及用途等相关信息见表1。
表1 供试引物的背景信息

引物对编号引物名称用途序列(5′—3′)产物大小/bp1HVCN1-3′-UTR-F3′-UTR的PCR扩增CCTCGAGTGCTGGGCTACCGAGTCATC549HVCN1-3′-UTR-RTTGCGGCCGCGCAGGCAGAAAGGGAAGGAG2HVCN1-mut-3′-UTR-F3′-UTR突变体载体构建TCGAGCAGGCTTCTCCAATTGATTTCAGCT⁃58GCAGCCAGCTCCTCCCAGCACTGAGCGCHVCN1-mut-3′-UTR-RGGCCGCGCTCAGTGCTGGGAGGAGCTGGC⁃TGCAGCTGAAATCAATTGGAGAAGCCTGC3mut-miR-M12-5p-F3′-UTR突变体载体构建AATTCATTAAAGAAGTATAATGTAAATGTCC⁃59AAAGGTTTGCATAATACGGAGGGTTCTCmut-miR-M12-5p-RTCGAGAGAACCCTCCGTATTATGCAAACCT⁃TTGGACATTTACATTATACTTCTTTAATG4HVCN1-qPCR-FqRT-PCRTGAGGAGGAGGACAATGGAGAGA111HVCN1-qPCR-RTGAAACCTGCGTGAACTGAAGAG5GAPDH-qPCR-FqRT-PCRAAGTCCCTGAAAATTGTCAGCAAT119GAPDH-qPCR-RATGGCATGGACAGTGGTCATAAG
1.4 miR-M12-5p候选靶基因生物信息学预测
分析挑选出30个在MDV感染过程中表达下调的宿主基因,利用miRNA靶基因生物信息学预测软件RNAhybrid(http://bibiserv.techfak.uni-bielefeld.de/rnahybrid/)在线预测miR-M12-5p的候选靶基因。根据miRNA∶mRNA杂合配对的特异性及预测软件的特点,设定筛选条件为允许G∶U配对,miRNA 2—8位种子区域匹配,匹配区域位于mRNA的3′-UTR序列中。
1.5 双荧光素酶报告载体构建
以CEF基因组cDNA为模板,扩增鸡HVCN1基因3′-UTR目的片段。PCR反应体系包括:ExTaq10 μL、引物对1的上下游引物(表1)各1 μL(10 μmol/L)、CEF cDNA 1 μL(100 ng/μL)和ddH2O 7 μL。PCR程序为:95 ℃ 5 min;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物用1%琼脂糖凝胶电泳分析。割胶回收目的片段,将其和psiCHECK-2质粒进行双酶切。同上电泳分析,割胶回收目的片段。将纯化后的目的片段与载体连接,然后直接转化大肠杆菌JM109,涂琼脂平板培养过夜,挑取单克隆菌落经PCR及双酶切鉴定阳性后,送生工生物工程(上海)股份有限公司测序。
将引物对2和3(表1)合成的寡核苷酸分别用ddH2O溶解至终浓度为50 μmol/L,进行退火反应。反应体系包括:Nuclease-Free Water 40 μL,Annealing Buffer for DNA Oligos (5×) 20 μL,正、反寡核苷酸链各20 μL(50 μmol/L)。反应程序为:95 ℃变性2 min,然后每90 s下降1 ℃直至25 ℃。将退火形成的双链DNA同上构建人工突变型报告基因载体。
1.6 DLRA
psiCHECK2-HVCN1-3′-UTR 和pcDNA6.2-miR-M12-5p质粒各取300 ng,均匀混于12.5 μL无血清培养基中,按照48孔细胞板每孔1 μg Lipofectamine 2000和12.5 μL质粒的比例均匀混合,按Lipofectamine 2000说明书,将孵育后的Lipofectamine 2000和混合质粒(25 μL/孔)共转染融合度为80%~90%的HEK 293T细胞。以pcDNA6.2-miR-neg为阴性对照组,每组均设3个重复,在37 ℃、5% CO2培养箱中静置培养。
转染48 h后,将HEK 293T细胞培养基弃去,用PBS洗2次,然后用DLRA系统进行报告基因检测。首先用20 μL ddH2O稀释细胞裂解液,裂解细胞,室温孵育15 min。然后将细胞裂解液转移至96孔白色底透酶标板中,每孔加入100 μL LAR Ⅱ,轻柔混合均匀后用Ω酶标仪(BMG Labtech)测定萤火虫荧光素酶数值。最后向每孔中加入100 μL Stop & Glo Reagent,轻柔混合均匀后,同上测定海肾荧光素酶数值。最后统计分析海肾荧光素酶/萤火虫荧光素酶活性比值。
1.7 qRT-PCR
用MDV亲本毒株GX0101和miR-M12-5p前体基因缺失株GX△miR-M12分别感染CEF细胞,分别于感染后96 h和120 h收集细胞样品,同时以CEF细胞为阴性对照,按照TRIzol操作说明书提取总RNA。取上述RNA样品各1 μg,按照PrimeScriptTMRT reagent Kit with gDNA Eraser操作说明书去除基因组DNA,反应体系包括:5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL、RNA 1 μg、RNase-free H2O补足至10 μL,42 ℃反应2 min。向上述10 μL反应体系中加入:5×Primer Script Buffer 4 μL、Primer Script RT Enzyme Mix Ⅰ 1 μL、RT Primer Mix 1 μL和RNase-free H2O 4 μL,于37 ℃反应15 min,然后85 ℃反应5 s进行cDNA合成反应,合成的cDNA 于-20 ℃保存备用。
以CEF阴性细胞为对照,以鸡GAPDH为内参基因进行qPCR分析,每个反应体系均设置3个重复。20 μL qPCR反应体系包括:cDNA模板(1.4 μg/μL)2 μL、引物对4或5的上下游引物(表1)各 0.8 μL(10 μmol/L)、ROX Dye Ⅱ 0.4 μL、2×SYBR Premix ExTaq10 μL和ddH2O 6 μL。反应程序为:95 ℃ 2 min;95 ℃ 20 s,60 ℃ 34 s。溶解曲线生成条件为荧光定量PCR仪(7500 Fast,ABI)默认参数。所有qRT-PCR试验数据均采用2-△△Ct法进行分析。
2 结果与分析
2.1 miR-M12-5p候选靶基因的预测结果
利用RNAhybrid在线预测软件对miR-M12-5p的候选靶基因进行预测分析,从MDV感染过程中下调表达的30个基因中,预测出4个位于mRNA 3′-UTR的匹配靶点(表2),包括HVCN1、P2RX5、CD79B、SLC22A16基因。HVCN1基因为多个MDV-1编码的miRNA的共同候选靶基因,故优先选取HVCN1进行下一步试验分析。
表2 生物信息学预测 miR-M12-5p 的候选靶基因背景信息

2.2 双荧光素酶报告载体构建及鉴定结果
从CEF基因组cDNA中扩增出大小为549 bp的HVCN1 3′-UTR片段(图1),然后将该片段定向插入到psiCHECK-2载体中,经过PCR及双酶切对重组质粒进行鉴定(图1),最后进行测序分析,结果显示,扩增序列与预期完全相符,成功获得重组载体质粒psiCHECK2-HVCN1-3′-UTR。将人工合成的突变型miR-M12-5p前体序列或HVCN1基因的3′-UTR分别定向插入pcDNA-6.2和psiCHECK-2载体中,分别获得重组质粒pcDNA6.2-mut-miR-M12-5p和psiCHECK2-HVCN1-3′-UTR,经过质粒测序分析,与预期完全一致(未显示)。
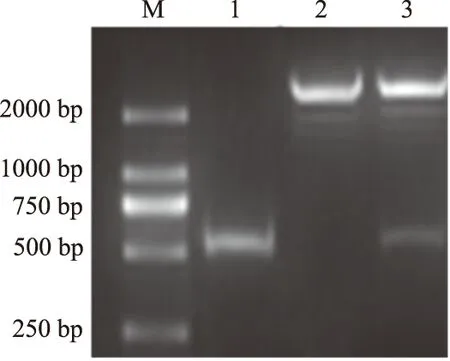
M.DNA Marker; 1.HVCN1基因3′-UTR PCR扩增产物; 2.psiCHECK-2空载体双酶切; 3.psiCHECK2-HVCN1-3′-UTR重组质粒双酶切图1 HVCN1 3′-UTR的PCR扩增及重组质粒双酶切鉴定
2.3 DLRA分析结果
将双荧光素酶报告基因载体psiCHECK2-HVCN1-3′-UTR分别和pcDNA6.2-miRKG-M12-5p或阴性对照组质粒pcDNA6.2-miR-neg共转染HEK 293T细胞,48 h后用DLRA系统检测荧光值并计算相对荧光素酶活性(即海肾荧光素酶活性值/萤火虫荧光素酶活性值)。结果显示,与对照组pcDNA6.2-miR-neg质粒相比,pcDNA6.2-miR-M12-5p质粒与psiCHECK2-HVCN1-3′-UTR质粒共转染HEK 293T细胞时,海肾荧光素酶/萤火虫荧光素酶活性比值极显著降低 (图2)。将HVCN1 3′-UTR或miR-M12-5p靶点序列进行人工突变,构建2个突变重组载体质粒psiCHECK2-mut-HVCN1-3′-UTR和pcDNA6.2-mut-miR-M12-5p,分别交叉对应共转染HEK 293T细胞时,海肾荧光素酶/萤火虫荧光素酶活性比值明显提高(图2)。上述结果表明,miR-M12-5p可与HVCN1 3′-UTR发生特异性相互作用,即miR-M12-5p可以体外靶向结合HVCN1的mRNA 3′-UTR,并显著抑制报告基因活性。

**表示差异极显著(P<0.01)。下图同图2 DLRA分析miR-M12-5p与HVCN1 3′ -UTR的相互作用结果
2.4 qRT-PCR验证HVCN1表达的分析结果
为了进一步验证miR-M12-5p与候选靶基因HVCN1的体内相互作用关系,用qRT-PCR分析HVCN1的表达水平。如图3所示,与CEF阴性对照相比,在GX0101感染的细胞中HVCN1 mRNA的表达水平极显著下调,而在GX△miR-M12感染的CEF细胞中HVCN1 mRNA的表达量与GX0101感染组相比极显著上调。上述结果表明,在MDV感染的CEF细胞中,HVCN1的表达水平与miR-M12-5p的表达水平呈显著的负相关关系,进一步证实miR-M12-5p在体内抑制HVCN1的表达。
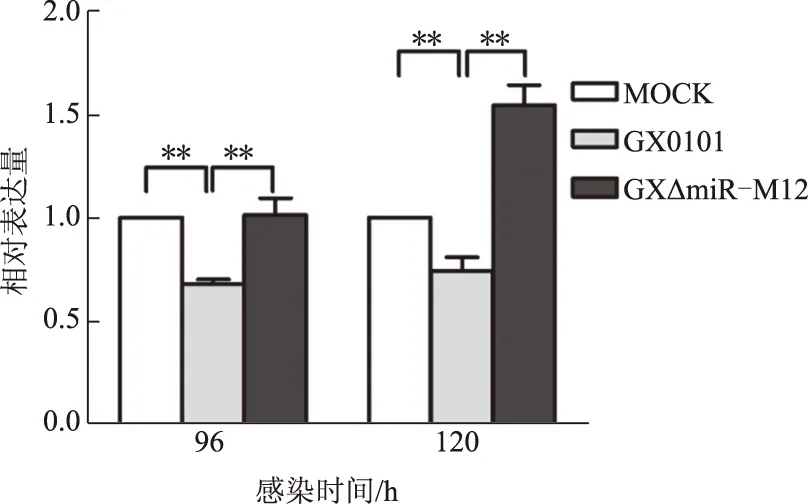
图3 MDV感染CEF细胞中HVCN1的表达变化
3 讨论
MDV对鸡不仅具有致病性,而且MDV-1强毒株的感染最终还诱发其自然宿主发生多组织脏器的T淋巴肿瘤,是少数几个可以导致肿瘤发生的代表性疱疹病毒之一。因此,深入研究MDV-1编码的病毒基因的结构与功能,对于揭示其他致瘤性疱疹病毒的感染及致病机制也具有重要的科学意义。MDV-1病毒共编码14个miRNA前体基因,表达26个成熟的miRNA分子,并且在基因组中形成3个miRNA基因簇[14-15]。其中miRNA前体基因miR-M2、miR-M3、miR-M4、miR-M5、miR-M9和miR-M12组成第1个基因簇,即Meq基因簇;miR-M6、miR-M7、miR-M8、miR-M10和miR-M13组成第2个基因簇被称为LAT基因簇;另外3个前体基因miR-M1、miR-M11和miR-M31组成第3个miRNA基因簇,位于上述2个基因簇之间,因此之前又被称为Mid基因簇[15]。这些病毒miRNA在MD的发生、发展过程中,如在病毒复制[9]、维持潜伏感染[10]、介导细胞凋亡[11]、激活原癌基因表达[12]等方面都可能发挥极其重要的作用,其中位于Meq基因簇中的miR-M4-5p,此前已被鉴定为宿主的原癌基因miR-155类似物,笔者所在课题组研究发现,miR-M4-5p可在感染宿主体内靶向调控宿主基因LTBP1的表达,影响TGF-β1的成熟及向胞外分泌的过程,进而抑制TGF-β信号通路来激活原癌蛋白c-Myc的表达,最终促进诱导MD的肿瘤发生[12]。动物攻毒试验数据也显示,缺失miR-M4前体基因的MDV突变毒株与其亲本毒株相比致瘤率显著下降[9]。miR-M3-5p是位于Meq基因簇中的另外一个病毒miRNA,此前有国内学者研究发现,miR-M3-5p可通过靶向下调宿主基因SMAD2的表达,从而抑制TGF-β信号通路、促进细胞存活、抑制细胞凋亡,为MDV的病毒复制提供空间[11]。
除了miR-M4-5p和miR-M3-5p之外,Meq基因簇中编码的其他多个miRNA在MDV-1的致病及致瘤过程中也可能发挥重要的调控作用。miR-M12-5p也位于Meq基因簇中,笔者所在课题组通过逐一基因缺失该基因簇中各病毒miRNA的前体单一基因研究其对MDV致病表型的影响,结果发现,miR-M12-5p的前体基因缺失也可使MDV的致瘤率显著下降[13]。为了进一步研究miR-M12-5p在MDV致病过程中的调控作用,本研究首先利用生物信息学软件对miR-M12-5p的宿主候选靶基因进行预测分析,然后通过DLRA对miRNA与候选靶基因3′-UTR的体外相互作用进行验证,经过qRT-PCR对MDV感染细胞中候选基因的表达水平进行了分析,最终证实miR-M12-5p可靶向调控宿主基因HVCN1的表达。HVCN1的作用主要在于调节电压依赖型质子,兴奋细胞膜的渗透性,可能与肿瘤转移存在相关性。近年来研究发现,电压门控性通道基因在多种肿瘤细胞中过表达,并通过影响细胞膜电压、改变细胞体积等方式影响肿瘤细胞的周期和增殖[16-17]。此外,HVCN1还参与调节机体的免疫反应,可调控多种免疫细胞产生活性氧簇(reactive oxygen species,ROS)[18],ROS在肿瘤细胞的迁移和入侵过程中发挥重要作用[19]。本研究发现,miR-M12-5p可靶向调控鸡HVCN1基因的表达,预示氢电压门控通道可能在MD肿瘤的发生、发展过程中发挥重要调控作用,但其分子机制仍有待进一步深入研究。
[1] Calnek B W.Pathogenesis of Marek’s disease virus infection[J].Curr Top Microbiol Immunol,2001,255:25-55.
[2] Churchill A E,Payne L N,Chubb R C.Immunization against Marek’s disease using a live attenuated virus[J].Nature,1969,221:744-747.
[3] Osterrieder N,Kamil J P,Schuamacher D,etal.Marek’s disease virus:From miasma to model[J].Nat Rev Microbiol,2006,4(4):283-294.
[4] Lee Y S,Dutta A.MicroRNAs in cancer[J].Annu Rev Pathol,2009,4:199-227.
[5] Sullivan C S,Ganem D.MicroRNAs and viral infection[J].Molecular Cell,2005,20(1):3-7.
[6] Boss I W,Plaisance K B,RenneR.Role of virus-encoded microRNAs in herpesvirus biology[J].Trends in Micro-biology,2009,17(12):544-553.
[7] Bartel D P.MicroRNA:Genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[8] Filipowicz W,Bhattacharyya S N,Sonenberg N.Mechanisms of post-transcriptional regulation by microRNAs:Are the answers in sight?[J].Nature Reviews Genetics,2008,9(2):102-114.
[9] Yu Z H,Teng M,Sun A J,etal.Virus-encoded miR-155 ortholog is an important potential regulator but not essential for the development of lymphomas induced by very virulent Matek’s disease virus[J].Virology,2014,448(1):55-64.
[10] Strassheim S,Stik G,Rasschaert D,etal.mdv1-miR-M7-5p,located in the newly identified first intron of the latency-associated transcript of Marek’s disease virus, targets the immediate-early genes ICP4 and ICP27[J].The Journal of General Virology,2012,93(Pt 8):1731-1742.
[11] Xu S,Xue C,Li J,etal.Marek’s disease virus type 1 microRNA miR-M3 suppresses cisplatin-induced apoptosis by targeting Smad2 of the transforming growth factor beta signal pathway[J].Journal of Virology,2011,85(1):276-285.
[12] Chi J Q,Teng M,Yu Z H,etal.Marek’s disease virus-encoded analog of microRNA-155 activates the oncogene c-Myc by targeting LTBP1 and suppressing the TGF-β signaling pathway[J].Virology,2015,476:72-84.
[13] Teng M,Yu Z H,Sun A J,etal.The significance of the individual Meq-clustered miRNA of Marek’s disease virus in oncogenesis[J].Journal of General Virology,2015,96(pt 3):637-649.
[14] Burnside J,Bernberg E,Anderson A,etal.Marek’s di-sease virus encodes microRNAs that map to meq and the latency-associated transcript[J].Journal of Virology,2006,80(17):8778-8786.
[15] 罗俊,滕蔓,樊剑鸣,等.马立克氏病病毒编码的microRNA:从基因组学到功能研究[J].中国科学(生命科学),2010,40(6):476-483.[16] Li M,Wang B,Lin W.Cl-channel blockers inhibit cell proliferation and arrest the cell cycle of human ovarian cancer[J].European Journal of Gynaecological Oncology,2008,29(3):267-271.
[17] Zhang H N,Zhou J G,Qiu Q Y,etal.ClC-3 chloride channel prevents apoptosis induced by thapsigarain in PC12 cells[J].Apoptosis,2006,11(3):327-336.
[18] Capasso M.Regulation of immune responses by proton channels[J].Immunology,2014,143(2):131-137.
[19] Lee J L,Kang S W.Reactive oxygen species and tumor metastasis[J].Molecules and Cells,2013,35(2):93-98.
Targeted Regulation of Host GeneHVCN1 by Viral microRNA miR-M12-5p Encoded by Marek’s Disease Virus
LI Huizhen1,2,TENG Man2,DANG Lu2,FENG Lili3, MA Shengming4,ZHAO Pu2,LUO Jun2,ZHANG Gaiping1,2*
(1.College of Animal Scienceand Veterinary Medicine,Henan Agricultural University,Zhengzhou 450002,China; 2.Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences/Key Laboratory of Animal Immunology of the Ministry of Agriculturel/Henan Provincial Key Laboratory of Aminal Immunology,Zhengzhou 450002,China; 3.Institute of Agricultural Economics and Information,Henan Academy of Agricultural Sciences,Zhengzhou 45000 2,China; 4.College of AnimalScience and Technology,Henan University of Science and Technology,Luoyang 471003,China)
In order to study the regulatory role of miR-M12-5p,we predicted the host target genes utilizing bioinformatics method and obtained four candidate mRNA targets for miR-M12-5p.Dual luciferase reporter assay(DLRA) showed that miR-M12-5p couldinvitrointeract with the 3′-UTR of the mRNA of hydrogen voltage gated channel 1(HVCN1) gene.Further analysis results of the quantitative real-time PCR(qRT-PCR) showed that the expression level ofHVCN1 gene wasinvivodown-regulated by miR-M12-5p.These data suggested that miR-M12-5p could regulate the expression of host chicken geneHVCN1.
MDV; miRNA; miR-M12-5p; target gene;HVCN1 gene
2016-01-30
国家自然科学基金面上项目(31372445);河南省农业科学院优秀青年科技基金项目(2013YQ28)
李会珍(1990-),女,河南郑州人,在读硕士研究生,研究方向:动物疫病分子致病机制。 E-mail:lihuizhen01@163.com
*通讯作者:张改平(1960-),男,河南内黄人,研究员,博士,主要从事动物免疫学及重大疫病快速检测技术研究。 E-mail:zhanggaiping2003@163.com
S855.3
A
1004-3268(2016)06-0121-06

