芝麻茎点枯病菌的生物学特性及9种杀菌剂对其抑制作用测定
倪云霞,王 飞,刘玉霞,刘新涛,赵 辉,刘红彦(河南省农业科学院 植物保护研究所/农业部华北南部农作物有害生物综合治理重点实验室/河南省农作物病虫害防治重点实验室,河南 郑州 450002)
芝麻茎点枯病菌的生物学特性及9种杀菌剂对其抑制作用测定
倪云霞,王 飞,刘玉霞,刘新涛,赵 辉,刘红彦*
(河南省农业科学院 植物保护研究所/农业部华北南部农作物有害生物综合治理重点实验室/河南省农作物病虫害防治重点实验室,河南 郑州 450002)
为了有效防治芝麻茎点枯病,对芝麻茎点枯病菌的生物学特性进行研究,并测定了9种杀菌剂的室内毒力。采用常规鉴定和分子鉴定相结合的方法,鉴定致病菌株为菜豆壳球孢[Macrophominaphaseolina(Maubl.) Ashby]。对菌株的生物学特性研究结果表明,最适合菌丝生长的培养基为PSA,碳源为蔗糖,氮源为胰蛋白胨;适合菌丝生长的pH值为5.02~6.22;菌丝生长的最适温度为28~30 ℃,致死温度为59 ℃;12 h光暗交替有利于菌丝生长。采用菌丝生长速率法测定了9种杀菌剂对该菌株的室内毒力,结果显示,9种杀菌剂对芝麻茎点枯病菌菌丝的抑制效果有很大的差异,12.5%烯唑醇WP、50%多菌灵WP、40%氟硅唑EC的抑菌效果较好,相应的EC50值分别为0.06、0.18、0.21 μg/mL;抑菌效果最差的是70%恶霉灵SP,EC50值为33.61 μg/mL。
芝麻; 茎点枯病; 菜豆壳球孢; 生物学特性; 杀菌剂; 室内毒力
芝麻属胡麻科1年生草本植物[1-2]。芝麻茎点枯病是由菜豆壳球孢[Macrophominaphaseolina(Maubl.) Ashby]引起的一种真菌病害[3-4],是危害芝麻的主要病害之一,在亚洲、欧洲、美洲等芝麻产区严重发生[5-6]。芝麻茎点枯病在芝麻的整个生育期均可发生,导致茎秆中空、折断,蒴果干枯,种子带有病菌菌核[7]。河南省是我国芝麻的主产区,种植面积最大,占全国总种植面积的2/5,产量占全国芝麻总产量的40%以上[8-9],芝麻茎点枯病的发生尤其严重[10-11]。目前国内外关于芝麻茎点枯病菌生物学特性和流行规律方面的研究报道很少,因此缺乏有效的防治手段[10,12-14],生产上对该病害仍旧采用传统的方法进行防治。为此,对芝麻茎点枯病病原菌的生物学特性进行研究,期望通过控制外部环境条件来降低芝麻茎点枯病的发生,并研究了9种杀菌剂对病原菌的抑制作用,以筛选防治该病害的高效药剂。
1 材料和方法
1.1 材料
病原菌株:芝麻茎点枯病菌标样采自河南省农业科学院芝麻试验田。
供试药剂:50%多菌灵WP,江苏省江阴市祝上镇化工工业园区生产;40%福星(氟硅唑) EC,美国杜邦公司生产;70%甲基硫菌灵WP,日本曹达株式会社生产;80%代森锰锌WP,美国固信公司生产;50%福美双WP,河北冀丰农药化工有限责任公司生产;12.5%禾果利(烯唑醇)WP,江苏辉丰农化有限公司生产;30%醚菌酯SC,山东京博农化有限公司生产;10%宝丽安(多氧霉素)WP,日本科研制药株式会社生产;70%山推(恶霉灵)SP,山东京博农化有限公司生产。
1.2 病原菌分离及鉴定
病原菌的分离培养采用常规的组织分离法[15],选取芝麻茎秆上的典型症状标样,在光学显微镜下直接镜检后,置于 PDA平板上28 ℃下培养获得病菌纯培养,观察菌落形态、菌丝形态及菌核着生情况。并根据真菌鉴定手册进行病原菌鉴定[16]。
采用改良CTAB法提取病原菌基因组DNA[17]。合成ITS通用引物,ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′[18]。以病原菌基因组DNA为模板,采用ITS通用引物进行PCR扩增,反应体系 (25 μL)为: 模板2 μL、10×Buffer(含Mg2+)2.5 μL、Taq(5 U/μL)0.2 μL、ITS1和ITS4各1 μL、dNTP(10 mmol/L) 0.4 μL、ddH2O 17.9 μL。反应程序:95 ℃ 预变性5 min;95 ℃ 变性1 min,50 ℃退火30 s,72 ℃延伸80 s,35个循环;72 ℃延伸10 min。测序工作在生工生物工程(上海)有限公司进行。
1.3 芝麻茎点枯病菌生物学特性观察
1.3.1 培养基对芝麻茎点枯病菌菌落生长的影响试验 共选用 PDA、PSA、PDA+芝麻茎秆煎汁、PSA+芝麻茎秆煎汁、芝麻茎秆煎汁、Bilai’s、高氏1号、葡萄糖蛋白胨培养基、查彼(Czapek)培养基和燕麦片培养基等10种培养基[19]。其中,PDA+芝麻茎秆煎汁:葡萄糖20 g、马铃薯200 g、琼脂20 g、芝麻茎秆煎汁70 g(取新鲜芝麻茎秆70 g加少量水煮后过滤,下同)、蒸馏水1 000 mL;PSA+芝麻茎秆煎汁:蔗糖20 g、马铃薯200 g、琼脂20 g、芝麻茎秆煎汁70 g、蒸馏水1 000 mL;芝麻茎秆煎汁培养基:芝麻茎秆煎汁70 g、琼脂20 g、蒸馏水1 000 mL。
接种直径6 mm的病原菌菌块于各种培养基平板中央,28 ℃培养,重复5次,第3天用十字交叉法测量菌落直径[15]。
1.3.2 温度和pH值对芝麻茎点枯病菌菌落生长的影响试验 将直径6 mm的病原菌菌块接种到PSA平板中央,设置培养温度分别为 5、10、15、20、22、25、28、30、35 ℃等9个不同梯度,每处理重复5次,第3天测量菌落直径。
以PSA培养基为基础,用0.1%的NaOH和HCl溶液调配培养基pH值分别为5.02、6.00、7.01、8.00、9.02、10.07和11.00,以不调节pH值的培养基为对照(pH值6.22),28 ℃培养,每处理重复5次,第3天测量菌落直径。
1.3.3 光照对芝麻茎点枯病菌菌落生长的影响试验 将直径6 mm的病原菌菌块接种到 PSA平板中央,28 ℃培养,光照条件分别为连续光照、连续黑暗、12 h光暗交替,每处理重复5次,第3天测量菌落直径。
1.3.4 碳、氮源对芝麻茎点枯病菌菌落生长的影响试验 以查彼培养基为基础培养基,以KNO3为氮源,使碳源的总质量浓度为12.63 g/L,共选择9种不同的碳源:蔗糖、D-葡萄糖、D-果糖、肌醇、乳糖、可溶性淀粉、甘油、葡聚糖、柠檬酸钠,以无碳、氮源培养基和无碳源培养基为对照,每处理重复5次,28 ℃培养,第3天测量菌落直径。
以蔗糖为碳源,使氮源总质量浓度为0.329 6 g/L,共选择10种不同的氮源:胰蛋白胨、牛肉膏、硝酸钾、硫酸铵、硝酸钠、亚硝酸钠、磷酸二氢铵、脲、磷酸氢二铵、草酸铵,以无碳、氮源培养基和无氮源培养基为对照,每处理重复5次,28 ℃培养,第3天测量菌落直径。
1.3.5 芝麻茎点枯病菌菌丝致死温度的测定 将直径6 mm的病原菌菌块放置于装有10 mL无菌水的灭菌离心管中,将离心管分别置于35~60 ℃(每隔5 ℃设置梯度)的恒温水浴锅中处理10 min(先预热1 min)后取出迅速冷却[19-20]。将处理过的菌块置于PSA平板培养基中,每个处理5次重复,28 ℃恒温培养,第3天测量菌落直径。
先以相隔5 ℃梯度确定致死温度范围,然后相隔1 ℃设置梯度重复以上试验,确定菌丝致死温度。
1.4 9种杀菌剂对芝麻茎点枯病菌的抑制作用测定
采用菌丝生长速率法测定9种杀菌剂对芝麻茎点枯病菌的抑制作用。将直径6 mm的病原菌菌块接种到含有不同质量浓度药剂的PSA平板上,每质量浓度处理重复5次,28 ℃培养,第3天测量菌落直径,以不含药剂处理为对照。
培养基中供试药剂的质量浓度如下:50%多菌灵WP 50、25、12.5、6.25、3.125 μg/mL,40%氟硅唑EC 5、2.5、1.25、0.625、0.312 5 μg/mL,70%甲基托布津WP 70、35、17.5、8.75、4.375、2.187 5 μg/mL,80%代森锰锌WP 40、20、10、5、2.5 μg/mL,50%福美双WP 50、25、12.5、6.25、3.125 μg/mL,12.5%烯唑醇WP 18.75、9.375、4.687 5、2.343 75、1.171 875 μg/mL,30%醚菌酯SC 22.5、11.25、5.625、2.812 5、1.406 25 μg/mL,10%多氧霉素WP 20、10、5、2.5、1.25 μg/mL,70%恶霉灵SP 14、7、3.5、1.75、0.875 μg/mL。
农药毒力计算公式如下:
相对抑制率=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-菌饼直径)×100%[21];
采用Excel 软件,以相对抑制率(y)为纵坐标,将药剂质量浓度换算成质量浓度对数(x)作为横坐标,计算出线性回归方程(即毒力公式,y=a+bx)和r值,并根据毒力公式计算各种农药的有效中浓度(EC50)[22];
毒力倍数=EC50最高值/其他药剂EC50值,其中EC50值最高药剂的毒力倍数为1。
2 结果与分析
2.1 病原菌鉴定结果
2.1.1 常规鉴定 直接镜检:分生孢子器黑褐色,圆形,埋生于芝麻茎秆表皮,直径为112~189 μm,平均为147.98 μm;成熟的分生孢子器压破后,溢出大量分生孢子,分生孢子长椭圆形或短棒状,单胞无色,大小为(17.28 ~25.2)μm ×(7.2 ~11.3)μm,平均为21.6 μm×8.21 μm。将成熟的菌核压破,有大量油球溢出。
培养性状:PDA培养基上菌落生长迅速,菌丝由接种菌块处沿培养基表面向四周放射状生长,气生菌丝初呈白色,48 h后菌落中间至周围颜色由白色向灰白色过度,72 h产生黑色素,使培养基变黑,颜色从中间向周围逐渐变淡。在30 ℃条件下培养7~8 d即可形成大量菌核,但不形成分生孢子器。显微观察:菌丝有隔,褐色;菌核较小,球形、椭圆形或不规则形,黑色或深褐色,大小(82.5~120)μm×(67.5~120)μm,直径为92.95~167.31 μm,平均为125.7 μm。
2.1.2 分子鉴定 测序结果显示,病原菌ITS序列为583 bp。经DNAman比对,其与MacrophominaphaseolinaR-4242菌株同源性为100%。
综合2.1.1和2.1.2结果,将菌株鉴定为菜豆壳球孢[M.phaseolina(Maubl.) Ashby]。
2.2 病原菌生物学特性观察结果
2.2.1 不同培养基对芝麻茎点枯病菌菌落生长的影响 芝麻茎点枯病菌在PSA培养基上生长最好,菌落突起,菌丝白色致密呈絮状、生长旺盛,菌落直径为79.8 mm;其次为PDA培养基和PSA+芝麻茎秆煎汁,菌落直径分别为76.4 mm和76.0 mm;燕麦片培养基、PDA+芝麻茎秆煎汁和查彼培养基上菌落生长比较快,但菌落质地稀薄;葡萄糖蛋白胨培养基、Bilai’s、高氏1号培养基和芝麻茎秆煎汁培养基上,菌落生长较慢而且质地稀薄。PSA培养基、PDA培养基、PSA+芝麻茎秆煎汁、燕麦片培养基、PDA+芝麻茎秆煎汁和查彼培养基上的菌落直径极显著大于葡萄糖蛋白胨培养基、Bilai’s、高氏1号培养基和芝麻茎秆煎汁培养基上的菌落直径(表1)。
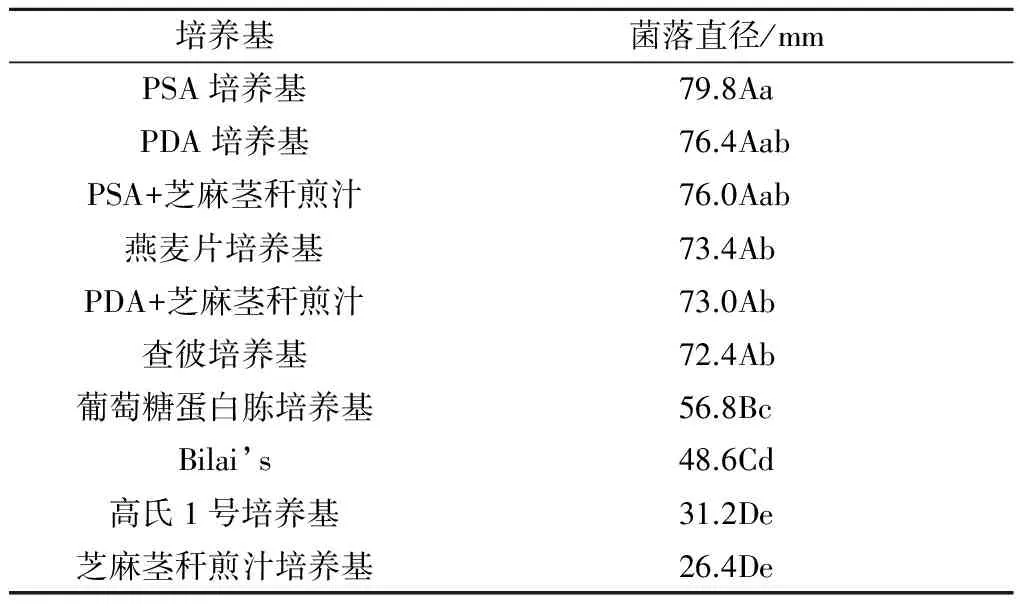
表1 10种培养基对芝麻茎点枯病菌菌落生长的影响
注:同列不同小写字母和大写字母分别表示在5%、1%水平上差异显著、极显著,下同。
2.2.2 不同碳源和氮源对芝麻茎点枯病菌菌落生长的影响 从表2可以看出,碳源对芝麻茎点枯病菌的生长影响较大,以柠檬酸钠为碳源的培养基上菌落没有生长,以蔗糖为碳源的培养基上生长最好,菌落直径为64.0 mm。以蔗糖为碳源的培养基与其他8种碳源培养基之间差异极显著,其他8种培养基上菌落直径均不超过50 mm。因此,培养芝麻茎点枯病菌的碳源以蔗糖最好。
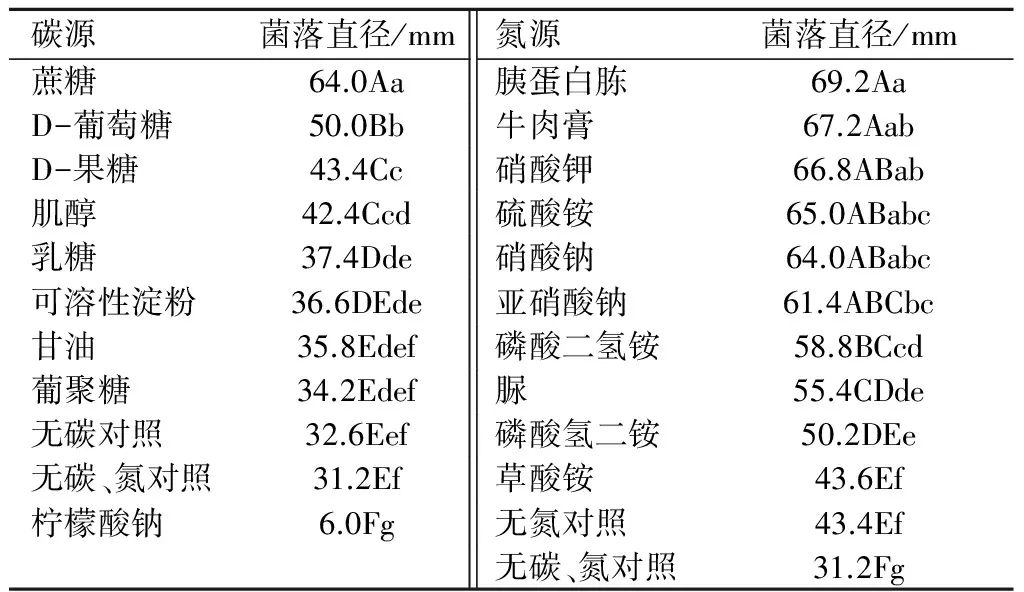
表2 不同碳源和氮源对芝麻茎点枯病菌菌落生长的影响
氮源比较试验结果显示,以胰蛋白胨、牛肉膏、硝酸钾、硫酸铵和硝酸钠为氮源的培养基之间差异不显著,菌落直径分别为69.2、67.2、66.8、65.0、64.0 mm,以草酸铵为氮源的培养基上菌落生长最差,菌落直径为43.6 mm,与其他氮源培养基差异显著。
2.2.3 不同温度和pH值对芝麻茎点枯病菌菌落生长的影响 从图1A可以看出,5 ℃以上菌落开始生长,30 ℃和28 ℃下菌落生长量差异不显著,菌落直径分别为64.4 mm和60.4 mm,30 ℃与25、35、22、20、15、10、5 ℃之间差异极显著,后者菌落直径分别为54.6 mm、50.8 mm、50.0 mm、38.6 mm、21.8 mm、9.8 mm、6.0 mm,因此芝麻茎点枯病菌的最适生长温度是28~30 ℃。
芝麻茎点枯病菌在pH值5.02~11.00内均可生长,pH值为5.02时生长最快,菌落直径达到70.2 mm,与其他pH值条件下的差异达到显著水平,pH值6.00~6.22时菌落直径达到60.0~61.8 mm(图1B)。因此芝麻茎点枯病菌最适合在微酸性的培养基上生长。考虑到试验的方便性,一般不需要调节pH值。
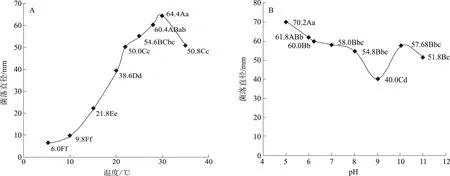
不同小写、大写字母分别表示差异达5%、1%水平图1 不同温度和pH值对芝麻茎点枯病菌菌落生长的影响
2.2.4 菌丝致死温度的确定 从表3可以看出,病原菌菌块在59 ℃处理10 min后,菌丝在PSA平板培养基上不生长,因此确定芝麻茎点枯病菌菌丝致死温度为59 ℃(处理10 min)。
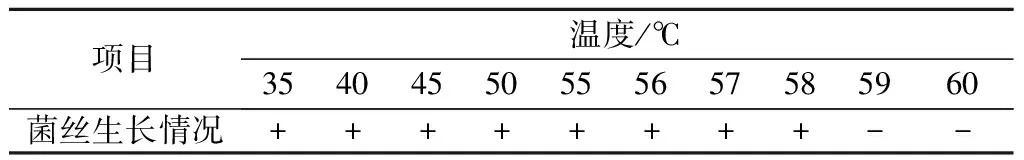
表3 芝麻茎点枯病菌的致死温度
注:+表示菌丝或菌核存活,-表示菌丝或菌核死亡。
2.2.5 不同光照条件对芝麻茎点枯病菌菌丝生长的影响 试验结果表明,在连续光照、12 h光暗交替和连续黑暗条件下,气生菌丝均发达。12 h光暗交替、连续黑暗和连续光照条件下菌落直径分别为87.4 mm、72.0 mm和72.8 mm,12 h光暗交替处理与其他2个处理差异极显著(表4),表明光照对病原菌菌丝生长影响很大。因此在茎点枯病菌培养时光照条件可以选用12 h光暗交替。

表4 不同光照条件对芝麻茎点枯病菌菌落生长的影响
2.3 9种杀菌剂对芝麻茎点枯病菌的抑制作用
从表5可以看出,9种杀菌剂对芝麻茎点枯病菌菌丝的抑制效果有很大的差异,烯唑醇、多菌灵、氟硅唑抑制作用最强,EC50分别为0.06、0.18、0.21 μg/mL,毒力分别是恶霉灵的560.17、186.72、160.05倍;其后依次为醚菌酯、甲基硫菌灵、多氧霉素、代森锰锌、福美双,EC50分别为1.15、1.48、4.07、 6.98、9.18 μg/mL;恶霉灵抑制作用最弱,EC50为33.61 μg/mL,其毒力最小,不适合于大田防治。
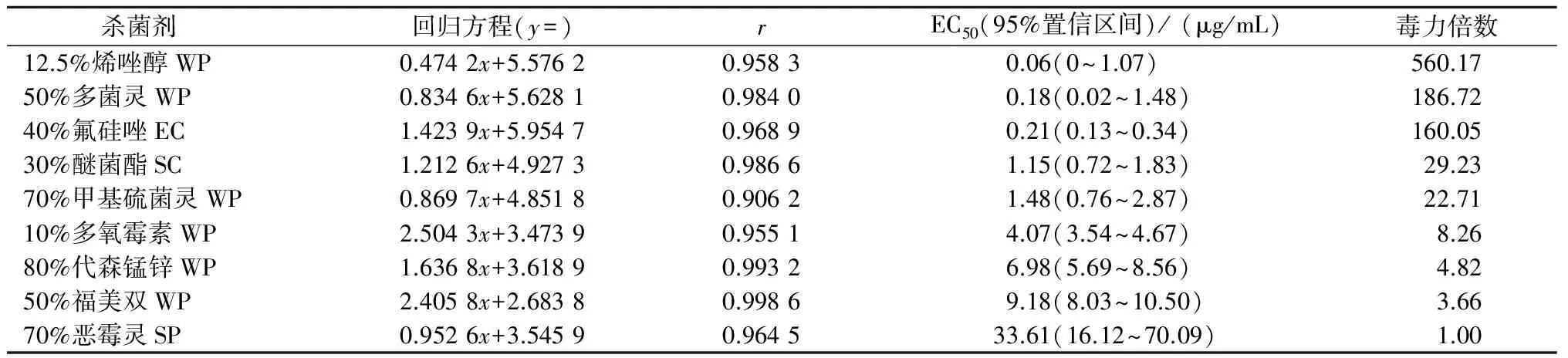
表5 9种杀菌剂对芝麻茎点枯病菌的毒力测定结果
3 结论与讨论
对菌丝生长特性研究结果表明,芝麻茎点枯病菌菌丝生长对氮源利用范围较广,但对培养基、温度、pH 值、碳源及光照均具有一定的选择性。同时,病菌菌丝致死温度为59 ℃(10 min)。可见,病菌菌丝对生长和生存条件都有一定的要求,这为深入研究该病害的发生规律和防治方法提供了理论依据。现有的菜豆壳球孢研究报道中,无关于人工培养基上产孢的报道[3],因此生物学特性方面未进行病菌分生孢子的研究。
目前,我国芝麻种植中防治茎点枯病主要使用的药剂为甲基硫菌灵、多菌灵、退菌特、代森锰锌等,在芝麻封顶前后进行田间药剂喷雾防治[10]。本研究证明,芝麻茎点枯病菌对三唑类杀菌剂敏感,烯唑醇对芝麻茎点枯病菌的毒力约是甲基硫菌灵的25倍,是代森锰锌的116倍,氟硅唑的毒力与广谱杀菌剂多菌灵基本相当。三唑类药剂以其优异的抑菌作用以及对植物生长的调节作用,将逐步取代多菌灵、代森锰锌等常规杀菌剂成为防治芝麻茎点枯病的首选药剂。室内杀菌剂毒力测定结果只能说明此种杀菌剂在室内离体条件下对芝麻茎点枯病菌有一定的杀菌活性,而田间防治效果受到很多因素影响,因此在应用于大田防治前还有待于进一步的田间试验证实其效果。
[1] 刘思衡.作物育种与良种繁育学词典[M].北京:中国农业出版社,2001:133.
[3] 董金皋.农业植物病理学:北方本[M].北京:中国农业出版社,2001:192-194.
[4] 谢中卫,柳西玉.芝麻茎点枯病及青枯病的发生与防治[J].现代农业科技,2005(8):30.
[5] 李丽丽.我国芝麻病害种类研究概况及展望[J].中国油料,1989(1):11-15.
[6] Koltc S S.Disease of annual edible oilseed[J].Oilseed Crop,1985,1:83-109.
[7] Thiyagu K,Candasamy G,Manivannan N,etal.Resistant genotypes to root rot disease(Macrophominaphaseolina) of sesame(SesamumIndicumL.)[J].Agric Sci Digest,2007,27(1):34-37.
[8] 邓伟,任晓,韩香珍.河南芝麻与WTO[J].农村经济与科技,2007,18(10):107.
[9] 高桐梅,卫双玲,吴寅,等.芝麻高产示范基地建设的实践与思考[J].河南农业科学,2015,44(4):62-65.
[10] 孟祥锋,高新国,张春生.河南省芝麻茎点枯病发病规律及防治措施[J].河南农业科学,2003(10):69.
[11] 杨永东,薛香云,杨修身,等.河南省芝麻主要病害综合治理研究[J].华北农学报,1992,7(1):112-117.
[12] 倪云霞,刘玉霞,刘新涛,等.不同药剂拌种对芝麻出苗及幼苗生长的影响[J].河南农业科学,2009(12):94-96.
[13] 高志国,张弘弼.芝麻主要病害的发生与防治技术[J].内蒙古农业科技,2012(2):84,92.
[14] 杨修身,薛香云,杨永东.杀菌剂对芝麻茎点枯菌抑制效果测定[J].河南农业科学,1989(7):18-19.
[15] 方中达.植病研究方法[M].3版.北京:中国农业出版社,1998.
[16] 魏景超.真菌鉴定手册[M].3版.上海:上海科学技术出版社,1979.
[17] 吴发红,黄东益,黄小龙,等.几种真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[18] Bainade P S,Tripathi B P,Khare N.Effect of chemical and biological control ofMacrophominaphaseolinainvitroandinvivo[J].Environment and Ecology,2007,25(1):29-31.
[19] 杨焕青,王开运,范昆,等.草莓枯萎病菌的生物学特性及7种杀菌剂对其抑制作用[J].植物保护学报,2008,35(2):169-173.
[20] 孟娜,周如军,傅俊范,等.紫草白霉病菌生物学特性研究[J].沈阳农业大学学报,2008,39(2):186-190.
[21] 王会芳,王三勇,芮凯,等.不同杀菌剂对红麻炭疽病菌的室内毒力测定[J].中国麻业科学,2010,32(5):258-260.
[22] 刘昌孝,孙瑞元.药物评价实验设计与统计学基础[M].北京:军事医学科学出版社,1999.
Biological Characteristics of the Pathogen of Sesame Stem Blight and Inhibitory Effects of Nine Fungicides
NI Yunxia,WANG Fei,LIU Yuxia,LIU Xintao,ZHAO Hui,LIU Hongyan*
(Institute of Plant Protection,Henan Academy of Agricultural Sciences/IPM Key Laboratory in Southern Part of North China for Ministry of Agriculture/Henan Key Laboratory of Crop Pest Control,Zhengzhou 450002,China)
The biological characteristics of the pathogen of sesame stem blight and the indoor toxicity of nine fungicides were studied.Using morphological identification and molecular identification,the isolated strain was identified asMacrophominaphaseolina(Maubl.) Ashby.The results of biological characteristics onM.phaseolinashowed that the suitable medium for the mycelium growth was PSA,the most suitable carbon source and nitrogen source were sucrose and tryptone;the optimum temperature for the mycelium growth was 28—30 ℃,and the mycelium death temperature was 59 ℃;the optimum pH value for the mycelium growth was 5.02—6.22;the suitable light condition for the mycelium growth was L∶D=12∶12.The toxicity of nine kinds of fungicides against theM.phaseolinawas measured by growth velocity in lab.The results revealed that the inhibitory effects of nine fungicides had great difference on the mycelium growth.12.5% Diniconazole WP,50% Carbendazim WP and 40% Flusilazole EC had higher inhibitory effect.The EC50values of these fungicides were 0.06 μg/mL,0.18 μg/mL and 0.21 μg/mL.The inhibitory effect of 70% Hymexazol SP was the lowest,with EC50value of 33.61 μg/mL.
sesame; stem blight;Macrophominaphaseolina; biological characteristics; fungicide; indoor toxicity
2015-11-20
国家芝麻产业技术体系建设项目(CARS-15-1-05);河南省农业科学院自主创新专项基金项目
倪云霞(1980-),女,江苏溧水人,助理研究员,硕士,主要从事植物病害防治技术研究。 E-mail:nyx2008@163.com
*通讯作者:刘红彦(1964-),男,河南嵩县人,研究员,博士,主要从事植物病虫害生物防治技术研究。 E-mail:liuhy1219@163.com
S435.653
A
1004-3268(2016)06-0072-05

