氨基糖苷类药物的危害及其检测方法研究进展
高 月,王 耀,胡骁飞,邓瑞广,侯玉泽(.河南科技大学 食品与生物工程学院/畜禽疫病诊断与食品安全检测河南省工程实验室,河南 洛阳 4703;.河南省农业科学院 动物免疫学重点实验室,河南 郑州 45000)
氨基糖苷类药物的危害及其检测方法研究进展
高 月1,王 耀1,胡骁飞2,邓瑞广2,侯玉泽1*
(1.河南科技大学 食品与生物工程学院/畜禽疫病诊断与食品安全检测河南省工程实验室,河南 洛阳 471023;2.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002)
氨基糖苷类药物是一个种类丰富的抗生素类别,因其能防治某些动物性疾病且能促进动物的生长发育,在养殖业中应用广泛。但长期高剂量使用该类药物,会因其降解困难对环境造成危害,并且可通过食物链传递给人。该类药物能够在人体内蓄积,从而产生耳毒性、肾毒性等危害。因此,检测食物中氨基糖苷类药物的残留十分必要。对氨基糖苷类药物的危害及其检测方法进行综述,并对其未来发展方向进行展望。
氨基糖苷类药物; 危害; 检测方法
氨基糖苷类药物(aminoglycosides,AGs)是一类天然发酵产物或者半合成衍生物,其结构中包含1个氨基环醇和1个或多个氨基糖分子,二者通过配糖键连接[1]。该类药物含有多个氨基和羟基基团,所以具有较强的极性,易溶于水,脂溶性差,还具有较强碱性,且在碱性环境中抗菌性能增强。AGs自身无发色集团,无特征紫外吸收。其主要包括新霉素(Neo)、链霉素(Str)、卡那霉素(Kan)、庆大霉素(Gen)、大观霉素、阿米卡星等,各类似物性质接近,被广泛应用于防治某些动物性疾病。但研究发现,长期高剂量使用此类药物会对用药动物产生蓄积毒性,更严重的是能够通过食物链传递给人类,所以各国制定了针对AGs的国家标准,在动物性食品流入市场之前要对AGs进行检测,检测的方法有微生物学检测方法、免疫学检测方法、理化检测方法等。详细阐述了AGs的危害并对各种检测方法进行综述,最后对其发展方向进行展望, 旨在为建立快速、简单、高效的AGs检测方法提供参考。
1 AGs的分类
自Waksman等在1944年制得AGs后,又陆续产生了3 000多个种类AGs,根据AGs的发展历程,可将其分为3类[2]。第一类源于链霉菌培养液中,如链霉素,能有效抑制巴氏杆菌(Pasteurella)、结核杆菌(Mycobacteriumtuberculosis)、布氏杆菌(Brucella)、沙门氏菌(Salmonella)、志贺痢疾杆菌(Shigella)、放线菌(Actinomycete)等,可以用来治疗白痢、鼠疫、猪肺疫、禽霍乱、犊肺炎、布氏杆菌病、牛出血性败血病;新霉素,能抑制放线菌、大肠杆菌(Escherichiacoli)、变形杆菌(Proteusbacillusvulgaris)、阿米巴原虫(Amebicprotozoa)等,可以用来治疗鸡白痢、幼畜白痢等疫病;卡那霉素,能够抑制葡萄球菌(Staphylococcus)、巴氏杆菌、沙门氏菌等,可以用于治疗禽霍乱、雏白痢、猪哮喘、猪萎缩性鼻炎等动物疾病;广泛兽用的安普霉素(Apr)等。这类药物的结构中完全羟基化的氨基糖与氨基环醇结合(图1),不具有抗绿脓杆菌的能力[3]。
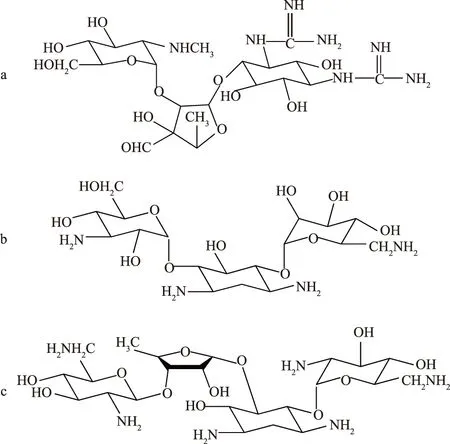
a.链霉素; b.卡那霉素; c.新霉素图1 常见的第一类AGs的化学结构式
第二类来自于小单胞菌,如庆大霉素,能有效抑制支原体、肺炎球菌溶血性链球菌等;西索米星,因其副作用强而未得到广泛应用;异帕米星由庆大霉素B衍生而来。此类药物结构中脱氧氨基糖与氨基环醇结合(图2),均能有效抑制绿脓杆菌。

a.庆大霉素; b.异帕米星图2 常见的第二类AGs的化学结构式
第三类为半合成类(图3),其抑菌性能不变,耳毒性、肾毒性降低,包括阿米卡星、地贝卡星、乙基西梭霉素等[4]。
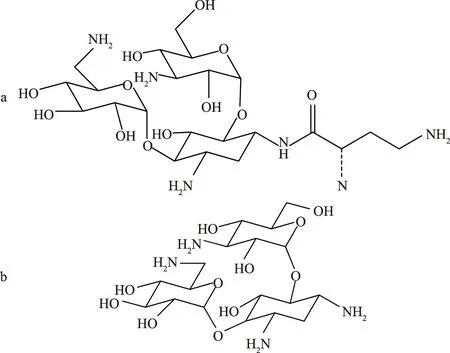
a.阿米卡星; b.地贝卡星图3 常见的第三类AGs的化学结构式
2 AGs的应用及其危害
氨基糖类药物属于静止期杀菌药,杀菌谱较广,其杀菌机制主要是通过作用于细菌蛋白质合成过程[5-6],使蛋白质合成异常,但几乎不与血清蛋白结合,只改变细菌细胞膜通透性,能有效抑制大部分革兰氏阴性杆菌和一些革兰氏阳性杆菌[7]。AGs能有效抑制葡萄球菌属、部分结核分支杆菌和其他分支杆菌属的活性。此外,这类药物具有剂量依赖性,对细菌的抑制作用随剂量的升高而增强[8]。
在畜牧兽医领域中,AGs不仅在治疗细菌感染病方面得到了广泛的应用,还被应用在饲料中,以达到预防疾病和促进生长的作用。最常用来作为治疗药物的是庆大霉素、新霉素、双氢链霉素(Dhstr)和链霉素。然而,长期用药会对人及动物造成危害,其危害性主要包括肾毒性、耳毒性和神经肌肉阻滞等。肾毒性主要表现在对肾小管上皮细胞的损害,导致患病动物尿蛋白、尿血,严重的可致肾功能减退。大量试验表明,AGs对肾造成的危害是可逆的,减少用药剂量、缩短用药期可使其恢复[9]。耳毒性主要表现在对第8对脑神经、前庭神经和耳蜗神经的损害[10],导致动物失去平衡、姿势异常。耳毒性的严重程度随用药剂量和用药期长短而改变,早期是可逆的,严重致失聪时不可恢复。神经肌肉阻滞主要通过阻碍神经肌肉传导造成骨骼肌松弛、心肌抑制、呼吸衰竭[5,11]。
此外,AGs可致敏,且病死率较高,占发生者的20%左右。牛过敏时有肌肉抽搐、气喘现象,严重时可导致昏迷,皮肤较薄的地方可看到水肿;马和骡过敏后肌肉抽搐,呼吸也会加快等。此外,AGs还可导致恶心呕吐、食欲下降、黄疸等,停止给药可恢复正常。用药期过长还可能引发二重感染[12]。
因AGs残留对动物及人体存在危害,各国对常用的AGs的最大残留限量(maximum residue limit,MRL)都有严格的规定,我国农业部对几种常用的AGs也做出详细的限量规定(表1)。
表1 我国动物性食品中几种AGs的最大残留限量
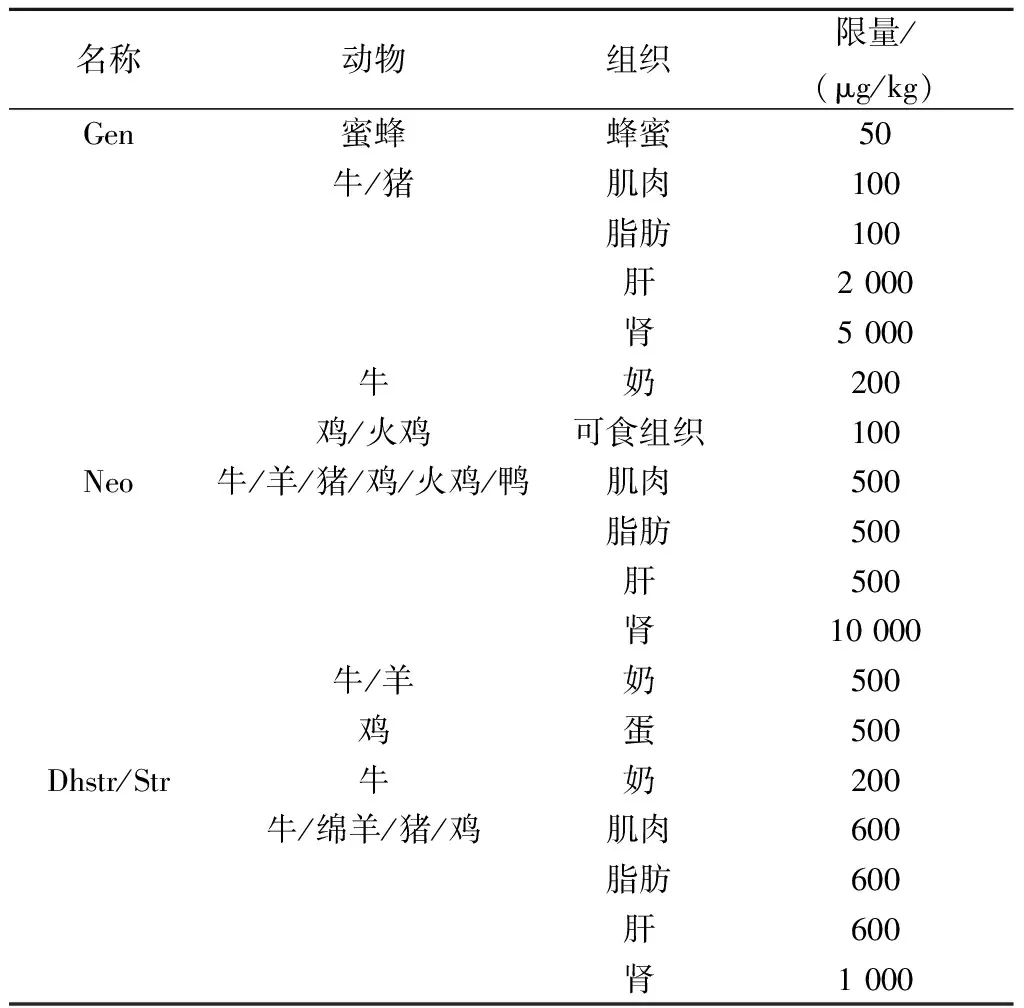
名称动物组织限量/(μg/kg)Gen蜜蜂蜂蜜50牛/猪肌肉100脂肪100肝2000肾5000牛奶200鸡/火鸡可食组织100Neo牛/羊/猪/鸡/火鸡/鸭肌肉500脂肪500肝500肾10000牛/羊奶500鸡蛋500Dhstr/Str牛奶200牛/绵羊/猪/鸡肌肉600脂肪600肝600肾1000
3 AGs残留的检测方法
灵敏的检测方法对测定动物性食品中药物残留极其重要。相关部门不仅可以利用这些方法来确保食品安全,还可以强制执行规章制度来控制药物在动物性食品中的使用。目前,AGs常用的检测方法主要包括以下几种。
3.1 微生物法
从广义上讲,微生物法是指在特定条件下,采用适当的某种微生物来检测待测物含量的方法[3]。此种方法因所需设备少、价格低、操作简单而得到广泛应用。
微生物法可以检测所有种类的AGs,并且成本低、操作简单,在残留量的筛选测试中是最佳选择。Cazedey等[13]采用微生物比浊法测定滴眼液中盐酸环丙沙星的含量,检测范围是14.0~56.0 μg/mL。王苏华等[14]在对鸡蛋中AGs进行检测时发现,最低检测限(LOD)为0.075 μg/mL,标准曲线反映的检测范围是0.15~2.40 μg/mL。随着检测方法研究的深入,该方法因只能测定生物总效价,不能对主要成分进行定量,且因其影响因素众多、灵敏度低等缺点而被取代[15]。
3.2 理化法
3.2.1 毛细管电泳法 毛细管电泳法是指在高压电场的驱动下,样品通过毛细管实现分离。Flurer[16]研究和分离了12种AGs以证实该方法的的鉴定能力,结果表明,该法具有效率高、便于自动化管理、检测范围广、检测限低等特点。但是由于其进样量较少,故制备能力较差,毛细管的直径较小,降低了其灵敏度。
3.2.2 薄层色谱(TLC)法 TLC法是一种色谱分离方法,检测前选择合适的固定相均匀涂布在平板上,然后点样,由于不同成分吸附能力有差别,样品展开后,各成分相互分离,计算它们的比移值(retention factor value,Rf),Rf=该成分移动的距离/展开及前沿移动的距离,Rf是一个常数,与物质本身的极性有关,可认为是一种物理性质,可以用来对药品进行定性检测。
杨绪明等[17]优化了庆大霉素的TLC法检测条件,并用其来检测庆大霉素发酵液,实现对几种主要成分的分离检测,然后将优化的TLC体系与微生物法结合进行检测,与高效液相色谱(HPLC)法比较后发现,二者结果一致,证明了TLC法的准确性。该法操作简单,速度快,同时能够分离多个样品,成本较低,但对于沸点较低的物质,由于其易挥发而不适用。
3.2.3 HPLC法 因具有高压、高速、高效、高灵敏度的特点在AGs的检测中得到了广泛的应用。高压即对流动相实施高压以减小阻力,高速即分析的速度比经典色谱快,高效即分离的效能较高,高灵敏度即紫外检测器的灵敏度可达0.01 ng。
链霉素和双氢链霉素在兽医领域应用十分广泛。Gremilogianni等[18]研究了离子对色谱法(ion pair chromatography,IPC)和亲水相互作用色谱(hydrophilic interaction chromatography,HILIC)在测定链霉素和双氢链霉素时的差别,HILIC法对2种物质的最低检测限均为14 μg/kg,IPC对以上2种物质的检测限分别为109 μg/kg、31 μg/kg,HILIC法的灵敏度是IPC法的80~210倍。
Kumar等[19]采用HILIC法对10种AGs进行检测,并对检测条件进行研究,发现灵敏度和分离效率最佳的是两性离子。之后,在此基础上,Kumar等[20]又对蜂蜜和肾脏中的AGs进行检测,得到蜂蜜的检测范围是2~125 μg/kg,肾脏的检测范围25~264 μg/kg。
HPLC法优点众多,但因其需要昂贵的仪器设备和熟练的操作人员,发展受到一定限制。
3.3 免疫学法
传统的色谱法不仅耗时而且操作复杂,所以在过去的几年,便宜且操作方便的免疫学分析方法被广泛用来测定AGs的含量。由于免疫学方法不需要昂贵的设备,非常适合用来进行常规检查,例如,检测40种不同的血清样本只需要3 h[21]。3.3.1 放射免疫分析(RIA)法 RIA法用同位素标记抗原,由于标记的抗原与未标记的抗原有相同的免疫原性,当加入同一体系时,会竞争结合抗体,最终达到动态平衡,已知加入的标记抗原和抗体的量(比例恒定),当加入的未标记的抗原与标记的抗原的量之和大于抗体能结合的量时,标记抗原与抗体的结合物与未标记抗原之间会产生一定的函数关系,据此可对待测物定量[22-23]。
秦燕等[24]利用RIA法检测鸡肝中的链霉素残留,得到的检测限为200 μg/kg,达到了国家限量要求。RIA法所需试验用品价格低,检测时因其速度快、操作简单、特异性强、灵敏度高而大大提高了工作效率[25]。但该方法在使用时会产生放射性污染,处理起来较为麻烦,使其应用受到限制,在AGs的检测中未得到广泛应用[26]。
3.3.2 化学发光免疫分析(CLIA)法 化学反应释放的能量被分子吸收后,使处于基态的分子跃迁至激发态,激发态不稳定,分子回到基态时会释放光能,根据光的强度来判断被测物含量的方法称为CLIA法。
邓安平等[27]采用增强的CLIA法测定血液中庆大霉素的含量,得到的检测限为3.3~11.4 ng/mL,回收率为88.2%±4.5%。该方法操作简单,有良好的特异性、灵敏度,与其他免疫学分析方法相比,具有无辐射、标记物不易失效、可全面自动化的优点,但受化学反应稳定性的影响,结果的变异系数较高,阻碍了该方法的应用。
3.3.3 酶联免疫分析(ELISA)法 ELISA法是目前AGs残留检测中应用较为广泛的一种免疫学检测方法(表2),主要采用竞争ELISA模式,即酶标抗原或抗体与待测物竞争结合包被在固相载体上的抗体或抗原,加入显色液(可被酶催化而显色的物质)后根据颜色深浅对待测物进行定性和定量。
ELISA法以其成本低、灵敏度高、特异性强等优点广泛应用于AGs残留的筛选检测,但该方法也具有稳定性、重复性差,易出现基质效应和交叉反应等缺点。
表2 ELISA法检测AGs的报道

年份检测药物作者主要内容2003Gen、Kan、NeoLoomans等[28]以新霉胺为半抗原制备多抗,建立ELISA检测方法,用于牛奶中的药物残留检测2005StrSamsonova等[29]建立了间接和直接竞争2种ELISA检测方法2010KanGal’vidis等[30]制备Kan单抗,建立间接竞争ELISA检测方法,该方法用于水溶液、牛奶和鸡蛋中的检测限为1.2ng/mL,蜂蜜中的检测限为2.5ng/mL2011NeoXu等[31]建立间接竞争ELISA用于牛奶中Neo残留的检测,检测限为0.08μg/L2013AprBurkin等[32]利用Apr单抗建立ELISA检测方法,检测限为0.015ng/mL
4 展望
随着AGs的广泛应用,AGs的副作用显现出来,不合理使用会产生药物残留,进而对人类健康造成危害,所以应严格按照其限量进行使用,并注意休药期。但生产中,在利益的驱使下,超限量使用的情况仍然存在,这就要求相关监管部门加大对抗生素类药物残留的监测力度。为了便于监管部门对食品中AGs残留进行快速精准监测,确保食品安全性,为广大消费者提供健康保障,建立完善的快速高效灵敏的AGs检测技术已刻不容缓。
在众多检测方法中,微生物法可通过半定量筛选试验对食物中的兽药残留进行分析,但无法定量;TLC法可分离多种物质、成本低,但其结果易受主观因素影响;HPLC法在药代动力学研究和其他调查研究中能够提供所需要的特异性和灵敏度,但需要昂贵的仪器设备和熟练的操作人员;快速的酶联免疫在精确测定复杂体系中AGs时非常有用,但操作过程中需要反复洗涤及孵育,在一定程度上影响了检测时间和效率。因此,构建一种操作简单、灵敏快速、高效特异的高通量检测方法将成为一个热门研究方向。
荧光偏振免疫分析(fluorescence polarization immunoassay,FPIA)法符合当今快速检测的发展方向:与HPLC法相比,不需要大型的仪器设备和专业操作人员[33],反应体系属均相系统,仅需样品、示踪剂、特异性抗体,三者混合数分钟即可测;与传统固相免疫分析法相比,此法操作更为简单、快速、成本低,省去了清洗没有结合抗原的过程,大大缩短反应时间,试验所需的时间仅为加样所需时间。除此之外,不受溶液颜色、浊度、仪器灵敏度等的影响,重现性好[34]。目前,该方法已广泛应用于一些小分子污染物的快速检测中,如头孢类药物[35]、磺胺类药物[36-37]、喹诺酮类药物[38]、真菌毒素[39]等。AGs本身无发色集团,与荧光标记物结合以后可在一定条件下发射荧光,采用FPIA法检测AGs,可根据结合荧光的抗原在特异性结合抗体前后的变化,对待测药物进行定量检测,但该技术目前仍未在食品AGs残留的检测中得到广泛应用。FPIA法虽然具有诸多优点,但仍存在一些问题,如基质的荧光性、光的散射、荧光标记抗原可能与基质结合所导致的荧光偏振值增加都可对结果造成影响[40]。所以,今后对该方法的研究将主要集中在消除或降低这几方面因素对结果的影响上,探索能够建立快速、简单、高效检测AGs的方法。
[1] 郑卫.氨基糖苷类抗生素研究的新进展[J].国外医药(抗生素分册),2005(3):101-110.
[2] 李满秀,武晓东,张海容.氨基糖苷类药物衍生荧光性质的研究及应用[J].中国抗生素杂志,2009,34(6):341-343.
[3] 刘晓冬,林洪,江洁.动物源性食品中氨基糖苷类抗生素检测技术的研究进展[J].安徽农业科学,2010,38(8):4128-4132.
[4] 诸玲玲,孟现民,张永信.氨基糖苷类药物的发展历程[J].上海医药,2011,32(7):322-326.
[5] 孙永华,于东宁.氨基糖苷类药物的临床合理使用[J].世界临床药物,2003,24(12):718-721.
[6] Tsai A,Uemura S,Johansson M,etal.The impact of aminoglycosides on the dynamics of translation elongation[J].Cell Rep,2013,3(2):497-508.
[7] Stead D A.Current methodologies for the analysis of aminoglycosides[J].Journal of Chromatography B(Biomedical Sciences and Applications),2000,747(1/2):69-93.
[8] Matthaiou D K,De Waele J,Dimopoulos G.What is new in the use of aminoglycosides in critically ill patients? [J].Intensive Care Medicine,2014,40(10):1553-1555.
[9] 于宏涛.氨基糖苷类药物的合理应用[J].黑龙江科技信息,2008,30(30):216.
[10] 周英欣.饲料中氨基糖苷类药物检测技术研究[D].北京:中国农业大学,2007.
[11] 陈江,周广青.氨基糖苷类药物的不良反应及合理用药[J].临床合理用药杂志,2013,6(5):65.
[12] 吴敏,吴洪文,李锦燊.氨基糖苷类药物的不良反应及防治对策[J].抗感染药学,2008,5(4):252-254.
[13] Cazedey E C,Salgado H R.A novel and rapid microbiological assay for ciprofloxacin hydrochloride[J].Journal of Pharmaceutical Analysis,2013,3(5):382-386.
[14] 王苏华,周杨.鸡蛋中新霉素残留的微生物学检测方法[J].中国兽药杂志,2003,37(2):16-19.
[15] 王金凤,杨化新,陈金泉,等.新技术在氨基糖苷类药物质控方面的应用和进展[J].中国药事,2014,28(4):409-412.
[16] Flurer C L.The analysis of aminoglycoside antibiotics by capillary electrophoresis[J].Journal of Pharmaceutical and Biomedical Analysis,1995,13(7):809-816.
[17] 杨绪明,张家骊,李江华,等.庆大霉素发酵液薄层色谱(TLC)分析方法研究[J].食品与生物技术学报,2008,27(5):128-133.
[18] Gremilogianni A M,Megoulas N C,Koupparis M A.Hydrophilic interaction vs ion pair liquid chromatography for the determination of streptomycin and dihydrostreptomycin residues in milk based on mass spectrometric detection[J].Journal of Chromatogr A,2010,1217(43):6646-6651.
[19] Kumar P,Rubies A,Companyó R,etal.Hydrophilic interaction chromatography for the analysis of aminoglycosides[J].Journal of Separation Science,2012,35(4):498-504.
[20] Kumar P,Rúbies A,Companyó R,etal.Determination of aminoglycoside residues in kidney and honey samples by hydrophilic interaction chromatography-tandem mass spectrometry[J].Journal of Separation Science,2012,35(20):2710-2717.
[21] Kolosova A Y,Blintsov A N,Samsonova J V,etal.Development of an enzyme-linked immunosorbent assay for gentamicin in human blood serum[J].Fresenius Journal Analytical Chemistry,1998,361(3):329-330.
[22] 霍来文,李藏珍.放射免疫分析法[J].河北医药,1984(6):371-374.
[23] 杨梅芳,李振甲.放射免疫分析技术及其临床应用[J].人民军医,1980(10):65-67.
[24] 秦燕,鲍伦军,朱柳明.鸡肝中链霉素残留的2种免疫分析法[J].华南农业大学学报,2003,24(4):88-91.
[25] 刘锐克,孙桂宽,刘湛.放射免疫分析法[J].中国药物依赖性通报,1994(3):179-182.
[26] 管华,石茂健,崔亚男.免疫分析技术研究进展[J].亚太传统医药,2007,3(10):33-36.
[27] 邓安平,杨秀岑,杨永明,等.用增强的化学发光免疫分析法测定血清中庆大霉素的含量[J].华西医科大学学报,1993,24(1):101-103.
[28] Loomans E G,Van W J,Koets M,etal.Neamin as an immunogen for the development of a generic ELISA detecting gentamicin,kanamycin,and neomycin in milk[J].Journal of Agricultural and Food Chemistry,2003,51(3):587-593.
[29] Samsonova J V,Bashkurov M L,Ivanova N L,etal.ELISA of streptomycin in buffer and milk:Effect of reagents’ structure and analysis format on assay performance[J]. Food and Agricultural Immunology,2005,16(1):47-57.
[30] Gal’vidis I A,Burkin M A.Monoclonal antibody based enzyme-linked immunosorbent assay for aminoglycoside antibiotic kanamycin in foodstuff[J].Russian Journal of Bioorganic Chemistry,2010,36(6):789-796.
[31] Xu N F,Qu C L,Ma W,etal.Development and application of one-step ELISA for the detection of neomycin in milk[J].Food Agric Immunol,2011,22(3):259-269.
[32] Burkin M,Galvidis I.Immunochemical detection of apramycin as a contaminant in tissues of edible animals[J].Food and Agricultural Immunology,2013,34(2):408-413.
[33] Wang Z H,Zhang S X,Shen J Z,etal.Analysis of sulfamethazine by fluorescence polarization immunoassay[J].Chinese Journal of Analytical Chemistry,2007,35(6):819-824.
[34] 朱广华,郑洪,鞠熀先.荧光偏振免疫分析技术的研究进展[J].分析化学,2004,32(1):102-106.
[35] Zhang J,Wang Z H,Mi T J,etal.A homogeneous fluorescence polarization immunoassay for the determination of cephalexin and cefadroxil in milk[J].Food Anal Methods,2014,7(4):879-886.
[36] Wang Z,Liang X,Wen K,etal.A highly sensitive and class-specific fluorescence polarisation assay for sulphonamides based on dih ydropteroate synthase[J].Biosensors & Bioelectronics,2015,70:1-4.
[37] 王战辉,张素霞,丁双阳,等.荧光偏振免疫分析法研究17种磺胺类药物与抗体亲和力的构效关系[J].高等学校化学学报,2008,29(6):1107-1111.
[38] 宋佩,孟萌,Sergei A E,等.荧光偏振免疫分析方法快速检测沙拉沙星残留[J].分析化学,2012,40(8):1247-1251.
[39] Maragos C M.Fluorescence polarization for mycotoxin determination[J].Mycotoxin Research,2006,22(2):96-99.
[40] 王战辉,张素霞,沈建忠,等.荧光偏振免疫分析在农药和兽药残留检测中的研究进展[J].光谱学与光谱分析,2007,27(11):2299-2306.
Review on Hazards and Detection Methods of Aminoglycoside Antibiotics
GAO Yue1,WANG Yao1,HU Xiaofei2,DENG Ruiguang2,HOU Yuze1*
(1.College of Food and Bioengineering,Henan University of Science and Technology/Henan Engineering Laboratory of Livestock Disease Diagnosing and Food Safety Testing,Luoyang 471023,China; 2.Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
Aminoglycoside drugs are a wide variety of antibiotics.They have been widely used in animal husbandry and aquaculture for this class of antibiotics which can prevent some kind of animal diseases,and promote animal growth and development.But if these drugs were used for a long term with high dose,it would cause harm to the environment because of its bad degradation ability,and it could transmit to people by food chain.More serious was the accumulation of the drug in the body,which would produce ototoxicity, kidney toxicity and other hazards to the human body.Therefore,the detection of residues of these drugs in food was essential.In this paper,the hazards and the detection methods of aminoglycoside antibiotics were reviewed,and a preliminary outlook for future development of the detection were conducted.
aminoglycosides; hazards; detection methods
2015-12-19
国家科技支撑计划项目(2014BAD13B05);公益行业(农业)科研专项(201203040);河南科技大学博士科研启动基金项目(13480062)
高 月(1990-),女,河南安阳人,在读硕士研究生,研究方向:食品安全。E-mail:gaoyueyy@126.com
*通讯作者:侯玉泽(1956-),男,河南陕县人,教授,主要从事食品质量与安全研究。E-mail:houyuze@126.com
S859.84
A
1004-3268(2016)06-0009-06

