二倍体矮牵牛花粉母细胞异常减数分裂的观察与核型分析
魏 跃,蔡善亚,董 慧,史红林,嵇 怡
(1 江苏农林职业技术学院,江苏镇江 212400;2 南京农业大学 园艺学院,南京 210095)
二倍体矮牵牛花粉母细胞异常减数分裂的观察与核型分析
魏 跃1,2,蔡善亚1,董 慧1,史红林1,嵇 怡1
(1 江苏农林职业技术学院,江苏镇江 212400;2 南京农业大学 园艺学院,南京 210095)
以夏季高温时期二倍体矮牵牛花蕾为材料,采用常规制片法,对花粉母细胞异常减数分裂进行观察并选取终变期进行染色体核型分析。结果发现:异常减数分裂主要表现为具有多核仁、二价体提前分离成单价体、赤道板外的染色体,姊妹染色单体提前分离、不均等分离,落后和丢失染色体,具有微核的三分体和四分体,中期Ⅱ纺锤体定位发生异常出现融合纺锤体和八字形纺锤体可导致2n花粉产生;矮牵牛终变期核型公式为K(2n)=2x=14=10m+4sm(2SAT),其中第1、4、5、6、7号为中部着丝粒染色体,第2号(具有随体)、3号为亚中部着丝粒染色体,染色体相对长度组成为 2n=14=4M1+10M2,核型分类为2A型。研究表明,矮牵牛异常减数分裂可导致2n花粉和不育花粉的产生,利用终变期进行核型分析具有材料丰富、二价体形态清晰不需人为配对分析等优点,为矮牵牛细胞学研究提供了新方法。
矮牵牛;花粉母细胞;减数分裂;2n花粉;核型分析
矮牵牛(PetuniahybridaVilm.)又名碧冬茄、撞羽朝颜和灵芝牡丹,为茄科矮牵牛属一年生草本花卉,性喜温暖多在夏秋季开花,花色艳丽多姿花期长具有较高观赏价值,广泛应用于广场、庭院和露天花坛等的美化装饰与绿化,被喻为“世界花坛花卉之王”。近些年来,国内研究人员对矮牵牛开展了遗传多样性[1]、组织培养[2]、多倍体[3]、基因克隆[4]和遗传转化[5]等方面研究,但对其细胞学研究相对较少,仅有蔡华等[6]利用根尖进行了核型分析并证实二倍体矮牵牛染色体数目为2n=14,魏跃等[7-8]也对二、四倍体矮牵牛花粉母细胞减数分裂过程进行过初步细胞学观察。夏季高温会降低花粉育性,研究表明小麦[9]、百合[10]不育花粉形成与花粉母细胞减数分裂小孢子和雄配子发育异常有关,但目前矮牵牛还没有相关研究;未减数分裂配子即2n配子的发生在植物界是较普遍的现象,据Veilleux[11]统计已在13个科85个种或种间杂种中发现过2n配子的产生,国内学者在大白菜[12]、小白菜[13]、草莓[14]和甜柿[15]等作物中都发现了自然产生的2n配子并对形成的细胞学机制进行了研究,但目前矮牵牛也没有类似研究报道。
本研究以夏季高温时期二倍体矮牵牛花蕾为材料,对花粉母细胞减数分裂的异常现象进行观察和分析,并对终变期染色体进行核型分析,试图从细胞学角度阐明不育花粉和2n配子形成的机制。该研究为矮牵牛2n配子的遗传研究和有性多倍化育种应用奠定细胞学基础,相关的核型分析对研究矮牵牛演化与分类、与其它物种的亲缘关系、远源杂交及遗传工程中染色体鉴别具有重要意义。
1 材料和方法
1.1 材 料
供试材料为栽培广泛的二倍体矮牵牛品种‘梦幻’,购自浙江虹越花卉有限公司,在江苏农林职业技术学院园艺试验基地塑料大棚进行栽培,2014年4月6日穴盘播种、5月2日移入育苗钵、5月24日移入直径20 cm塑料花盆,6月14日进入始花期。
1. 2 方 法
1.2.1 不育花粉和2n配子的观察统计 分别于6~7月连续阴雨天(白天温度22~25 ℃)、7月连续高温天(白天33~36 ℃)的早上11:00~12:00时,取矮牵牛花粉粒于载玻片上,参考李润芳等[16]方法用1%醋酸洋红染色5 min 后,在光学显微镜下观察计数可育花粉(染色深、大小正常、外形圆的)和不育花粉(不染色或染色浅、外形皱缩畸形)数目。不育花粉率=不育花粉数/花粉总数×100%。根据花粉直径大小[17]确认2n花粉。在显微镜下用显微测微尺测量花粉的直径并统计2n花粉数,2n花粉百分率=2n花粉数/花粉总数×100%。
1.2.2 减数分裂观察方法 晴天上午8:00至11:00每隔1 h取矮牵牛的幼小花蕾,用卡诺氏固定液(无水乙醇∶冰醋酸体积比为3∶1)固定24 h后,经90%、80%乙醇梯度脱水最后转入70%乙醇4 ℃下保存备用。用1 mol/L盐酸60 ℃恒温水浴花蕾约2~3 min,蒸馏水冲洗3~4次,从花蕾中剥取花药,用1%醋酸洋红染色常规染色、压片,火焰拷片2 s分色[18],在德国ZEISS.Imager.A1光学显微镜镜检并照相。
1.2.3 核型分析方法 分别取50个分散良好、着丝点清晰的终变期分裂相进行染色体计数,从中分别选取5个染色体完整、形态与着丝点清晰的分裂相拍照。利用Photoshop软件进行染色体图像处理分析,染色体相对长度系数按Kuo等[19]的方法划分,染色体相对长度(某染色体的长度/全组染色体平均长度×100%)、臂比、着丝粒指数、着丝粒位置及类型按照Levan等[20]的方法计算分类,核型分析采用李懋学等[21]制定的标准。根据Arano[22]的方法计算染色体不对称系数(染色体长臂总长度/染色体组总长度×100%),核型分类参照Stebbins[23]的分类标准。
2 结果与分析
2.1 花粉粒育性统计
7月连续高温时期随机取样共观察统计了570个成熟花粉粒,其中不染色或染色浅、外形皱缩畸形的花粉粒为不育花粉(图1,A),不育花粉粒82个不育率为14.39%;6~7月连续阴雨天共观察统计了620个成熟花粉粒,不育花粉29个,不育花粉率为4.68%,可见高温可导致矮牵牛产生较多不育花粉。
2.2 2n花粉统计
花粉直径大小通常被作为未减数花粉的一个判断依据[17],随机取样共观察530个成熟花粉粒,发现二倍体矮牵牛存在着少量的2n花粉(图1,B),未减数2n花粉的平均直径为(40.1±2) μm,减数n花粉平均直径约为(30.2±3) μm,未减数花粉的平均直径约为减数花粉的1.33倍,2n花粉直径明显大于减数n花粉,经统计2n花粉百分率为1.51%。
2.3 减数分裂适宜取样期
为确定适宜的减数分裂取样时期,在晴天上午8:00至11:00每隔1 h取样,每个时间段均制30个片子进行观察。表1表明早9点左右分裂相最多平均每个制片可达16.2个,此时气温约为25~29 ℃比较适宜减数分裂、花粉母细胞处于分裂旺盛期为最佳取样期;11点取样制片中的分裂相最少降低为8.1个,减数分裂活动的降低可能与此时温度过高达到30~35 ℃有关。
2.4 花粉母细胞减数分裂观察
二倍体矮牵牛花粉母细胞的减数分裂过程基本正常符合二倍体植物减数分裂的规律,但也有一些异常行为,其动态特征如下:
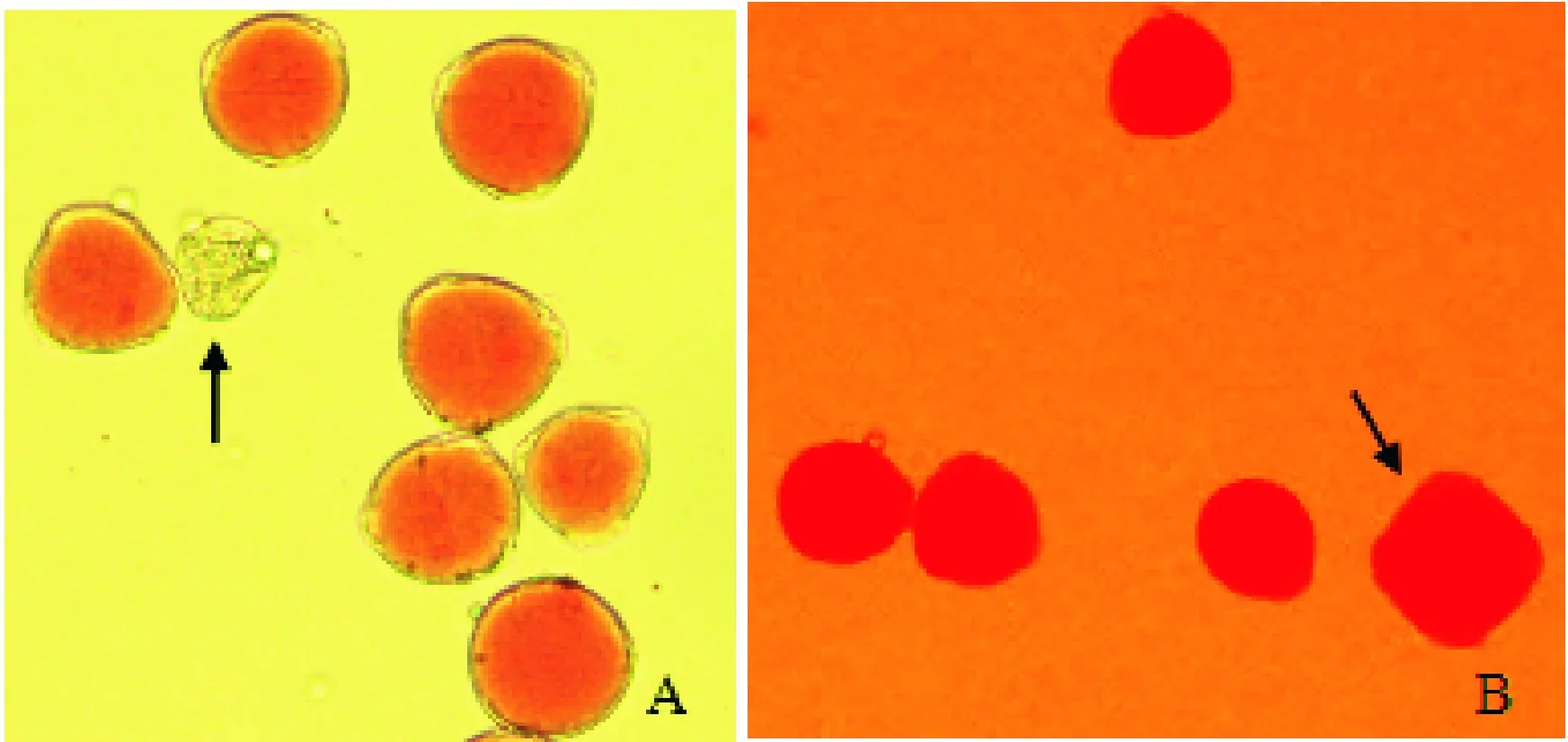
A.败育花粉粒(箭头示);B.2n花粉粒(箭头示)图1 花粉(×210)A. Aborted pollen grains (arrow showing); B. 2n pollen grains (arrow showing)Fig.1 Pollen(×210)

取样时间Samplingtime单个制片减数分裂相数Numberofmeiosiseveryslide8:0013.79:0016.210:0010.511:008.1
前期Ⅰ:除了具有一个正常核仁(图2,A),还可观察到核内具有双核仁(图2,B)。终变期大多数细胞核内分布着7个同源配对的棒状或环状二价体,也观察到少数二价体结合不紧密甚至提前分离成二个单价体(图2,C~D),异常比率为3.63%。
中期Ⅰ:配对的二价体排列于赤道板上,大多数二价体能同步分离,也有少数比率为5.51%的细胞出现二价体分离延迟(图2,E)。
后期Ⅰ:同源染色体被纺锤丝均等牵引拉向两极,少数细胞出现落后染色体(图2,F)。在后期Ⅰ拉向极区染色体的1对姊妹染色单体一般不分离,只有少数细胞中1~2对姊妹染色单体提前发生分离(图2,G~K)。其中2对姊妹染色单体有2∶2均等分离(图2,G),还有1∶3不均等分离(图2,H);1对姊妹染色单体除在同极发生分离(图2,Ⅰ),还有其中一染色单体反向牵引至另一极(图2,J)或滞留在主核外成为丢失染色体(图2,K) 这将导致不均等分离,后期Ⅰ异常比率统计为4.79%。后期Ⅰ中产生的落后、丢失和核外滞留染色体将导致四分体时期产生微核[16],染色体不均等分离则导致各种非整倍体配子形成[24]。
中期Ⅱ:此期有5.37%的细胞含有排列在赤道板外的染色体(图2,L),2个纺锤体因角度和相距程度不同,表现为4种形式:平行纺锤体(图2,L)、融合纺锤体(图2,M) 、八字形纺锤体(图2,N)和垂直纺锤体(图2,O)。
中期Ⅱ融合纺锤体的二组染色体彼此非常靠近(图2,M),末期Ⅱ时整个花粉母细胞内的4个子核呈二极分布每一极含双核,随后的四分体胞质分裂只形成1个分裂沟形成二分体(图2,P)实现了核重组,最终发育成2个2n花粉。如有落后或丢失染色体,则形成微核、1个非整倍体配子和1个2n配子(图2,Q)。
中期Ⅱ八字形纺锤体(图2,N)在后期Ⅱ分离的四组染色体将可能只牵引至三极,其中一极由于二组染色体融合,染色体数目为n=2x=14,而另两极各包含有1组染色体(图2,R)。四分体时期胞质分裂将形成三分体(图2,S),最终发育成1个2n花粉和2个n花粉。在观察到的四种形式的纺锤体中,以平行纺锤体和垂直纺锤体最为普遍,二者比率约合为87.3%,而融合纺锤体、八字形纺锤体比率之和为12.7%。
后期Ⅱ:多数细胞中姊妹染色单体正常分离移向两极,约有比率为7.75%细胞中出现落后染色体(图2,T)。

A~B.终变期(A.单核仁,B.双核仁);C~D.终变期(单箭头示二价体提前分离成2个单价体,双箭示随体);E.中期Ⅰ;F.后期Ⅰ;G.后期Ⅰ(箭头示2对姊妹染色单体2∶2均等分离);H.后期Ⅰ(箭头示2对姊妹染色单体3:1不均等分离);I.后期Ⅰ(箭头示1对姊妹染色单体分离);J.后期Ⅰ(单箭头示染色体留在主核内,双箭头示反向牵引染色体);K.后期Ⅰ(单箭头示染色体滞留在主核外,双箭头示反向牵引染色体); L.中期Ⅱ,平行纺锤体;M.融合纺锤体;N.八字形纺锤体;O.后期Ⅱ,垂直纺锤体;P.二分体;Q.1个微核+二分体;R.后期Ⅱ,两极染色体融合;S.三分体;T.后期Ⅱ;U.四分体(左右对称型);V.四分体(四面体型);W.1个微核+四分体;X.2个微核+四分体;图2 矮牵牛花粉母细胞减数分裂(×1300)A-B.Diakinesis(1.mononucleolus,2.binucleolus);C-D.Diakinesis(single arrowhead indicated bivalent dividing into two univalent in advance, double arrowhead indicated satellite); E.Metaphase Ⅰ;F.Anaphase I;G.Anaphase Ⅰ(arrowhead indicated 2:2 equational division of two pairs of sister chromatids);H.Anaphase Ⅰ(arrowhead indicated 3:1 unequal division of two pairs of sister chromatids);I.Anaphase Ⅰ(arrowhead indicated one pairs of sister chromatids dividing);J.Anaphase Ⅰ(single arrowhead indicated chromosome staying outside of the main nucleus, double arrowhead indicated reverse moving chromosome);K.Anaphase Ⅰ(single arrowhead indicated chromosome staying outside of the main nucleus, double arrowhead indicated reverse moving chromosome);L.Metaphase Ⅱ, parallel spindle; M.Fusing spindle; N.Tripolar spindle;O. Anaphase Ⅱ,Vertical spindle; P.Dyad; Q.Dyad with one micronuclei;R.Anaphase Ⅱ,Chromosomes of two polars converging; S.Triad;T. Anaphase Ⅱ;U.Tetrad(isobilateral);V.Tetrad(tetrahedral);W.Tetrad with one micronuclei;X.Tetrad with two micronucleiFig.2 Meiosis of pollen mother cells in petunia (×1 300)
四分体时期:大多数为正常四分体,主要为左右对称型(图2,U)和四面体型(图2,V)。由于落后或丢失染色体往往导致微核形成,观察到少数具有1~2个微核的四分体(图2,W~X)和1个微核的二分体(图2,Q);由于纺锤体的异常定位使后期Ⅱ的染色体牵引和末期Ⅱ的核排布方式改变,从而形成二分体(图2,P)和三分体(图2,S)。四分体时期各种异常比率总和为8.0%。
对花粉母细胞减数分裂6个时期百分率进行平均,每个时期约有5.84%的花粉母细胞减数分裂表现异常(表2)。
2.5 减数分裂终变期染色体的核型分析
二倍体矮牵牛终变期核型分析的染色体数为7对二价体,未观察到非整倍性变异现象,证实了二价体矮牵牛2n=2x=14,同时发现2号染色体具有随体(图2,C~D),这与Smith等[25]报道一致。
核型参数值见表3,终变期1~7号染色体绝对长度的变化范围在3.04~4.30 μm之间,相对长度的变化范围在12.27%~17.34%之间,相对长度系数(某染色体长度/染色体组的平均长度)[19],在0.86~1.22之间,其中第1、2对为中长染色体(M1),第3~7对为中短染色体(M2)。臂比(长臂/短臂)变化范围为1.04~2.48,着丝粒指数为28.74%~49.02%,着丝粒位置为中部着丝粒m和亚中部着丝粒sm,其中第1、4、5、6、7号为中部着丝粒染色体(m),第2、3号为亚中部着丝粒染色体(sm)。
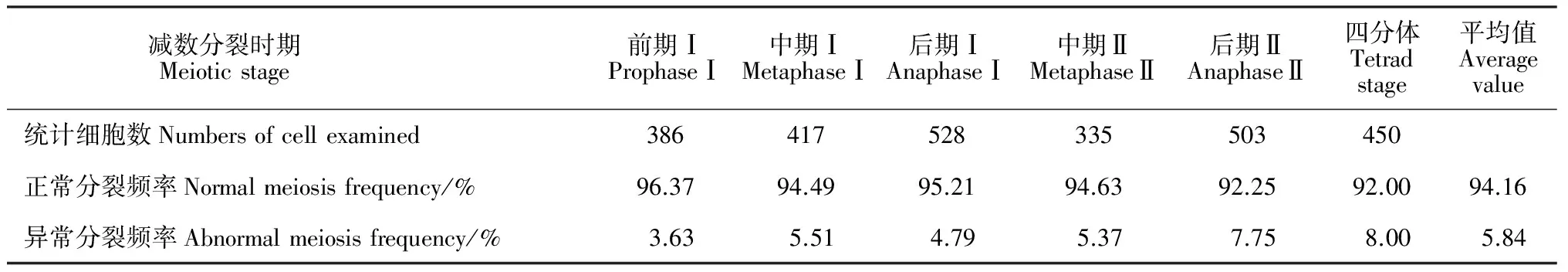
表2 减数分裂各时期染色体行为异常的花粉母细胞百分率
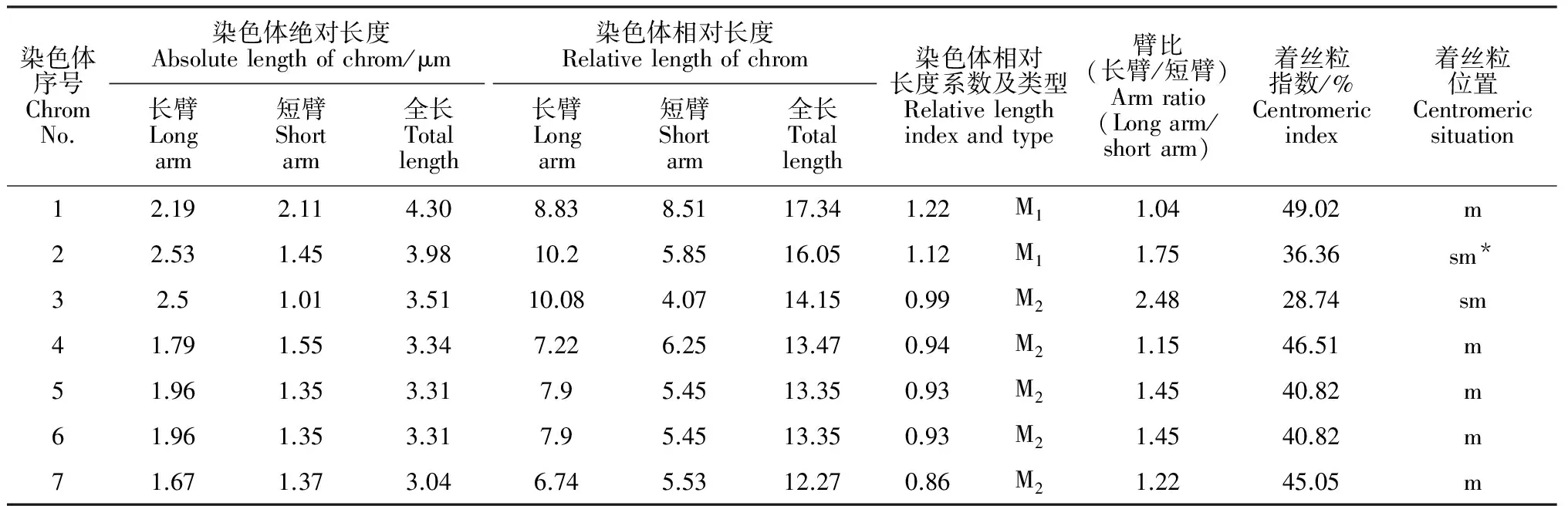
表3 花粉母细胞减数分裂终变期的核型参数
注:*表示具有随体
Note:*indicate satellite

表4 花粉母细胞减数分裂终变期的核型分析
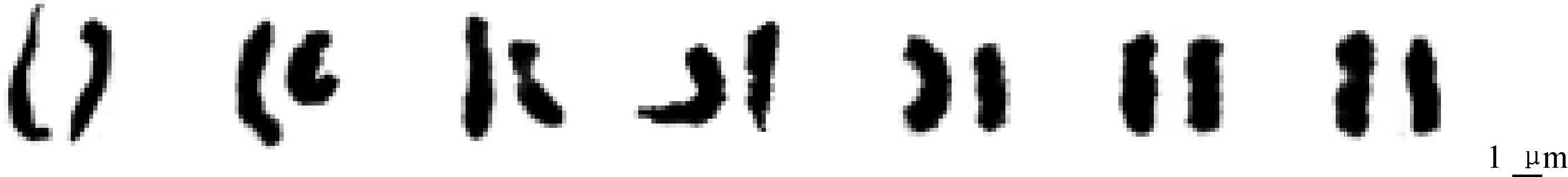
图3 减数分裂终变期分裂相及其核型图(×2 000)Fig.3 Diakinesis chromosomes and karyotype(×2 000)

图4 减数分裂终变期染色体核型模式Fig.4 Idiogram of diakinesis chromosomes
表4显示,矮牵牛终变期核型公式为K(2n)=2x=14=10m+4sm(2SAT),染色体相对长度组成为 2n=14=4M1+10M2。染色体长度比(最长/最短)比值为1.41,臂比大于2的染色体比例为14.29%,不对称系数为58.88%,为较对称类型,按照Stebbins[23]核型分类标准,矮牵牛核型分类均为2A型,属于较原始类型。减数分裂终变期分裂相及核型图见图3,染色体核型模式见图4。
3 讨 论
通过观察二倍体矮牵牛花粉母细胞减数分裂过程,发现减数分裂过程中各时期绝大多数花粉母细胞的分裂行为正常,只有5.84%细胞表现减数分裂异常,主要表现为具有多核仁、二价体提前分离成单价体、赤道板外的染色体,姊妹染色单体提前分离、不均等分离,落后染色体、丢失染色体,具有微核的二、三分体和四分体。本试验中夏季高温矮牵牛花粉不育率达到14.39%,大于花粉母细胞减数分裂平均异常率5.84%,这表明高温可能还导致雄配子体发育异常率升高、致使不育花粉进一步增加[10],这还需要试验证实。
罗双霞等[26]观察到大白菜2n-1单体在减数分裂后期Ⅰ单体染色体的姊妹染色体有提前分离现象,轩淑欣等[27]观察到同源四倍体结球甘蓝减数分裂的终变期、中期Ⅰ出现单价体,后期Ⅰ出现提前解离的姊妹染色单体,认为这导致四倍体结球甘蓝遗传不稳定、结实性较差。本试验中矮牵牛终变期也出现少数二价体结合不紧密提前分离成单价体现象,与上述作物相同,后期Ⅰ姊妹染色体提前分离与前期Ⅰ单价体提前形成有很大相关性,容易导致染色体不均等分离和各种非整倍体雄配子的产生。分子细胞学研究已证明姊妹染色体的黏着是由黏着素介导的。当细胞分裂至中后期过渡时,分离酶催化的酶解导致着丝点区域的黏着素蛋白质环开环,使黏着素从染色体上解离,启动姊妹染色体的分离[28]。张新忠等[29]通过检查辣椒小孢子母细胞减数分裂染色体行为,观察到热激或低温处理影响联会复合体的稳定性,偶线期的花粉母细胞经过热激或低温处理后联会复合体的形成受到抑制形成FDR重组核,导致终变期二价体提前解体。在高温逆境下,矮牵牛前期Ⅰ花粉母细胞的联会复合体是否也提前发生分离、产生单价体与分离酶酶解离机制等还有待于进一步研究。
根据遗传效应,可将2n配子分为FDR(first division restitution)和SDR(second division restitution)2种类型。FDR型配子具有每一对同源染色体的各1个染色单体,SDR型则拥有同源染色体其中一条染色体的2个姊妹染色单体,FDR型和SDR型配子各传递亲本70%和40%的杂合性,FDR型配子的高度杂合性决定了其高效传递亲本杂合性和上位性的能力,在育种中有较高的利用价值[30]。在大白菜[12]、小白菜[13]和草莓[14]等研究中,在减数分裂Ⅱ纺锤体定位发生异常、同源染色体发生再组合,形成的FDR型重组孢子含有整套亲本染色体组中的所有非姊妹染色单体。本试验在花粉母细胞减数分裂中期Ⅱ观察到平行、三极和融合纺锤体等类似纺锤体定位异常现象导致重组2n配子形成,故矮牵牛2n花粉也应属于FDR型,在遗传育种中具有较好的利用前景。
目前进行核型分析主要有两种方法, 一是对有丝分裂细胞(主要为根尖细胞)染色体进行核型分析,二是对处于减数分裂染色体进行核型分析,前人核型分析的研究报道绝大多数都是以根尖体细胞为材料,只有少量报道利用减数分裂进行核型分析[31-32]。利用花粉母细胞减数分裂进行矮牵牛核型分析主要有2个优点,第一矮牵牛是草本花卉花期长开花多,确定花蕾大小形态特征后,可以容易获得大量处于减数分裂的花粉母细胞,对植株生长不会产生影响;而利用有丝分裂进行核型分析,材料一般都为种子萌发后的根尖,材料稀少而且切取根尖对植株以后生长不利,对于种子量较少的试验对象不适合。第二利用体细胞有丝分裂进行染色体核型分析时,需要对核内染色体进行逐一测量、比对配对,工作量较大而且配对容易发生错误。而终变期被认为是减数分裂过程中最理想的观察染色体时期,此时二价体端化、染色单体分离收缩程度高、形态清晰,二价体之间排斥力使它们分散,便于观察。二条同源染色体处于自然配对状态,省去比对步骤避免人为配对错误。
蔡华等[6]以矮牵牛有丝分裂中期根尖细胞为材料进行核型分析,认为第1、2、4、5、6号是中部着丝粒(m型)染色体,第3、7号为亚中部着丝粒(sm型)染色体,核型公式为2n=2x=14=10m+4sm,属于“2B”型,全套染色体上均无随体。而本研究表明矮牵牛第1、4、5、6、7对为中部着丝粒染色体(m型),第2、3对为亚中部着丝粒(sm型)染色体,矮牵牛终变期核型公式虽也为2n=2x=14=10m+4sm(SAT),但属于“2A”型。本研究与蔡华对第2和第7号染色体核型有分歧,可能与减数分裂终变期和有丝分裂中期染色体的不同形态差异有关。Smith等[25]曾用荧光显微镜观察矮牵牛单倍体根尖细胞的染色体,用荧光强度变化曲线研究了着丝粒位置和随体,认为第7号染色体臂比(长臂/短臂)在1~1.22之间,2号染色体臂比1.7且具有随体。本研究第7号染色体臂比为1.22,2号染色体臂为1.75且具有随体,与Smith等[25]的结论较为接近。
[1] 吴志祥,聂京涛,曹 娴,等. 利用ISSR对矮牵牛品种遗传多样性的聚类分析[J].上海交通大学学报(农业科学版),2012,30(3):36-44.
WU Z X,NIE J T,CAO X,etal.Cluster analysis of genetic diversity ofPetuniahybridaVilm by ISSR[J].JournalofShanghaiJiaotongUniversity(Agricultural Science),2012,30(3):36-44.
[2] 代色平,包满珠.矮牵牛花药培养及植株再生研究[J].亚热带植物科学,2003,32(2):55-57.
DAI S P, BAO M Z. The anther culture and plant regeneration ofPetuniahybrida[J].SubtropicalPlantScience,2003,32(2):55-57.
[3] 魏 跃,王开冻,李洪海,等.矮牵牛四倍体的诱导及其形态特征[J].江苏农业科学,2007,3:125-127.
WEI Y,WANG K D, LI H H,etal. Induction and morphological characteristics of tetraploidPetuniahybridaVilm[J].JiangsuAgricultureofScience, 2007,3:125-127.
[4] 郭余龙,闫明旭,陈 君,等.矮牵牛PMADS9基因启动子的克隆及分析[J].植物遗传资源学报,2011, 12(2): 275-280.
GUO Y L,YAN M X,CHEN J,etal. Cloning and characterization of thePMADS9 gene promoter from petunia[J].JournalofPlantGeneticResources, 2011,12(2): 275-280.
[5] 司爱君,祝建波,李吉莲,等.F3′5′H基因的克隆、表达载体构建与矮牵牛遗传转化[J].西北农业学报, 2008,17(5):306-309,329.
SI A J,ZHU J B,LI J L,etal. Cloning and construction of plant expression vector and transformation ofFlavonoid-3′,5′-hydroxylasegene inPetuniahybrid[J].ActaAgriculturaeBoreali-OccidentalisSinica, 2008,17(5):306-309,329.
[6] 蔡 华,张 传,王业精,等.观赏花卉矮牵牛与野生牵牛花的染色体核型比较[J].生物学通报,2006,41(4):49-50
CAI H,ZHANG C,WANG Y J,etal. Karyotypic comparison between of ornamental flowers of petunia and wild morning glory[J].BiologicalBulletin, 2006,41(4):49-50.
[7] 魏 跃,张蜀宁,隋益虎,等.同源四倍体矮牵牛花粉母细胞减数分裂观察[J].西北植物学报,2008,28(9):1 742 -1 745.
WEI Y,ZHANG S N,SUI Y H,etal. Meiosis of pollen mother cells in autotetraploid petunia[J].ActaBotanicaBoreali-OccidentaliaSinica,2008,28(9):1 742-1 745.
[8] 魏 跃,王开冻,张蜀宁.矮牵牛花粉母细胞减数分裂和雄配子形成的观察[J].河南农业科学,2007,9:79-81.
WEI Y, WANG K D, ZHANG S N. Studies on the meiosis of pollen mother cell and formation of male gametophyte in Petunia[J].HenanAgricultureofScience, 2007, 9:79-81.
[9] 蒙立颖,石晓艺,胡 甘,等.K型温敏雄性不育小麦KTM3315A的鉴定及花粉败育特点的初步分析[J].中国农业大学学报,2015,20(5):1-8.
MENG L Y,SHI X Y,HU G,etal.Identification and characteristics of KTM3315A,a thermo-sensitive male sterile line withAegilopskotschyicytoplasm [J].JournalofChinaAgriculturalUniversity, 2015,20(5):1-8.
[10] 李 雪,陈丽梅,杜 捷,等.兰州百合小孢子母细胞减数分裂异常现象的观察[J].西北植物学报,2003,23(10):1 796-1 799.
LI X,CHEN L M, DU J,etal. Observations on abnormal meiosis of pollen mother cells inLiliumdavidiivar.unicolor[J].ActaBotanicaBoreali-OccidentaliaSinica, 2003,23(10):1 796-1 799.
[11] VELLLEUX R E. Diploid and polyploid gametes in crop plants[J].PlantBreedingReviews,1985,3:253-258.
[12] 张成合,申书兴,刘学崛,等.三分体形成是大白菜2n雄配子发生的主要途径[J].遗传学报, 1999,26(1):76-80.
ZHANG C H, SHEN S X, LIU X J,etal. Cytological studies of 2n gamete formation in Chinese cabbage(Brassicacamepastrisssp.pekinenssi)[J].ActaGeneticaSinica, 1999,26(1):76-80.
[13] 于旭红,陈芳莉,张蜀宁,等.普通白菜未减数雄配子形成的细胞学机制[J].西北植物学报,2010,30(9):1 799-1 803.
YU X H,CHEN F L,ZHANG S N,etal. Cytological mechanism of unreduced male gamete formation inBrassicacampestrisssp.chinensisMakino[J].ActaBotanicaBoreali-OccidentaliaSinica, 2010,30(9):1 799-1 803.
[14] 时翠平,葛会波,张成合,等.草莓未减数配子形成的细胞学研究[J].中国农业科学,2002,35(10):1 260-1 263.
SHI C P,GE H B, ZHANG C H,etal. Cytological studies on unreduced gamete formation of strawberries(Fragaria) [J].ScientiaAgriculturaSinica, 2002,35(10):1 260-1 263.
[15] 唐仙英,罗正荣. 甜柿2n花粉形成的细胞学机理研究[J].中国农业科学,2002,35(5):585-588.
TANG X Y,LUO Z R.Cytology of 2n pollen formation in nonastringent persimmon [J].ScientiaAgriculturaSinica, 2002,35(5):585-588.
[16] 李润芳,吕 松,邓瑞宁,等.荠菜的花粉母细胞减数分裂及核型分析[J].中国油料作物学报,2008,30(4):506-510.
LI R F,LÜ S, DENG R N,etal. Karyotype analysis and meiotic observations of pollen mother cells inCapsellabursa-pastorisL. Medick[J].ChineseJournalofOilCropSciences, 2008,30(4):506-510.
[17] OHKUMA T, TAO R, TAMURA M, SUGIURA A. Use of unreduced giant pollen to produce nonaploid persimmon[J].JournaloftheJapaneseSocietyforHorticulturalScience,1997,66(suppl.):134-135.
[18] 张蜀宁,张 伟,张红梅.同源四倍体萝卜花粉母细胞减数分裂[J].南京农业大学学报,2009, 32(1): 27-30.
ZHANG S N,ZHANG W,ZHANG H M.Meiosis of pollen mother cells in autotetraploid radish[J].JournalofNanjingAgriculturalUniversity, 2009, 32(1): 27-30.
[19] KUO S R,WANG T T,HUANG T C. Karyotype analysis of some formosam gymnosperms [J].Talwante, 1972, 17(1): 66-80.
[20] LEVAN A, FREDGA K, SAMDBERG A A. Nomenclacture for centromeric position on chromosomes [J].Hereditas, 1964, 52: 201-220.
[21] 李懋学,陈瑞阳.关于植物核型分析的标准化问题[J].武汉植物学研究,1985,3(4):297-302.
LI M X,CHEN R Y.A suggestion on the standardization of karyotype analysis in plants[J].JournalofWuhanBotanicalResearch, 1985,3(4):297-302.
[22] ARANO H. Cytological studies in subfamily Carduoideae (Compositae) of Japan IX [J].TheBotanicalMagazine(Tokyo),1963, 76(895):32-39.
[23] STEBBINS G L.Chromosomal Evolution in High Plants [M].London:Edward Amold Ltd., 1971: 87-90
[24] 申书兴,侯喜林,张成合.利用小孢子培养创建大白菜初级三体的研究[J].园艺学报, 2006,33(6):1 209-1 214.
SHEN S X, HOU X L, ZHANG C H. A study on obtain primary trisomics by the isolated microspore culture of autoetraploid chinese cabbage[J].ActaHorticulturaeSinica, 2006,33(6):1 209-1 214.
[25] SMITH F J, OUD J L, DEJONG J H. A standard karyogram ofPetuniahybridaHort[J].Genetica,1973,44(3): 474-484.
[26] 罗双霞,陈雪平,申书兴. 大白菜单体的鉴定及染色体行为研究[J].园艺学报,2012,39(3):561-566.
LUO S X,CHEN X P,SHEN S X. Identification of several monosomics in Chinese cabbage and observation of their chromosome behaviors[J].ActaHorticulturaeSinica,2012,39(3):561-566.
[27] 轩淑欣, 张成合, 申书兴,等.二倍体和四倍体结球甘蓝减数分裂观察[J].河北农业大学学报,2008,31(2):22-26.
XUAN S X,ZHANG C H,SHEN S X,etal. Meiotic observation of pollen mother cells in diploid and autotetraploid cabbage(Brassicaoleraceavar.capitata)[J].JournalofHebeiAgriculturalUniversity, 2008,31(2):21-26.
[28] 丁兆军,邓祝云,陶佳乙,等.染色体分离的分子机理[J].科学通报,2003,48(19):2 014-2 021.
DING Z J,DENG Z Y,TAO J Y,etal. Molecular mechanism of chromosome segregation[J].ChineseScienceBulletin, 2003, 48(19):2 014-2 021.
[29] 张新忠,刘国俭,闫立英.热激或低温诱导辣椒产生2n花粉的细胞遗传学机理[J].河北农业科学,2003,7(3):7-12.
ZHANG X Z, LIU G J, YAN L Y. Cytogenetic mechanism of 2n pollen formation induced with heat-shock or low temperature inCapsicumAnnuumL[J].JournalofHebeiAgriculturalSciences, 2003,7(3):7-12.
[30] 张正海,康向阳.植物2n配子发生及其遗传标记研究进展[J].遗传, 2006,28(1):105-109,200.
ZHANG Z H,KANG X Y. Advances in researches on genetic markers of 2n gametes[J].Hereditas, 2006,28(1):105-109,200.
[31] 赵 冬,张蜀宁,郑金双,等.中国芹花粉母细胞减数分裂终变期的核型分析[J].南京农业大学学报, 2011, 34(1): 25 -28.
ZHAO D,ZHANG S N, ZHENG J S,etal. Karyotype analysis for pollen mother cells meiosis diakinesis ofApiumgraveolensL.[J].JournalofNanjingAgriculturalUniversity, 2011,34(1): 25-28.
[32] 刁 英,佘朝文,胡中立.中国莲的偶线期核型分析[J].氨基酸和生物资源, 2006, 28(3): 34-35.
DIAO Y,SHE C W,HU Z L.Karyotype analysis for zygotene chromosome ofNelumbonucifera. [J].AminoAcids&BioticResources, 2006, 28(3): 34-35.
(编辑:潘新社)
Observations of Abnormal Meiosis and Karyotype Analysis for Pollen Mother Cells in DiploidPetuniahybridaVilm.
WEI Yue1,2, CAI Shanya1, DONG Hui1, SHI Honglin1, JI Yi1
(1 Polytechnical College of Agriculture and Forestry, Zhenjiang, Jiangsu 212400,China; 2 Horticultural College of Nanjing Agricultural University, Nanjing 210095,China)
In order to illuminate cytological mechanism of small amount 2n pollen existing in petunia, high sterile rate of petunia pollen in hot summer and explore chromosomal karyotype analysis in meiosis period, we conducted the observation of abnormal meiosis and karyotype analysis in meiosis diakinesis period by conventional plate method using flower buds of diploid petunia plant in hot summer as material. The results showed that abnormal meiosis was mainly characterized by multinucleolus, bivalent and sister chromatids dividing beforehand, chromosomes outside metaphase plate, unequal segregation, lagged chromosomes, lost chromosomes, triad and tetrad with micronucleus. These abnormal meiosis behaviour could cause the production of abortive pollen. In metaphase Ⅱ, fusing spindles, tripolar spindle in which spindle were orientated abnormally could easily lead to 2n pollen formation, the occurrence of 2n pollen percentage was 1.51% through statistics. The karyotype formula ofPetuniahybridaVilm. in meiosis diakinesie was K(2n)=2x=14=10m+4sm(SAT), which had 5 pairs of metacentric chromosomes (chrom. No.1,4,5,6,7), 2 pairs of submetacentric chromosomes(chrom. No.2 and 3, No.2 with satellite). Relative length was 2n=14=4M1+10M2, belonging to 2A type. The abnormal meiosis ofP.hybridacould lead to the production of 2n pollen and sterile pollen, the advantages of karyotype analysis in diakinesis for petunia included abundant materials, clear bivalents form and without artificial pairing analysis, etc al. It provided a new method for study on petunia cytology.
PetuniahybridaVilm.; pollen mother cells; meiosis; 2n pollen; karyotype analysis
1000-4025(2016)12-2440-08
10.7606/j.issn.1000-4025.2016.12.2440
2016-10-24;修改稿收到日期:2016-11-22
江苏省科技厅自然科学基金(BK20131243);江苏省农业科技自主创新资金(CX(15)1021);江苏农林职业技术学院科研项目(2013kj003)
魏 跃(1970-),男,博士,副教授,主要从事园艺花卉细胞学与遗传育种研究。E-mail:1069125418@qq.com
Q253;Q343.2+4
A
——矮牵牛

