氧氟沙星联合多西环素对牛源大肠杆菌突变选择窗的研究
李彦庆 , 张 震 , 孙冬冬 , 孙思超 , 刘 云
(东北农业大学动物医学学院, 黑龙江哈尔滨150030)
氧氟沙星联合多西环素对牛源大肠杆菌突变选择窗的研究
李彦庆 , 张 震 , 孙冬冬 , 孙思超 , 刘 云
(东北农业大学动物医学学院, 黑龙江哈尔滨150030)
研究氧氟沙星与多西环素联用对牛源大肠杆菌耐药突变选择窗(MSW)及防突变浓度(MPC)的影响。该试验通过琼脂二倍稀释法分别测量了氧氟沙星(OFL)及多西环素(DOX)两药单用及联合用药时牛源大肠杆菌临床分离株E.coliⅠ、E.coliⅡ。试验结果测得E.coliⅠ、E.coliⅡOFL单独用药时MSW为2.95、9.74 ,DOX单独用药时MSW为48.43、53.64,OFL及DOX联合应用时对OFL其MPC分别缩小了4倍、6倍,与8MIC浓度DOX联用时分离株E.coliⅡMSW完全关闭。研究表明,OFL和DOX联用,可以缩小各自单独用药对牛源大肠杆菌的MSW,降低其MPC,减少耐药突变菌株产生。
防耐药突变浓度; 突变选择窗; 牛源大肠杆菌; 氧氟沙星; 多西环素
大肠杆菌(E.coli)中的一些特殊血清型,对人和动物有致病性,尤其对婴儿和幼畜(禽),常引起严重腹泻和败血症。在兽医临床上随着畜牧业集约化规模化生产,当前大肠杆菌病给养殖业带来的损失越来越大,其传染性强、难于治愈、死亡率高正困扰着广大养殖户和兽医工作者。据我们对部分牛场成年母牛和犊牛死亡病例致病菌的分离与鉴定,致病性大肠杆菌的检出率占首位,大肠杆菌对犊牛泌乳牛均敏感,可引起犊牛肠炎、肺炎,泌乳牛肠炎、乳房炎、子宫炎等。而为了达到预期的治疗效果,近年来临床用药不断加大,这使得大肠杆菌抗菌谱不断扩大,多重耐药性大肠杆菌不断产生。
随着Zhao等提出的关于防细菌耐药突变选择浓度(MPC)、突变选择窗(MSW)的新假说和新理论,临床给药方案有了新的思路[1-2]。传统的治疗方案认为药物浓度在MIC以上就可以达到抑菌效果,但在实际应用中,由于细菌存在自体突变,在MIC之上会发生选择性富集[3],因此人们希望的新的治疗思路为疗效好且耐药低。当药物浓度达到MPC以上,虽然避免产生耐药突变菌株但会带来严重的副作用。现在提出不同作用机制的药物联合应用,可以降低MPC和选择指数(SI)甚至关闭 MSW,防止耐药突变株产生。国内外的一些研究已经证明这点,但这些研究大都集中在人类医学领域[4-5],在兽医领域研究领域只见猪源链球菌、鸡源沙门菌等报道[3,5],牛源大肠杆菌防耐药突变浓度的报道较少。因此本试验提出了联合用药方案,通过氧氟沙星与多西环素联合应用对牛源大肠分离E.coliⅠ、E.coliⅡ的MPC影响,研究抗菌药物联合应用对牛源大肠杆菌MPC降低、MSW缩小甚至关闭的影响,为合理指导临床用药提供理论基础。
1 材料与方法
1.1 菌株 大肠杆菌标准菌株ATCC2592,购自中国工业微生物菌种保藏管理中心;试验菌株分离自黑龙江省某牛场病死犊牛肺和肠系膜。编号为E.coliⅠ、E.coliⅡ。
1.2 抗菌药物与培养基 氧氟沙星(OFL),中国食品药品检定研究院采购;多西环素(DOX),购自北京奥拓达科技有限公司。Muller-Hinton(M-H)肉汤、M-H琼脂、脑心浸液肉汤(BHI)等培养基,购自青岛海博生物试剂有限公司。
1.3 OFL及DOX的MIC的测定 采用琼脂倍比稀释法分别测定氧氟沙星和多西环素对牛源大肠杆菌的MIC值。标准大肠杆菌ATCC 2592为质控菌株、按CLSI 2013年标准判断,并记录结果。计算MIC值。
1.4 OFL及DOX的MPC的测定
1.4.1 单药平板的配置 以各菌株的MIC为基准,采用倍比稀释法配置不同浓度的含药M-H平板,每个浓度4个平板,用以测定MPC。
1.4.2 两药平板的配置 以各药的MPC为标准呈线性20%递减至1/2MPC以简化棋盘法交叉配置含药M-H平板,每个浓度4个平板,用以测定联合MPC。
1.4.3 MPC的测定 按照Zhao[4]等方法加以改进,使菌液浓度达到3×1010CFU/mL,取0.1 mL 制备好的菌悬液均匀涂抹在各含药琼脂平板上,37 ℃恒温培养72 h,每隔 24 h观察1次细菌生长情况。培养72 h后无细菌生长的最低药物浓度定义为暂定 MPC(MPCpr)。再以MPCpr为基线,线性递减(20%)药物浓度,以不出现细菌生长的最低药物浓度为MPC。
1.4.4 联合指数测量 药物平板按照两药16倍MIC到1/4MIC交叉棋盘法配置96孔板,药物与菌液比为1:9制备好的菌悬液盖好盖子放置于37 ℃普通恒温培养箱中,孵育16~20 h判断结果。并计算FIC、SI。
2 结果
2.1 OFL与DOX单独及联合用药MIC、MPC、SI测定结果 本试验通过琼脂倍比稀释法及琼脂平板二倍稀释分别测定了OFL、DOX及复方OFL/DOX对大肠杆菌标准菌株E.coliⅠ、E.coliⅡ的MIC、MPC、SI如表1,2。

表1 OFL、DOX及复方OFL/DOX对E.coliⅠ、E.coliⅡ分离株的MIC值得测定结果

表2 OFL、DOX及复方OFL/DOX对E.coliⅠ、E.coliⅡ分离株的MPC、SI值得测定结果
2.2 OFL与DOX联用缩小牛源大肠杆菌MSW结果 OFL与DOX联用缩小牛源大肠杆菌对分离株E.coliⅠ的MSW结果显示,当DOX浓度小于MIC时,OFL的MPC没有减小,当DOX浓度增加至2MIC时,OFL的MPC降低至原来的1/4,但随着DOX浓度增加,OFL的MPC不再降低(表3)。
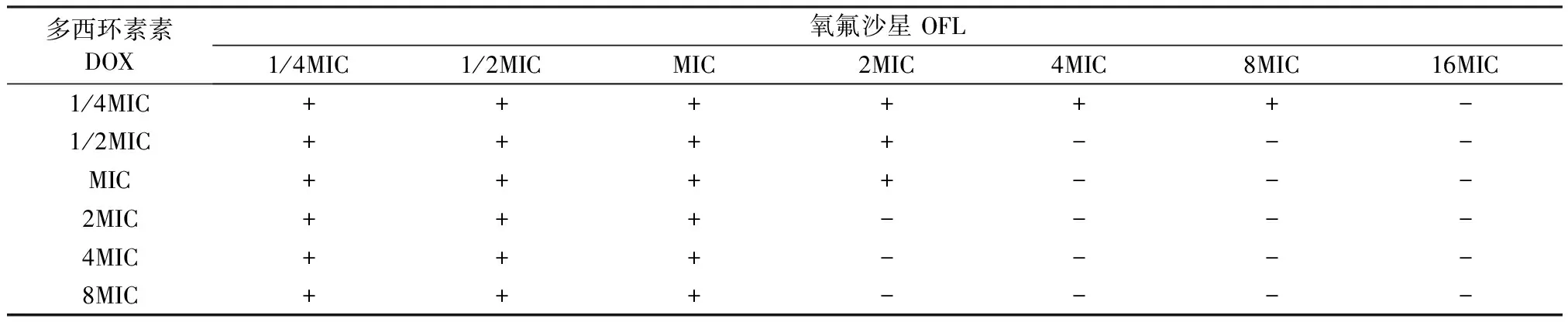
表3 OFL与DOX缩小牛源大肠杆菌分离株E.coli Ⅰ的MSW
OFL与DOX联用缩小牛源大肠杆菌对分离株E.coliⅡ的MSW结果显示,当DOX浓度小于MIC时,OFL的MPC没有减小,当DOX浓度增加至4MIC时,OFL的MPC降低至原来的1/6,当DOX浓度增加至8MIC,OFL的MSW完全关闭(表4)。
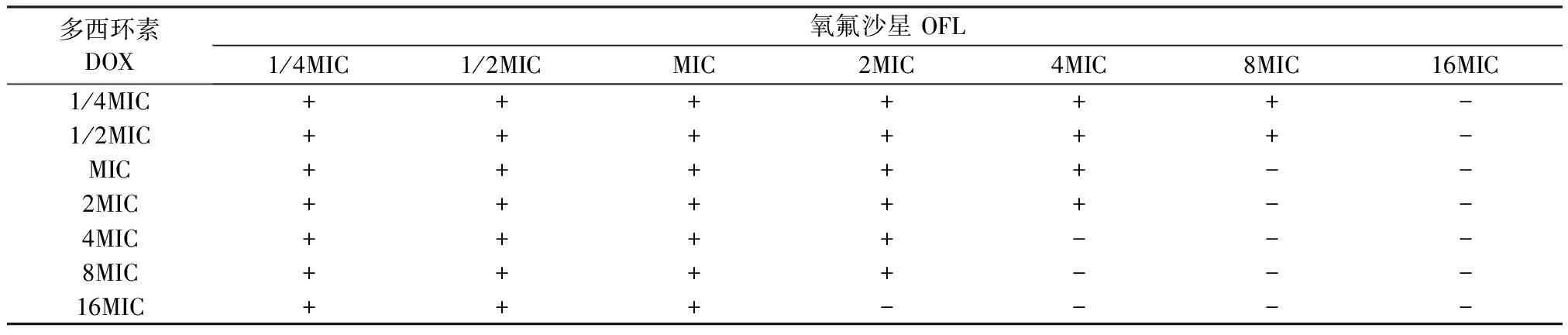
表4 OFL与DOX缩小牛源大肠杆菌分离株E.coliⅡ的MSW
“+”有耐药突变体生长;“-”无耐药突变体生长
3 讨论
目前,基于最小抑菌浓度(Minimum inhibitory concentration ,MIC)的传统治疗法案,可以抑制或杀死大部分敏感细菌,但会诱使耐药突变菌株产生和优势生长[6]。但是这种治疗方案并没有抑制细菌耐药性的产生,因此寻找一种新的治疗策略使在控制细菌感染的同时还可以防止耐药突变菌株的产生变得十分重要。随着MSW理论研究的深入,针对突变选择窗(MSW)理论,提出两种给药方案[2,7],一种是使血药浓度迅速达到MPC及以上,防止耐药突变菌株的产生,但是此方法势必要增大给药浓度带来严重的毒副作用。另一种给药方案为通过两种不同作用机制的抗菌药物的联合应用,使两种药物的MSW缩小甚至关闭,降低两种药物的MPC,既防止了耐药突变菌株的产生又维持正常的给药浓度,减少了副作用的产生,是现在最优的给药方案。并且有大量的研究已经证明两种不同作用机制的药物联合应用可以减小MPC,缩小MSW[8-9]。
本试验通过OFL对两株牛源大肠杆菌用药,研究测定OFL与DOX单独及联合用药时其MPC及MSW的变化,单独用药时MPC为其MIC的12.8、20.48倍,如果使其血药浓度达到MPC浓度以上,会对机体产生严重的毒副作用。因此,临床上加大给药浓度使其血药浓度保持在MPC以上并不可行。联合用药时,测得两种药物的MIC结合药物动力学参数,这两种药物的Cmax均小于MPC,落在MSW中,容易产生耐药突变菌株,因此应避免单独用药。
试验表明,当药物浓度低于MIC时,不能降低各药的MPC,减小各药的MSW,细菌只要克服一种选择压力即可,此时相当于单独用药,所以必须时两种药物浓度同时大于MIC值,各药物浓度大于MIC时,细菌需要克服两种选择压力才能生长,所以可以使各药的MPC成倍减小,大幅度缩小MSW,降低了突变菌株产生概率。SI可以反映限制耐药菌株突变选择的能力,SI越小,说明该药物抑制细菌突变能力越强,联合用药SI也从12.8~20.48降低到8.19~16.38,且OFL及DOX联合应用时对OFL其MPC分别缩小了4倍、6倍,与8MIC浓度DOX联用时分离株E.coliⅡ号MSW完全关闭。这表明通过选择不同作用机制的抗菌药物联合应用,可达到抗菌药物在安全剂量下,既杀灭敏感菌又限制耐药菌株富集生长的理想效果。如果想知道对于牛源大肠杆菌对于其他联合用药效果尚需进一步研究。
[1] Zhao X,Drlica K.Restricting the selection of antibiotic-resistant mutants:a general strategy derived from fluoroquinolone studies[J].Clin Infect Dis,2001,33(Suppl 3):147-156.
[2] Drlica K,Zhao X.Mutant Selection Window Hypothesis Updated[J].Clin Infect Dis,2007,44:681-8.
[3] 李淑梅,郝海玲,齐永华,等.环丙沙星联合用药缩小鸡沙门氏菌耐药突变选择窗的研究[J].中国预防兽医学报,2013,37(8):623-626.
[4] 廖卫宁.左氧氟沙星联合多西环素治疗泌尿生殖道支原体感染疗效观察[J].亚太传统医学,2012,8(5):150-151.
[5] 刘洋,徐刚,王敏,等.酒石酸泰乐菌素联合阿莫西林钠缩小猪链球菌耐药突变选择窗的研究[J].中国预防兽医学报,2010,34(1):65-67.
[6] Drlica K.A strategy for fighting antibiotic resistance[J].ASM News,2001,67 :27-33.
[7] 李朝霞,刘又宁,王睿,等.左氧氟沙星联合万古霉素缩小金黄色葡萄球菌耐药突变选择窗的初步研究。中国临床药理学与治疗学,2007,12(8):911-914.
[8] George P.Allen,Lalitagauri M.Deshpande.Determination of the mutant selection window for clindamycin,doxycycline,linezolid,moxifloxacin and trimethoprim/sulfamethoxazole against community-associated meticillin-resistant Staphylococcus aureus (MRSA)[J].International Journal of Antimicrobial Agents,2010,35:45-49.
[9] Londa J.Berghaus,Steeve Gigue’re ,Kristen Guldbech.Mutant prevention concentration and mutant selection window for 10 antimicrobial agents against Rhodococcus equi[J].Veterinary Microbiology,2013,166 :670-675.
Narrowing mutant selection window of cattle Escherichia coli by combined ofloxacin with doxycycline
LI Yan-qing, ZHANG Zhen, SUN Dong-dong, SUN Si-chao, LIU Yun
(College of veterinary medicine ,Northeast Agricultural University,Harbin 150030,China)
The study investigated whether ofloxacin and doxycycline combination was able to narrow mutant selection window (MSW) and mutant prevention concentration (MPC) of a single drug group for cattleEscherichiacoli.Based on MIC determination of the ofloxacin (OFL) and doxycycline (DOX),anti-mutation concentration and mutant selection window of both single and combined drugs for the clinically isolated strains ofE.coliⅠ andE.coliⅡ.The results showed when OFL was used alone,MSW was 2.95,and 9.74.When DOX was used alone,MSW was 48.43 and 53.64,when OFL and DOX were used together.The MPC of OFL was reduced 4-fold and 6-fold.When OFL combined with 16 MIC DOX,the standard strain MSW was completely shut down,and when OFL combined with 8 MIC DOX,MSW of the isolatedE.coliⅡwas shut down.This study shows that OFL combined with DOX reduces the MSW and MPC of the single agent for cattleE.coli,and reduce the resistance mutation.
mutant prevention concentration; mutant selection window;E.coli; ofloxacin; doxycycline
LIU Yun
2016-01-29
黑龙江省自然科学基金(面上项目)(C2015020)
李彦庆(1989-),女,硕士,主要从事临床兽医方向,E-mail:1329756276@qq.com
刘云,E-mail:abliuyun@yeah.net
R378.2+1
A
0529-6005(2016)12-0038-03

