猪瘟活疫苗(传代细胞源)对我国不同猪瘟病毒流行毒株的免疫保护研究
王 琴 , 范学政 , 徐 璐 , 赵启祖 , 张乾义 , 邹兴启 , 朱元源 , 杨劲松 , 宁宜宝
(中国兽医药品监察所 , 北京海淀100081)
猪瘟活疫苗(传代细胞源)对我国不同猪瘟病毒流行毒株的免疫保护研究
王 琴 , 范学政 , 徐 璐 , 赵启祖 , 张乾义 , 邹兴启 , 朱元源 , 杨劲松 , 宁宜宝
(中国兽医药品监察所 , 北京海淀100081)
为再评价猪瘟兔化弱毒疫苗的免疫效力,采用近年在我国流行的不同临床致病力和不同基因亚型的9株猪瘟病毒流行毒株,进行免疫保护效力研究。结果表明,以C-株疫苗种毒生产的猪瘟活疫苗(传代细胞源)对我国目前流行的猪瘟病毒高、中、低致病力毒株及不同基因亚型(1.1、2.1、2.2)流行毒株均具有坚强的保护力,且免疫猪接种不同流行毒株毒后不排毒。研究结果为我国继续使用猪瘟兔化弱毒疫苗进行全面免疫提供了重要科学依据。
猪瘟活疫苗;猪瘟病毒;基因亚型;免疫效力
猪瘟(CSF)是由猪瘟病毒(CSFV)引起的严重危害养猪业的重大传染病,是OIE规定的必需报告的疫病,也是我国《国家中长期动物疫病防治规划(2012—2020)》和《全国兽医事业发展“十二五”规划》确定优先防治和重点防范重大动物疫病之一。猪瘟兔化弱毒疫苗株(HCLV, C-Strain)是目前世界公认最安全有效的猪瘟疫苗株,先后被亚、欧和南美几十个国家广泛应用,在全球CSF防控中起着重要的作用。我国目前采取以免疫为主的综合防控策略,养猪业十分重视CSF的免疫,但是一些猪场免疫效果却不理想[1]。针对这种状况,采用近年来在我国流行的高、中、低不同致病力,分属1.1、2.1和2.2基因亚型的CSFV进行免疫攻毒保护试验,对猪瘟兔化弱毒疫苗的免疫保护力进行再评价研究,以分析其免疫有效性。
1 材料与方法
1.1 猪瘟活疫苗和标准石门强毒株 猪瘟活疫苗(STTM传代细胞源)(批号20100402),广东永顺生物制药有限公司产品,每头份病毒含量>7500个兔体感染量。标准石门强毒血毒(SM,F114,1998.6.28),国家猪瘟参考实验室保存。
1.2 试验用猪瘟流行毒株 从我国CSFV流行毒株库[2-3]中筛选9株流行株(GDGZ1/95、HeBHH1/95、HeNBY1/96、BJCY1/96、BJTX3/96、JL1/94、GXBH1/98、HeNXH2/98、FJFQ1/99),病毒滴度、致病力和E2基因分等毒株信息见表1。
1.3 试验用猪 66头30日龄长白断奶仔猪,购自河北保定山区。经检测为CSFV、PRRSV、PRV、PRRSV和PRV抗原抗体阴性。实验前进行为期一周的驱虫和观察,确保健康后使用。
1.4 试验分组 试验用猪按毒株分为9组,每组6头,其中3头免疫1头份猪瘟活疫苗,另3头不免疫,免疫14 d后用不同毒株攻毒(攻毒当日记为0dpi);第10组为石门标准强毒株攻毒对照组;第11组(3头)为疫苗免疫对照组;第12组(3头)为阴性对照组。攻毒剂量见表1。
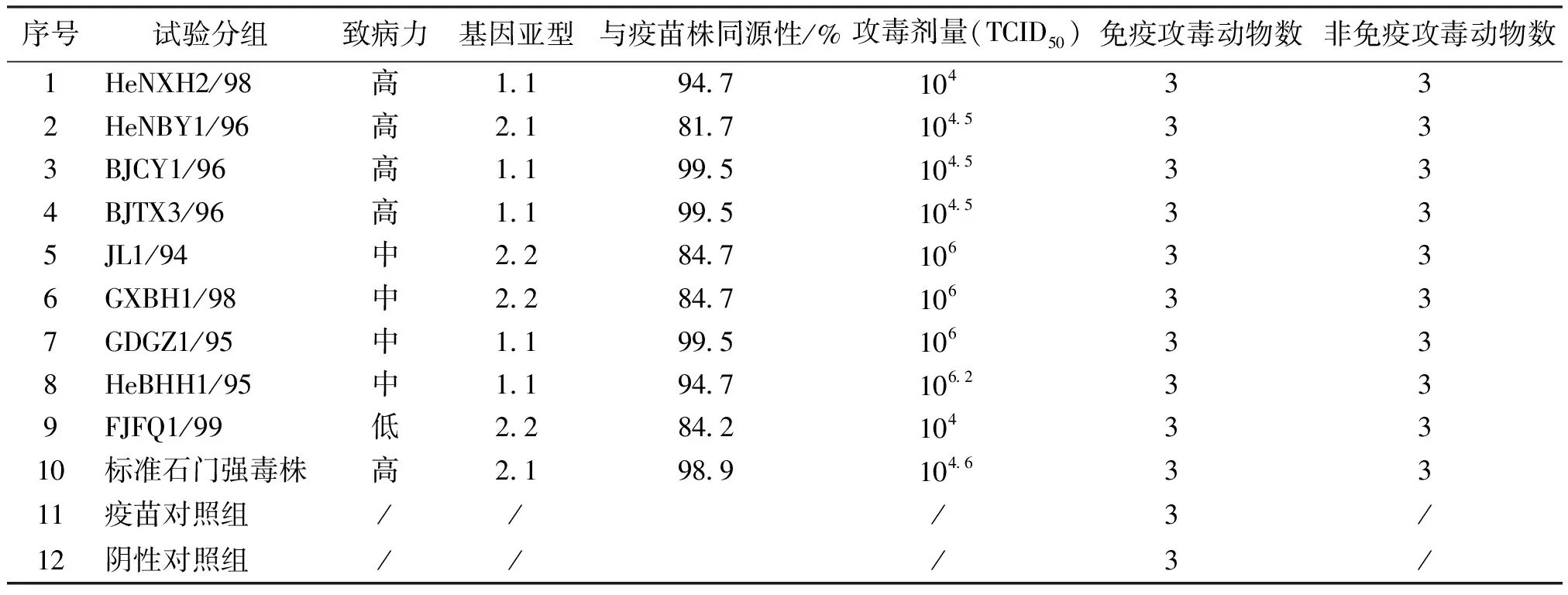
表1 试验分组及猪瘟流行毒株背景信息
1.5 体温和临床记分 免疫后每天两次对实验猪进行体温测定和临床记分[4],其数据按免疫攻毒组、疫苗对照、阴性对照、石门攻毒对照、强、中和低致病力毒株攻毒对照等7组汇总分析。
1.6 免疫攻毒后排毒检测 在免疫14 d后攻毒,每周采取1~10个免疫组和攻毒对照组猪的前腔静脉血和扁桃体,采用CSFVTaqMan-MGB荧光定量PCR鉴别方法进行病毒排毒跟踪检测[5]。
2 结果与分析
2.1 猪瘟活疫苗(传代细胞源)免疫与攻毒猪的体温和临床记分 免疫后每天两次对实验猪进行体温测定,结果免疫攻毒组、免疫组和阴性对照组体温一直保持正常,维持在(39.5±0.5) ℃;石门攻毒组攻毒后1 dpi体温明显上升,之后高热稽留41 ℃,6 dpi回落至39.5 ℃,7 dpi濒死;强致病力毒株攻毒后大部分猪与石门株相似,1 dpi体温上升,之后上升至41.5 ℃,直到21 dpi濒死前回落至39 ℃;中等致病力毒株攻毒后5 dpi体温正常,6 dpi~10 dpi呈上升趋势,11 dpi~26 dpi高热稽留41.5 ℃,濒死前回落至39.5 ℃;低致病力毒株攻毒后,除3 dpi~6 dpi一过性发热至(0.5-1) ℃,之后一直保持正常。体温曲线见中插彩版图1A。免疫攻毒、免疫和阴性对照临床记分为0,将石门攻毒组、强、中和低致病力毒株4组取其临床记分算术平均值,石门攻毒组攻毒后1 dpi小于2,2 dpi~7 dpi为4~22分,7 dpi达最高值22分;强致病力毒株对照组攻毒后0 dpi~2 dpi小于2,3 dpi~22 dpi为5~20分,10 dpi达21分;中等致病力毒株对照组攻毒后1 dpi~5 dpi少于5分,6 dpi~10 dpi为5~15分,11 dpi~26 dpi在15分,34 dpi达20分;低致病力毒株攻毒后,3 dpi~6 dpi临床记分略有增加,但皆小于3,之后一直为0分。临床记分见中插彩版图1B。
2.2 猪瘟活疫苗(传代细胞源)对流行毒株的免疫效力 猪瘟活疫苗(传代细胞源)对强、中、低致病力的9个CSFV流行毒株(不同基因亚型1.1、2.1、2.2)均具有坚强保护效力,免疫组100%保护,对标准石门强毒株也表现100%免疫效力,所有免疫猪攻毒后未表现任何临床症状。而攻毒对照组根据毒株致病力特征均表现出不同的CSF临床症状。
2.3 免疫攻毒后排毒检测 其数据按免疫攻毒组、疫苗对照、阴性对照、石门攻毒对照、强、中和低致病力CSFV攻毒对照7组汇总分析,9株流行毒株按照临床致病力高、中和低分为3组和石门株数据进行统计分析。结果10个免疫攻毒组均检测不到病毒核酸;疫苗组和阴性对照组也一直检测不到核酸;石门强毒株和强致病力毒株攻毒猪攻毒后 1 dpi~21 dpi,平均Ct值从23.21下降到14.83;中等致病力毒株从4 dpi~34 dpi,平均Ct值从26.5下降到14.65;低致病力毒株攻毒后,除3 dpiCT值为27.8,6 dpi为28.37外,从10 dpi一直到试验结束Ct值一直保持在30~33。核酸载量变化曲线见中插彩版图2。表明疫苗能够完全保护不同致病力毒株的攻击且不排毒。
3 讨论
根据对临床上分离到的流行毒株致病特性研究,证实我国CSFV高、中和低临床致病力毒株均有流行,低致病力毒株导致的种猪带毒现象,是免疫失败的原因之一[3]。CSFV分子流行病学研究对阐明病毒遗传变异特征和规律,监测现行使用疫苗的有效性,提供防控策略具有重要的科学意义。国际上根据公认的CSFV E2基因主要抗原区域序列分析将其分为3个基因型(Ⅰ型、Ⅱ型和Ⅲ型),10个基因亚型(1.1、1.2、1.3、2.1、2.2、2.3、3.1、3.2、3.3和3.4)[6]。通过对来自我国31个省728条CSFV E2基因相同区域序列分析,中国流行的CSFV分属2.1、2.2、2.3和1.1四个基因亚型,近年基因Ⅱ型成为我国优势流行毒株(73.82%),其次是基因Ⅰ型(26.18%)[7],尚未监测到基因Ⅲ型。由于C-株种毒为基因1.1亚型,有报道推测疫苗对当前流行的基因Ⅱ型毒株不能提供有效保护[8],为此本研究开展了猪瘟疫苗对我国不同流行毒株的免疫保护相关性再评价,由于9个流行毒株临床致病力不同,对猪致死剂量不同,在本研究中采用了不同攻毒感染剂量。结果表明,采用以C-株疫苗种毒生产的猪瘟活疫苗,对我国目前流行的不同基因亚型(1.1、2.1、2.2)的高、中、低不同临床致病力毒株均具有坚强的保护力,与之前的研究相符[9]。在本研究使用的攻毒株中,采用了1株与疫苗株E2基因主要抗原区域同源性最低(81.7%)的流行毒株HeNBY1/96(2.1),猪瘟活疫苗也能对其产生完全保护。尽管如此,持续开展我国CSFV流行毒株与疫苗株E2基因相同区域的监测和比较分析对监测疫苗的有效性非常重要,一旦发现与疫苗株E2基因相同区域序列同源性低于该比例的流行毒株,应及时开展疫苗株对该流行毒株的保护效力试验,以确定流行毒株是否变异至疫苗对其不能产生保护。研究还表明猪瘟活疫苗免疫抗体甚至可持续至578 dpv[10]仍然高于85%。英国AHVLA采用3.3亚型泰国CBR94/2毒株和2.1亚型UK2000毒株进行C株疫苗免疫保护试验,不但证明C株疫苗有效,还证实了C株疫苗能在早期快速(72 h)产生保护并且可以用于紧急免疫[11]。
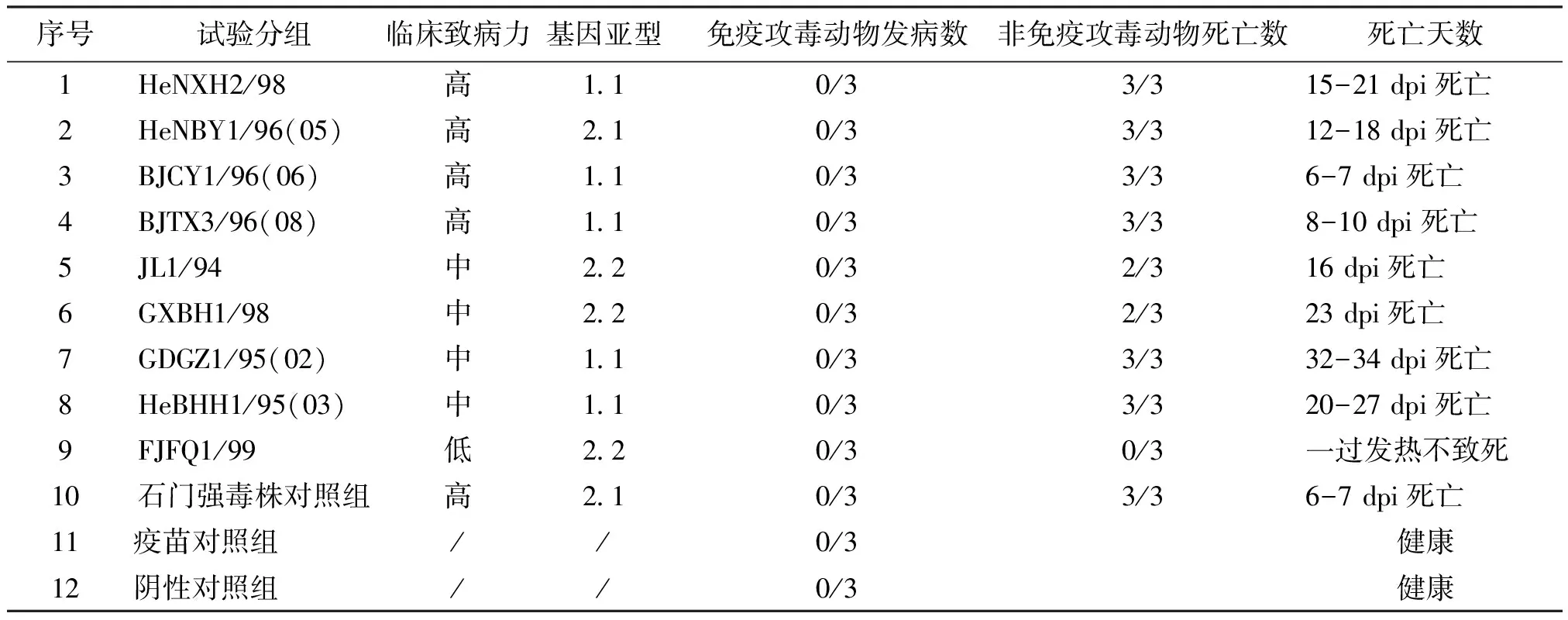
表2 猪瘟活疫苗(传代细胞源)免疫攻毒保护效果
综上,猪瘟兔化弱毒疫苗依然是一株优秀疫苗,能有效预防国际上流行的3个基因型毒株引起的CSF,澄清了CSF防控中“由野毒株变异引起免疫失败”的观点,为我国继续使用猪瘟兔化弱毒疫苗进行全面免疫提供了重要科学依据。
[1] 王泽洲,张东,张永宁,等. 四川省部分种猪场猪瘟血清抗体的检测[J]. 四川畜牧兽医,2002,29(4):24-25.
[2] 王琴,涂长春,黄保续,等. 猪瘟病毒分子流行病学信息系统的建立与应用[J]. 中国农业科学,2013,46(11):2363-2369.
[3] 王琴,宁宜宝,赵耘,等. 9株猪瘟分离毒株的致病特性[J]. 中国兽医学报,2007,27(2):145-149.
[4] Mittelholzer C,Moser C,Tratschin J-D,etal. Porcine cells persistently infected with classical swine fever virus protected from pestivirus-induced cytopathic effect[J]. Journal of general virology, 1998,79:2981-2987.
[5] 刘俊,王琴,范学政,等. 猪瘟病毒野毒株TaqMan-MGB荧光定量PCR鉴别方法的建立与应用[J]. 中国农业科学,2009,42(12):4366-4371.
[6] Paton D J,McGoldrick A,Greiser-Wilke I,etal. Genetic typing of classical swine fever virus[J]. Vet Microbiol,2000,73:137-157.
[7] 王琴,涂长春. 猪瘟[M].北京:中国农业出版社,2015.
[8] Zhang H,Leng C,Feng L,etal. A new subgenotype 2.1d isolates of classical swine fever virus in China,2014[J]. Infect,Genet Evol,2015,34:94-105.
[9] 丘惠深,朗洪武,王在时. 猪瘟兔化弱毒疫苗与我国近年猪瘟野毒的免疫保护相关性试验[J].中国兽药杂志,1997,3(3):1-3.
[10] 熊丁杰,范学政,徐璐,等. 不同剂量的猪瘟活疫苗单次免疫效果评价及疫苗存留试验[J]. 中国兽医杂志,2011,47(8):3-6.
[11] Simon P. Graham,Helen E,etal. Challenge of pigs with classical swine fever viruses after c-strain vaccination reveals remarkably rapid protection and insights into early immunity[J]. PLoS ONE,2012,7:1-9.
Evaluation of CSF live vaccine(ST cell line)Efficacy against Different Epidemic Virulent CSFV Strains from China
WANG Qin, FAN Xue-zheng, XU Lu, ZHAO Qi-zu,ZHANG Qian-yi, ZOU Xing-qi, ZHU Yuan-yuan,YANG Jing-song, NING Yi-bao
(China Institute of Veterinary Drug Control,Beijing 100081, China)
To re-evaluate the efficacy of C-strain vaccine, 9 strains with different virulence and viral subgenotypes isolated from domestic pigs in China were used to study vaccine efficacy. Pigs were vaccinated with C-Strain live vaccine, and then challenged with high, moderate and low virulence belonging to different viral subgenotypes (1.1, 2.1, 2.2) at 14 days post vaccination (dpv). The vaccine provided complete protection against clinical disease caused by all of the 9 challenge strains including standard virulent strain Shimen, as expected. Viral RNA was not detected in blood and tonsil in all vaccinated pigs but the control pigs. These results indicate that C-strain is still an outstanding vaccine. The study on C-strain vaccine efficacy provides an important scientific evidence for government to use C-strain vaccine to control CSF in China.
CSF live vaccine; CSFV; Subgenotype; Efficacy
NING Yi-bao
2016-12-12
国家“十一五”科技支撑计划(2006BAD06A18);国家“十二五”科技支撑计划(2015BAD12B04)
王琴(1962-),女,研究员,博士,主要从事猪病毒病研究,E-mail:Wq551@vip.sina.com
宁宜宝,E-mail:ningyibao@sina.com
S852.65+1
A
0529-6005(2016)12-0093-03

