阿霉素负载的Fe5C2纳米粒子在光热治疗/化疗中的研究
王丹利, 王 俊, 周治国, 杨仕平
(上海师范大学 生命与环境科学学院,上海 200234)
阿霉素负载的Fe5C2纳米粒子在光热治疗/化疗中的研究
王丹利, 王 俊, 周治国, 杨仕平
(上海师范大学 生命与环境科学学院,上海 200234)
采用高温热解法制备了粒径均一的Fe5C2磁性纳米粒子,并在其表面包裹磷脂改善纳米粒子的水溶性和稳定性,同时在纳米粒子表面负载阿霉素(DOX)实现化疗作用.阿霉素负载的Fe5C2磁性纳米粒子(Fe5C2-DOX-DSPE-mPEG),不仅具有一定的磁学性质,且具有优良的光热转化效率.细胞实验说明该纳米粒子对肿瘤细胞具有光热治疗和化疗协同治疗作用.
Fe5C2纳米粒子; 光热治疗; 化疗; 协同治疗
0 引 言
近几十年,恶性肿瘤已经成为人类生命的最大威胁之一[1].传统的化学疗法经常会引起很强的副作用或者毒性而导致一系列的后遗症.目前,刺激响应下的药物运输纳米系统因其治疗的高效性而广受关注[2-3].理想的药物运输系统应携带安全“货物”,在响应pH、温度、氧化还原电势、磁场、超声波以及光等刺激下,释放出“货物”[4].这种运输系统的特别之处在于,所携带的药物在水或血清中溶解度低.这些药物通常具有亲水壳层和疏水内部结构,其亲水壳层用于脂质和胶团的携带,其疏水内部则适合疏水“货物”的携带.这种运载系统在生理环境的稳定性还有待进一步提高.
肿瘤治疗中关键的挑战是开发具有肿瘤选择性的方法.光热疗法作为一种微创型肿瘤局部治疗方法,利用光吸收试剂在近红外光照下将光能转化为热能,继而杀死肿瘤细胞.此方法的高效性和微创性深受广大研究者的青睐[5].由于其表面等离子体共振效应,用于光热治疗的材料通常在近红外光区域具有很强的吸收,例如各类金基纳米结构(金纳米棒、纳米星、纳米笼和纳米壳等)[6-8].但是金的表面等离子共振效应受纳米结构的形貌、大小以及周围介质的介电常数影响非常大,虽有较好的升温效果,但是光热稳定性较差,而且成本也较高[9].因此,兼具较强近红外吸收和良好稳定性的光热试剂亟待开发.近年来,已开发多种具有良好稳定性的纳米光热试剂,如CT成像引导光热治疗的WO3-x纳米棒[10],磁靶向光热疗的Fe@Fe3O4纳米粒子[11]、光热治疗的Ni3C纳米晶[2]以及光热/磁热联合治疗的CoFe2O4@MnFe2O4/Polypyrrole磁性纳米复合材料[3]等.此外,碳基纳米材料,例如富勒烯、碳纳米管、石墨烯以及氧化石墨烯[12-13]等,因具有独特的理化性质也越来越多的被作为光热转化试剂.然而,因受肿瘤组织内部受热不均匀的限制,光热疗法会导致部分肿瘤组织不能根除的问题[14].而将化疗与光热疗结合起来的方法达到协同治疗的效果,有望解决这个问题.
因此,本文作者制备出了一种具有光热治疗与化疗协同治疗效果的药物运输系统.首先制备出磷脂包裹的Fe5C2纳米粒子,并在外层接上具有化疗作用的DOX.在模拟肿瘤环境下,发现当有外加激光时,因Fe5C2纳米粒子的光热作用是体系的温度升高,DOX从纳米粒子表面到溶剂的扩散速率增加,另一方面,DOX在酸性环境下也能释放出来,因此,该纳米粒子可以通过近红外激光和pH值实现药物的可控释放.该纳米粒子与4T1细胞共同孵育时,同时化疗和光热治疗作用比单一治疗(化疗或者光热治疗)时,细胞的存活率有着显著下降,体现出协同治疗效果.
1 实验部分
1.1 实验试剂与仪器
1.1.1 试 剂
十八烯(octadecene)、油胺(oleylamine)购买于Acros公司,十六烷基三甲基溴化铵(CTAB)、乙醇(ethanol)、正己烷(hexane)购买于上海国药集团化学试剂有限公司,Fe(CO)5购买于北京化学技术发展有限公司,阿霉素(DOX)购买于Aladdin公司,磷脂(DSPE-mPEG)购买于Corden公司.实验所用去离子水均由Millipore Milli-Q Plus 185仪器制备.
1.1.2 仪 器
磁力搅拌器(SZCL-2),真空干燥箱(DZG-6050SA),注射泵(KD Scientific KDS 100),Sigma高速离心机,加热套,X射线粉末衍射(XRD,RigakuDMAX2000),紫外分光光度仪(Beckman Coulter DU 730),透射电子显微镜(TEM,JEOL JEM-2011),纳米粒径电位分析仪(Malvern Nano-ZS90),傅里叶变换红外光谱(FT-IR,Nicolet iS10),超导量子干涉仪(Quantum DesignSQUID MPM S XL-7),光谱扫描多功能读数仪(Thermo Scientific VarioskanFlash),ThermoCO2培养箱,808 nm激光器(ADR-1805),光热成像仪(FLIR A300).
1.2 材料合成
1.2.1 Fe5C2纳米粒子的制备[15]
取10 mL 油胺、10 mL 1-十八烯、0.05 g CTAB置于100 mL 的三颈烧瓶中,超声混合,并加入一个磁搅拌子.向混合体系中通入氮气升温至120 ℃除水除氧15 min,仍在氮气保护下,将反应混合物升温至140 ℃,缓慢注入0.55 mL Fe(CO)5,升温至180 ℃,保持10 min,再升温至320 ℃,反应10 min.停止反应,待体系冷却至室温后加入2倍量的乙醇离心分离,并用正己烷和乙醇的混合溶液洗涤3次,分散于正己烷中.
1.2.2 磷脂包裹的Fe5C2纳米粒子的制备[16]
称取20 mg DSPE-mPEG溶解于5 mL 氯仿中,与5 mL 2 mg/mL的Fe5C2正己烷纳米粒子分散液混合,置于摇床中反应12 h,然后常温旋蒸除去有机溶剂,再在80 ℃水浴中旋蒸1 min,最后将所得纳米粒子分散于5 mL水中.
1.3 载药及药物释放实验
1.3.1 载药实验
配置10 mL 浓度为1 mg/mL 的Fe5C2-DSPE-mPEG纳米粒子PBS 溶液(pH=8.0),取10 mg DOX溶解于其中,置于摇床中反应24 h,然后透析除去未吸附的DOX,分散在20 mL pH=7.4 的磷酸缓冲溶液中.以Fe5C2-DSPE-mPEG纳米粒子为基准配置相同浓度的Fe5C2-DSPE-mPEG纳米粒子和Fe5C2-DOX-DSPE-mPEG 纳米粒子溶液,测其在490 nm 处的紫外吸收值,并根据DOX的标准曲线计算DOX 含量,以此得到DOX 的载药量.
1.3.2 药物释放实验
选取pH=5.3 和7.4 2个pH 值进行实验.每个pH 值分2组实验,一组不加光照,另外一组加光照.选取1,2,3,4,5,7,9,11,13,23,33 h 时间点测透析液的紫外吸收,光照组采用功率密度为0.5 W/cm2的808 nm处激光在1,5,9,13 h 等时间点将样品照射10 min.每个实验均平行测定3组以分析偏差.取2 mL 1 mg/mL的样品于透析袋中,并浸泡在含有8 mL相应pH值缓冲溶液的样品管中,在预先设定好的时间点,取样品管中的溶液测其在490 nm 处的紫外吸收值,并根据相应pH值下的DOX 标准曲线计算DOX 含量,以此计算DOX 的释放率.
1.4 溶液光热实验
首先配置浓度梯度为0、200、300、400、500 μg/mL 的Fe5C2-DSPE-mPEG纳米粒子水溶液,各取1 mL置于石英比色皿内,置于808 nm激光下照射10 min.其中,激光功率密度为1.5 W/cm2,激光光斑直径为1 cm,恰好能完全照到溶液上,溶液温度使用FLIR A300 红外成像仪监控.材料的光热转化效率可按公式(1)[17]计算:
(1)
其中,h为导热系数,S为容器表面积,Tmax为温度达到稳定状态时的平衡温度,Tsurr为初始温度,Qdis为溶剂吸收光产生的热量,I为808 nm 激光的功率,A808为样品在808 nm 处的吸收值.
1.5 细胞培养
实验所使用的正常小鼠成纤维细胞(L929)、小鼠乳腺癌细胞(4T1)、人肝细胞(Chang Liver)、人脑胶质瘤细胞(U-87MG)及人乳腺癌细胞(MCF-7)均购买于中国科学院上海细胞库.细胞均贴壁生长,培养所需的培养基为RPMI-1640 培养基(L929、4T1)、DMEM 培养基(MCF-7、Chang Liver)和MEM 培养基(U-87),并添加质量分数为10%的胎牛血清及1%的双抗(青霉素与链霉素)溶液.细胞均在37 ℃ 含5% CO2的条件下培养.
1.6 细胞毒性实验
实验材料分为3组,分别为Fe5C2-DSPE-mPEG 组、Fe5C2-DOX-DSPE-mPEG组及纯DOX 组,以相应培养基为溶剂,配置质量浓度梯度为0、20、50、100、200、400 μg/mL的Fe5C2-DSPE-mPEG 样品液,其他两组材料的浓度梯度以此为基准配置,其中每2组的对应浓度梯度中相同组分浓度相同,将配置好的溶液提前置于紫外灯下照射杀菌.将细胞硝化后分散计数,并将细胞密度定为50 000 cells/mL.向96 孔板每孔中加入100 μL细胞悬浮液,然后将其置于 37 ℃、饱和湿度、5% CO2培养箱中静置培养12 h.将配好的材料溶液加入到孔板中,每孔100 μL,此时,孔板中样品浓度分别减半,即浓度梯度变为0、10、25、50、100、200 μg/mL,分别培养12 和24 h.随后在每孔中加入20 μL MTT 溶液(溶剂为PBS,5 mg/mL),继续培养4 h 后将孔中溶液小心吸出,并用PBS 小心润洗2遍,然后向每孔中加入150 μL DMSO,并放入酶标仪中检测492 nm 处的吸收值.
1.7 体外治疗实验
实验使用4T1细胞铺板,待细胞完全贴壁后加入材料,孵育4 h 后不同实验组采取不同的刺激手段.各组细胞存活率以MTT法得到.
2 结果与讨论
2.1 材料的制备与表征
根据文献方法,制备出了粒径均一的Fe5C2纳米粒子(图1a),粒径约为10 nm.由X 射线粉末衍射图谱(图1b)可以看出,合成的纳米材料与粉末衍射标准联合委员会(JCPDS)卡片序号36-1248 一致,证明合成的纳米材料确为Fe5C2.从材料的磁滞回线(图1c)可以看出,Fe5C2具有较强磁性,而用磷脂将油溶性Fe5C2改为水溶性后,其饱和磁化强度从85 Am2/kg 左右降低为~35 Am2/kg.为了能够进一步进行生物实验,研究了磷脂改性后的水溶性材料在不同溶液(水和完整培养基)中的稳定性(图1d).由图1可知,放置30 d后,材料在水及完整培养基中的水动力学直径没有明显变化,分别稳定在60 nm 以及110 nm左右,表明该材料在这两种溶剂中能够长期稳定存在,有利于进一步开展细胞实验.
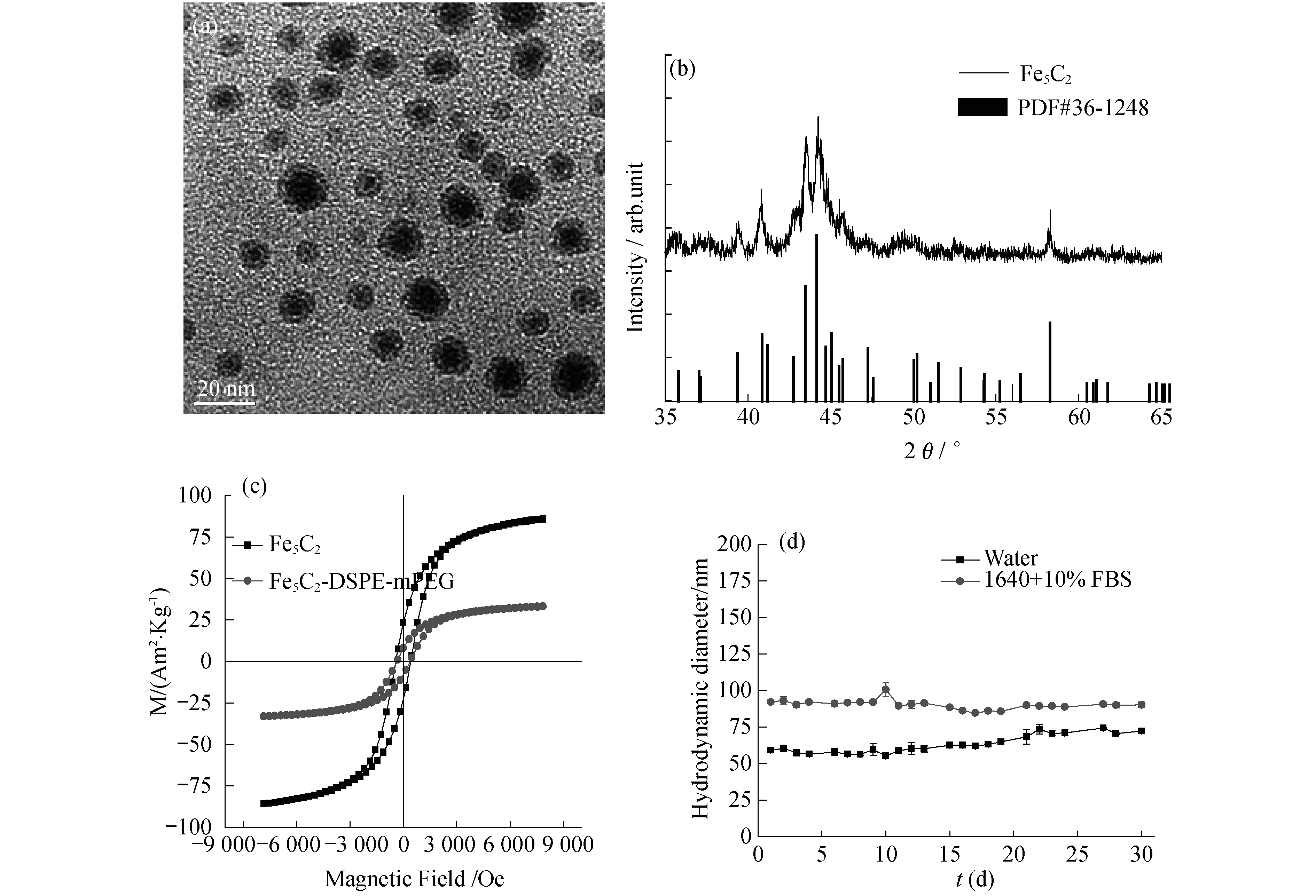
图1 (a) Fe5C2纳米粒子的TEM图;(b) Fe5C2纳米粒子的XRD图谱;(c) Fe5C2和Fe5C2-DSPE-mPEG纳米粒子的磁滞回线;(d) Fe5C2-DSPE-mPEG纳米粒子在不同溶液中的凝胶稳定性
2.2 溶液光热性能研究
在Fe5C2-DSPE-mPEG 纳米粒子的光热性质实验中,首先配置好不同浓度梯度的溶液,然后将其置于0.5 W/cm2的808 nm 激光下照射10 min,同时记录溶液的温度变化.图2显示,200 μg/mL的样品在激光下照射10 min 后,溶液温度升高约12 ℃,随着溶液浓度的增大,溶液的温度升高值随之增大,表现出很强的光热效果.根据文献报道[17]的计算方法,计算出Fe5C2-DSPE-mPEG 纳米粒子的光热转化效率约为36.7%,其转化效率很高.为了考察材料的光热稳定性,将材料置于激光下照射30 min,然后对比纳米粒子形貌的变化.由图2b,c中的TEM 对比图可以看出,材料在经过长达30 min 的激光照射后,其形貌没有发生任何变化,这足以说明材料对近红外激光具有良好的稳定性.

图2 (a)不同浓度梯度的Fe5C2-DSPE-mPEG溶液光热升温曲线图以及光照前(b)、后(c) Fe5C2-DSPE-mPEG材料的TEM图
2.3 载药及药物释放实验
从图3a的紫外吸收图谱(溶液浓度均为200 μg/mL)可以看出,负载DOX 后,溶液吸收图谱在490 nm处出现了明显的吸收峰,表明药物负载成功,根据DOX 的标准曲线计算得到负载量为150 μg DOX/mgFe5C2-DSPE-mPEG.实验表明,DOX 的释放同时受pH值与激光照射的影响(图3b).对于pH 实验组,pH=5.3的光促发效果远好于pH=7.4 的,这是因为当溶剂pH值降低时,DOX 的溶解度升高,从而加快药物的释放速率.由相同pH值条件下,光照可以进一步增大DOX的释放量,这主要是由于当有外加激光时,随溶剂温度的升高,DOX 从纳米粒子表面到溶剂的扩散速率增加.由此可知,通过协调激光照射与溶剂的pH 值,可以控制DOX 从Fe5C2-DSPE-mPEG 材料中的释放速率[18].众所周知,肿瘤部位以及细胞质中的pH 值较人体血浆中的pH 值低,这也是Fe5C2-DSPE-mPEG纳米粒子能够成为抗肿瘤药物运输载体的重要生理条件.
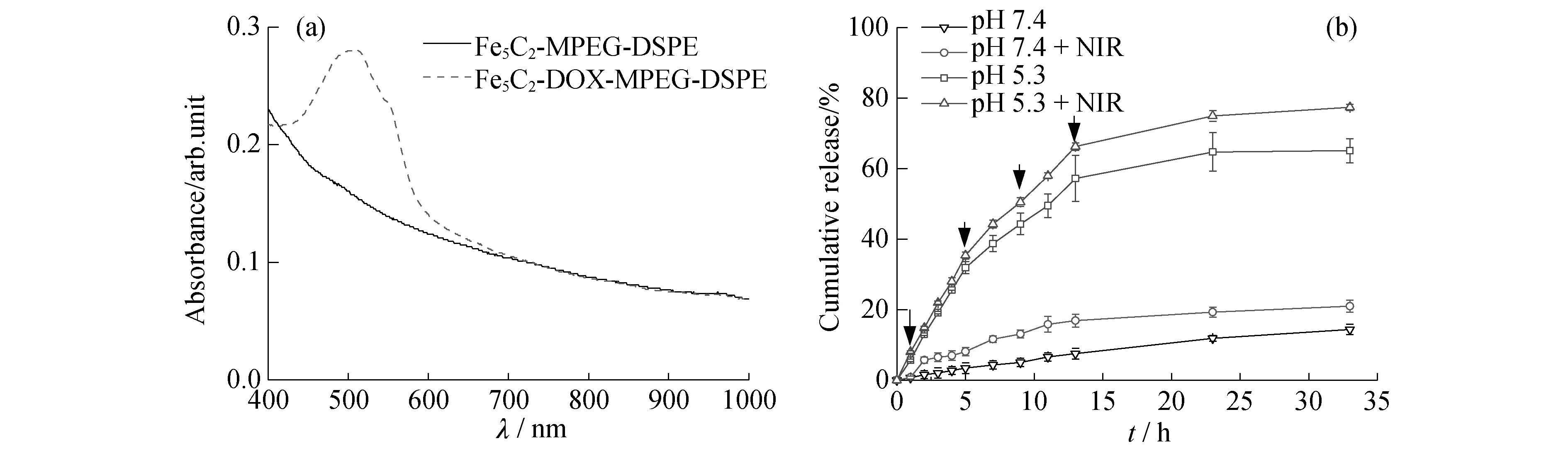
图3 (a) Fe5C2-DSPE-mPEG 载药前后紫外吸收图;(b) 不同pH值和激光照射下药物释放图
2.4 细胞毒性及细胞光热疗
首先,对比研究了Fe5C2-DSPE-mPEG 、Fe5C2-DOX-DSPE-mPEG 和纯DOX 三种材料对细胞的毒性作用.通过MTT 法研究材料对4T1细胞的毒性(图4a).由图4a可知,Fe5C2-DSPE-mPEG 纳米粒子对细胞的毒性小,当材料浓度为200 μg/mL 时,细胞存活率仍在85%以上,而相同浓度负载DOX 的材料则体现出一定的毒性,细胞存活率约为60%,这主要是因为材料中的DOX 在细胞内部部分释放出来,致使细胞死亡.
其次,进行了细胞光热疗实验,光热疗效果的研究也采用MTT 法定量分析.还选取了0.5 W/cm2的激光功率密度,改变材料的浓度梯度,由图4b可以发现,当浓度为200 μg/mL,细胞的存活率也达到了60%左右.

图4 (a) Fe5C2-DSPE-mPEG、Fe5C2-DOX-DSPE-mPEG 及DOX 对4T1 细胞的毒性;(b)不同浓度纳米粒子的光热毒性
2.5 光热/化疗协同治疗
实验选取4T1细胞进行研究,通过MTT 法评价细胞光热/化疗协同治疗的效果.Fe2C5-DSPE-mPEG 纳米粒子的浓度均为200 μg/mL,其中DOX 浓度均为30 μg/mL,808 nm 激光功率密度为0.5 W/cm2.如图5所示,对照组(纯激光、Fe5C2-DSPE-mPEG纳米粒子)细胞存活率均在90% 以上,而负载DOX 的Fe2C5-DSPE-mPEG 纳米粒子以及Fe2C5-DSPE-mPEG纳米粒子+激光组,细胞存活率为60%左右,可见单独化疗或光热疗在一定程度上也有效果,但并不显著.而协同治疗组,细胞存活率仅为10%左右,体现出了协同治疗的高效性.这主要是由于化疗药物不仅能够杀死部分细胞,更能够促进细胞对热的敏感性,从而加大热疗对细胞的刺激作用.
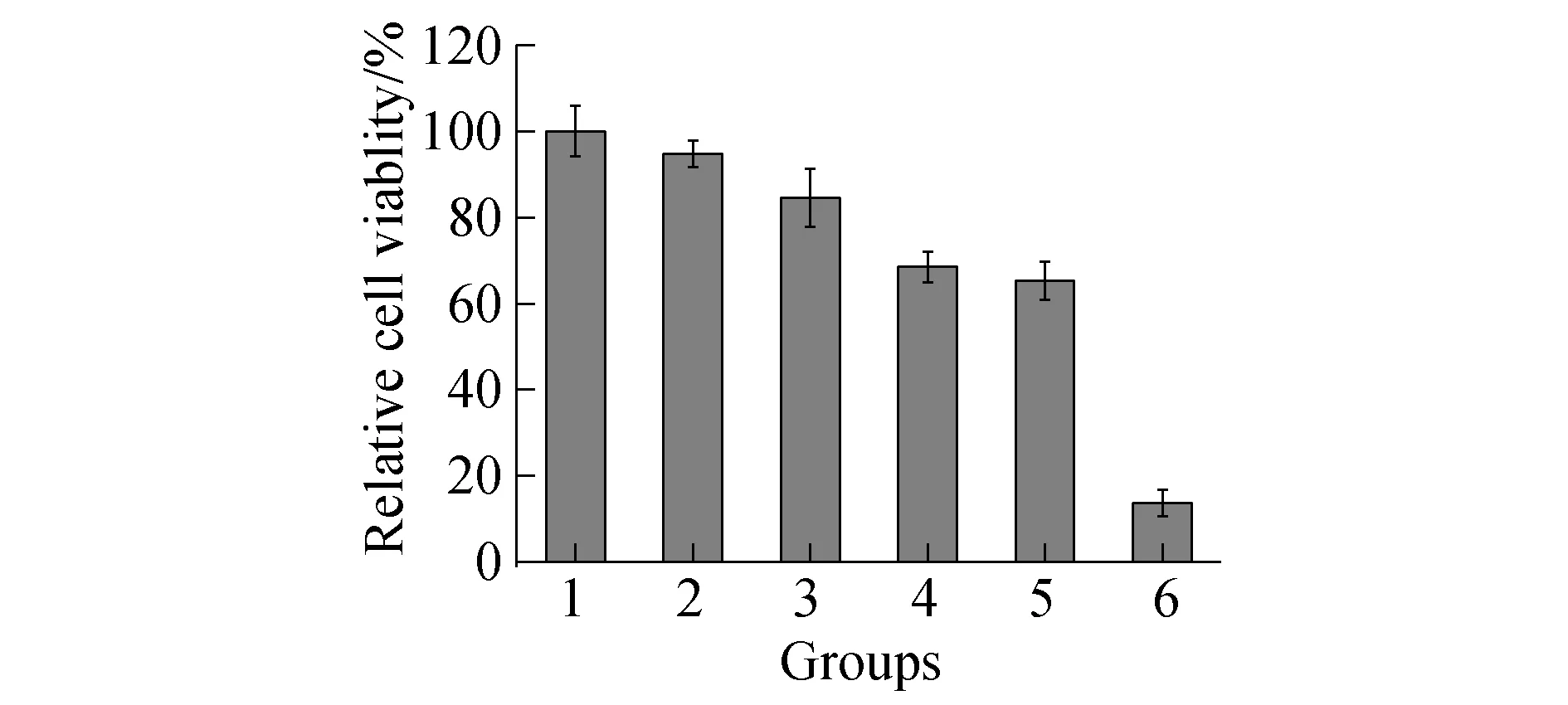
图5 不同实验组细胞存活率图(其中1~6 组分别为:Control、纯激光、Fe5C2-DSPE-mPEG纳米粒子、Fe5C2-DOX-DSPE-mPEG纳米粒子、Fe5C2-DSPE-mPEG纳米粒子+激光、Fe5C2-DOX-DSPE-mPEG纳米粒子+激光)
3 结 论
本文作者采用高温热解法制备出了10 nm 左右粒径均一的油溶性Fe5C2磁性纳米粒子,然后通过在其表面包裹磷脂改善纳米粒子的水溶性和生理稳定性,并在外部负载具有化疗作用的DOX.所制备的Fe2C5-DSPE-mPEG纳米粒子具有良好的光照稳定性和较高的光热转化效率,在负载抗肿瘤药物DOX后,由于外加激光的存在,大大加速了DOX的释放速率,所以,具有较低毒性的Fe2C5-DOX-DSPE-mPEG纳米粒子在光热疗/化疗的治疗中表现出较高的协同治疗效果.
[1] 唐劲天.磁性医药材料 [M].北京:清华大学出版社,2012.
Tang J T.Magnetic induction hyperthermia for cancer [M].Beijing:People’s Medical Publishing House,2009.
[2] Zhou Z,Wang J,Liu W,et al.PEGylated nickel carbide nanocrystals as efficient near-infrared laser induced photothermal therapy for treatment of cancer cellsinvivo[J].Nanoscale,2014,6(21):12591-12600.
[3] Wang J,Zhou Z,Wang L,et al.CoFe2O4@MnFe2O4/polypyrrole nanocomposites for in vitro photothermal/magnetothermal combined therapy [J].RSC Advances,2015,5(10):7349-7355.
[4] Chen Y W,Chen P J,Hu S H,et al.NIR-triggered synergic photo-chemothermal therapy delivered by reduced graphene oxide/carbon/mesoporous silica nanocookies [J].Advanced Functional Materials,2014,24(4):451-459.
[5] Huang X,Jain P K,El-Sayed I H,et al.Plasmonic photothermal therapy (PPTT) using gold nanoparticles [J].Lasers in Medical Science,2007,23(3):217-228.
[6] Choi W I,Kim J Y,Kang C,et al.Tumor regression in vivo by photothermal therapy based on gold-nanorod-loaded,functional nanocarriers [J].ACS Nano,2011,5(3):1995-2003.
[7] Yuan H,Fales A M,Vo-Dinh T.TAT peptide-functionalized gold nanostars:enhanced intracellular delivery and efficient NIR photothermal therapy using ultralow irradiance [J].Journal of American Chemical Society,2012,134(28):11358-11361.
[8] Wang Y,Black K C L,Luehmann H,et al.Comparison study of gold nanohexapods,nanorods,and nanocages for photothermal cancer treatment [J].ACS Nano,2013,7(3):2068-2077.
[9] Shibu E S,Hamada M,Murase N,et al.Nanomaterials formulations for photothermal and photodynamic therapy of cancer [J].Journal of Photochemistry and Photobiology C:Photochemistry Reviews,2013,15:53-72.
[10] Zhou Z,Kong B,Yu C,et al.Tungsten oxide nanorods:an efficient nanoplatform for tumor CT imaging and photothermal therapy [J].Scientific Reports,2014,4:3653.
[11] Zhou Z,Sun Y,Shen J,et al.Iron/iron oxide core/shell nanoparticles for magnetic targeting MRI and near-infrared photothermal therapy [J].Biomaterials,2014,35(26):7470-7478.
[12] Zhang H,Wu H,Wang J,et al.Graphene oxide-BaGdF5nanocomposites for multi-modal imaging and photothermal therapy [J].Biomaterials,2015,42:66-77.
[13] Sherlock S P,Tabakman S M,Xie L,et al.Photothermally enhanced drug delivery by ultrasmall multifunctional FeCo/graphitic shell nanocrystals [J].ACS Nano,2011,5(2):1505-1512.
[14] Su Y Y,Teng Z,Yao H,et al.A Multifunctional PB@mSiO2-PEG/DOX Nanoplatform for Combined Photothermal-Chemotherapy of Tumor [J].ACS Applied Materials & Interfaces,2016,8(27):17038-17046.
[15] Yu J,Yang C,Li J,et al.Multifunctional Fe5C2nanoparticles:a targeted theranostic platform for magnetic resonance imaging and photoacoustic tomography-guided photothermal therapy [J].Advanced Materials,2014,26(24):4114-4120.
[16] Tang W,Zhen Z,Yang C,et al.Fe5C2nanoparticles with high MRI contrast enhancement for tumor imaging [J].Small,2014,10(7):1245-1249.
[17] Yang C,Zhao H,Hou Y,et al.Fe5C2nanoparticles:a facile bromide-induced synthesis and as an active phase for fischer-tropsch synthesis [J].Journal of American Chemical Society,2012,134(38):15814-15821.
[18] Jeon S L,Chae M K,Jang E J,et al.Cleaved iron oxide nanoparticles as T2contrast agents for magnetic resonance imaging [J].Chemistry-A European Journal,2013,19(13):4217-4222.
(责任编辑:郁 慧,包震宇)
Study of Fe5C2nanoparticlesloaded with doxorubicin for photothermal therapy and chemotherapy
WANG Danli, WANG Jun, ZHOU Zhiguo, YANG Shiping
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
In this paper,uniform sized Fe5C2magnetic nanoparticles were synthesized bythermaldecomposition method.The materials modified with phospholipids have good solubility in water and physiological stability.Meanwhile,nanoparticles have been loaded with doxorubicin (DOX) to achieve chemotherapy.Fe2C5-DOX-DSPE-mPEG nanoparticles havenot only magnetic propertiesbut high photothermal conversion efficiency.Cell experiments showed that Fe2C5-DSPE-mPEG loaded with DOX has a significant synergistic effect ofphotothermaltherapy and chemotherapy.
Fe5C2magnetic nanoparticles; photothermal therapy; chemotherapy; synergistic therapeutic
2016-09-22
国家自然科学基金(21571130)
周治国,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:zgzhou@shnu.edu.cn;杨仕平,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:shipingy@shnu.edu.cn
O 614.81+1
A
1000-5137(2016)06-0729-07

