聚多巴胺/银复合纳米粒子的制备及其在细胞荧光/表面增强拉曼双成像中的应用
周延玲, 陈 偲, 周亚蕾, 杨晓彤, 王 丰, 杨海峰
(上海师范大学 生命与环境科学学院,上海 200234)
聚多巴胺/银复合纳米粒子的制备及其在细胞荧光/表面增强拉曼双成像中的应用
周延玲, 陈 偲, 周亚蕾, 杨晓彤, 王 丰, 杨海峰
(上海师范大学 生命与环境科学学院,上海 200234)
提出了一种具有荧光/表面增强拉曼光散射(SERS)双成像能力的复合纳米粒子的简便制备方法.在银纳米粒子表面修饰上4-巯基吡啶,再在其表面包裹聚多巴胺膜并吸附罗丹明6G.选择合适的激发波长,获得了良好的细胞的荧光和SERS图像,研究了肿瘤细胞的荧光/SERS双成像与药物释放.这种具有荧光/SERS双成像能力的复合纳米粒子有望在生物体成像和药物控释等领域获得应用.
荧光成像; 表面增强拉曼散射; 双光学纳米粒子; 细胞成像
0 引 言
功能性纳米粒子目前已广泛应用于生物传感、药物传运、疾病诊断等领域[1-3].利用具有光学活性的纳米粒子可以更直观地监测纳米粒子与生物体相互作用的过程并进行生物成像.荧光成像技术以其穿透力强、灵敏度高、重复性好、所得信息丰富等特点,在生物医学领域得到了广泛的应用[4-5].例如,应用荧光成像技术可以观察细胞内小室和转运通路,可以用来分析药物及其他试剂在细胞内的分布和转运情况.此外,细胞成像还可以提供药物在体内和体外复杂的生物环境中转运的动力学信息[6-7].尽管荧光成像技术已非常成熟,但其仍然存在一些局限性,如荧光信号易被漂白、荧光发射谱较宽、生物体内自发荧光干扰等.
除了荧光成像技术,近年来新兴的表面增强拉曼散射(SERS)成像技术是另一种有力的生物分析手段[8].产生SERS效应的前提是具有SERS能力的基底材料,即纳米尺度粗糙的金属表面.因为SERS效应只产生在纳米尺度粗糙的金属表面附近,所以SERS成像具有鲜明的局域特性,能很好地抑制背景信号的干扰.常见的SERS基底为胶体金属纳米颗粒,主要由金或银元素组成,包括球形[9]、棒形[10]等金属纳米粒子.另外,表面增强拉曼光谱具有超高灵敏度、独特的指纹光谱信息以及无损数据采集的特点,因此在环境监测、化学分析以及生物研究中越来越受到人们的关注.基于SERS的成像分析方法具有频带窄、水溶液背景弱、稳定性好、高特异性等优势,已成为生物成像领域的优良选择[1-2],利用所获得的成像信息还可以进一步对成像区域内化学物质成分、分布及变化进行整体统计和描述.但与荧光成像技术相比,SERS成像技术还存在着SERS信号相对较弱、信号采集时间相对较长的缺点.
将荧光与SERS信号整合到同一纳米粒子上,使该粒子同时具有荧光成像和SERS成像能力,便可首先用荧光进行信号快速定位和成像,再用SERS技术进行多目标跟踪和定量研究,从而同时解决这两种成像技术各自存在的问题[11-12].周军等[13]在上转换材料表面生长金纳米粒子并负载上对巯基苯甲酸,研究了该粒子的荧光/SERS信号.崔一平等[14-15]先在金/银纳米粒子表面修饰巯基苯甲酸作为SERS源,并包覆一层负载阿霉素的介孔SiO2材料,研究了复合粒子的荧光/SERS成像能力.Lee等[16]将同时有荧光和SERS成像能力的石墨烯量子点和磁性纳米粒子通过抗体/抗原联接,形成了三明治结构复合粒子,用于基于荧光/SERS成像的免疫研究.但目前多数具有双成像能力的纳米粒子制备过程较为复杂、拉曼信号分子容易泄露,这极大地影响了拉曼信号的强度,也给拉曼定量带来了困难[14-15].Lee等[17]利用含有邻苯二酚基和氨基的小分子多巴胺 (DA) 作为仿生贻贝黏附蛋白的前驱体,开发了新型仿生材料聚多巴胺(PDA).在室温、弱碱性条件下,DA及其衍生物会被溶解氧氧化,自发聚合形成PDA.PDA可以黏附在几乎所有材料的表面,形成均匀的纳米薄膜.根据PDA的反应性还可以进一步对材料分子进行修饰,已有研究证实仿生 PDA 膜具有优良的生物相容性[18-20].
本文作者提出了一种具有荧光/SERS双成像能力的复合纳米粒子的简便制备方法.首先用银纳米粒子作为SERS增强基底,与拉曼分子作用产生SERS信号;之后利用DA的自聚合性和PDA的粘附性,在银粒子表面包覆一层PDA薄膜并吸附荧光染料作为荧光信号源.通过选择合适的激发波长,避免SERS信号和荧光信号的相互干扰,获得了良好的细胞的荧光和SERS图像.
1 实 验
1.1 试 剂
实验所用试剂包括:盐酸多巴胺(DA)、三羟甲基氨基甲烷(Tris·HCl)、 4-巯基吡啶(4-Mpy)购于阿拉丁试剂(上海)有限公司;硝酸银(AgNO3)、柠檬酸三钠(Na3Cit)、罗丹明6G(R6G),Hoechst33342购于西格玛奥德里奇(上海)贸易有限公司;无水乙醇购于上海润捷化学试剂公司.
所有的试剂均为分析纯,且使用前未经进一步纯化.所用实验均用超纯水(电阻率为18.2 MΩ·cm).24孔板配套用石英材质的细胞爬片(直径为14 mm,厚度为0.17 mm).
Tris-HCl 缓冲溶液的配制:配制物质的量浓度为1×10-3mol/L的Tris 溶液,用稀 HCl溶液将溶液 pH 值调至8.5.
1.2 仪 器
实验过程中所制备的银纳米粒子以及具有双光学成像能力的复合纳米粒子的消光光谱用紫外-可见分光光度计(UV-7504PC,上海欣茂仪器有限公司)测定;粒子形貌和微观结构由透射电子显微镜(TEM,JEM-2000EXII,日本日立仪器有限公司)测定;粒子粒径由动态光散射仪(Zetasizer Nano ZS ZEN3600,英国马尔文仪器有限公司)测定;粒子的荧光信号由荧光光谱仪(F-2500 HITACHI)和激光共聚焦荧光显微镜(SP5 Ⅱ,Leica Microsystems)测定;SERS光谱成像实验由拉曼光谱仪(LabRAM XploRA,HORIBA)测定,激发波长为633 nm,功率为10 mW;粒子的SERS光谱图由便携式拉曼仪(ProTT-EZRaman-A2,Enwave USA)测定得到,该拉曼光谱仪的激发光源是由波长为785 nm 的二极管激光器组成,其最大可调功率为300 mW.缓冲液的酸度由pH计(PHS-3C,上海精密仪器有限公司)测定.
1.3 荧光/SERS双响应复合纳米粒子(Ag(Mpy)/PDA(R6G) NPs)的制备
银溶胶的合成:参照Lee[21]的方法制备银溶胶,称量0.0255 g AgNO3装入一洁净的250 mL锥形瓶中,用150 mL去离子水溶解,加热煮沸10 min 后缓慢加入3 mL质量分数为1% 的柠檬酸三钠溶液,继续煮沸30 min.反应结束后,定容至 150 mL.
SERS响应复合纳米粒子的制备:先取500 μL 4-巯基吡啶(1×10-4mol)与4.5 mL 银溶胶混合,震荡过夜,得到具有SERS响应的复合纳米粒子(Ag(Mpy) NPs);之后再将5 mL的Ag(Mpy) NPs加入到10 mL多巴胺的Tris缓冲溶液中,超声条件下,持续反应2 h,多次洗涤离心,便可以得到PDA修饰的SERS响应复合纳米粒子,记为Ag(Mpy)/PDAxNPs.其中x为合成时多巴胺的质量浓度(x=0.10,0.25,0.50和0.75 mg/mL)荧光/SERS双响应复合纳米粒子的制备:将4.5 mL Ag(Mpy)/PDAxNPs与500 μL荧光染料R6G (1×10-4mol) 混合,震荡过夜后,离心洗涤数次,便可得到荧光/SERS双响应复合纳米粒子,记为Ag(Mpy)/PDAx(R6G) NPs,如图1所示.
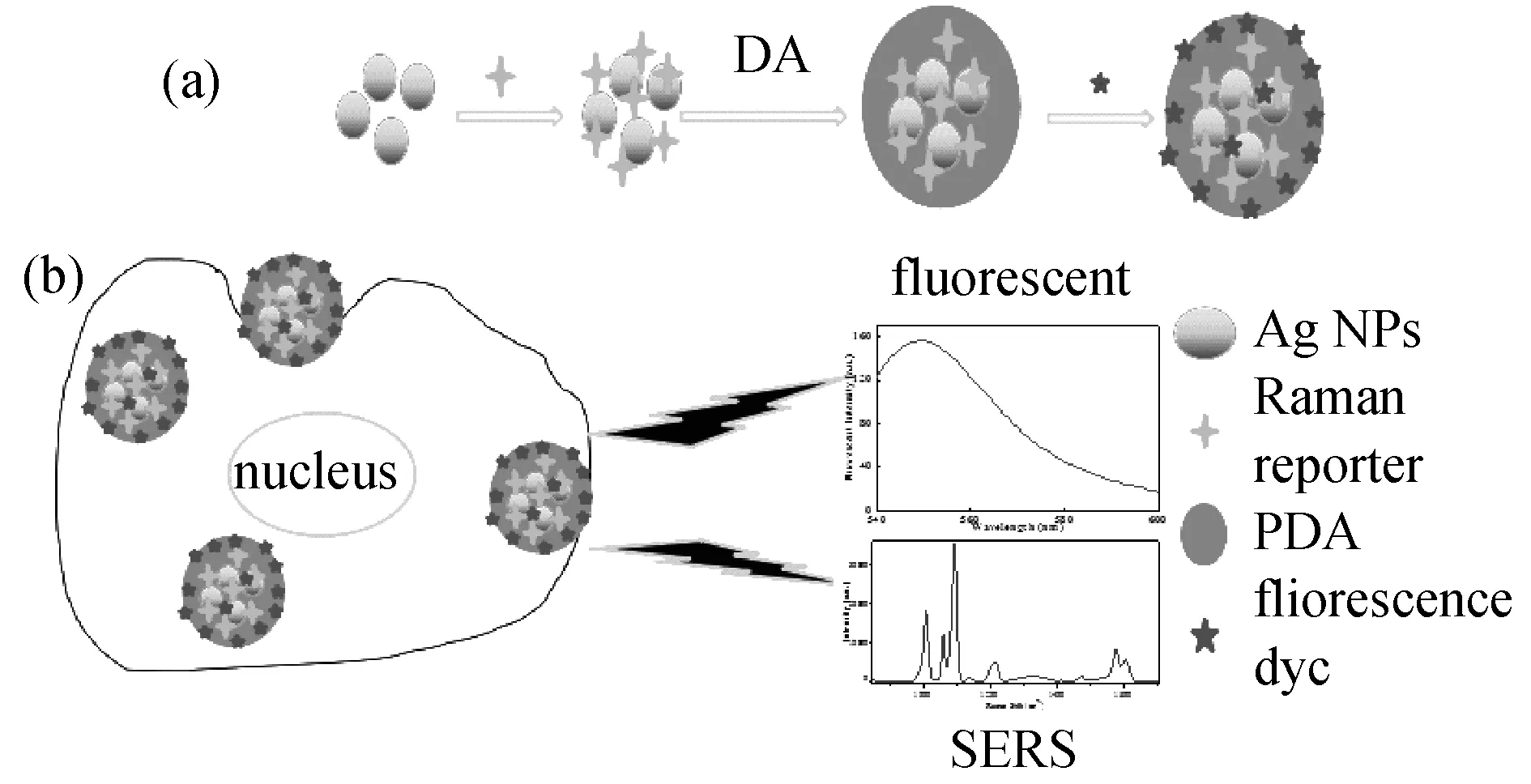
图1 具有荧光/SERS双成像能力的Ag(Mpy)/PDAx(R6G)复合纳米粒子的制备.(a)细胞成像;(b)示意图
1.4 人结肠癌(HT-29)细胞的培养
HT-29细胞购自中国科学院上海细胞库.细胞培养液为体积分数是10%的胎牛血清及100 IU/mL青霉素和100 mg/mL链霉素的DMEM培养基.细胞培养条件为体积分数为5% CO2,培养温度恒定在37 ℃,每3~4 d用胰酶酶解传代.
细胞成像实验中,将1×105mL-1的胰酶酶解后单个悬浮HT-29细胞接种于放置有细胞爬片的二十四孔板中,每孔500 mL,培养5 d,期间更换新鲜培养基一次.实验时加入成像纳米粒子悬液(体积比为:V培养基∶V粒子悬液=6∶1).继续培养5 h后,弃掉孔板中的培养液,用1×PBS缓冲液轻轻冲洗爬片上的HT-29细胞2次;再用Hoechst33342溶液(5 μg/mL)进行细胞核染色15 min,用1×PBS缓冲液轻轻洗涤爬片上的HT-29细胞3次;再用质量分数为2%的多聚甲醛溶液固定,最后将细胞爬片取出放置于载玻片上进行激光共聚焦成像和SERS成像.实验中用未加入复合纳米粒子的HT-29细胞作为对照组.
活细胞代谢物还原剂3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)实验中,将HT-29细胞(104mL-1)接种于96孔板(100 μL/孔)培养24 h后分别加入不同浓度的复合纳米粒子.培养48 h后,每孔加入50 μL稀释5倍的MTT溶液,继续培养4 h后,吸去孔中培养液,每孔加入150 μL 二甲基亚砜(DMSO).用酶标仪读取490 nm处的吸收值.实验中用未加入复合纳米粒子的HT-29细胞作为对照组.
2 结果与讨论
2.1 荧光/SERS双响应复合纳米粒子的制备与表征

图2 Ag NPs(a)、Ag(Mpy)/PDA0.10(R6G) NPs(b)和Ag(Mpy)/PDA0.25(R6G) NPs (c)的TEM图
制备的双响应复合纳米粒子以Ag(Mpy) NPs为SERS信号源,PDA为粘附层,在其上吸附的R6G为荧光信号源.图2为Ag NPs和Ag(Mpy)/PDA NPs的透射电子显微镜(TEM)图,由图2可见Ag NPs粒径约为35~50 nm;在包覆PDA的过程中,单个的Ag纳米粒子发生聚集.图3(a)为银溶胶的紫外-可见吸收光谱图,由图3可见银溶胶的表面等离子共振峰(SPR)位于408 nm左右;包覆上PDA粘附层之后,SPR峰发生红移且在可见光范围内出现吸收,这可能是PDA粘附层使得Ag NPs所处环境介电常数增大[22],也可能是银纳米粒子发生了聚集所导致,该解释与图2(b),(c)的TEM结果相对应.图3(b)为Ag NPs及Ag(Mpy)/PDAx(R6G)复合纳米粒子粒径的动态光散射图,与上述结果一致,间接证明PDA成功包覆在银粒子表面;且随着DA浓度的增加,形成的复合纳米粒子的聚集程度逐渐增大.
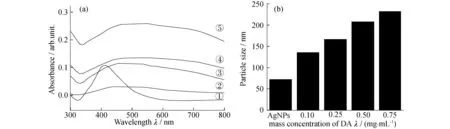
图3 Ag NPs(1)和制备的Ag(Mpy)/PDAx(R6G)复合纳米粒子(2~5分别对应x=0.10,0.25,0.50 及0.75 mg/mL)的(a)UV-vis谱图及(b)粒子粒径
2.2 复合纳米粒子的SERS及荧光特性
Ag(Mpy) NPs的SERS光谱如图4所示,在1 010、1 096、1 609、1 579、1 062 cm-1等处观察到了4-Mpy的典型SERS峰,证明了4-Mpy在Ag NPs上成功修饰.复合纳米粒子的SERS光谱与Ag(Mpy)粒子的SERS光谱相比较,其强度降低,间接说明PDA粘附层包覆成功.当DA浓度较低时复合纳米粒子的SERS信号较弱,这可能是由于PDA是一种类黑色素物质[23],具有吸光作用,阻碍了光的散射效应.而随着DA浓度的增加,复合纳米粒子的SERS信号先逐渐增强后逐渐减弱,这可能是由于复合纳米粒子聚集程度逐渐增大,产生了更多的hot spot使SERS信号又有所增强;但随着聚集程度的进一步增加,内层的SERS信号被更多的PDA所吸收.图5是复合纳米粒子的荧光光谱图,可见PDA能成功吸附荧光染料,并且一定程度上阻碍了R6G与Ag NPs间的能量转移,避免了R6G荧光信号的完全淬灭.但是随着PDA粘附层厚度的增加,双模式纳米粒子的荧光信号却逐渐降低,这同样是由于PDA这种类黑色素物质具有吸光作用,导致R6G的信号强度随PDA量的增加而减弱.通过选择不同的激发波长,该复合纳米粒子能分别产生较强的SERS及荧光信号,且不产生相互干扰.综合考虑复合纳米粒子的SERS及荧光信号,本研究中选取DA质量浓度为0.25 mg/mL时制得复合纳米粒子进行下面的细胞实验.
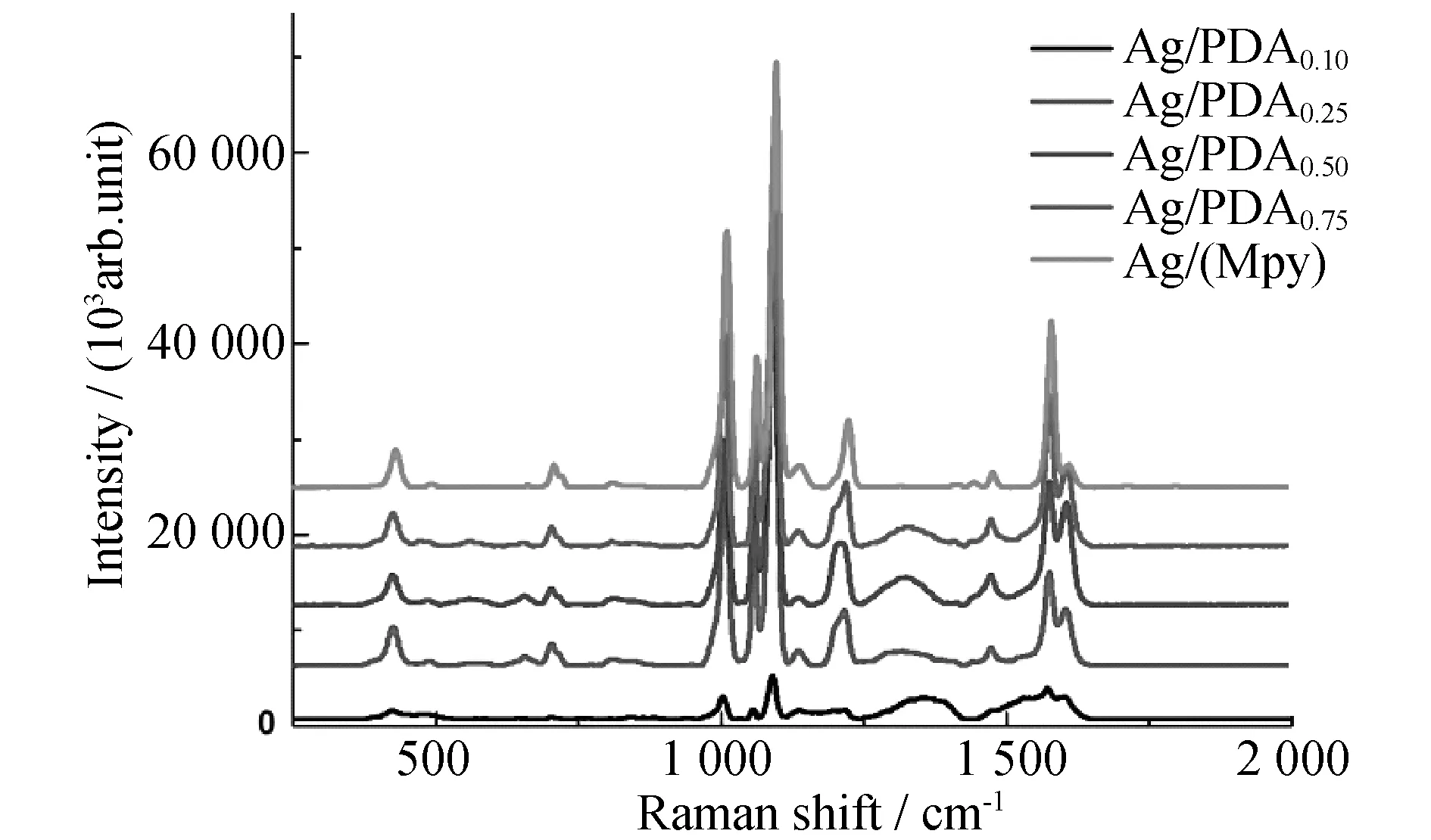
图4 4-Mpy在Ag NPs和Ag(Mpy)/PDAx(R6G) NPs
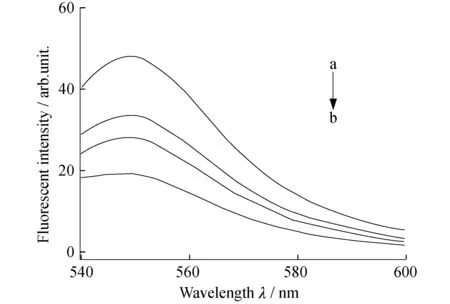
图5 Ag(Mpy)/PDAx(R6G)的荧光光谱图 (激发光波长:514 nm)
2.3 复合纳米粒子在细胞成像与药物释放中的应用
为检验复合纳米粒子的细胞成像能力,将该粒子与HT-29细胞共培养5 h后首先进行荧光成像.实验中激发光波长为514 nm,滤过波长范围是555~625 nm,获得了HT-29细胞的荧光图像,如图6(b)所示,该图像明确表明R6G主要分布在细胞质中;未与粒子共培育的HT-29细胞中的细胞质内未发现荧光信号,如图6(f)所示,排除了图6(b)中荧光为细胞自发荧光的可能.接着用波长为633 nm,功率为10 mW的激光,选取4-Mpy在1 010~1 096 cm-1处的SERS信号进行SERS成像,如图7所示.由图7可见SERS信号主要分布在靠近细胞膜的局部细胞质区域,且该信号与R6G的荧光信号不重合.这可能是因为SERS信号仍然来源于聚有Ag NPs的复合纳米粒子中,而R6G却从复合纳米粒子中脱附并在细胞质中扩散.这一假设被随后的复合粒子中R6G的释放曲线所证实(图8).该实验进一步表明R6G在接近溶酶体环境的pH下更容易释放,表明该复合纳米粒子还可作为pH敏感的药物载体材料.上述实验证明提出的复合纳米粒子可以实现活细胞的荧光及SERS成像,并且可以应用于药物控制释放.

图6 HT-29细胞与Ag(Mpy)/PDA(R6G)复合纳米粒子共培育后的激光共聚焦图.(a)光镜;(b)荧光,514 nm激发;(c)荧光,405 nm激发;(d)叠加图,粒子质量浓度为5 μg/mL;(e~h)未加入粒子的对照组

图7 HT-29细胞与Ag(Mpy)/PDA(R6G)复合纳米粒子共培育后的SERS图.(a)光镜;(b)SERS;(c)叠加图(粒子质量浓度为5 μg/mL)
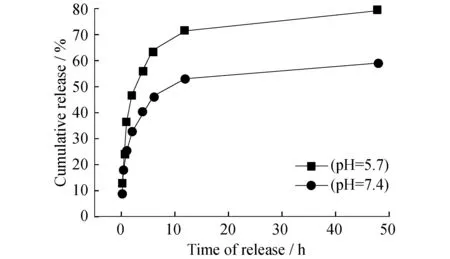
图8 Ag(Mpy)/PDA(R6G)复合纳米粒子中的R6G在不同pH的PBS缓冲液中的释放曲线
对于用作活细胞成像的复合粒子来说,研究其生物相容性很有必要.实验中采用MTT法检验复合纳米粒子的毒性.图9表明复合纳米粒子在质量浓度较低时(<5 μg/mL)具有较好的生物相容性,可以用于活细胞成像.
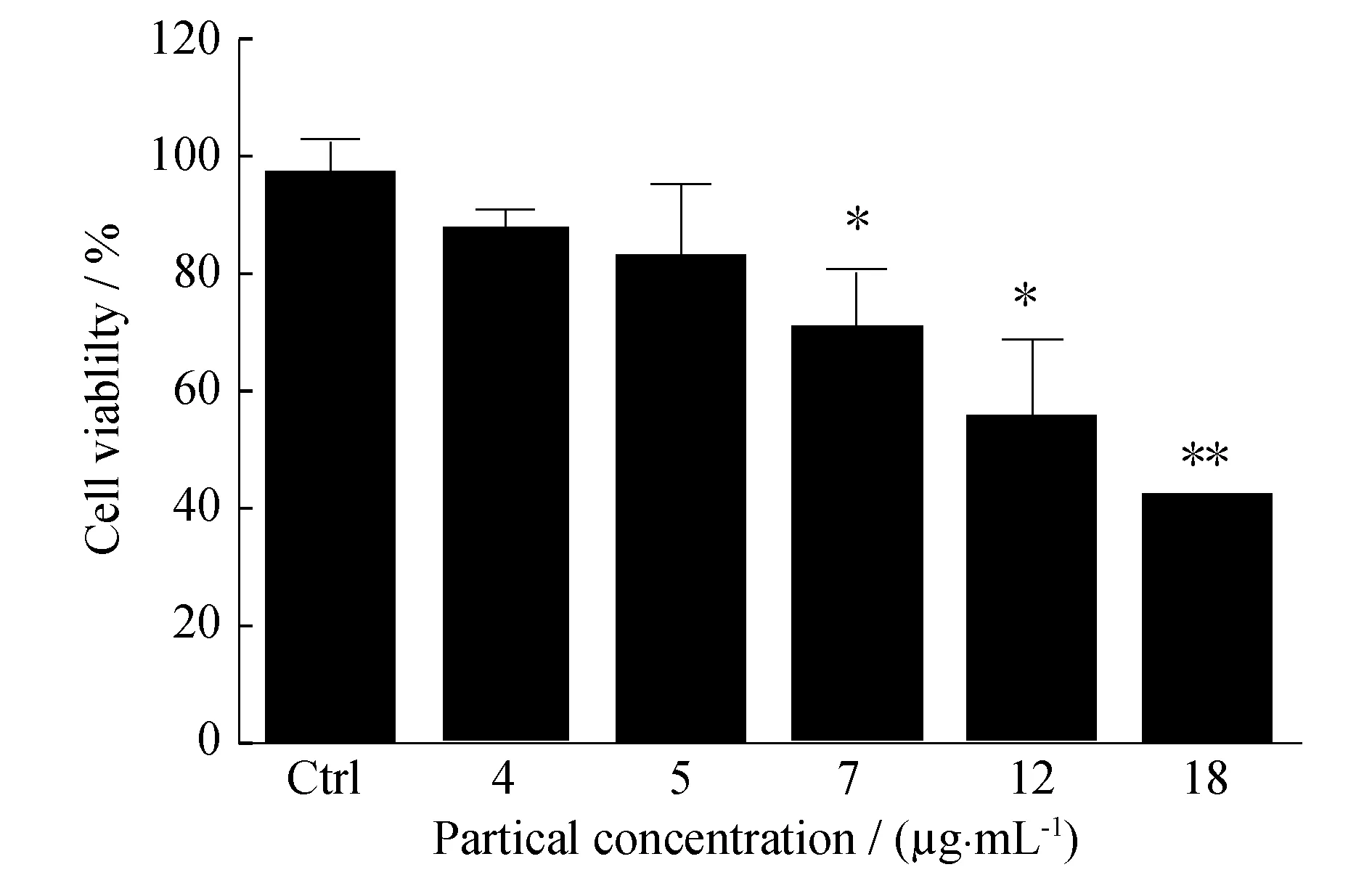
图9 Ag(Mpy)/PDA(R6G)复合纳米粒子浓度对细胞活性影响的MTT实验结果(**P<0.01;*P<0.05)
3 结 论
利用简单便捷方法设计了一种兼具荧光及SERS响应的复合纳米粒子.该粒子以拉曼分子标记的银纳米粒子为基底产生SERS信号,利用DA的自聚性在其表面包裹上PDA层并吸附有机染料产生荧光信号.将其用于细胞成像中,通过选择合适的激发波长便可分别获得良好的荧光及SERS信号进行荧光/SERS双成像.利用该复合纳米粒子还可以进行药物控制释放.根据聚多巴胺的粘附性,还原性,螯合性等可以进一步对复合纳米粒子进行靶向性修饰.这种复合纳米粒子在肿瘤靶向,疾病诊断及药物控释等领域具有潜在的应用前景.
[1] Lee S,Chon H,Yoon S Y,et al.Fabrication of SERS-fluorescence dual modal nanoprobes and application to multiplex cancer cell imaging [J].Nanoscale,2012,4(1):124-129.
[2] Niu X,Chen H,Wang Y,et al.Upconversion fluorescence-SERS dual-mode tags for cellular and in vivo imaging [J].ACS Applied Materials & Interfaces,2014,6(7):5152-5160.
[3] Liong M,Lu J,Kovochich M,et al.Multifunctional inorganic nanoparticles for imaging,targeting,and drug delivery [J].ACS Nano,2008,2(5):889-896.
[4] 朱新建,宋小磊,汪待发,等.荧光分子成像技术概述及研究进展 [J].中国医疗器械杂志,2008,32(1):1-5.
Zhu X J,Song X L,Wang D F,et al.Introduction of fluorescence molecular imaging technology and its development) [J].Chinese Journal of Medical Instrumentation,2008,32(1):1-5.
[5] Paige J S,Nguyen-Duc T,Song W,et al.Fluorescence imaging of cellular metabolites with RNA [J].Science,2012,335(6073):1194-1194.
[6] Hayashi K,Jiang P,Yamauchi K,et al.Real-time imaging of tumor-cell shedding and trafficking in lymphatic channels [J].Cancer Research,2007,67(17):8223-8228.
[7] Shim S H,Xia C,Zhong G,et al.Super-resolution fluorescence imaging of organelles in live cells withphotoswitchable membrane probes [J].Proceedings of the National Academy of Sciences,2012,109(35):13978-13983.
[8] Kneipp K,Wang Y,Kneipp H,et al.Single molecule detection using surface-enhanced Raman scattering (SERS) [J].Physical Review Letters,1997,78(9):1667-1670.
[9] Cui Y,Zheng X S,Ren B,et al.Au@ organosilica multifunctional nanoparticles for the multimodal imaging [J].Chemical Science,2011,2(8):1463-1469.
[10] von Maltzahn G,Centrone A,Park J H,et al.SERS-coded gold nanorods as a multifunctional platform for densely multiplexed near-infrared imaging and photothermal heating [J].Advanced Materials,2009,21(31):3175-3180.
[11] Lee J E,Lee D J,Lee N,et al.Multifunctional mesoporous silica nanocomposite nanoparticles for pH controlled drug release and dual modal imaging [J].Journal of Materials Chemistry,2011,21(42):16869-16872.
[12] Wang Z,Zong S,Li W,et al.SERS-fluorescence joint spectral encoding using organic-metal-QD hybrid nanoparticles with a huge encoding capacity for high-throughput biodetection:putting theory into practice [J].Journal of the American Chemical Society,2012,134(6):2993-3000.
[13] Jiang T,Li J,Qin W,et al.Greatly enhanced Raman scattering and upconversion luminescence of Au-NaYF4nanocomposites [J].Journal of Luminescence,2014,156:164-169.
[14] Fang W,Wang Z,Zong S,et al.pH-controllable drug carrier with SERS activity for targeting cancer cells [J].Biosensors and Bioelectronics,2014,57:10-15.
[15] Wang Z,Zong S,Yang J,et al.Dual-mode probe based on mesoporous silica coated gold nanorods for targeting cancer cells [J].Biosensors and Bioelectronics,2011,26(6):2883-2889.
[16] Zou F,Zhou H,Tan T V,et al.Dual-mode SERS-fluorescence immunoassay using graphene quantum dot labeling on one-dimensional aligned magnetoplasmonic nanoparticles [J].ACS Applied Materials & Interfaces,2015,7(22):12168-12175.
[17] Lee H,Dellatore S M,Miller W M,et al.Mussel-inspired surface chemistry for multifunctional coatings [J].Science,2007,318(5849):426-430.
[18] Hong S,Kim K Y,Wook H J,et al.Attenuation of theinvivotoxicity of biomaterials by polydopamine surface modification [J].Nanomedicine,2011,6(5):793-801.
[19] Zhang X,Wang S,Xu L,et al.Biocompatible polydopamine fluorescent organic nanoparticles:facile preparation and cell imaging [J].Nanoscale,2012,4(18):5581-5584.
[20] Liu X,Cao J,Li H,et al.Mussel-inspired polydopamine:a biocompatible and ultrastable coating for nanoparticles in vivo [J].Acs Nano,2013,7(10):9384-9395.
[21] Lee P C,Meisel D.Adsorption and surface-enhanced Raman of dyes on silver and gold sols [J].The Journal of Physical Chemistry,1982,86(17):3391-3395.
[22] Chen C D,Cheng S F,Chau L K,et al.Sensing capability of the localized surface plasmon resonance of gold nanorods [J].Biosensors and Bioelectronics,2007,22(6):926-932.
[23] Simon J D,Peles D N.The red and the black [J].Accounts of Chemical Research,2010,43(11):1452-1460.
(责任编辑:顾浩然,郁 慧)
Preparation of polydopamine/silver composite nanoparticles for cell fluorescence/SERS dual-mode imaging
ZHOU Yanling, CHEN Si,ZHOU Yalei, YANG Xiaotong, WANG Feng, YANG Haifeng
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
A simple method for preparation of a dual mode composite nanoparticles,which combine fluorescence and surface-enhanced Raman scattering (SERS) imaging capability,is proposed in this paper.4-mercaptopyridine coated silver nanopaticles (AgNPs) were used to generate SERS signal,a thin layer of polydopamine was then coated on AgNPs to adsorb fluorescent rhodamine 6G to generate fluorescence signal.The composite nanoparticles that we gained show good image and drug release capability for cancer cell when excited by lasers with proper wavelength,which provide good prospect in application for organism image and drug controlled delivery.
fluorescence imaging; surface-enhanced Raman scattering; dual-mode imaging; composite nanoparticle
2016-09-22
国家自然科学基金面上项目(21475088);上海市科学技术委员会基金项目(14ZR1430200)
王 丰,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:wangfeng@shnu.edu.cn;杨晓彤,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:xtyang@shnu.edu.cn
Q 334
A
1000-5137(2016)06-0686-07

