枯草芽孢杆菌8-32拮抗菌株的紫外诱变选育
高同国,贾天瑶,郭晓军,张冬冬,朱宝成
(河北农业大学 生命科学学院,河北 保定 071001)
枯草芽孢杆菌8-32拮抗菌株的紫外诱变选育
高同国,贾天瑶,郭晓军,张冬冬,朱宝成
(河北农业大学 生命科学学院,河北 保定071001)
摘要:为了获得更高拮抗活性的菌株,以对大豆根腐病病原菌具有较强拮抗作用的Bacillus subtilis 8-32为实验材料,采用紫外线诱变方法选育具有更高拮抗活性菌株.紫外诱变条件为30 W紫外线,15 cm辐射距离,诱变时间4 min.结果表明,经初筛和复筛,从诱变后菌落形态差异显著的100个菌株中,筛选得到3株(YB-1,YB-2和YB-3)拮抗活性明显增强的菌株,其拮抗活性与对照相比分别提高了50%,55%和50%,并且传代培养10次后其活性保持不变,说明诱变菌株YB-1,YB-2和YB-3遗传性状稳定.
关键词:大豆根腐病;枯草芽孢杆菌;尖孢镰刀菌;紫外诱变
第一作者:高同国(1984-),男,河北邢台人,河北农业大学讲师,博士,主要从事植物真菌病害及生物防治研究.
E-mail:gtgrxf@163.com
大豆是世界上重要的粮食及经济作物,近些年由于重茬、迎茬比例不断增加,大豆根腐病日趋严重,成为制约大豆生产的主要病害之一.仅黑龙江垦区大豆根腐病发病率就为75%~90%,感病品种产量损失为5%~10%,严重可达90%以上,有的甚至绝产[1],给我国经济带来严重损失.
大豆根腐病(soybean root rot)是大豆根部和茎部疾病的统称[2],是一种根治困难、危害严重的常发性土传病害.大豆根腐病在整个生长期都有可能发生,病原菌通过浸染植株的根、茎、叶以及部分豆荚,引起根和茎的腐烂、植株矮化、枯萎,最终导致大豆死亡.大豆根腐病的致病菌有多种,其中以尖孢镰刀菌为主要致病菌[3].目前,对大豆根腐病的治疗主要依靠化学农药,但化学农药的使用造成严重的环境污染,所以生物防治土传染疾病逐渐引起大家的关注[4],并且由于细菌自身的优点,在生物防治中展现出良好的发展前景,因此,用生物来防治疾病的研究与开发有着重要的意义[5-7].
目前用于生物防治的菌株中研究最多的是芽孢杆菌属(Bacillussp.)和假单胞菌属(pseudomonassp.),芽孢杆菌可以产生内生芽孢,抗逆能力强,繁殖速度快,营养要求简单,易定殖在植物表面,其逐渐成为世界上生防细菌研究的重点.如Zhang等[8]采用拌种和根施2种方法研究了10株枯草芽孢杆菌在防治镰刀菌引起的根腐病上的效果,其中4株细菌对根腐病的防治效果达到43%~63%.芽孢杆菌BH1对尖孢镰刀菌引起的大豆根腐病的田间防效达56.1%,大豆增产7.6%[9-10];细菌 BRF-1可促进大豆幼苗生长,在豆长连、重1年和正茬土壤上,对大豆根腐病的防治效果分别达 53.9%,34.4%和 15.8%[11].上述研究均表明芽孢杆菌可以有效地防治大豆根腐病的发生,目前可用于大豆根腐病的商业菌剂中的菌种以枯草芽孢杆菌为主,如Bio safe,Companion,HiStick N/T等[12],但这些产品主要集中在美国等发达国家,国内对大豆根腐病的防治虽然取得了一定的进展,但是有效的商业化菌剂依然很少.
在前期工作中,以大豆根腐病病原菌——尖孢镰刀菌为指示菌,从实验室保存的237株细菌中筛选得到1株对尖孢镰刀菌具有明显拮抗作用的菌株Bacillussubtilis8-32,平板对峙实验表明其抑菌圈直径达21.62 mm,孢子萌发抑制率达42.5%~71.6%,温室生防效果显示该菌株使大豆根腐病病情指数降低了32.08%.为进一步提高其拮抗能力,本实验拟通过对枯草芽孢杆菌(B.subtilis)8-32进行紫外诱变,筛选出具有更强拮抗性能的菌株,为8-32菌剂的开发及大豆根腐病的防治奠定基础.
1材料与方法
1.1 材料
生防细菌:枯草芽孢杆菌Bacillussubtilis8-32(本实验室筛选保藏).
大豆根腐病病原真菌:尖孢镰刀菌(Fusariumoxysporum)(由中国科学院东北地理与农业生态研究院王光华教授提供).
1.2 方法
1.2.1菌种活化
尖孢镰刀菌的活化:取保存好的尖孢镰刀菌斜面1支,挑取1块菌落接种在PDA培养基平板上,倒置放在28 ℃的培养箱中培养,培养3~5 d.
枯草芽孢杆菌的活化:取实验室保存好的枯草芽孢杆菌斜面1支,用划线的方法接种在NA培养基平板上,倒置放在37 ℃的培养箱中培养,培养1~2 d.
1.2.2枯草芽孢杆菌8-32生长曲线的测定
用竹签挑取活化好的枯草芽孢杆菌,接种到NB培养基中,37 ℃,180 r/min震荡培养12 h.再按1%的接种量接种到新鲜的NB培养基中,37 ℃,180 r/min震荡培养,并每隔2 h取样,测定样品在600 nm波长下的吸光度,并绘制生长曲线[13-14].
1.2.3紫外诱变方法
参考文献紫外诱变方法根据[15],具体步骤如下:将活化好的8-32菌种接种于NB培养基中,置于37 ℃,180 r/min的摇床上震荡培养7 h.将培养好的菌液离心,4 000 r/min,15 min收集菌体,并用生理盐水洗涤2次,调整细胞浓度为108~109/mL,待用.将制作好的菌悬液倒入平皿中(加液量为15 mL左右),加入转子,放置在磁力搅拌器上与紫外灯(30 W)相距15 cm处,分别照射0,1,2,4 min.在红灯下对诱变后的菌悬液进行梯度稀释,并选择合适的梯度涂布平板,涂好后放入37 ℃黑暗培养箱中倒置培养24 h.对培养后的平板计数,并计算菌体的存活率.
1.2.4检测平板的制备
将约20 mL灭菌PDA培养基倒入培养皿中,作为底层培养基.取5 mL无菌水倒入病原菌活化平板并用接种针刮取孢子制成菌悬液,将菌悬液倒入45 ℃左右的灭菌PDA培养基,混匀铺板,作为上层培养基,待平板冷却后制成含有病原菌的PDA检测平板.
1.2.5枯草芽孢杆菌的诱变及筛选
根据致死率曲线选择致死率为80%~90%的诱变时间对枯草芽孢杆菌进行诱变,步骤同1.2.3.挑取紫外诱变后形态特征不同的枯草芽孢杆菌单菌落,用十字划线的方法接种在尖孢镰刀菌鉴定平板上,进行初筛.将平板倒置放在28 ℃的培养箱中培养48~72 h,观察并挑选出抑菌圈比较大的单菌落进行复筛.采用琼脂扩散抑菌圈法对初筛后抑菌圈比较大的菌体进行复筛.首先对初筛后的菌体进行液体发酵培养24 h,然后将发酵液4 000 r/min离心20 min,取上清液加入所打的孔中,放在28 ℃的培养箱中培养48~72 h,观察并测量抑菌圈的直径,计算抑菌圈增长率.
1.2.6遗传稳定性测定
将复筛后抑菌圈比较大的菌株(YB-1,YB-2,YB-3)进行传代培养,用竹签挑取经过复筛后抑菌圈比较明显的单菌落,用划线的方法接种在NA培养基平板上,培养24 h,重复10次,即完成传代培养10代.对传代培养10代以后的菌株发酵培养24 h,采用琼脂扩散抑菌法观察抑菌圈的变化情况,同时与出发菌株的抑菌圈进行比较,分析此菌株的稳定性.
2结果与分析
2.1 生长曲线的绘制
本实验采用分光光度法对枯草芽孢杆菌8-32的生长曲线进行测定,结果见图1.结果显示:0~2 h菌体处于调整期,2~20 h菌体处于对数期,20~90 h菌体处于稳定期;90 h以后菌体死亡速率大于生长速率,菌体处于衰亡期.本实验选取对数期的菌体进行研究,选择生长7 h(对数生长初期)的菌体作为研究对象.
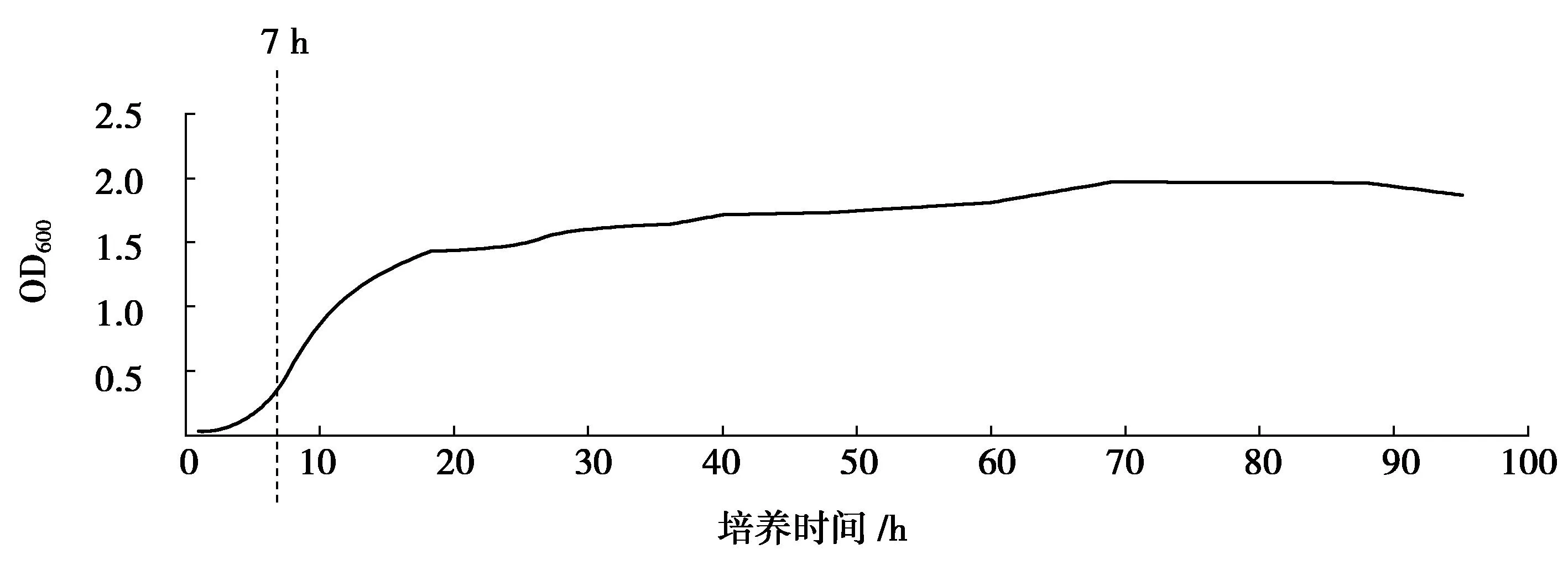
图1 8-32的生长曲线
2.2 诱变后菌体存活率
根据生长曲线,对培养7 h的菌体进行紫外诱变,在30 W紫外灯,辐射距离15 cm条件下,以NA为培养基,采用梯度稀释涂布平板方法,研究不同辐射时间对8-32菌体存活数量的影响,结果见图2和图3.由图2可知,随着紫外照射时间的延长菌体的存活率越来越低.通过对图2平皿上的菌体计数,计算出不同诱变时间下菌体的存活数量,绘制存活率曲线.由图3可知,当诱变时间为1 min时,其存活率为66.40%,2 min的存活率为26.60%,4 min的存活率为17.5%.
2.3 初筛结果
对诱变处理4 min,避光培养24 h后形态不同的菌体进行筛选.通过对100个形态不同的菌株进行筛选,得到3株抑菌效果较强的菌株,筛选结果如图4.结果显示:与对照菌相比较,YB-1,YB-2和YB-3的抑菌效果都有所增加,将这3株菌进行保藏并对其复筛,进一步研究其抑菌作用.

图2 紫外诱变不同时间后8-32菌体存活数量

图3 紫外诱变不同时间8-32菌体存活率变化曲线

图4 诱变后初筛结果
2.4 复筛结果
采用琼脂扩散抑菌圈法对初筛得到的3株抑菌活性较高的菌株(YB-1,YB-2,YB-3)进行复筛,结果见图5.结果表明,诱变后得到的3株细菌YB-1,YB-2和YB-3的抑菌圈直径与对照菌相比较都有明显的增大.与对照菌相比较,YB-1,YB-2和YB-3抑菌圈的平均直径分别增加了50%,55%和50%.

图5 复筛结果
2.5 遗传稳定性检测
对复筛得到的3株抑菌活性较高的菌株进行连续传代培养, YB-1,YB-2和YB-3连续传10代后分别标记为YB-1-C,YB-2-C和YB-3-C.采用琼脂扩散抑菌圈法对传代后的菌株进行稳定检测(图6),结果显示经过传代培养10代以后,抑菌圈大小未有明显改变,说明本实验筛选得到的3株菌株的高产性状可以稳定遗传.

图6 诱变菌株遗传稳定性检测
3讨论
大豆根腐病是引起大豆减产的主要原因之一,生物防治因其高效、安全、无污染等优点越来越引起人们的重视.采用紫外线进行诱变育种是生防菌株常用的育种方法之一,如王静等[16]对枯草芽孢杆菌 B47进行了2次紫外诱变选育,诱变后其菌株对西瓜枯萎病病菌的拮抗能力提高37.5%~68.8%,贾洁等[17]采用紫外诱变后其菌株对大肠杆菌的抗菌活性提高58.49%.本研究通过紫外诱变选育方法也成功筛选出3株拮抗活性明显提高的菌株,其活性与诱变前相比分别提高了50%,55%和50%,并且该3株细菌遗传性状稳定.但研究中未能对突变株的生防效果进行跟踪实验,也未能明确突变株产生的拮抗物质和抗菌谱是否发生了改变,上述问题还需要进一步深入研究.
综上所述,本研究通过紫外诱变技术选育出3株具有更高拮抗能力的菌株YB-1,YB-2和YB-3,其拮抗活性分别提高50%,55%和50%,且3株细菌的遗传稳定性良好.
[1]王佳. 大豆根腐病生防菌的鉴定及发酵条件的优化[D]. 哈尔滨:黑龙江大学, 2010: 9-10.
WANG Jia. Identification of biocontrol strain against to soybean root rot and fermentation conditions optimization [D]. Haerbin: Heilongjiang University, 2010: 9-10.
[2]许艳丽, 战丽莉, 李春杰, 等. 大豆病害发生特点和综合防治技术[J]. 大豆科技, 2009(3):15-17.
[3]刘辉. 黑河地区大豆根腐病防治措施[J]. 种子世界, 2014(4):51-52.
[4]JOHN M, WHIPPS. Microbial interactions and biocontrol in the rhizosphere [J]. Journal of Experimental Botany, 2001,52:487-511.
[5]ELIZABETH A B, EMMERT, JO HANDELSMAN. Biocontrol of plant disease:a (Gram-) positive perspective[J].FEMS Microbiology Letters,1999,171:1-9.
[6]CHEN Yun, YAN Fang, CHAI Yunrong, et al. Biocontrol of tomato wilt disease byBacillussubtilisisolates from natural environments depends on conserved genes mediating biofilm formation [J]. Environmental Microbiology, 2013, 15(3): 848-864.
[7]张彦杰, 罗俊彩, 武燕萍, 等. 生防枯草芽孢杆菌研究进展[J].生命科学仪器, 2009,7(4):19-23.
ZHANG Yanjie, LUO Juncai, WU Yanping, et al. Research advancement of the biological control bacteriaB.subtilies[J]. Life Science Instruments, 2009,7(4):19-23.
[8]ZHANG Jinxiu, XUE A G, TAMBONG J T. Evaluation of seed and soil treatments with novelBacillussubtilisstrains for control of soybean root rot caused byFusariumoxysporumandF.graminearum[J]. Plant Disease, 2009, 93(12):1317-1323.
[9]郭荣君,刘杏忠,杨怀文,等.芽孢杆菌BH1防治大豆根腐病的效果及机制[J].中国生物防治,2003,19(4):180-184.
GUO Rongjun, LIU Xingzhong, YANG Huaiwen, et al. Mechanism of Rhizobacteria BH1 (Bacillussp .) to suppress soybean root rot disease caused byFusariumspp [J] . Chinese Journal of Biological Control, 2003, 19(4):180-184.
[10]郭荣君, 刘杏忠, 杨怀文. 大豆根际细菌I拮抗大豆根腐病菌研究[J]. 大豆科学, 1998, 17(l):53-58.
GUO Rongjun, LIU Xingzhong, YANG Huaiwen. Soybean Rhizobacteria I studies control of soybean root rot disease [J]. Soybean Science, 1998, 17(l):53-58.
[11]王光华, 周克琴, 张秋英, 等. 拮抗细菌 BRF-1 对几种植物病原真菌的抗生效果[J]. 中国生物防治, 2003, 19(2):73-77.
WANG Guanghua, ZHOU Keqin, ZHANG Qiuying, et al. Antagonism ofBacillusstrain BRF-1 against plant pathogenic fungi [J]. Chinese Journal of Biological Control, 2003, 19(2):73-77.
[12]CAWOY H, BETTIOL W, FICKERS P, et al.Bacillus-based biological control of plant diseases//STOYTCHEVA M. Pesticides in the modern world-pesticides use and management [J]. InTech, Rijeka, 2011, 273-302.
[13]牛春华, 高岩, 李玉秋, 等. 紫外诱变选育高产蛋白酶枯草芽孢杆菌[J].中国酿造, 2011(12):67-69.
NIU Chunhua, GAO Yan, LI Yuqiu, et al. Selection of high protease-producing strain ofBacillussubtilisby UV mutation [J]. China Brewing, 2011(12):67-69.
[14]牛春华,丁东红,徐文静,等.用玉米浆发酵生产类胡萝卜素红酵母的紫外诱变选育[J].中国酿造, 2010(1):61-63.
NIU Chunhua, DING Donghong, XU Wenjing, et al. Mutation and selection of carotenoid-producing Rhodotorula [J]. China Brewing, 2010(1):61-63.
[15]施巧琴, 吴松刚. 工业微生物育种学[M]. 北京:科学出版社,2003.
[16]王静, 朱建华, 林纬, 等. 枯草芽孢杆菌 B47 高产拮抗物质菌株的紫外诱变选育[J]. 安徽农业科学, 2008, 36(33): 14642-14644.
WANG Jing, ZHU Jianhua, LIN Wei, et al. Screening for the strain highly producing antagonistic substance fromBacillussubtilisB47 by UV Mutageneisis [J]. Journal of Anhui Agricultural Sciences, 2008, 36(33):14642-14644.
[17]贾洁, 郭小华, 惠明, 等. 枯草芽孢杆菌 R21-4 的诱变育种及其抗菌蛋白性质的研究[J]. 食品工业科技, 2006, 26(11): 53-56.
(责任编辑:赵藏赏)
Ultraviolet mutation of antagonistic strainBacillussubtilis8-32
GAO Tongguo, JIA Tianyao, GUO Xiaojun, ZHANG Dongdong, ZHU Baocheng
(College of Life Science, Agricultural University of Hebei, Baoding 071001, China)
Abstract:In order to obtain higher antagonistic activity producing strains, Bacillus subtilis 8-32 which had significant antagonistic against to soybean root rot was used to get more effective strains through ultraviolet mutagenesis method. Conditions for mutagenesis were 30 W UV lamp, 15 cm irradiation distance and irradiation dose of 4 min. Results showed that 100 different morphology colonies of bacteria were picked according to first and second screening, and three strains (YB-1, YB-2, YB-3) which had higher antagonist activities were screened from 100 mutation colonies, their activities were increased by 50%, 55% and 50%, respectively, and the activities were unchanged after 10 generations.
Key words:soybean root rot; Bacillus subtilis; Fusarium oxysporum; UV mutagenesis
基金项目:河北省自然科学基金资助项目(C2015204031);保定市科学技术研究与发展计划项目(13ZN023)
收稿日期:2015-05-20
中图分类号:Q933
文献标志码:A
文章编号:1000-1565(2015)06-0610-06
DOI:10.3969/j.issn.1000-1565.2015.06.010

