KCL22/NOD-SCID小鼠慢性粒细胞白血病
移植瘤模型的建立及其鉴定
文良雪,刘鑫,李会,黄宁姝,黄峥兰,冯文莉*
(重庆医科大学检验医学院,临床检验诊断学教育部重点实验室,重庆 400016)
KCL22/NOD-SCID小鼠慢性粒细胞白血病
移植瘤模型的建立及其鉴定
文良雪,刘鑫,李会,黄宁姝,黄峥兰,冯文莉*
(重庆医科大学检验医学院,临床检验诊断学教育部重点实验室,重庆400016)
【摘要】目的研究人慢性粒细胞白血病细胞株KCL22在NOD-SCID小鼠体内致白血病的能力,为慢性粒细胞白血病血液移植瘤模型鼠的建立奠定基础。方法取对数生长期的KCL22细胞2×107个,经尾静脉注射入NOD-SCID小鼠,对照组小鼠注射无菌PBS。观察小鼠一般情况,瑞氏染色监测血象和骨髓象变化,PCR检测骨髓细胞BCR-ABL基因转录水平,HE染色观察肝、脾组织肿瘤细胞浸润情况。结果实验组小鼠于注射细胞后约4周开始出现反应力下降、精神萎靡、股骨肌肿大、后肢骨节出血点等体征,外周血白细胞从第5周逐渐增多,计数较对照组显著升高(P<0.05),血涂片可见幼稚粒细胞,肝、脾、骨髓组织切片可见白血病细胞浸润,骨髓细胞高表达BCR-ABL融合基因,未经治疗存活约70天,较对照组显著缩短(P<0.05)。结论KCL22细胞可成功构建NOD-SCID小鼠慢性粒细胞白血病移植瘤模型。
【关键词】慢性粒细胞白血病;KCL22细胞;NOD-SCID小鼠;白血病
慢性粒细胞性白血病(chronic myeloid leukemia, CML)是一种发生在造血干细胞的以粒系细胞慢性增殖为主要特征的恶性克隆性疾病,95%的患者骨髓中可找到Ph染色体,即特征性t( 9;22) (q34;q11) 染色体易位,和/或BCR-ABL融合基因[1]。酪氨酸激酶抑制剂如伊马替尼的使用是CML治疗的里程碑式改变,但是由于BCR-ABL突变引起的耐药给临床治疗带来了一定的困难,促使研究人员寻找新的治疗方法[2]。随着研究的深入,药物筛选、基因治疗等研究方法均需在动物体内进行。目前多采用伊马替尼敏感的白血病K562细胞株构建慢性粒细胞白血病模型[3]。而KCL22细胞是人源髓系急变期的慢性粒细胞白血病细胞株,其生物学特征基本上与K562相似,但对伊马替尼中度耐药[4]。目前尚未见采用该细胞构建CML移植瘤模型的报道。本研究首次尝试采用KCL22细胞构建NOD-SCID小鼠慢性粒细胞白血病移植瘤模型,旨在为后续使用该细胞株进行药物筛选的体内实验或探索其他治疗手段奠定基础。
1材料与方法
1.1材料
1.1.1细胞株与实验动物
CML急性变细胞系KCl22购自上海拜力生物有限公司。SPF级NOD-SCID雌性小鼠12只,体重16.7 ~17.8 g,3~4周龄,购于北京华阜康生物科技股份有限公司[SCXK(京)2009-0015]。
1.1.2仪器设备
Heraeus Heracell-240型CO2培养箱(德国Heraeus公司),ABI 9700 PCR反应仪(美国ABI公司),正置荧光显微镜(日本Nikon Eclipse 80i公司),凝胶成像仪(美国Bio-Rad公司)。
1.1.3主要试剂
瑞氏染色液(珠海贝索生物公司),逆转录试剂盒(TaKaRa公司),PCR反应试剂盒(TaKaRa公司)。
1.2方法
1.2.1白血病细胞系培养
低代次KCL22细胞在含有10%胎牛血清(Gibco公司)的1640培养基中,于37℃、5% CO2条件下常规培养。移植前取对数生长期的细胞,用无菌PBS调整细胞浓度。
1.2.2慢性粒细胞白血病KCL22细胞移植及NOD-SCID小鼠饲养
12只NOD-SCID小鼠随机分为实验组与对照组,每组6只。在超净工作台内,将KCL22细胞按每只2×107/200 μL经尾静脉注射至实验组NOD-SCID小鼠。对照组小鼠尾静脉注射无菌PBS 每只200 μL。两组小鼠饲养于重庆医科大学实验动物中心[SYXK(渝)2012-0001]层流架独立通风笼盒(individually ventilated cage,IVC)实验室,标准颗粒饲料,常规饮水、垫料。并按实验动物使用的3R原则给予人道的关怀。
1.2.3KCL22/NOD-SCID慢性粒细胞白血病小鼠移植瘤模型的鉴定
KCL细胞移植1周后开始每日观察NOD-SCID小鼠的一般状态,包括小鼠行为、体重、饮食、大小便和精神状况。移植4周以后,用剪尾取血法取小鼠尾静脉血10 μL,加入0.39 mL白细胞稀释液(4%冰醋酸)中,立即混匀后取10 μL进行改良牛鲍计数板充池计数白细胞。同时制备外周血涂片行常规瑞氏染色,观察是否出现原始和幼稚血细胞。当小鼠发病严重时,颈椎脱臼法处死小鼠,分别作如下检测:
(1)NOD-SCID小鼠外周血和骨髓涂片细胞学检查
颈椎脱臼处死小鼠前,摘除眼球取眼眶血,涂片2~3张,瑞氏染色,观察外周血象。处死小鼠后取双侧股骨,用10 mL医用注射器吸取PBS反复将骨髓冲洗入15 mL离心管中直至股骨外观呈白色。将骨髓沉渣离心后取2 μL涂片,瑞氏染色后镜检。剩余骨髓用于PCR检测BCR-ABL融合基因表达。
(2)NOD-SCID小鼠组织病理学检查
将濒死小鼠处死后分别摘取各小鼠肝、脾、肺称重,计算脾指数(脾指数=脾重量mg/体重g × 10)。将器官和病变组织标本经石蜡包埋、切片和HE染色后,显微镜下观察组织及周围炎症细胞浸润情况。
(3) RT-PCR检测小鼠骨髓细胞BCR-ABL融合基因的表达
收集小鼠骨髓细胞,用Trizol一步法提取RNA,逆转录成cDNA。Primer 5.0软件设计引物,Blast比对之后引物由上海英俊生物有限公司合成。引物序列为:目的基因BCR-ABL上游引物5’-GCA AGC TTA CCA TGG ACA TCC GTG G-3’,下游引物5’-GTC GAC CTT GCC ATC AGA AGC-3’,合成643 bp的片段;内参β-actin上游引物5’-CTG TC CCT GTA TGC CTC TG-3’,下游引物5’-ATG TCA CGC ACG ATT TCC-3’,合成218 bp的片段。
PCR反应体系为:PCR预混液10.0 μL,10 pmol/L上游引物0.6 μL,10 pmol/L下游引物0.6 μL,模板cDNA10 ng,加ddH2O至20.0 μL。PCR反应条件:94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸30 s,共30个循环;72℃再延伸5 min;4℃保存2 h。β-actin退火温度为55℃,其余条件相同。2%琼脂糖凝胶电泳鉴定PCR扩增产物,凝胶成像仪拍照,保存结果。
1.2.4统计学方法
采用SPSS 18.0软件包处理,数据采用平均值±标准差表示,两组数据间行独立t检验,P<0.05表示差异具有显著性意义。
2结果
2.1NOD-SCID小鼠体征变化
移植4周以后,实验组小鼠出现不同程度的萎靡少动、反应力下降、双后肢无力拖行和体重不增等现象,其中1例出现面部嘴角肿大,1例左后肢股骨侧肌肉肿大,体征变化明显,见图1。而对照组小鼠一般状况未见明显改变。实验组小鼠死亡前体重为(18.4±0.4)g,正常对照组小鼠实验结束时体重为(21.7±0.7)g。
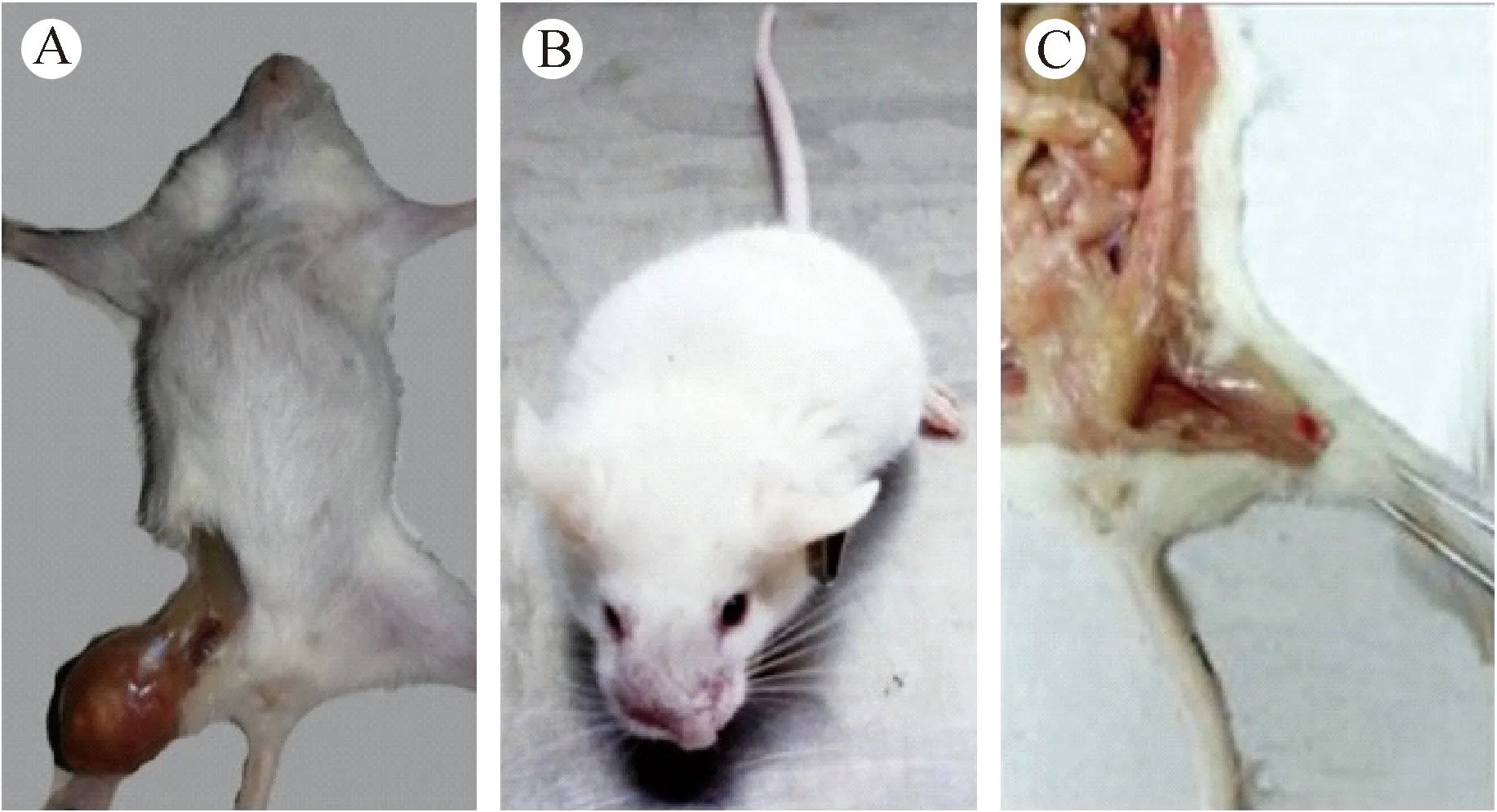
注:A图小鼠左后肢股骨侧肌肉肿大,B图小鼠嘴角肿大,C图小鼠右后肢股骨节出血点。 图1 实验组NOD-SCID小鼠体征变化Note. A: Swelling of left hindlimb muscles; B: Swelling near the mouth; C: Petechia on the right hindlimb femur. Fig.1 Changes of physical signs in the mice of experimental group
2.2NOD-SCID小鼠外周血白细胞计数及涂片镜检
实验组小鼠早期外周血白细胞计数约为2×109个/L,于第5周后,随着病程的发展明显升高,最高可达14.8×109个/L,均值为(9.3±1.4)×109个/L。血涂片瑞氏染色镜检显示白细胞数量显著增多,可见大量分叶核粒细胞,易见幼稚和原始细胞,其胞核大,核仁明显,核异形,胞质少而蓝染。而对照组小鼠外周血白细胞计数为(2.5±0.5)×109个/L(P<0.05),血涂片显示正常血象。见图2。
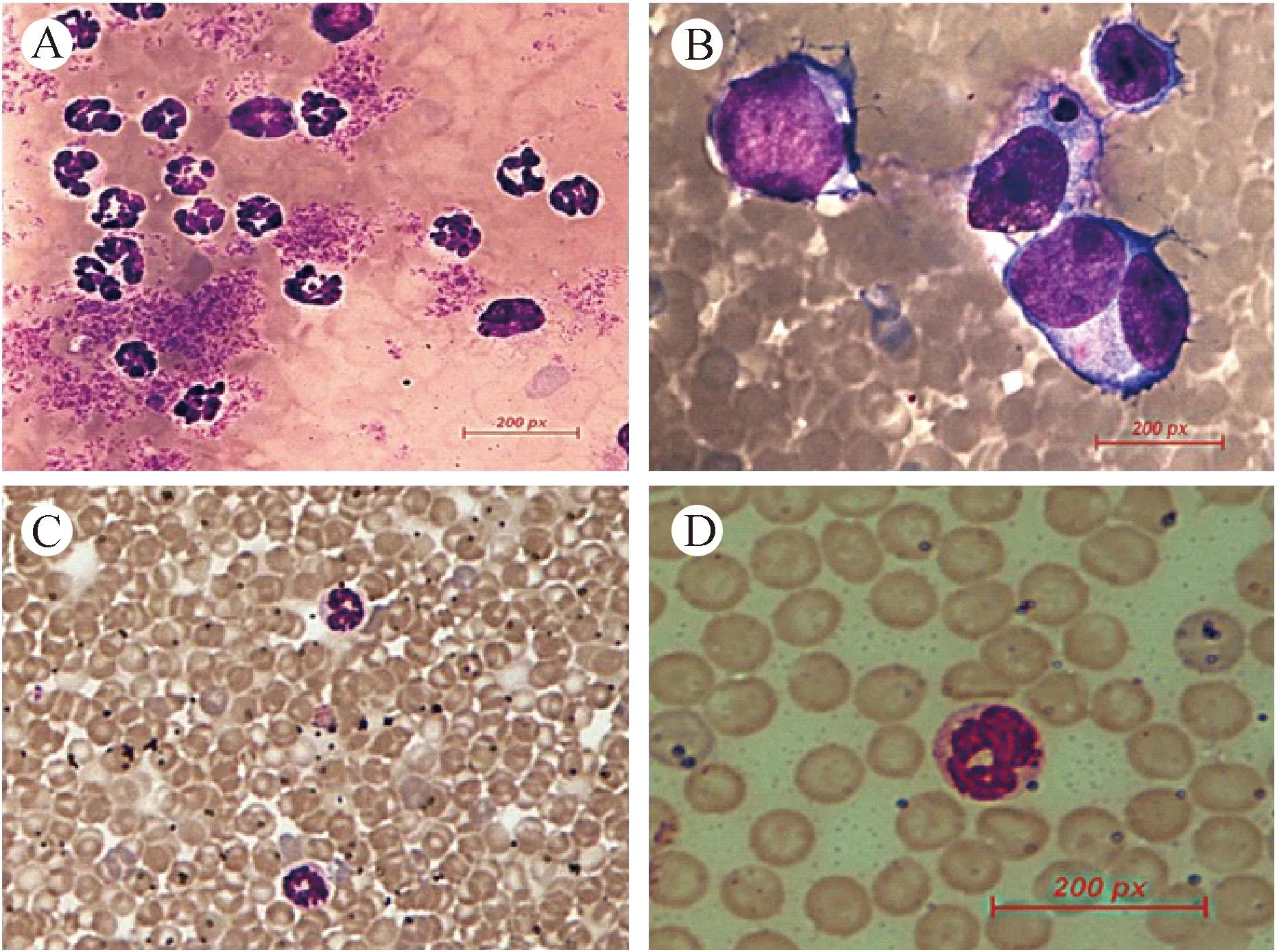
注:A、B:实验组小鼠外周血涂片瑞氏染色,A可见大量分叶核粒细胞(×400),B易见幼稚和原始细胞(×1000)。C、D:对照组外周血涂片瑞氏染色,见正常血象(C:×400,D:×1000)。 图2 NOD-SCID小鼠外周血涂片瑞氏染色Note. A&B: Experimental group, A: Segmented granulocytes (×400), B: Immature cells (×1000). C&D: Normal blood smear of a control mouse. C: ×200, D: ×1000. Fig.2 blood smear of the NOD-SCID mice. Wright staining
2.3NOD-SCID小鼠骨髓涂片检查
骨髓涂片(图3)显示实验组小鼠骨髓增生极度活跃,可见大量环状核中性粒细胞;巨核细胞增多,未见或少见产板型巨核细胞;易见异常增生的早期细胞,其形态各异,大小不一,核质发育不平衡,部分细胞核染色质疏松,胞质或胞核有空泡,而对照组小鼠骨髓涂片表现为正常骨髓象。
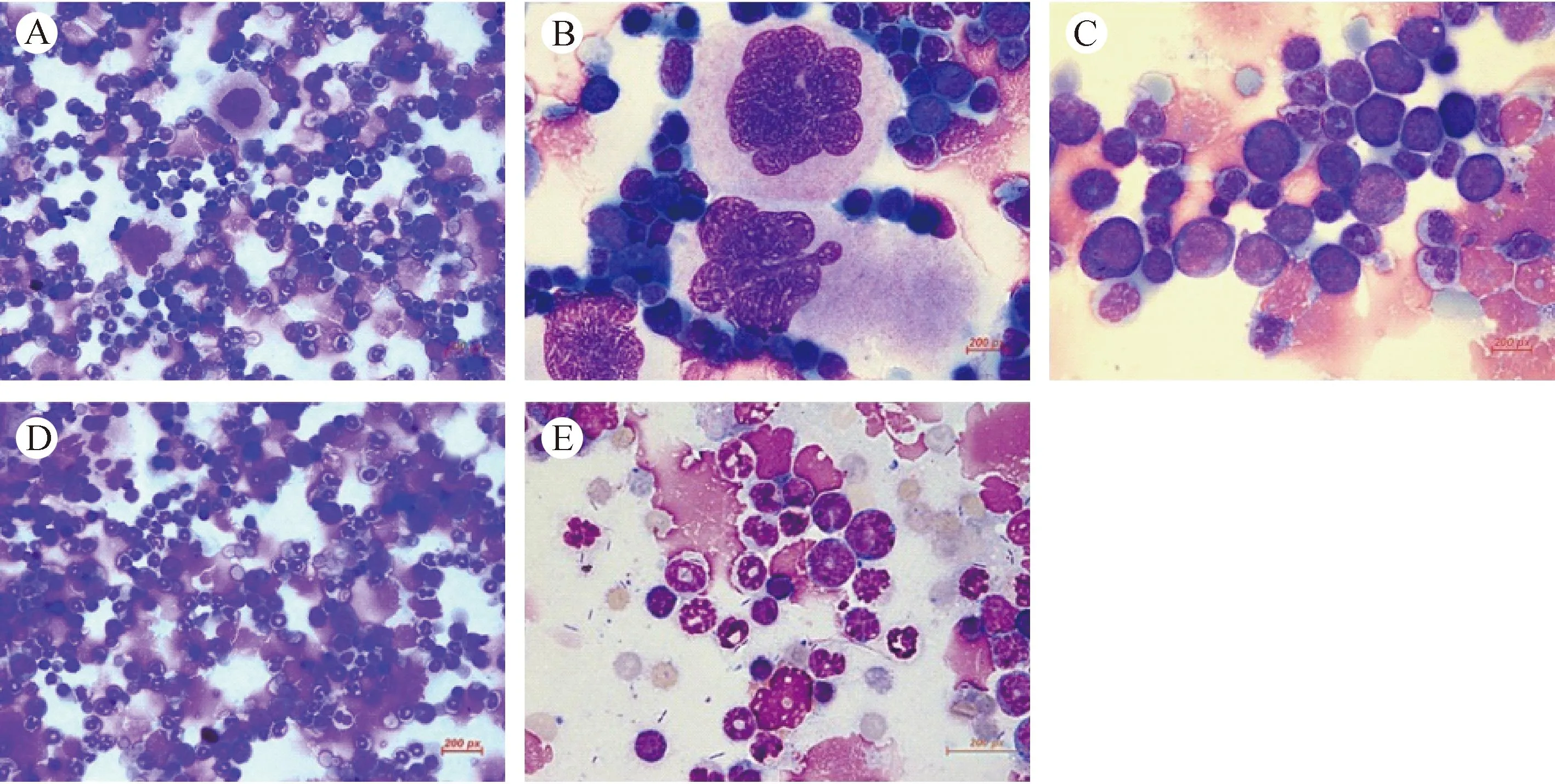
注:A、B&C:实验组骨髓涂片瑞氏染色,A图见骨髓增生极度活跃(×400),B图可见巨核细胞增多(×1000),C图易见早期细胞(×1000)。D&E:对照组小鼠骨髓涂片瑞氏染色,见正常骨髓象(D:×400,E:×1000)。 图3 NOD-SCID小鼠骨髓涂片瑞氏染色Note. A, B&C: Experimental group bone marrow, A: Extreme hyperplasia of the bone marrow, ×400. B: Megakaryocytes, ×1000. C: Early cells, ×1000. D&E: Normal bone marrow smear of the control group. D: ×400; E: ×1000. Fig.3 Bone marrow smear of the NOD-SCID mice. Wright staining
2.4NOD-SCID小鼠组织病理学检查
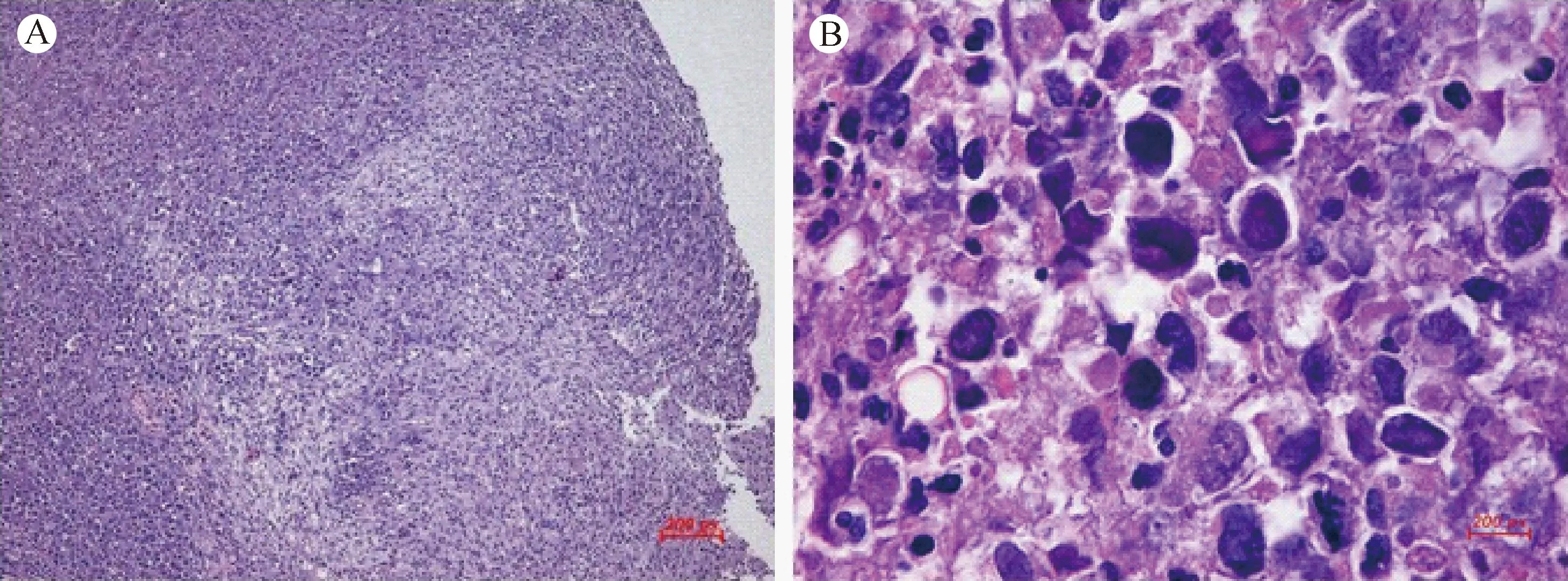
实验组小鼠发现两例异常体征:1例为左后肢股骨侧肌肉肿大,其肌肉层内侧为粘稠的脓性液体,HE染色结果提示炎症细胞浸润(图4);1例为小鼠右后肢骨节处存在约2 mm×3 mm大小的出血点,见图1C。与对照组小鼠相比,表现异常体征的小鼠肝脏重量(1.12±0.18)g、脾指数(30.2±2.1) mg/10 g,较其他小鼠[肝重量(1.30±0.11)g、脾指数(44.3±8.9)mg/10 g]明显减少(图5)。组织学切片HE染色结果显示肝细胞索和脾结节紊乱,且有肿瘤细胞浸润,肺组织淤血肿胀(图6)。
注:小鼠腿部肿块HE染色提示炎症细胞浸润(A:×100,B:×1000)。 图4 实验组NOD-SCID小鼠腿部肿块组织切片HE染色Note. Inflammatory cell infiltration in the leg muscles. HE staining(A:×100,B: ×1000). Fig.4 Histology of the tumor tissue in the leg muscles of a mouse of experimental group.
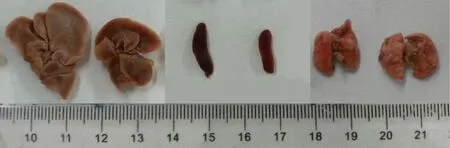
注:左边为对照组小鼠,右边为实验组。实验组肝脾组织体积明显缩小,肺脏淤血肿大。 图5 NOD-SCID小鼠肝脾肺组织Note. Left: Mice of the control group. Right: Mice of the experimental group. The size of mouse liver and spleen of the experimental group are reduced, and the lung shows congestion and swelling. Fig.5 Gross appearance of liver, spleen and lung of the NOD-SCID mice
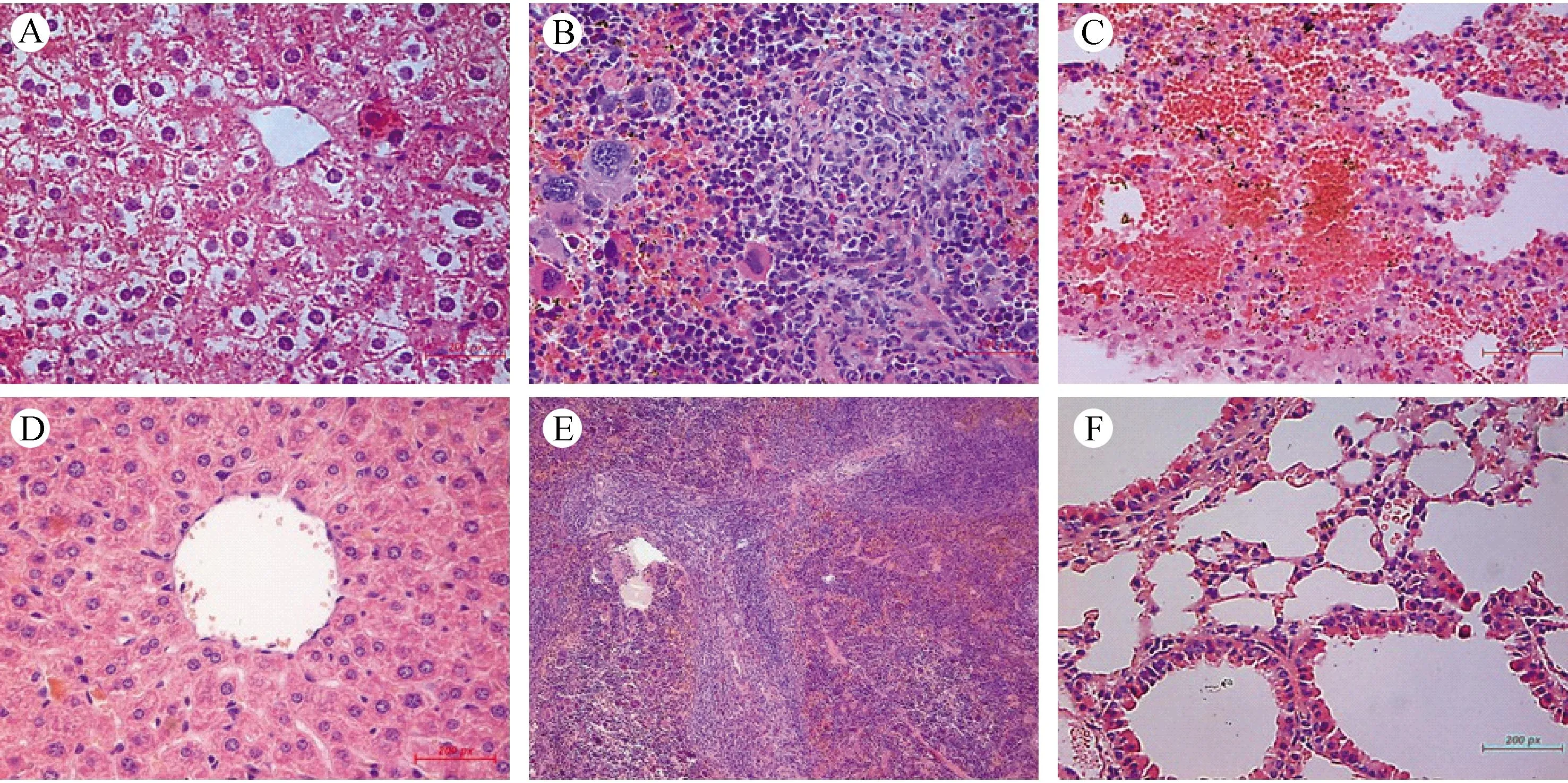
注:A、B&C:实验组小鼠肝脾肺组织病理切片HE染色(A图见肝细胞索紊乱, ×400;B图见脾结节紊乱、肿瘤细胞浸润, ×400;C图见肺淤血, ×400)。D、E&F:对照组肝脾肺组织病理切片,HE染色(D&F:×400,E:×100)。 图6 NOD-SCID小鼠组织病理学检查Note. A, B, C: Liver, spleen and lung tissues of the experimental group. A: Disorder of hepatic cord, ×400; B: Disorder of spleen nodules and tumor cell invasion, ×400; C: Lung congestion, ×400; D,E,F: Histology of the control group. (D&F ×400, E ×100). Fig.6 Histological changes of the liver, spleen and lung of NOD-SCID mice. HE staining.
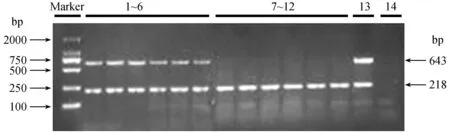
注:BCR-ABL大小为643 bp,内参β-actin大小为218 bp。Marker为DL2000,1~6孔为实验组小鼠均高表达BCR-ABL融合基因,7~12孔为对照组小鼠无融合基因表达,13孔为阳性对照,14孔为阴性对照。 图7 PCR检测NOD-SCID小鼠骨髓细胞BCR-ABL基因表达Note. BCR-ABL was 643 bp and β-actin was 218 bp. Marker: DL2000; 1~6: Mice in the experimental group highly expressed BCR-ABL; 7~12: Mice in the control group did not express BCR-ABL; 13: Positive control; 14: Negative control. Fig.7 Expression of BCR-ABL from mouse marrow cells detected by PCR amplification
2.5NOD-SCID小鼠骨髓细胞BCR-ABL融合基因的表达
PCR检测BCR-ABL融合基因的结果显示(图7):实验组6只小鼠骨髓细胞均高表达BCR-ABL融合基因,而对照组6只小鼠均该融合基因无表达。
2.6NOD-SCID小鼠生存期观察
经KCL22细胞移植的实验组小鼠均表现出白血病的特点且疾病无自发缓解,存活期为(68.5±17.4)d。而对照组小鼠于实验结束时均存活,存活期>90 d。图SPSS 18.0软件包绘制的小鼠生存曲线见图8。
3讨论
在CML研究中使用动物模型,可以克服白血病细胞体外培养的诸多局限性,模拟人体内肿瘤的生长情况,并能严格控制实验条件,增强实验材料的可比性,有助于更全面地认识疾病的本质。目前,慢性粒细胞白血病小鼠模型的建立主要有三种方法,包括将BCR-ABL阳性细胞移植给免疫缺陷鼠、BCR-ABL转基因小鼠模型和用表达P210BCR-ABL逆转录病毒载体转染小鼠骨髓细胞并移植正常鼠[5-7]。使用的BCR-ABL阳性细胞主要有两类,一类是经BCR-ABL转化后的细胞系如32D、Baf3,一类是CML患者原代细胞如K562、BV173[8]。
KCL22细胞是人源髓系急变期的慢性粒细胞白血病细胞株,BCR-ABL阳性,双Ph染色体,体外培养半贴壁生长,特征基本上与K562细胞相似,但其为伊马替尼中度耐药株[4],很多对于伊马替尼耐药的研究均需在此细胞株上进行。但是CML动物血液移植瘤模型多以伊马替尼敏感的K562细胞株构建。因此,有必要探讨KCL22细胞构建动物血液移植瘤模型的可能性。
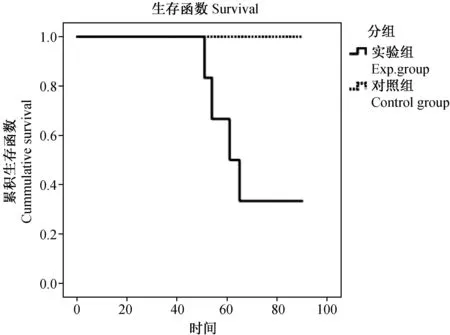
图8 血液瘤小鼠生存曲线 Fig.8 Survival curves for the NOD-SCID mice with KCL22 cell transplantation
Jackson实验室[9]于1992年建立了非肥胖糖尿病/严重联合免疫缺陷小鼠品系,即NOD-SCID小鼠。该小鼠存在严重的先天免疫缺陷,缺乏功能性T细胞、B细胞和NK细胞[10],其对人外周血移植水平是其他遗传品系小鼠的数倍[11]。因此,NOD-SCID小鼠是易于异种移植成功并可稳定应用的动物模型,广泛应用于人类白血病模型的构建[12]。
我国已有多例利用NOD-SCID小鼠经尾静脉注射或腹腔注射K562细胞成功建立CML模型的报道[13-15]。在本研究中,我们首次尝试通过尾静脉注射KCL22细胞构建NOD-SCID小鼠慢性粒细胞白血病移植瘤模型,初步探讨KCL22细胞在动物体内的致瘤能力。
KCL22细胞尾静脉注射实验组小鼠后,约4周左右,小鼠表现出明显的体征变化,主要表现为肌无力,特别是后肢无力或拖行,至死亡前其体重较对照组下降、存活期显著缩短(P<0.05)。外周血白细胞较对照组显著增生(P<0.05),可见大量分叶核粒细胞,易见原始和幼稚粒细胞,表现出典型的慢性粒细胞白血病外周血象的特点。骨髓象可见大量的中、晚幼和成熟粒细胞增生,骨髓细胞均高表达CML特征性的BCR-ABL融合基因。组织病理检查可见肝脾萎缩、形态紊乱且有肿瘤细胞浸润。以上观察指标说明我们成功使用KCL22细胞株建立了NOD-SCID小鼠慢性粒细胞白血病移植瘤模型。该模型较好地模拟了白血病细胞在体内细胞因子、免疫细胞等复杂微环境下的生长,反应了CML的真实发病情况。实验中个别小鼠还出现了后肢股骨侧肌肉肿大、面部嘴角肿大及后肢骨节出血点的独特体征改变,此对研究白血病细胞在动物模型体内的浸润、转移等行为有重要意义。进一步证实,KCL22细胞在体内生长和增殖能力强,有一定的致病性和侵袭性,可用于小鼠血液瘤模型的建立,尤其是耐药的研究。
综上所述,本研究成功使用KCL22细胞株构建了NOD-SCID小鼠慢性粒细胞白血病移植瘤模型,该模型稳定可靠,易于重复,有利于后续使用KCL22细胞株进行的药物筛选体内实验或探索其他治疗手段。
参考文献
[1]Quintás-Cardama A, Cortes J. Molecular biology of bcr-abl1-positive chronic myeloid leukemia [J]. Blood, 2009, 113: 1619-1630.
[2]Goldman JM. Treatment strategies for CML [J]. Best Pract Res Clin Haematol, 2009, 22(3): 303-313.[3]于文俊, 杨文华, 史哲新. NOD/SCID小鼠模型在实验血液学研究中的应用 [J]. 中国实验动物学报, 2008, 16(4): 964-968.
[4]Kubonishi I, Miyoshi I. Establishment of a Ph1 chromosome-positive cell line from chronic myelogenous leukemia in blast crisis [J]. Int J Cell Cloning, 1983, 1: 105-117.
[5]Ilaria RL Jr. Animal models of chronic myelogenous leukemia [J]. Hematol Oncol Clin North Am, 2004, 18(3): 525-543.[6]Wong S, Witte ON. Modeling Philadelphia chromosome positive leukemias [J]. Oncogene, 2001, 20(40): 5644-5659.
[7]刘伟, 季明春, 李厚达. 人慢性粒细胞白血病动物模型研究进展 [J]. 中国比较医学杂志, 2005, 15(1): 55-58.
[8]杜庆锋. 慢性髓系白血病动物模型的研究现状 [J]. 国外医学·输血及血液学分册,2002, 25(5): 393-395.
[9]Prochazka M, Gaskins HR, Shultz LD, et al. The nonobese diabetic SCID mouse: model for spontaneous thymomagenesis associated with immunodeficiency [ J ]. Proc Natl Acad Sci U S A,1992, 89(8): 3290- 3294.
[10]王怀远, 吴旭颖, 张文明, 等. NOD/SCID小鼠主要脏器重量、血生理生化指标和免疫细胞的测定 [J]. 中国比较医学杂志, 2014, 24(5): 47-51.
[11]Hesselton RM, Greiner DL, Mordes JP, et al. High levels of human peripheral blood mononuclear cell engraftment and enhanced susceptibility to human immunodeficiency virus type 1 infection in NOD/LtSz-scid/scid mice [J]. J Infect Dis, 1995, 172(4): 974- 982.
[12]周雪, 王娟, 陈秀华. 人常见白血病小鼠模型及其应用 [J]. 世界临床药物, 2013, 34(10): 615-618.
[13]宋艳秋, 刘敏, 李薇.K562 /NOD-SCID小鼠白血病模型的建立 [J]. 中国实验血液学杂志, 2007, 15( 1): 16-19.
[14]黎阳, 张绪超, 黄绍良. 小剂量K562细胞NOD/SCID小鼠动物模型的建立 [J]. 中山大学学报(医学科学版), 2005, 26(5): 523-527.
[15]张佳, 杨向东, 史哲新. 尾静脉注射K562细胞建立慢性髓系白血病小鼠模型及其鉴定[J]. 中国实验血液学杂志, 2012, 20(3): 773-776.
研究报告
Establishment and verification of a KCL22/NOD-SCIDmouse
transplantation tumor model of chronic myeloid leukemia
WEN Liang-xue, LIU Xin, LI Hui, HUANG Ning-shu, HUANG Zheng-lan, FENG Wen-li
(College of Laboratory Medicine, Key Laboratory of Medical Diagnostics,
Ministry of Education, Chongqing Medical University, Chongqing 400016, China)
【Abstract】ObjectiveTo investigate the potential of chronic myeloid leukemia (CML) cell line KCL22 in inducing leukemia in NOD-SCID mice for setting up a basis for constructing a CML mouse transplantation tumor model. Methods 2×107KCL22 cells in logarithmic growth phase were injected via the tail vein into experimental NOD-SCID mice whereas PBS was injected to the mice of control group. General condition of the mice of both groups was observed. Wright staining was used to observe the changes of blood and bone marrow smears. PCR was conducted to detect the transcription level of BCR-ABL, and histology with HE staining was used to evaluate the tumor cell invasion in the liver and spleen. ResultsFour weeks after the injection of KCL22 cells, the mice in experimental group showed physical signs of decreased reactivity, depression, swollen hindlimb muscles and petechia on the hindlimb femur. Peripheral white blood cells (WBC) began to increase after 5 weeks, with a significantly increased quantity compared with the control group (P<0.05). Immature granulocytes could be seen in blood and bone marrow smears, and tumor cell infiltration was found in the liver and spleen. BCR-ABL was highly expressed in bone marrow cells. Survival time of the experimental mice without therapy was 70 days, significantly shorter than that in the control group (>90 days) (P<0.05). ConclusionsA NOD-SCID mouse model of CML transplantation tumor is successfully established with leukemia KCL22 cells.
【Key words】Chronic myeloid leukemia; KCL22 cells; NOD-SCID mice; Leukemia animal model
[收稿日期]2014-10-30
Doi:10.3969/j.issn.1005-4847.2015.02.016
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2015) 02-0188-06
[通讯作者]冯文莉,女,教授,博士生导师,电话:023-68485938,E-mail: fengwlcqmu@sina.com。
[作者简介]文良雪(1989-),女,硕士研究生,研究方向:白血病分子机制及基因治疗。Email: shuiyang5656@163.com。

