十二指肠-空肠转流手术对 2型糖尿病大鼠胰岛素抵抗的改善作用
王龙霞,赵先哲,乔伟伟*,顾坚忠,陈立新
(1. 复旦大学实验动物科学部,上海 200032;2. 上海斯莱克实验动物有限责任公司,上海 201615)
十二指肠-空肠转流手术对 2型糖尿病大鼠胰岛素抵抗的改善作用
王龙霞1,赵先哲1,乔伟伟1*,顾坚忠2,陈立新2
(1. 复旦大学实验动物科学部,上海200032;2. 上海斯莱克实验动物有限责任公司,上海201615)
【摘要】目的建立十二指肠-空肠转流手术(duodenal-jejunal bypass surgery,DJB)动物模型,观察术后GK大鼠胰岛素抵抗情况的变化, 研究DJB手术治疗2型糖尿病的机理。方法雄性Wistar大鼠为空白对照组;雄性GK大鼠分为模型对照组和DJB手术组。分别于手术后3、6和9周每组随机抽取6只动物进行高胰岛素-正葡萄糖钳夹实验;钳夹实验结束后1周,检测肝脏GcK、G6P以及PEPCK mRNA表达情况以及骨骼肌细胞膜GLUT4含量变化。结果术后3周和6周,DJB手术组动物的葡萄糖输注率(GIR)较模型对照组差异无显著性(P>0.05),肝脏GcK、G6P以及PEPCK mRNA表达量较模型对照组差异无显著性(P>0.05);术后9周,DJB手术组动物的葡萄糖输注率(GIR)显著高于模型对照组(P<0.05),肝脏GcK表达量DJB手术组显著高于模型对照组(P<0.05),而G6P以及PEPCK mRNA表达量显著低于模型对照组(P<0.05);DJB手术后3、6和9周,DJB手术组骨骼肌细胞膜GLUT4的含量较模型对照组差异无显著性(P>0.05)。结论DJB手术改善血糖的水平是通过改善体内肝脏组织的胰岛素抵抗,通过调节糖代谢酶的表达,进而提高肝脏葡萄糖摄取并抑制肝脏糖异生作用。在实验周期内,DJB手术对于骨骼肌组织的胰岛素抵抗未发现有明显改善,提示DJB手术治疗2型糖尿病的效果与时间有一定关系。
【关键词】2型糖尿病;GK大鼠;十二指肠-空肠转流术;高胰岛素-正葡萄糖钳夹实验
胰岛素抵抗是指体内胰岛素作用的靶器官或靶组织的胰岛素信号通路的反应性降低或丧失而产生的一系列病理和临床表现,是2型糖尿病的主要发病机制之一,也是其主要病理生理特征之一[1]。
目前在治疗2型糖尿病方面,传统的治疗方法虽然能有效地降低血糖,但是血糖的长期控制不稳定,不能避免2型糖尿病的各种并发症出现和病情进一步加重。20世纪90年代初,Pories发现肥胖者患者在接受胃肠转流手术治疗后,其并发的2型糖尿病病情也得到了良好的改善,且血糖控制也相当稳定。Rou-en-Y术式为最早在临床上应用于治疗2型糖尿病,但其本质还是为减肥手术更适用于肥胖性2型糖尿病患者;十二指肠-空肠转流手术(duodenal-jejunal bypass surgery,DJB)是一类根据“前肠理论”建立的术式,该术式相较Rou-en-Y术式保留了全胃,减少胃大切引发的营养不良、微量元素缺乏等远期并发症,更适用于治疗非肥胖性2型糖尿病患者,是一种风险收益比较高的术式[2]。
根据目前针对胃肠转流手术治疗2型糖尿病机理的研究发现,GLP-1是关键的核心代谢分子[3,4]。体外研究发现,GLP-1能够恢复脂肪细胞和骨骼肌细胞受损的Akt1和Akt2的活性,进而有效地改善细胞的胰岛素抵抗[5]。自发性非肥胖2型糖尿病动物模型GK大鼠是在1973年由Goto与Kakizaki等人在日本仙台通过选择糖耐量处于上限的Wistar大鼠近交繁殖重复数代而来,其具有轻度血糖升高、葡萄糖刺激的胰岛素分泌能力受损等特点[6]。本次研究通过观察GK大鼠经过DJB手术后体内胰岛素抵抗的变化情况,探究DJB手术治疗2型糖尿病的作用机理。
1材料与方法
1.1动物及分组
9~12周龄SPF级雄性Wistar大鼠18只,9~12周龄SPF级雄性GK大鼠36只,体重220~250 g,购自上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002]。饲养于复旦大学实验动物科学部[SYXK(沪)2009-0082],采用普通大鼠饲料喂养,自由活动和饮食。动物饲养室12h昼夜交替,温度为23~25℃。
所有动物分为3组:分别为空白对照组(I组,n=18,Wistar大鼠)、模型对照组(II组,n=18,GK大鼠)、DJB手术组(III组,n=18,GK大鼠)。术前,动物均禁食16 h,给予50 g/L葡萄糖生理盐水溶液自由饮水。
1.2材料
PE-50导管(内径0.58 mm,外径0.99 mm,英国Smith Medical公司);戊巴比妥钠(美国Sigma公司);PVP-10(美国Fisher公司);总RNA 提取试剂盒RNeasy Mini Kit (Qiagen)、逆转录试剂盒iScriptcDNA Synthesis Kit、定量试剂盒iQ Syber Green Supermix Kit (Bio-Rad)、GLUT4多克隆抗体(美国Santa Cruz公司)、β-actin多克隆抗体(美国Santa Cruz公司)、PVDF(美国Dupont公司);Roche血糖仪、荧光定量PCR 仪(Bio-Rad) Gel Doc200 型全自动凝胶成像分析系统(美国Bio-Rad公司);胰岛素(诺和灵30R 400 iU/mL,中国诺和诺德制药有限公司);微量注射泵(美国Harvard Apparatus公司)。
1.3手术方式
手术麻醉前1h,在大鼠的颈后被皮下各注射2 mL的0.9%生理盐水和5%葡萄糖注射溶液。皮下注射阿托品(0.1 mg/kg)20 min后,按30 mg/kg的剂量腹腔注射0.5%戊巴比妥钠作为基础麻醉,手术过程中采用间歇性吸入乙醚维持深度麻醉。手术过程中需注意保持大鼠气道的通畅。动物开腹后于胃窦下离断十二指肠,关闭十二指肠残端,在Treiz韧带处切断空肠,远端肠襻行胃空肠吻合,距吻合口12 cm近端肠襻与空肠作端侧吻合。
1.4高胰岛素-正血糖钳夹实验
分别于DJB手术后的第3、6和9周,每组随机抽取6只动物,大鼠禁食6 h按30 mg/kg的剂量腹腔注射0.5%戊巴比妥钠麻醉,进行左侧颈动脉和右侧颈静脉插管手术,PE-50导管末端由实心不锈钢针封闭并经皮下延续至颈背,固定于颈背部。用300 μL 等渗盐水(肝素40 U/ mL)氨苄青霉素5 g/ L 冲洗导管,后用80% PVP-10 溶液(含肝素300 U/ mL)充满导管防止血液返流。
术后恢复3d,钳夹实验当日禁食16 h,右侧颈静脉导管所接的三通管一侧接装有胰岛素溶液的20 mL注射器,另一侧则接装有25%葡萄糖注射液的20 mL注射器。两侧注射器分别安置于微量注射泵上,开始进行持续注射。钳夹实验开始后,以每分钟4 mU/kg的速度连续输注胰岛素溶液,每5 min使用血糖仪检测血糖值,若测出的血糖值低于基础血糖值(5.3 ±0.5 mmol/L)时,即可以开始进行葡萄糖注射。葡萄糖开始输注后,依旧每5 min监测血糖值,根据血糖值调节葡萄糖输注率(GIR),当连续3次血糖值均在基础血糖值范围内时,即“钳夹形成”,继续上述过程,持续至2 h(胰岛素开始输注时计时)。记录60~120 min的稳态葡萄糖输注率(GIR)(期间每10 min监测血糖值),取稳态下6次葡萄糖输注率的平均值作为最终的葡萄糖输注率值。
1.5分子指标检测
三批动物进行钳夹实验结束后,分别于DJB手术后的第4、7、10周进行处死。处死当日禁食16 h,用50%葡萄糖注射液以葡萄糖2.5 g/kg体重的剂量灌胃。灌胃后60 min处死动物,取肝脏和骨骼肌,用DEPC处理的0.1 mol/L pH7. 4磷酸缓冲液洗涤,剪成约5×5 mm小块,液氮速冻,-70℃保存待测。肝脏组织采用定量PCR检测GcK、G6P以及PEPCK mRNA表达情况,PCR反应条件:引物序列如下:PEPCK:上游引物5′-CCCAGGAAGTGAGGAAGTTTGT-3′,下游引物5′- GGAGCCGTCGCAGATGTG-3′,扩增128 bp (NM2011044);G6P: 上游引物5′-GAGCACCCAATGACTTTAACCTTC-3′,下游引物5′-TATTCTCAGCCAGGTTCCGGT-3′,扩增116 bp (U00445);GcK: 上游引物5′-AGCAGATCCACAACATCCTAAGC-3′下游引物5′-TCCTGCGGAGCACATATGG-3′,扩增200 bp (NM010292);β-actin: 上游引物5-AGAGGGAAATCGTGCGTGAC-3′,下游引物5′-CAATAGTGATGACCTGGCCGT-3′, 扩增138 bp (AY618569) ,为内参基因。mRNA相对含量采用2 (-Delta Delta C ( T)) 方法计算及统计分析;骨骼肌组织采用免疫印迹法检测骨骼肌细胞膜GLUT4的含量[7]。
1.6统计学处理
数据应用SPSS 13.0软件分析,计量资料用均数±标准差描述。采用重复测量方差分析或单因素方差分析进行数据分析。统计结果取双尾值,P<0.05为差异具有统计学意义。
2结果
2.1葡萄糖输注率的变化
DJB手术后3周和6周时,DJB手术组动物的葡萄糖输注率与模型对照组差异无显著性(P>0.05);DJB手术后9周时,DJB手术组动物的葡萄糖输注率显著高于模型对照组(P<0.05)。实验第9周时模型对照组动物的葡萄糖输注率显著低于第3周和第6周时的模型对照组动物(P<0.05);DJB手术组动物在DJB手术后3、6和9周时的葡萄糖输注率差异无显著性(P>0.05)。见图1。

注:* P<0.05, 与模型对照组比较。 图1 各组GK大鼠钳夹实验中葡萄糖输注率变化的比较Note. * P<0.05, vs. model control group. Fig.1 Comparison of the changes of glucose infusion rate during the clamp test in each group
2.2肝脏GcK、G6P及PEPCK mRNA表达的变化
DJB手术后3周和6周,肝脏GcK、G6P以及PEPCK mRNA表达量DJB手术组较模型对照组差异无显著性(P>0.05);DJB手术后9周时,肝脏GcK表达量DJB手术组显著高于模型对照组(P<0.05),G6P以及PEPCK mRNA表达量DJB手术组则显著低于模型对照组(P<0.05)。见图2~4。

图3 各组GK大鼠PEPCK mRNA表达量变化的比较 Fig.3 Comparison of the changes of PEPCK mRNA expression in each group

注:* P<0.05, 与模型对照组比较。 图4 各组GK大鼠G6P mRNA表达量变化的比较Note. * P<0.05, vs. model control group. Fig.4 Comparison of the changes of G6P mRNA expression in each group
2.3骨骼肌细胞膜上GLUT4蛋白含量的变化
DJB手术后3、6和9周,骨骼肌细胞膜GLUT4的含量DJB手术组较模型对照组差异无显著性(P>0.05)。见图5。
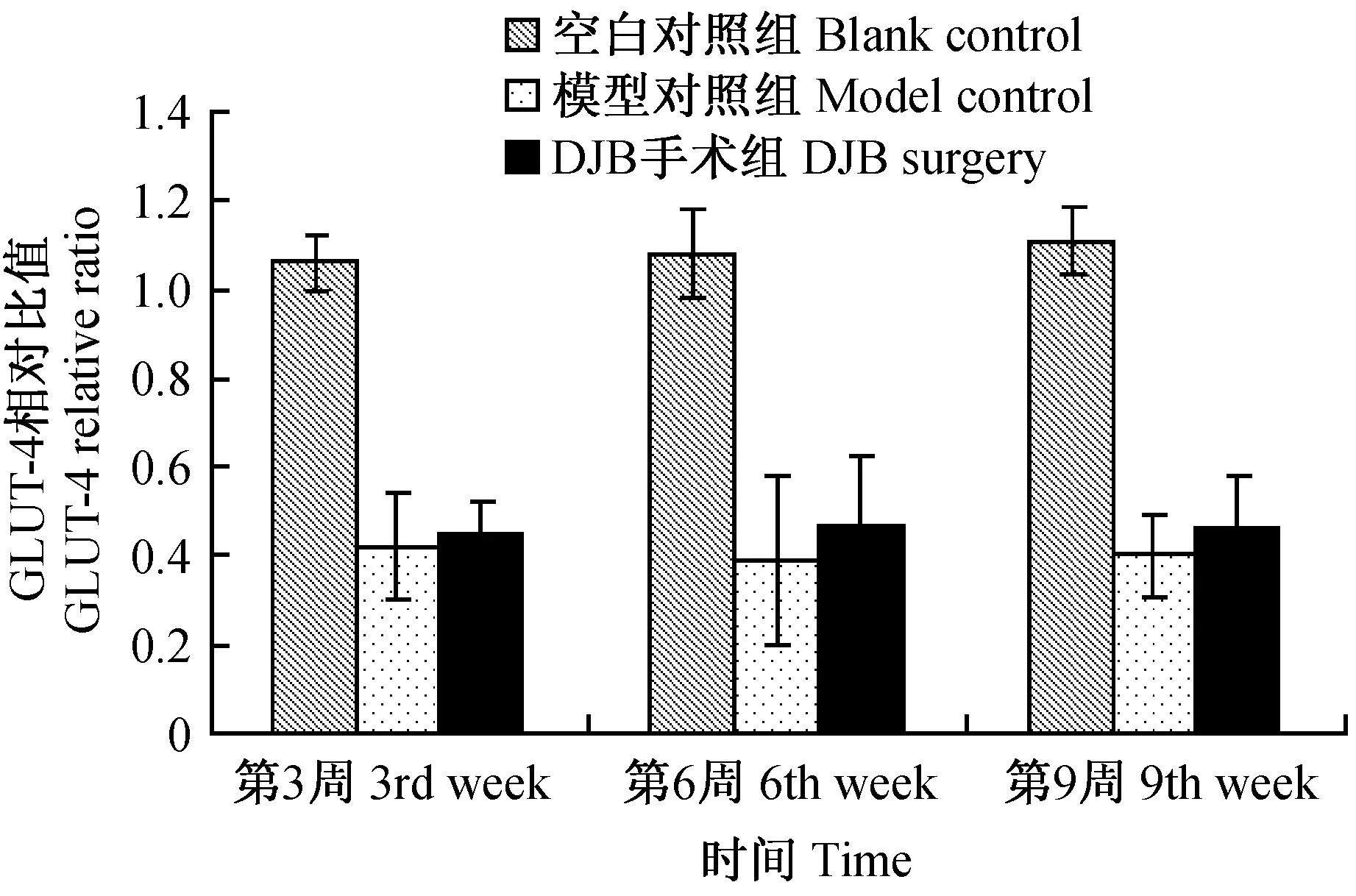
图5 各组GK大鼠GLUT4含量变化的比较 Fig.5 Comparison of the changes of GLUT4 content in each group
3讨论
2型糖尿病的主要发病机制是胰岛素素抵抗,即体内靶器官组织对胰岛素的敏感度下降,抑制了胰岛素信号通路调节能量代谢的作用,导致一系列体内的代谢紊乱[8]。发病初期虽然能够通过胰岛β细胞代偿大量胰岛素,但是相对体内的高血糖环境仍显不足。随着病程的发展,体内的自由基大量产生,导致胰岛β细胞加速凋亡,形成“胰岛素抵抗-胰岛素分泌量不足”的恶性循环[9]。因此目前2型糖尿病的治疗主要通过改善患者的胰岛素抵抗。
GLP-1是一类肠促胰岛素,主要由食物内的营养物质刺激末端回肠和结肠的L细胞合成产生,发挥促进胰岛素分泌的作用,并能刺激胰岛β细胞增殖及新生,另外还具有增强外周组织胰岛素敏感性的作用,如抑制肝糖输出、促进外周组织吸收葡萄糖[10,11]。临床研究发现,2型糖尿病患者血液内GLP-1的分泌量显著减少,导致肠促胰岛素(incretin)和抗-肠促胰岛素(anti-incretin)的分泌平衡破坏,进而引起2型糖尿病病情的进一步发展。
近几年,国内外采用胃旁路术治疗2型糖尿病的效果显著。根据研究显示,胃旁路术治疗2型糖尿病的机制可能与肠-胰岛轴的分泌改变有关,即重建肠促胰岛素(incretin)和抗-肠促胰岛素(anti-incretin)的分泌平衡,由于抗-肠促胰岛素的分泌部位主要分布于十二指肠和空肠即前肠部位,而肠促胰岛素则主要分布于回肠和结肠即后肠部位,胃旁路术则通过前肠的旷置和加快后肠接触营养物质改善肠-胰岛轴的分泌平衡[12,13]。
本实验结果显示, DJB手术实验第9周时,DJB手术组的葡萄糖输注率显著高于模型对照组,说明DJB手术具有治疗2型糖尿病的效果,但是效果显现需要一定时间。通过对每组GK大鼠的纵向分析发现,模型对照组GK大鼠在实验第9周时的葡萄糖输注率显著降低,表明2型糖尿病随着时间推移胰岛素抵抗的情况更为严重;而DJB手术组GK大鼠在实验周期内葡萄糖输注率具有改善趋势,表明GK大鼠经DJB手术后对胰岛素抵抗情况的发展起到了抑制作用。综合葡萄糖输注率检测的横向和纵向结果,提示DJB手术后的前期虽然对GK大鼠的葡萄糖输注率并未有明显改善,但是相较模型对照组在实验周期内葡萄糖输注率的下降,说明DJB手术后的前期能够防止GK大鼠体内的葡萄糖摄取功能随着2型糖尿病的发展而进一步恶化,由于正血糖-高胰岛素钳夹实验是目前检测胰岛素抵抗的“金标准”[14,15],因此提示DJB手术治疗2型糖尿病的机制可能通过控制或改善胰岛素抵抗。
通过分析正血糖-高胰岛素钳夹实验的结果,本实验检测各组大鼠体内胰岛素抵抗靶器官的葡萄糖代谢关键蛋白的变化,研究DJB手术治疗2型糖尿病的分子机理。肝脏是体内维持血糖稳定的重要器官,它既能摄取血液内多余的葡萄糖,又能在血糖水平过低时通过产生内源性葡萄糖满足机体的需求,两者的平衡主要依靠胰岛素调控。在2型糖尿病发病过程中,由于肝脏对胰岛素产生抵抗作用,导致肝脏的摄取葡萄糖和释放葡萄糖平衡被打破,IRS-1信号传导通路缺失引起肝细胞内负责内源性葡萄糖释放的关键酶G6P和PEPCK表达过量而负责摄取葡萄糖的关键酶GcK 的表达受到抑制,从而导致体内的血糖保持较高的水平[16-18]。本实验检测大鼠肝脏GcK、G6P以及PEPCK mRNA表达的情况,在DJB手术后的第3周和第6周时,DJB手术组和模型对照组相比较差异无显著性(P>0.05),而在第9周时DJB手术组GcK mRNA的表达量显著高于模型对照组,G6P和PEPCK mRNA的表达量则显著低于模型对照组,此结果与钳夹实验的结果相符,另外也提示DJB手术治疗2型糖尿病的分子机制可能是通过肠道结构重构后提高体内GLP-1 的分泌量从而改善机体的胰岛素抵抗。根据相关体外研究报道,GLP-1能够通过同时恢复Akt1和Akt2的活性修复胰岛素抵抗细胞的PI3K/Akt通路,从而促使由胰岛素调控的葡萄糖摄取,改善机体的血液葡萄糖水平。
骨骼肌是体内由胰岛素介导摄取葡萄糖的主要组织之一,而GLUT4是骨骼肌主要的葡萄糖转运载体,仅在胰岛素的作用下由细胞内的贮存囊泡转运至细胞膜上[19]。根据检测大鼠骨骼肌细胞膜GLUT4含量的结果,在DJB手术后的第3周、第6周和第9周时,DJB手术组和模型对照组相比较无显著差异(P>0.05)。体内葡萄糖的摄取与骨骼肌细胞膜上GLUT4的含量有着密切的联系,钳夹实验的葡萄糖输注率结果在手术后9周时DJB手术组显著高于模型对照组, Rubino等的研究显示GK大鼠经DJB手术后葡萄糖耐量会有显著提高,而骨骼肌细胞膜GLUT4含量检测结果与上述结论有所不符。一方面,由于骨骼肌是在葡萄糖耐量实验血糖达到峰值时取材;另一方面,根据文献报道GLP-1在机体内能够被二肽酶IV(DPPIV)迅速降解,在体内的半衰期仅为2 min左右[20,21],而本次研究的实验周期为9周,根据文献报道DJB手术后GK大鼠的GLP-1水平的恢复与时间有一定关系,因此该原因也可能与本次研究中骨骼肌细胞膜GLUT4含量未见改善有关。
根据本次研究各项结果, DJB手术治疗2型糖尿病的分子机制主要通过提高机体内GLP-1的水平[22],增强葡萄糖摄取的肝脏组织对胰岛素的敏感度,使肝脏能够调控摄取和释放葡萄糖的平衡。另外,骨骼肌细胞膜GLUT4含量检测结果也提示DJB手术的治疗效果并不能在短期内完全体现,需要一定时间才能使2型糖尿病患者在各方面得到相应的改善。本次研究只是初步观察DJB手术的短期效果,而DJB手术治疗2型糖尿病的分子机制的全面了解还有待DJB手术长期效果的观察和研究。
参考文献
[1]Suzuki R, Tobe K, Aoyama M, et al. Both insulin signaling defects in the liver and obesity contribute to insulin resistance and cause diabetes in Irs2-/-mice [J]. J Biol Chem. 2004, 279(24): 25039-25049.
[2]Rubino F, Marescaux J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease [J]. Ann Surg. 2004, 239(1): 1-11.
[3]de Luis D, Domingo M, Romero A, et al. Effects of duodenal-jejunal exclusion on beta cell function and hormonal regulation in Goto-Kakizaki rats [J]. Am J Surg. 2012, 204(2): 242-247.
[4]Rubino F, Forgione A, Cummings DE, et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes [J]. Ann Surg. 2006, 244(5): 741-749.
[5]朱慧丽, 翁泽平, 林琛莅, 等. GLP-1通过下调ATGL表达参与3T3-L1脂肪细胞脂质代谢 [J]. 南方医科大学学报, 2013, 33(10): 1499-1503.
[6]赵先哲, 乔伟伟. GK糖尿病大鼠发病机理的研究进展 [J]. 实验动物与比较医学, 2011, 31(2): 140-146.
[7]赵先哲, 乔伟伟. 表没食子儿茶素没食子酸酯对大鼠胰岛素抵抗的影响 [J]. 中国实验动物学报, 2011, 19(6): 489-494.
[8]Castagneto-Gissey L, Mingrone G. Insulin sensitivity and secretion modifications after bariatric surgery [J]. J Endocrinol Investig, 2012, 35(7): 692-698.
[9]Cho H, Mu J, Kim JK, et al. Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2 (PKB beta) [J]. Science, 2001, 292(5522): 1728-1731.
[10]Lee YS, Park MS, Choung JS, et al. Glucagon-like peptide-1 inhibits adipose tissue macrophage infiltration and inflammation in an obese mouse model of diabetes [J]. Diabetologia, 2012, 55(9): 2456-2468.
[11]Kindel TL, Yoder SM, Seeley RJ, et al. Duodenal-jejunal exclusion improves glucose tolerance in the diabetic, Goto-Kakizaki rat by a GLP-1 receptor-mediated mechanism [J]. J Gastrointest Surg, 2009, 13(10):1762-1772.
[12]de Moura EG, Martins BC, Lopes GS, et al. Metabolic improvements in obese type 2 diabetes subjects implanted for 1 year with an endoscopically deployed duodenal-jejunal bypass liner [J]. Diabetes Technol Ther, 2012, 14(2):183-189.
[13]Salinari S, Bertuzzi A, Asnaghi S, et al. First-phase insulin secretion restoration and differential response to glucose load depending on the route of administration in type 2 diabetic subjects after bariatric surgery [J]. Diabetes Care. 2009, 32(3): 375-380.
[14]Ahren B, Pacini G. Importance of quantifying insulin secretion in relation to insulin sensitivity to accurately assess beta cell function in clinical studies [J].Eur J Endocrinol, 2004, 150: 97-104.
[15]贾伟平, 陈蕾, 项坤三, 等. 扩展高胰岛素-正葡萄糖钳夹技术的建立 [J].中华内分泌代谢杂志, 200l, 17: 268-271.
[16]Pacheco D, de Luis DA, Romero A, et al. The effects of duodenal-jejunal exclusion on hormonal regulation of glucose metabolism in Goto-Kakizaki rats [J]. Am J Surg. 2007, 194(2): 221-224.
[17]Valverde AM, Burks DJ, Fabregat I, et al. Molecular mechanisms of insulin resistance in IRS-2-deficient hepatocytes [J]. Diabetes. 2003, 52(9): 2239-2248.
[18]Brozinick JT Jr, Roberts BR, Dohm GL. Defective signaling through Akt-2 and -3 but not Akt-1 in insulin-resistant human skeletal muscle: potential role in insulin resistance[J]. Diabetes. 2003, 52: 935-941.
[19]Corcoran MP, Lamon-Fava S, Fielding RA. Skeletal muscle lipid deposition and insulin resistance: effect of dietary fatty acids and exercise [J]. Am J Clin Nutr. 2007, 85: 662-677.
[20]Umpierrez GE, Meneghini L. Reshaping diabetes care: the fundamental role of DPP-4 inhibitors and glucagon-like GLP-1 receptor agonists in clinical practice [J]. Endocr Pract, 2013, 19(4): 718-728.
[21]Kim Chungle T, Hosaka T, Yoshida M, et al. Exendin-4, a GLP-1 receptor agonist, directly induces adiponectin expression through protein kinase A pathway and prevents inflammatory adipokine expression [J]. Biochem Biophys Res Commun, 2009, 390(3): 613-618.
[22]陈立新, 赵先哲, 乔伟伟, 等. 保留不同长度十二指肠的DJB术后GK大鼠肠道激素的研究 [J].实验动物与比较医学, 2014, 34(3): 223-227.
研究报告
Amelioration effect of duodenal-jejunal bypass surgery on
insulin-resistance in Goto-Kakizaki rats
WANG Long-xia1,ZHAO Xian-zhe1,QIAO Wei-wei1,GU Jian-zhong2,CHEN Li-xin2
(1.Department of Laboratory Animal Science,Fudan University,Shanghai 200032,China;
2. Shanghai SLAC Laboratory Animal CO. LTD,Shanghai 201615)
【Abstract】ObjectiveTo establish a Goto-Kakizaki (GK) rat model of duodenal-jejunal bypass(DJB) and observe the changes in insulin-resistance after surgery, and to explore the mechanism of DJB surgery in treatment of type 2 diabetes mellitus. MethodsMale Goto-kakizaki diabetic rats(GK,n=36)were used as experiment group and 18 healthy male Wistar rats as blank group. GK rats were randomly divided into two groups: diabetic control group and DJB surgery group (n=18). Euglycemic-hyperinsulinemic clamp technique was performed in 6 rats randomly taken from each group at third week, sixth week and ninth week after surgery, respectively. The expression levels of Gck, G6P, PEPCK mRNA in the liver and GLUT4 content on skeletal muscle cell plasma membrance were detected one week after the clamp test. ResultsIn the DJB surgery group at the end of third week and sixth week after surgery, the levels of glucose infusion rates and the expression levels of Gck, G6P, PEPCK mRNA in the liver showed no statistically significant difference as compared with the diabetic control group (P>0.05). In the DJB surgery group at the end of 9th week after surgery, the glucose infusion rate and expression level of Gck mRNA in the liver were significantly higher, and the expression of G6P and PEPCK mRNA was significantly lower than those in the diabetic control group (P<0.05 for all). At the three time points (3rd week, 6th week and 9th week after surgery), there was no significant difference in the GLUT4 content on skeletal muscle cell plasma membrane between the diabetic control group and DJB surgery group (P>0.05 for all). ConclusionsOur results indicate that the mechanism of DJB surgery improving blood glucose level may be closely related to the amelioration of insulin-resistance in the liver, thereby augmenting glucose uptake and inhibiting gluconeogenesis in liver through the regulation of glucose metabolism-related enzymes. There is no significant improvement in insulin-resistance in the skeletal muscles during the experiment period. This result implies that the effect of DJB surgery on type 2 diabetes is related to the duration of therapy.
【Key words】Type 2 diabetes mellitus; Goto-Kakizaki rats; Duodenal-jejunal bypass surgery;Euglycemic-hyperinsulinemic clamp technique; Insulin resistance
[收稿日期]2014-11-03
Doi:10.3969/j.issn.1005-4847.2015.02.011
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2015) 02-0159-06
[通讯作者]乔伟伟(1968-),男,副主任技师,硕士生导师,从事实验动物的教学、科研及管理。E-mail: qiaoww@shmu.edu.cn
[作者简介]王龙霞(1988-),女,在读硕士研究生,主要从事实验动物营养的研究。E-mail: 12211120002@fudan.edu.cn
[基金项目]上海市科学技术委员会科研计划项目(No.11140900702)。

