小鼠左肺原位移植模型的建立
贺仕才,仇广林,王泽兴,车向明,David. S Wilkes,谯瞧,卢靖,樊林*
(1. 西安交通大学第一附属医院普通外科,西安 710061;2. 美国印第安纳大学医学院,印第安纳波利斯 46202)
小鼠左肺原位移植模型的建立
贺仕才1,仇广林1,王泽兴1,车向明1,David. S Wilkes2,谯瞧1,卢靖1,樊林1*
(1. 西安交通大学第一附属医院普通外科,西安710061;2. 美国印第安纳大学医学院,印第安纳波利斯46202)
【摘要】目的通过显微外科技术建立小鼠原位肺移植模型,为肺移植研究提供动物模型。方法采用C57BL/6小鼠作为供、受体,行同基因小鼠原位左肺移植,使用Cuff套管法进行气管及血管吻合。术后7、14、21、28 d取移植肺及原肺,行HE染色,评价肺移植后效果。结果学习曲线后, 共30例小鼠移植,手术成功率89%,小鼠成活率100%。供体手术时间:(35.2±9.81 )min,受体手术时间:(24.6±7.42) min,冷缺血时间是:(46.6±8.92 )min,热缺血时间是:(17.2±3.08 )min。同基因移植物大体及病理无明显改变,病理显示与原肺无差别。结论本技术能够方便快捷建立小鼠肺移植模型,成功率高,可重复性强,符合原位肺移植临床生理,是研究肺移植发病机制和治疗的良好动物模型。
【关键词】原位肺移植;动物模型;小鼠
肺移植是终末期肺病重要的治疗手段,自1963年Hardy等[1]首次尝试肺移植至今,肺移植已取得了巨大进步,但其生存率远远低于其他移植,ISHLT[2]报道,肺移植后5 年生存率仅52%,10 年生存率仅29%。但目前肺移植后相关病理变化及其机制尚未完全阐明,因此建立动物模型来研究其机制,寻找治疗手段显得尤为重要。既往都以大动物及大鼠为动物模型,但对于免疫排斥研究都有其局限性,故尝试小鼠肺移植模型一直没有间断过。本实验通过显微外科技术建立小鼠原位肺移植模型,为该领域的研究提供重要的模型参考。
1材料与方法
1.1材料
1.1.1 实验动物
SPF 级C57BL/6 小鼠30只,雄性,体重25~30 g,购于西安交通大学医学院动物实验中心【SCXK(陕)2012-003】。实验动物操作及取材均于西安交通大学动物实验中心实验设施内进行【SCXK(陕)2012-005】。所有研究均遵守西安交通大学医学院实验动物管理办法。
1.1.2实验药品、手术器械及实验用设备
动物用吸入麻醉药物异氟醚,肝素,生理盐水,林格氏液。立式手术显微镜(40倍),小动物麻醉呼吸机,20G、22G、24G套管针。常规切开缝合器械,显微镊子,显微血管钳,显微剪刀,5-0、9-0线,纱布,棉签,1 mL和3 mL注射器,胸腔拉钩等。
1.2方法
1.2.1套管制备
套管采用静脉留置针制作,支气管为20G套管,长约1 mm,尾端长约0.7 mm;肺动脉为24G套管,长约0.5 mm,尾端长约0.7 mm;肺静脉套管长度根据供体小鼠体重决定:25~27 g的小鼠采用22G套管,长约0.7 mm,尾端长约0.7 mm,27~30 g的小鼠采用相同长度的20G套管。套管尾不超过管周径1/3,套管表面以砂纸打磨以利于吻合固定(图1)。
1.2.2建立小鼠原位左肺移植模型
(1)供者手术
常规选取25~30 g雄性小鼠,经5%异氟醚诱导后以20G导管气管插管行全身麻醉。连接麻醉机以100%氧气、心率125 次/分 和2 cm H2O 呼气末正压进行通气,异氟醚维持在1%~2%。麻醉成功后,取仰卧位,70%酒精消毒,取腹正中十字切口切开腹壁,暴露下腔静脉,注射0.1 mL(100 U/kg体重)肝素,牵出肝镰状韧带,向两侧剪开膈肌,以棉签保护肺脏,经胸廓两侧剪开胸廓至第1肋,去除颈周皮肤和肌肉,将胸廓牵向头侧,去除胸腺及脂肪组织,充分暴露肺及心脏,剪开剪断下腔静脉及左心耳,经肺动脉干根部以4℃肝素化林格氏液2 mL,10 cm H2O压力,灌注肺脏,肺为白色后,固定气管头端,游离切断气管,连同心脏及双肺切除后取出组织块(图2)。
(2)供肺准备
将供鼠心、肺置于冰、水混合物上,首先用镊子固定气管和食管,将食管向尾端牵拉,去除食管,然后夹住降主动脉和肺韧带周围的胸膜,将主动脉牵向头侧,清晰暴露出左侧肺门,固定肺动脉,分离肺动脉与支气管,分至肺动脉分叉处,离断左肺动脉,去除气管隆突周围的脂肪组织,暴露左主支气管,并于气管分叉处离断左主支气管,去除左心房周围的脂肪组织,暴露肺静脉,离断左肺静脉。肺动脉使用24G Cuff 套管固定,支气管使用20G Cuff 套管固定,肺静脉根据小鼠体重选用相应型号Cuff套管,均从套管尾端穿入,头端穿出,外翻以9-0丝线固定于套管上。供肺以生理盐水浸润的纱布包裹,置于冰水混合物上等待移植(图3)。以微血管夹夹闭支气管以防止保存液进入气道。
(3)受体手术
受体同样方法全麻后,取右侧卧位,剔除胸部毛发,70%乙醇消毒,经左侧第三肋间隙开胸,牵开胸廓,棉签拨开左肺,暴露并切断左肺下韧带,首先牵出左肺暴露肺门背面,肺动脉位于肺门的头侧,支气管位于中间,肺静脉位于尾侧,以棉签钝性分离周围的脂肪组织,然后于肺门前面分离左肺动静脉及支气管。于根部夹闭肺门,血管和气管置9-0丝线待固定用。分别在肺动静脉及支气管前壁开一小切口,长约1/4管径。取出供肺,将肺动脉套管经切口插入受体肺动脉,固定套管尾端以保持组织稳定,以预置的 9-0丝线固定,同样方式完成肺静脉吻合和支气管吻合,去除肺门夹钳。(图4)膨肺后查无损伤,5-0 丝线关胸,以30G钝头注射器抽出胸廓内气体,缝合皮肤。停止麻醉,受体苏醒后放置暖箱内吸氧恢复。1~2 h后即可恢复正常活动。
1.2.3病理组织学检查
小鼠以氯胺酮 (50 mg/kg)/甲苯噻嗪(10 mg/kg)处死,获取右肺和移植左肺,戊二醛固定,石蜡包埋。肺组织切片行HE染色观察双肺病理情况。
2结果
2.1手术效果
学习曲线后,共30例小鼠移植,手术成功率89%,小鼠成活率100%。供体手术时间:(35.2±9.81) min,受体手术时间:(24.6±7.42 )min,平均手术时间(59.8±17.32)min,冷缺血时间(46.6±8.92 )min,热缺血时间(17.2±3.08) min。

注:a:套管模拟图;b:自上而下依次是支气管套管、肺静脉套管、肺动脉套管。 图1 套管的制备Note.a:Cuff model;b:Top to bottom are the cuffs for bronchial, pulmonary vein, and pulmonary artery. Fig.1 Preparation of the cuffs
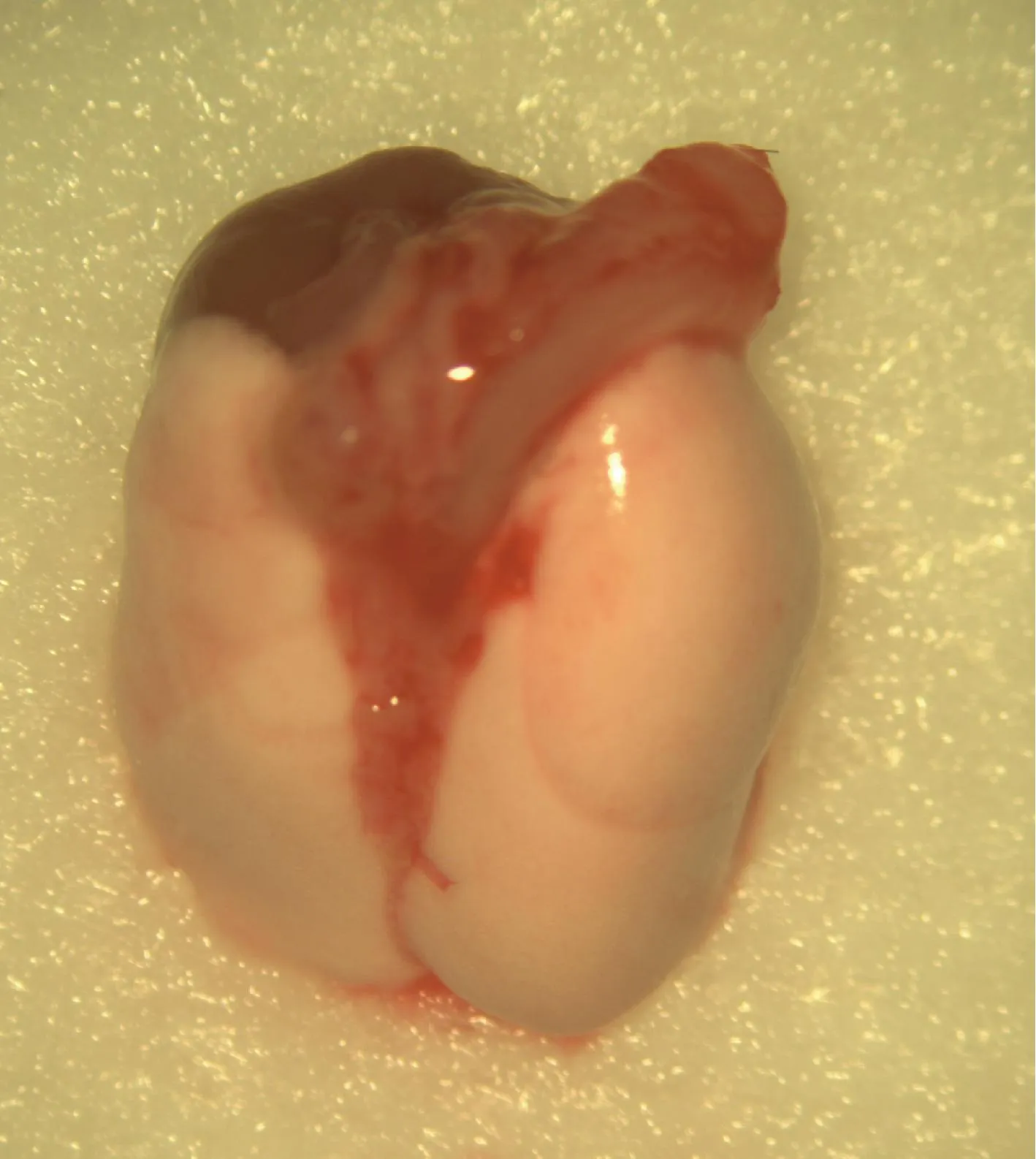
图2 离体的心肺组织块 Fig.2 The excised heart-lung block

图3 套管固定后的供肺 Fig.3 A donor lung after fixation with all cuffs
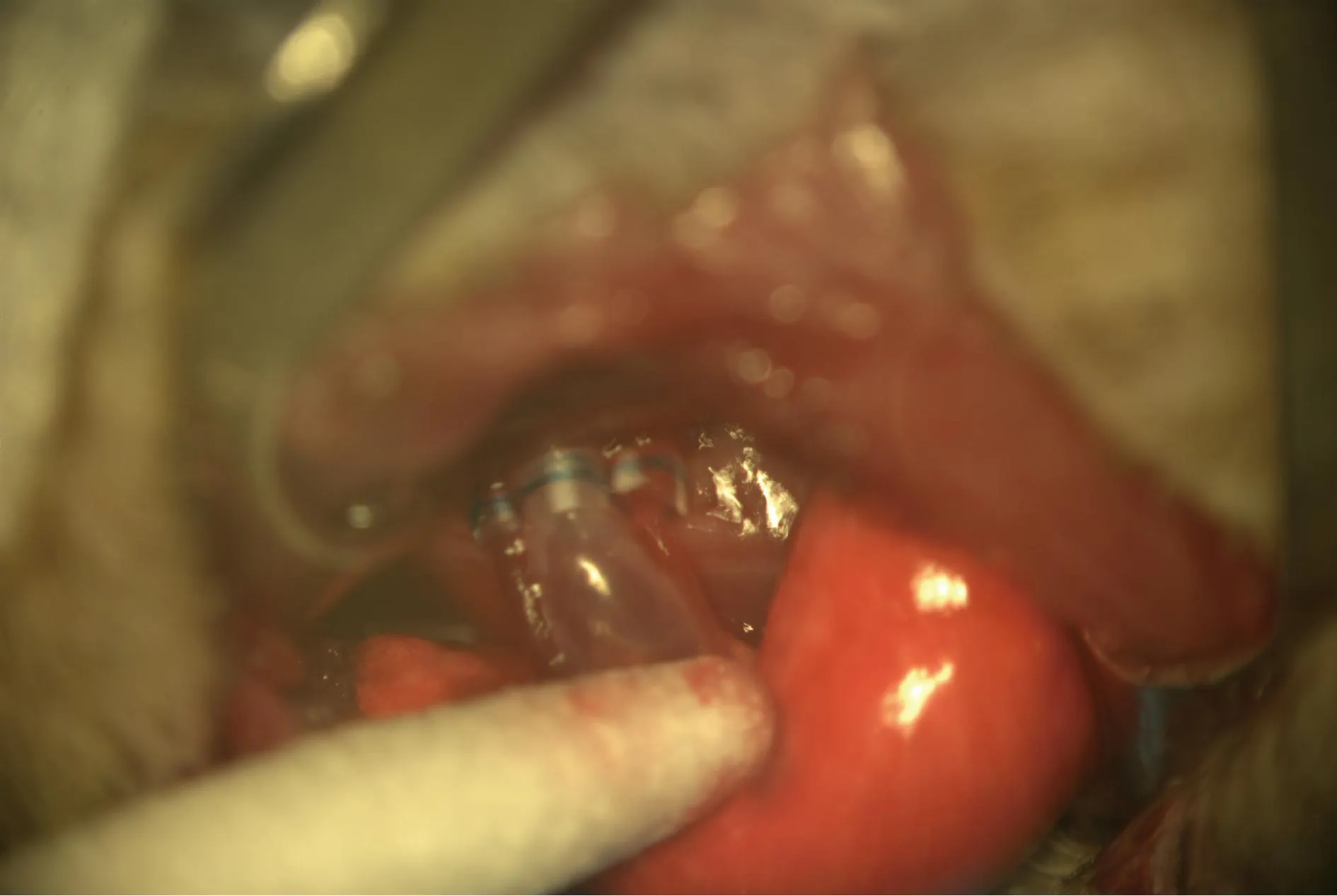
图4 套管固定的供肺血管、支气管与受体肺完成吻合 Fig.4 Anastomosis of the donor pulmonary vein, pulmonary artery and bronchus with the recipient lung.
2.2移植肺大体及病理结果
同基因移植物随时间增加大体无显改变(图5),病理显示移植肺结构正常,肺泡通气良好,与原肺无明显差异(图6)。

图5 移植肺肉眼观 Fig.5 Macroscopic appearance of the graft lung

图6 移植肺病理表现 Fig.6 Histological appearance of the graft lung tissue.
3讨论
肺移植患者长期生存率低于许多实质器官移植患者,然而对于肺移植后相关的生物学变化却知之甚少,因此肺移植动物模型的建立对于这一领域的研究具有重要的意义。1993年Hertz等[3]提出异位气管移植模型,该模型反映了部分肺移植后生物学改变,并得到广泛应用,对肺移植后相关病理变化及相关机制的研究具有重要意义。此后科研工作者建立了原位气管移植模型[4]、肺内气管移植模型[5]、原位肺移植模型[6]等,在这些模型中,原位肺移植模型最为符合生理,并接近人类肺移植过程,是研究肺移植的良好动物模型。
大动物原位肺移植模型操作方便,但大动物特殊的饲养条件、高昂的费用等限制了其应用,因此啮齿类动物成为良好的选择。而相对于大鼠,小鼠具有饲养方便、品系纯正、遗传背景明确的优点,而基因敲除、转基因小鼠的应用都极大地方便了研究。但是在小动物中,传统的吻合技术存在着操作困难、手术时间长、动物死亡率高等缺点,而cuff套管技术的引入极大地方便了原位肺移植模型的建立[7]。本研究通过显微外科采用cuff套管技术成功建立小鼠原位肺移植模型,为肺移植研究提供动物模型。
该模型在制作过程中应注意以下几点:①供肺灌注时压力不宜过大,否则易造成肺水肿,导致移植后成活率下降;②小鼠体重在25~30 g较为适宜,低于25 g不利于操作,而高于30 g过多的脂肪组织影响操作的安全性;③由于肺静脉部分膜组织和血管壁比较脆弱且易于剪切,分离支气管与血管时,应尽量使用锐性分离;④受体肺动脉残余外膜应尽量清除以避免造成假道;⑤肺静脉吻合是手术操作难点,因为肺静脉管壁菲薄,极易撕裂,应先行套管;⑥受体气管及血管切口应小于供体套管直径,切口过长可能导致进一步的撕裂;⑦套管固定位置的脂肪组织应尽可能去除,否则可能导致管腔狭窄和感染的发生;⑧确保血管分离长度足够,周围附着的脂肪和结缔组织尽可能清除干净,否则可能导致套管插入困难;⑨对于吻合位置出血,一般采用棉棒压迫约5 min可止血;⑩要注意肺静脉套管的位置和方向,避免气管套管的压迫,以免造成肺静脉血流受阻;受体肺静脉分支的位置和形状存在变异,切口应根据具体情况决定,如分叉较高,可选取共同开口处进行切开。
本技术能够方便快捷建立小鼠肺移植模型,成功率高,可重复性强,符合原位肺移植临床生理,是研究肺移植后相关生物学变化及其机制的良好动物模型。
参考文献
[1]Hardy J, Webb W, Dalton M, et al. Lung homotransplantation in man [J]. Transplantation, 1964, 2(6): 811.
[2]Christie JD, Edwards LB, Aurora P, et al. The registry of the International Society for Heart and Lung Transplantation: twenty-sixth official adult lung and heart-lung transplantation report—2009 [J]. J Heart Lung Transplant, 2009, 28 (10): 1031-1049.
[3]Hertz M, Jessurun J, King M, et al. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways [J]. Am J Pathol, 1993, 142 (6): 1945-1951.
[4]Ikonen TS, Brazelton TR, Berry GJ, et al. Epithelial re-growth is associated with inhibition of obliterative airway disease in orthotopic tracheal allografts in non-immunosuppressed rats[J]. Transplantation, 2000, 70 (6): 857-863.
[5]Dutly AE, Andrade CF, Verkaik R, et al. A novel model for post-transplant obliterative airway disease reveals angiogenesis from the pulmonary circulation [J]. Am J Transplantation, 2005, 5(2): 248-254.
[6]Okazaki M, Gelman AE, Tietjens JR, et al. Maintenance of airway epithelium in acutely rejected orthotopic vascularized mouse lung transplants [J]. Am J Resp Cell Mol Biol, 2007, 37 (6): 625-630.
[7]Mizuta T, Kawaguchi A, Nakahara K, et al. Simplified rat lung transplantation using a cuff technique [J]. J Thorac Cardiovasc Surg, 1989, 97 (4): 578-581.
研究报告
Establishment of a mouse model of orthotopic lung transplantation
HE Shi-cai1, QIU Guang-lin1, WANG Ze-xing1, CHE Xiang-ming1, David S Wilkes2, QIAO Qiao1, LU Jing1, FAN Lin1
(1. Department of General Surgery, the First Affliated Hospital, Medical School of Xi’an Jiaotong University,
Xi’an 710061, China; 2. Indiana University School of Medicine, Indianapolis U.S.A.)
【Abstract】ObjectiveTo investigate the lung transplantation by establishing an orthotopic mouse lung transplantation model by microsurgery. Methods Thirty SPF male C57BL/6 mice served as both recipient and donor. Orthotopic lung transplantation models were established in the mice by three-cuff anastomotic technique. Native and transplanted lung tissue samples were taken at 7, 14, 21 and 28 days after transplantation for pathological evaluation of the outcomes using HE staining. ResultsAfter learning curve, 30 mice received transplantation. All mice survived and the success rate of lung transplantation was 89%. The donor operation time was 35.2±9.81 min and recipient operation time was 24.6±7.42 min. Mean cold ischemia time was 46.6±8.92 min, and warm ischemia time was 17.2±3.08 min. No histological alterations were routinely detected in the isograft lungs at all times post-transplantation compared with the native lungs. ConclusionsMouse lung transplantation model can be successfully established by the established technique with a high success rate and excellent reproducibility, and is in accordance with the physiology of clinical orthotopic lung transplantation. It is a good animal model for studying the pathogenesis and treatment of lung transplantation.
【Key words】Orthotopic lung transplantation; Animal model; Mouse
[收稿日期]2015-01-15
Doi:10.3969/j.issn.1005-4847.2015.02.002
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2015) 02-0115-04
[通讯作者]樊林,男,博士,副主任医师,研究方向:移植免疫。Email: linnet@mail.xjtu.edu.cn。
[作者简介]贺仕才(1987-),男,博士,研究方向:器官移植。Email: hsc099@stu.xjtu.edu.cn。
[基金项目]国家自然科学基金面上项目(81270150);陕西省科技研究国际合作项目(2012KW-41)。

