Lewis肺癌细胞与其衍生细胞系的比较
王菲,谭娟,曹友德
(重庆医科大学病理教研室,重庆 400016)
Lewis肺癌细胞与其衍生细胞系的比较
王菲,谭娟,曹友德*
(重庆医科大学病理教研室,重庆400016)
【摘要】目的对比Lewis肺癌细胞(LLC)及LLC原位接种后获得的第一代衍生细胞(R1-LLC)和R1-LLC原位接种后获得的第二代衍生细胞(R2-LLC)间的生物学特性,比较该三种细胞在原位种植模型中的侵袭转移能力。方法离体实验:采用cck8法、克隆球形成实验、Tanswell侵袭试验分别检测细胞的增殖、侵袭能力,透射电镜观察细胞和组织的结构形态;活体实验:观察在7、14、21 d时LLC、R1-LLC、R2-LLC细胞分别原位种植模型中的成瘤与转移情况,统计成瘤率与成瘤时间。结果LLC、R1-LLC、R2-LLC细胞的增殖能力差异无显著性(P>0.05),侵袭能力R2-LLC>R1-LLC>LLC(P<0.05)。活体实验显示LLC、R1-LLC、R2-LLC成瘤率分别为66.67%、80%、93.33%(P<0.05)。结论在离体及活体实验中,R2-LLC比R1-LLC及LLC细胞具有更强的侵袭及转移特性。
【关键词】LLC肺癌;原位种植模型;绿色荧光蛋白;小鼠
肺癌目前占世界癌症死因的第一位,是世界上发病率和死亡率较高的恶性肿瘤之一,肺癌总体治疗效果目前仍不理想,整体5年生存率在15%左右[1]。目前动物模型是研究肿瘤的重要手段,而分子成像能在活体动物和细胞水平上直观的将肿瘤的发生过程直观的演示出来[2,3],本研究将比较可稳定遗传GFP(green fluorescent protein绿色荧光蛋白)的LLC及R1-LLC、R2-LLC细胞间的生物学特性及各自在原位种植模型中的成瘤及转移情况。
1材料与方法
1.1材料
1.1.1细胞
小鼠LLC细胞由加利佛利亚大学圣地亚哥分校的霍夫曼博士(Dr. Robert Hoffman)友情提供,为具有稳定遗传GFP的Lewis肺癌细胞[4]。
1.1.2实验动物
SPF级C57BL/6小鼠90只,雌性,8周龄,18~20 g,购于重庆医科大学实验动物中心【SCXK(渝)2012-0001】。无菌手术及小鼠组织取材均在重庆医科大学实验动物中心SPF级动物实验设施内进行【SYXK(渝)2012-0001】。
1.2方法
1.2.1细胞培养及原代细胞系的建立
用含10%胎牛血清的DMEM培养基,放入37℃、5% CO2培养箱中常规培养。用Matrigel胶包裹LLC细胞,原位种植于C57小鼠肺部,14d后解剖小鼠,取肺部原位肿瘤做原代培养,得第一代衍生细胞系(R1-LLC),多次传代培养后,再用Matrigel胶包裹R1-LLC细胞,原位种植于C57小鼠肺部,14 d后取肺部原位肿瘤做原代培养,得第二代衍生细胞系(R2-LLC)。
1.2.2CCK-8实验
分别收集LLC、R1-LLC、R2-LLC对数生长期的细胞;按每100 μL含4000个细胞的悬液接种于96孔板中。每组15个孔,将培养板在37℃、5% CO2培养箱孵育120 h,期间每隔24 h用CCK-8法检测细胞增殖情况。检测时,向每孔中加入10 μL CCK-8溶液,继续孵育2 h,每个时间点设3个复孔,然后用酶标仪测在450 nm处的光密度(A)值,取平均值。以加入等量的细胞培养基及CCK-8溶液但无细胞的孔作为空白对照。所得数据以天数为横轴,A值为纵轴绘制生长曲线。
1.2.3克隆形成实验
按每孔50个细胞量接种于6孔板,在37℃、5% CO2培养箱培养14 d,待形成克隆球后,弃去上清液,PBS清洗2次,加4%多聚甲醛2 mL固定细胞20 min,加苏木素染色5 min后流水冲洗,室温干燥克隆计数(≥50个细胞为1个克隆)。平板克隆形成率=形成克隆数/接种细胞数 × 100%。实验重复3次。
1.2.4Transwell侵袭试验
在Transwell小室中加入1∶6稀释的Matrigel 60 μL,37℃孵育4 h,在上室中加入300 μL含5×104个细胞的无血清细胞悬液,下室加入800 μL含10%胎牛血清完全培养基。37℃、5% CO2培养箱中培养24 h。取出小室,用棉签擦净小室上层的Matrigel及未穿过的细胞,冰甲醇固定20 min,苏木素染色5 min,蒸馏水冲洗,风干。3个重复小室,显微镜观察计数,取平均值。
1.2.5透射电镜观察细胞
常规培养细胞后收集于1.5 mL EP 管中离心1500 r/10 min。吸出上清液,加入预冷的4%戊二醛固定液,4℃固定1~1.5 h[5]后直接在EP 管中进行常规电镜样品固定、脱水和包埋,观察拍照。
1.2.6动物实验
收集细胞,无血清DMEM清洗3次,用PBS重悬,计数;再将细胞悬液与Matrigel按1∶1混匀[6],每只小鼠接种20μL 细胞悬液(含105个细胞)。原位种植方法:用0.1%戊巴比妥钠溶液每只0.2 mL腹腔注射麻醉小鼠,酒精消毒小鼠左侧胸壁皮肤,于小鼠左侧肩胛骨下做0.5 cm纵行切口,分离皮肤及皮下组织暴露至胸壁,用1 mL胰岛素注射器于肺实质中注射细胞悬液,停留5 s后拔针,缝合伤口[7]。从7~21 d,每组每周处死5只小鼠。解剖后使用Sellstrom Z87荧光护目镜和LDP470 nm蓝色光手电筒观察GFP阳性病灶[8]及转移情况。
1.2.7病理学检测
取肺肿瘤组织脱水,石蜡包埋,切片,做HE染色,显微镜下观察。
1.2.8组织透射电镜
取肺肿瘤组织切成1 mm3大小固定于预冷的4%戊二醛中, 做电镜检测,观察拍照。
1.2.9统计学分析
数据采用SPSS 16.0软件处理,将统计数据采用方差检验、卡方检验,以P<0.05有统计学意义。
2结果
2.1LLC、R1-LLC及R2-LLC细胞生长曲线
在荧光显微镜下观察细胞呈梭形生长(图1A),胞核呈绿色荧光(图1B),在连续5d的测量中,细胞均于传代后第2 天进入缓慢增殖期,第3 天达快速生长期,第4 天进入缓慢减速期(图2)。采用方差分析,P>0.05为无统计学意义,即三种细胞之间的增殖能力没有显著性差异。
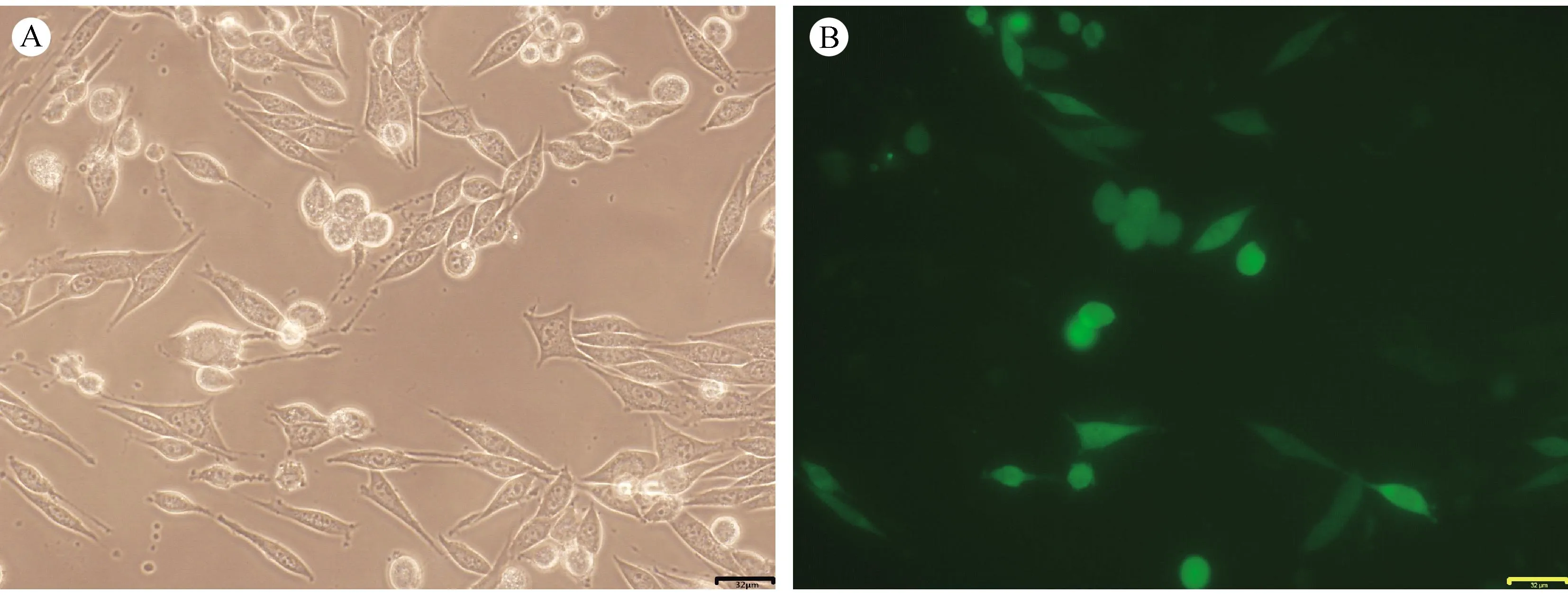
注:A.白光下LLC细胞;B.绿色荧光的细胞核(bar=32μm)。 图1 荧光显微镜下LLC细胞Note. A. LLC cells under white light microscope; B. GFP expression in the cell nuclei, under fluorescence microscope.(bar=32 μm). Fig.1 Fluorescence micrographs of cultured LLC cells
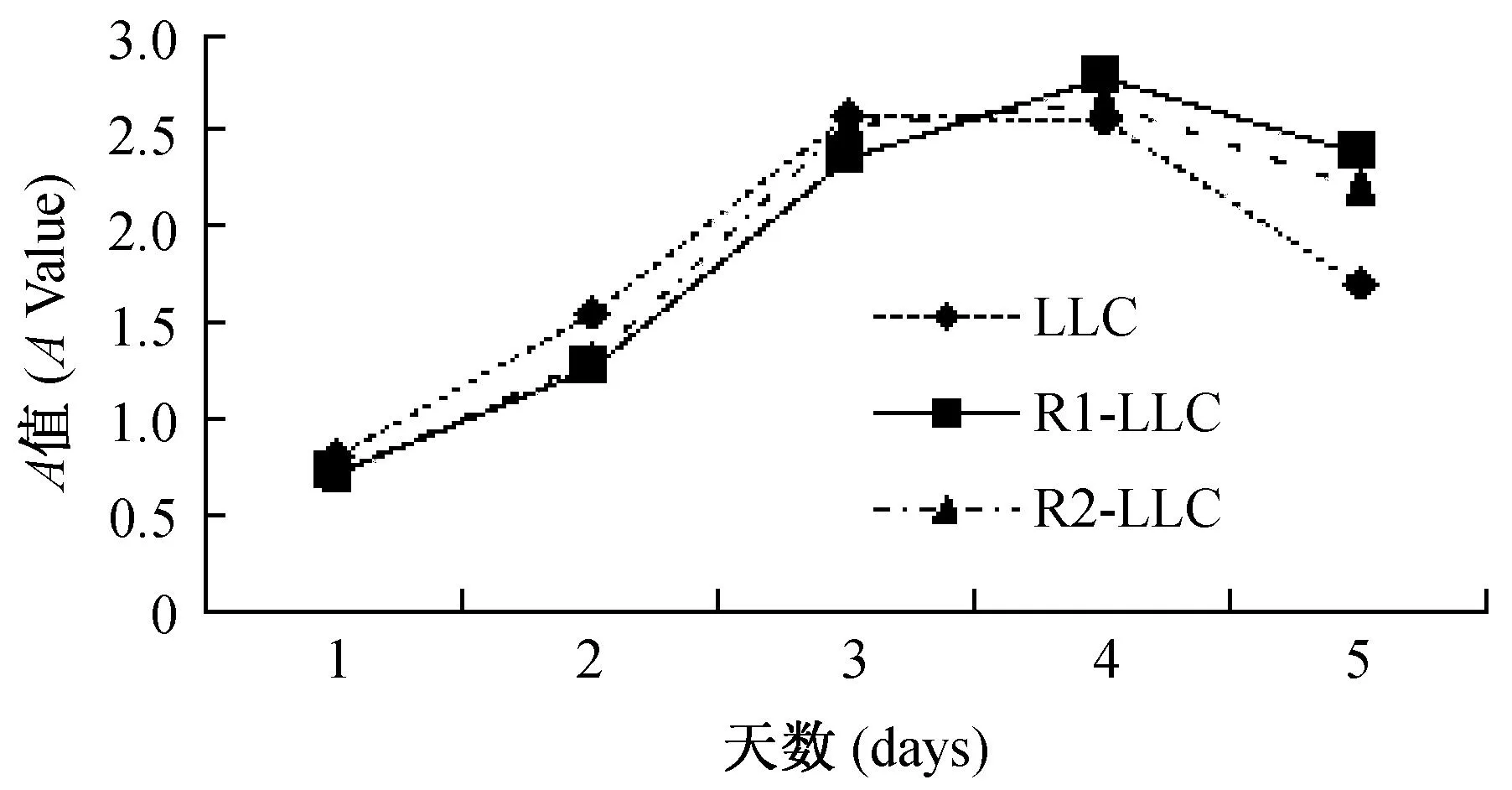
图2 LLC、R1-LLC及R2-LLC细胞的生长曲线 Fig.2 Growth curves of the LLC, R1-LLC,R2-LLC cells
2.2克隆形成实验
14 d后计数克隆球数,LLC、R1-LLC、R2-LLC细胞的克隆率分别为53.33%、56.67%、51.33%。采用卡方检验(P>0.05),差异无显著性,即三种细胞之间的增殖能力差异无显著性。
2.3 Transwell侵袭实验
在200倍放大的视野中,随机选取8个视野,LLC、R1-LLC和 R2-LLC 组的侵袭个数分别为(22.5±2.07)、(29±2)、(35.5±1.604)个(图3)。采用方差分析,P<0.05为差异有显著性,即三种细胞的侵袭能力R2-LLC>R1-LLC>LLC。
2.4 成瘤实验
观察在原位种植模型中的小鼠成瘤与转移情况,统计成瘤率(表1)。7 d和14 d解剖,成瘤率均有R2-LLC>R1-LLC>LLC,小鼠肺部出现原位肿瘤,进而转移到纵膈淋巴,21 d解剖,小鼠胸腔内胸壁和对侧肺的转移,R2-LLC组小鼠胸腔内出现广泛转移,肺内的侵袭转移能力:R2-LLC>R1-LLC>LLC,分别用卡方趋势检验进行统计学分析,P<0.05,有统计学意义,即三种细胞系之间的成瘤率有差异,其侵袭转移能力有R2-LLC>R1-LLC>LLC。
表1原位组成瘤率
Tab.1Tumor formation rate of the orthotopic transplantation groups at various time points

组别Groups时间Time/d71421LLC2/53/55/5R1-LLC3/54/55/5R2-LLC4/55/55/5
2.5HE染色
对小鼠肺癌组织进行常规石蜡切片HE染色,见组织中有大量核大深染的肿瘤细胞(图5)。
2.6细胞及组织透射电镜
细胞电镜可见LLC细胞核大浆少,核较幼稚,细胞器较少,较为幼稚;R1-LLC细胞核大浆少,但细胞器较LLC细胞多,更为分化;R2-LLC核分化程度大,可见分叶,更为成熟,可见不典型腺腔样结构,细胞表面微绒毛较多(图6ABC)。组织电镜观察LLC原位肿瘤,细胞核大浆少,细胞器缺乏,细胞之间以紧密连接为主,可见小的不典型腺腔(图6DEF),其结构与临床肺腺癌的结构相似。
3讨论
肺癌是目前发病率和死亡率增长最快的恶性肿瘤之一,严重威胁了人们的健康和生命。研究肺癌的生物学特性及肿瘤的发生发展过程一直是科研难题,建立一个可靠的动物肺癌模型,可以加速抗肿瘤药物研究[9]。
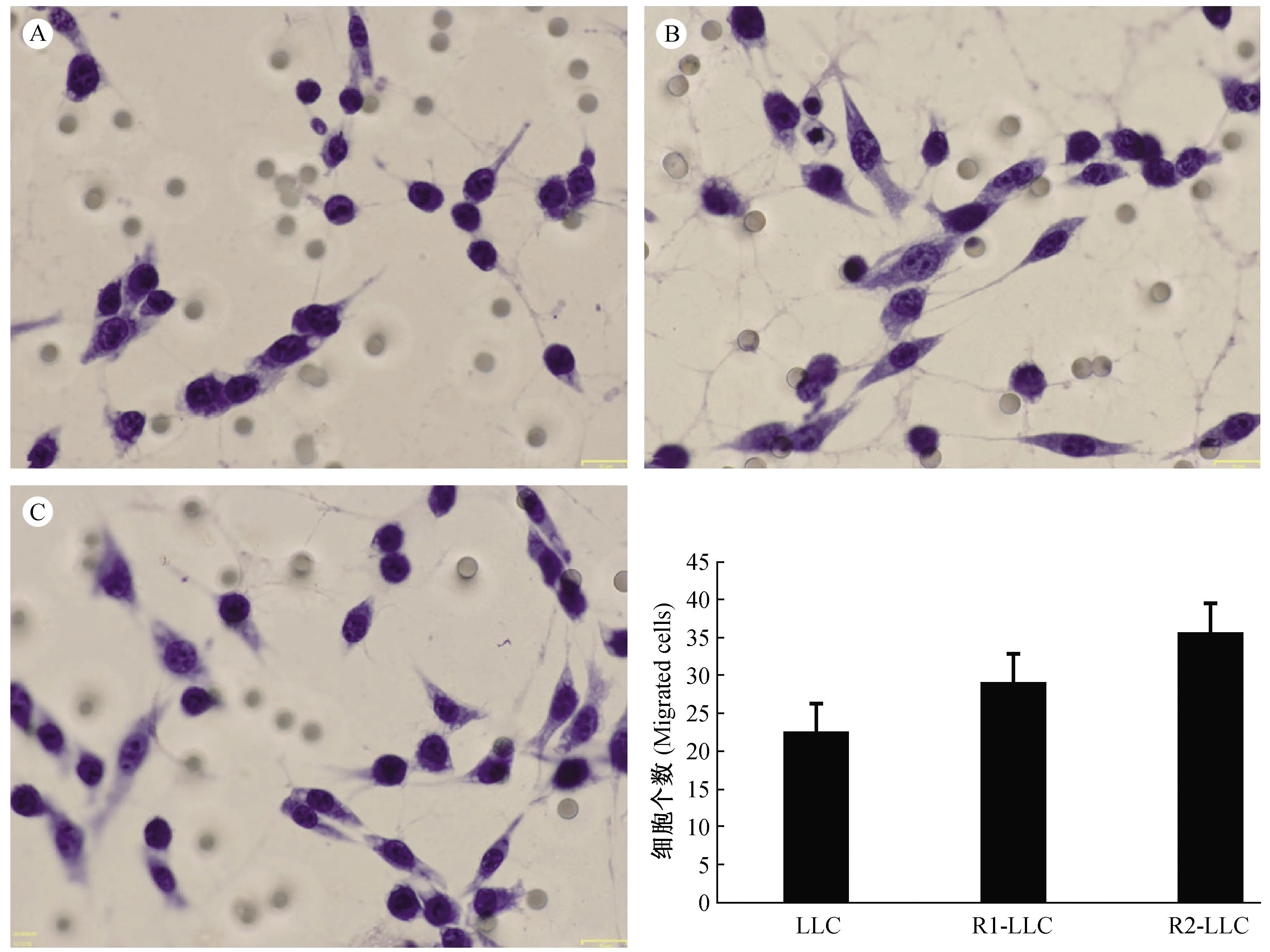
注:LLC(A),R1-LLC(B), R2-LLC(C)(bar=16 μm);侵袭能力大小R2-LLC>R1-LLC>LLC. 图3 侵袭试验Note. LLC cells (A), R1-LLC cells (B), R2-LLC cells (C)(bar=16 μm). The invasive ability is R2-LLC cells>R1-LLC cells>LLC cells. Fig.3 Transwell assay of the cells

注:A.肺内见原位肿瘤,纵隔淋巴结与胸壁转移;B.左肺原位肿瘤; C.LDP灯下见GFP阳性病灶。 图4 LLC组小鼠14 d解剖Note. In situ neoplasms, Mediastinal lymph nodes and chest wall metastasis were observed in the lungs of model mice; B. An orthotopic Lewis lung carcinoma in the left lung; C. GFP positive lesion under LDP light. Fig.4 The tumors are visible at autopsy (14 d)
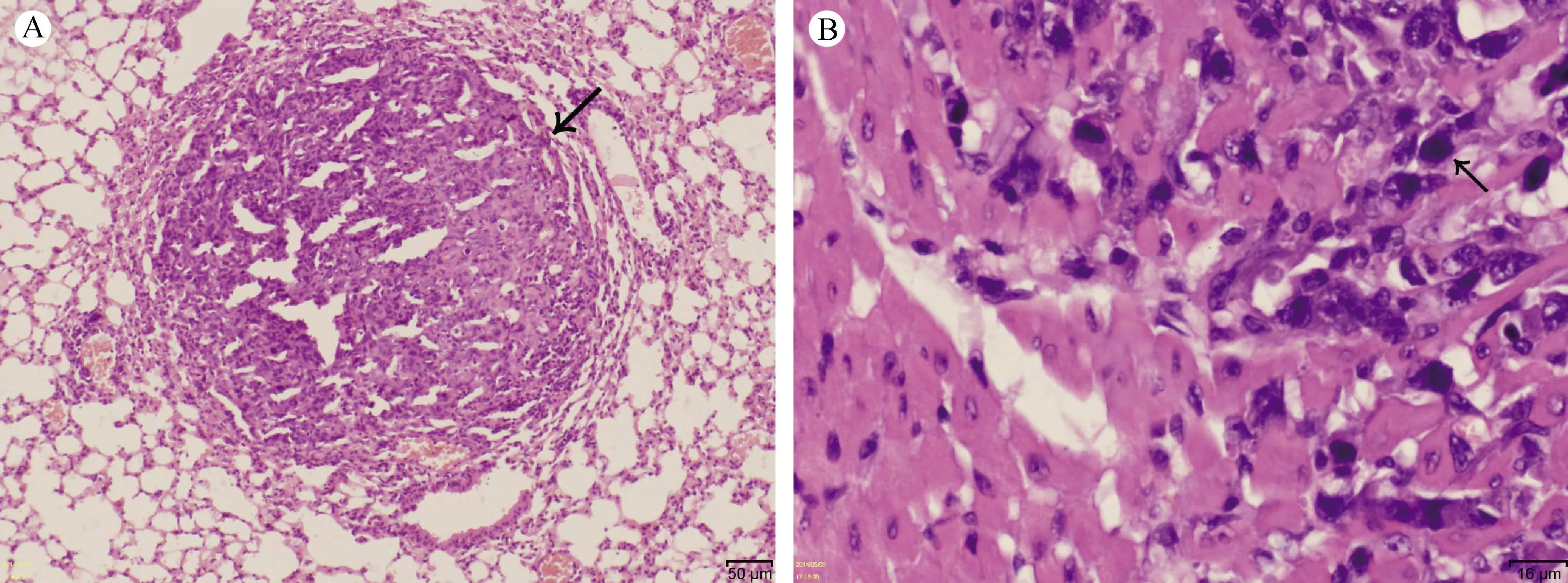
注:A.正常肺泡组织中的肺原位肿瘤(bar=50 μm);B.肺原位肿瘤组织中大量核大深染的肿瘤细胞(bar=16 μm)。 图5 肿瘤组织病理学检测Note. A. Lung tumor tissue (bar=50 μm); B. Massive tumor cells with large and dark blue nuclei in the lung tissue (bar=16 μm). Fig.5 Histopathological appearance of the tumor tissue in the lung

注:A:LLC(核大浆少,细胞核幼稚);B:R1-LLC(细胞表面可见微绒毛);C:R2-LLC(核可见分叶);D:肺原位肿瘤组织;E:肺原位肿瘤组织内的不典型腺腔结构;F:肺原位肿瘤组织内细胞间紧密连接。 图6 细胞及组织电镜Note. LLC(A),R1-LLC(B),R2-LLC(C) cells, in situ lesion(D), Atypical glandular cavity (E), Tight junction(F). Fig.6 Ultrastructure of the cultured cells and tumor tissues
本实验采用带有GFP标记的 LLC细胞建立R1-LLC、R2-LLC细胞系后,首次将R1-LLC和R2-LLC细胞原位种植于C57小鼠肺实质,比较三种细胞系的侵袭转移能力。在体外实验中,三种细胞系之间的增殖能力无明显差异(P>0.05),而侵袭能力R2-LLC> R1-LLC>LLC(P<0.05)。在活体实验中,使用matrigel胶包裹细胞后原位种植于小鼠肺实质[10],有利于形成单一病灶,可以更明确的观察原位肿瘤与转移瘤[11],从转移途径上观察,三种细胞为对宿主的影响均与临床类似[12-13],分别观察该三种细胞在小鼠肺内的生长及转移情况,细胞系之间的成瘤率及远处转移能力:R2-LLC>R1-LLC>LLC,因此,R2-LLC比R1-LLC和LLC细胞具有更高的成瘤率及更好的转移特性,为肺癌生物学特性研究及动物模型建立提供了新的方法和基础[14-16]。
参考文献
[1]李广灿,叶召. 全球常见恶性肿瘤的当前流行趋势 [J]. 肿瘤防治研究, 1999, 26(4): 308-312.
[2]Weissled R, Mahmood U. Molecular imaging[J].Radiology, 2001, 219: 316-333.
[3]Weissleder R.Molecular imaging: exploring the next frontier [J].Radiology, 1999, 212: 609-614.
[4]Bobek V, Plachy J, Pinterova D, et al. Development of a green fluorescent protein metastatic-cancer chick-embryo drug-screen model [J]. Clin Exp Metast, 2004, 21: 347-352.
[5]杨怡, 张飒, 周涛, 等. 培养细胞电镜样品制备方法 [J]. 解剖学杂志, 2003, 26(5): 509.
[6]Kee J, Arita Y, Shinohara K, et al. Antitumor immune activity by chemokine CX3CL1 in an orthotopic implantation of lung cancer model in vivo [J]. Mol Clin Oncol, 2013,1(1):35-40.
[7]刘馨, 伍只凭. 小鼠Lewis肺癌原位模型的构建 [J]. 中国肺癌杂志, 2010, 13(1): 42-47.
[8]Lussier YA, Xing HR, Salama JK,et al. MicroRNA expression characterizes oligometastasis [J]. PLoS ONE , 2011, 6(12): e28650.
[9]Imaida K, Yokohira M, Hashimoto N, et al. Risk analysis of environmental chemicals on lung carcinogenesis [J]. Asian Pac J Cancer Prev, 2010, 11: 9-12.
[10]Wiggins JF, Ruffino L, Kelnar K, et al. Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34[J]. Cancer Res, 2010, 70(14): 5923-5930.
[11]Boehle AS, Dohrmann P, Leuschner I, et al. An improved orthotopic xenotransplant procedure for human lung cancer in SCID big mice [J]. Ann Thorac Surg, 2000, 69(4): 1010-1015.
[12]余琛琳, 崔淑芳. 肺癌动物模型的制备与应用 [J]. 中国实验动物学报, 2008, 16(6):470-474.
[13]吴红英, 王月英, 李德冠, 等. IRM-2小鼠移植性肿瘤模型的生物学特性 [J]. 中国比较医学杂志, 2008, 18(12): 42-44.
[14]Chishima T, Miyagi Y, Wang X, et al. Cancer invasion and micrometastasis visualized in live tissue by green fluorescent protein expression [J].Cancer Res, 1997, 57: 2042-2047.
[15]Chishima T, Miyagi Y, Wang X, et al. Metastatic patterns of lung cancer visualized 1ive and in process by green fluorescent protein expression [J]. Clin Exp Metast, 1997, 15: 547-552.
[16]Yang M, Hasegawa S, Jiang P, et al. Widespread skeletal metastatic potential of human lung cancer revealed by green fluorescent protein expression [J]. Cancer Res, 1998, 58: 4217-4221.
研究报告
Comparison of Lewis lung cancer cells and their derived cells
WANG Fei , TAN Juan , CAO You-de
(Department of Pathology, Chongqing Medical University, Chongqing 400016, China)
【Abstract】ObjectiveBy comparing the biological characteristics among Lewis lung cancer cells (LLC), LLC orthotopic transplantation derivative cells (R1-LLC) and R1-LLC orthotopic transplantation derivative cells (R2-LLC), we evaluate their invasion and metastatic abilities in orthotopic transplantation models. Methods In vitro, we applied CCK8, clonogenic assay, and Transwell invasion assay to detect the proliferation ability, invasion ability and morphologic structures of LLC,R1-LLC, R2-LLC cells respectively, meanwhile observing morphologic structures by transmission electron microscopy. In vivo, we constructed LLC, R1-LLC and R2-LLC orthotopic transplantation models. Herein, we observed their tumor growth and metastasis. The tumor formation rate and tumor-forming time were recorded for statistic analysis. Results In vitro: LLC, R1-LLC and R2-LLC cells showed no significant difference in proliferation ability(P>0.05), but significant differences in invasion ability: R2-LLC>R1-LLC>LLC(P<0.05). In vivo: In the orthotopic group, the tumor formation rates of LLC, R1-LLC and R2-LLC cells were 66.67%、80%、93.33%(P <0.05). ConclusionsIn orthotopic implantation mouse models, R2-LLC cells present higher invasion and metastatic ability than R2-LLC and LLC cells.
【Key words】Lewis lung carcinoma; Orthotopic transplantation model; Green fluorescence protein; Mouse
[收稿日期]2014-12-09
Doi:10.3969/j.issn.1005-4847.2015.02.015
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2015) 02-0182-06
[通讯作者]曹友德E-mail: cydcyj@163.com.
[作者简介]王菲(1989-),女,硕士研究生,专业:病理学与病理生理学。E-mail: 592584737@qq.com
[基金项目]重庆市医学科研计划项目(编号:2012-1-079)。

