应用PCR法对小麦叶疫病菌的检测
张 雁, 张祥林, 王 翀, 罗 明, 马海波, 张 瑜
1新疆出入境检验检疫局,新疆 乌鲁木齐 830063;
2新疆农业大学农学院,新疆 乌鲁木齐 830052
应用PCR法对小麦叶疫病菌的检测
张雁1,2, 张祥林1*, 王翀1, 罗明2, 马海波1,2, 张瑜1
1新疆出入境检验检疫局,新疆 乌鲁木齐 830063;
2新疆农业大学农学院,新疆 乌鲁木齐 830052
摘要:【背景】小麦叶疫病菌于20世纪60年代入侵我国后,迅速传播扩散并在局部区域造成严重危害,对我国小麦的健康发展构成了巨大威胁。【方法】设计出检测小麦叶疫病菌的特异性引物,建立快速检测该病菌的PCR方法。用真菌通用引物ITS4/ITS5对小麦叶疫病菌进行PCR扩增,将扩增产物进行克隆和测序,使用DNAMAN软件设计出检测该病菌的特异性引物LJY1和LJY2,优化PCR反应体系。【结果】建立了该病菌的PCR检测方法,PCR反应体系:25 mmol·L-1MgCl22.5 μL,10 mmol·L-1dNTP 1.0 μL,10 μmol·L-1引物各0.5 μL,DNA模板8 ng,最佳退火温度57.6 ℃。【结论与意义】该方法可以准确地将小麦叶疫病菌与其他链格孢属的真菌区分开。本研究结果为小麦叶疫病的快速检测提供了依据,能够有效防止该病菌在小麦进出口贸易中传入我国。
关键词:小麦叶疫病菌; PCR; 体系优化;引物LJY1和LJY2
小麦叶疫病AlternariatriticinaPrasada & Prabhu是一种危害小麦的检疫性真菌病害,此病主要侵染小麦叶片,从而引起叶斑、叶枯症状,导致小麦严重减产(商鸿生等,1998)。自2000年以来,我国每年从美国、澳大利亚、加拿大等国大量引进小麦,进口的数量和重量均位居其他进口农产品之首,各口岸检验检疫局每年从进口的小麦中检测出大量有害生物。新疆自2010年以来,每年从哈萨克斯坦大量进口小麦,各口岸检验检疫局从入境的哈萨克斯坦小麦中截获多种危险性有害病菌,严重威胁到了新疆小麦的质量安全。由于小麦叶疫病病原菌形态与小麦上常见的其他病菌种类很难区分,因此,建立小麦叶疫病菌快速检测方法,对防止该病菌随进境小麦传入我国具有十分重要的意义。
国内外对此病的研究较少,主要集中在小麦叶疫病菌的分离鉴定和抗性遗传等方面,Mercadoetal.(2006)对该病菌进行了致病性检测和序列分析;商鸿生等(2000)研究证实,我国局部地区已有小麦叶疫病发生,并分离得到了11个小麦链格孢A.triticina菌株,研究了其生物学特性,确定了小麦链格孢的鉴定条件和鉴别标准。本研究利用通用引物ITS4/ITS5,对小麦叶疫病病菌进行PCR扩增,将扩增产物进行克隆和测序,根据测序结果设计筛选出该病菌的特异性引物,对PCR反应体系进行优化,并建立该病菌的PCR快速检测方法,为我国各口岸检验检疫局在检测小麦病害方面提供技术支持。
1材料与方法
1.1 供试菌株
供试的9个菌株分别由新疆检验检疫局、河北检验检疫局和新疆农业大学微生物学实验室提供,详见表1。
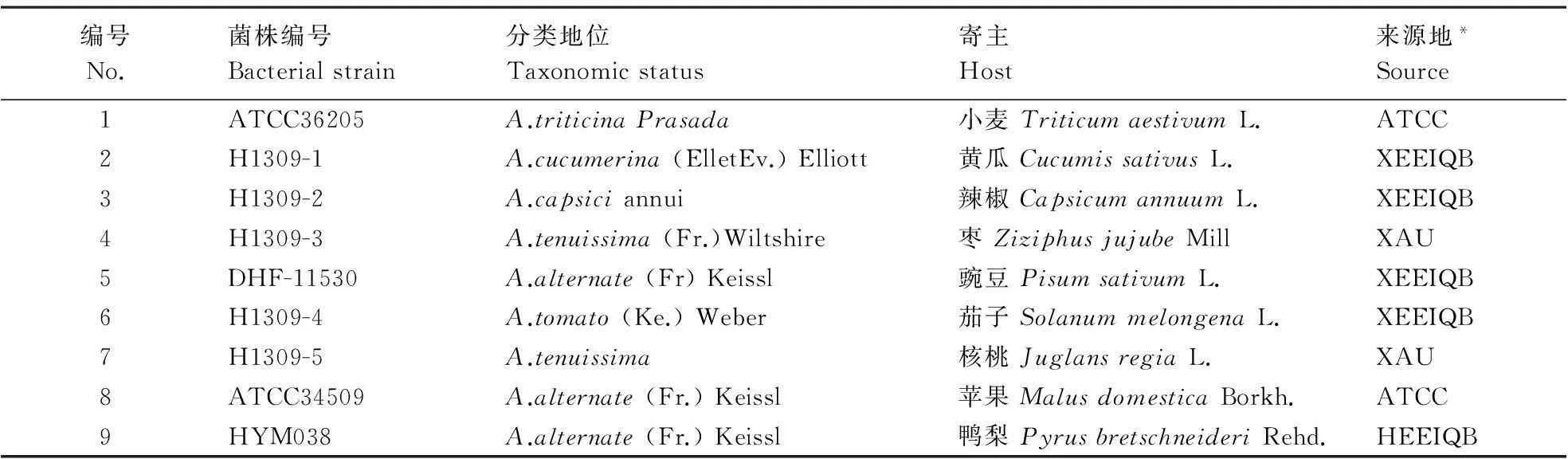
表1 供试菌株的病原名称、寄主和来源
*ATCC:美国标准菌种典藏中心;XEEIQB:新疆出入境检验检疫局;XAU:新疆农业大学;HEEIQB:河北出入境检验检疫局。
*ATCC: American type culture collection; XEEIQB: Xinjiang entry and exit inspection and quarantine bureau; XAU: Xinjiang agricultural university; HEEIQB: Hebei entry and exit inspection and quarantine bureau.
1.2 菌株DNA的提取
DNA的提取方法参照刘少华等(2005)的CTAB法,并稍加改进。将小麦叶疫病菌标准菌株ATCC36205接种到PDA培养基上,28 ℃培养5 d。挑取1 g菌丝,加入液氮充分研磨,加入1 mL CTAB提取液(pH 7.5的0.1 mol·L-1Tris-HCl、1% CTAB、0.7 mol·L-1NaCl、10 mmol·L-1EDTA、1% β-巯基乙醇),65 ℃水浴30 min,期间颠倒混匀5~6次,取出后冷却至室温,加入等体积的氯仿∶异戊醇(24∶1),混匀后于12000 r·min-1离心10 min,用移液枪将上清液移到一个新的离心管中,用氯仿∶异戊醇(24∶1)重复抽提1次,然后加入等体积的异丙醇,轻轻混匀,12000 r·min-1离心10 min后弃上清,用70%的无水乙醇洗涤沉淀2次,将无水乙醇室温晾干,加入30 μL ddH2O于-20 ℃保存。
1.3 通用引物的PCR反应
采用真菌通用引物ITS4/ITS5对供试材料进行PCR扩增。引物序列如下:ITS4:5′-TCCTCCGCTTATTGATATGC-3′,ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′。
PCR反应体系25 μL:10×Buffer 2.5 μL,25 mmol·L-1MgCl22.0 μL,10 mmol·L-1dNTP 1.0 μL,TaqDNA聚合酶0.5 μL,10 μmol·L-1上、下游引物各0.5 μL,DNA模板1.0 μL,无菌超纯水补充至25 μL。反应条件:94 ℃预变性5 min;94 ℃变性40 s,52 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸6 min。取PCR产物5 μL用1.5%琼脂糖凝胶进行电泳检测。
1.4 克隆及PCR鉴定
用试剂盒法(Agarose Gel DNA Fragment Recovery Kit Ver.2.0)从琼脂糖凝胶上回收PCR扩增片段。将回收的目的片段与载体pGM-T进行连接,之后转化到Top10感受态细胞中。在含有氨苄抗生素(AMP+)的蓝白斑筛选平板上挑取白色菌落,并对其摇菌过夜培养。用质粒提取试剂盒(Takara MiniBEST Plasmid Purification Kit Ver.2.0)从培养液中提取重组质粒DNA,对提取的质粒进行PCR检测,将阳性重组质粒送往北京鼎国公司进行测序。
1.5 特异性引物设计
将测序结果与NCBI上发布的小麦叶疫病菌序列进行BLAST比对,以验证测序结果的准确性,通过DNAMAN生物学软件设计出一对小麦叶疫病菌的特异性引物,LJY1引物序列为:GTCTTTTGTCTCCAGTTCGC;LJY2引物序列为:GCTGTTTGACTCTCTTTCCA。引物合成后配成100 μmol·L-1母液,-20 ℃保存,稀释10倍后再使用。该特异性引物的PCR扩增产物片段为520 bp。
1.6 PCR反应体系优化
1.6.1退火温度的优化使用LJY1/LJY2引物,在25 μL反应体系中进行PCR扩增,退火温度分别设置为46.5、48.4、49.5、50.8、51.2、52.6、53.4、54.2、55.0、56.8、57.6、58.5 ℃,共12个梯度,其他反应条件不变。
1.6.2MgCl2浓度的优化25 mmol·L-1MgCl2用量分别设置为0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 μL,共8个梯度,其他反应条件不变。
1.6.3dNTP浓度的优化10 mmol·L-1dNTP用量分别设置为0.5、1.0、1.5、2.0、2.5、3.0、3.5 μL,共7个梯度,其他反应条件不变。
1.6.4引物浓度的优化10 μmol·L-1上下游引物用量分别设置为0.5、1.0、1.5、2.0、2.5、3.0、3.5 μL,共7个梯度,其他反应条件不变。
1.6.5模板浓度的优化模板用量分别设置为1、2、3、4、5、6、7、8 ng,共8个梯度,其他条件不变。
1.7 引物的特异性检测
为了检验该引物的特异性,本试验使用LJY1/LJY2引物对供试的9种病原菌进行PCR扩增,并对PCR产物进行电泳检测。
1.8 特异性引物检测进口小麦样品
挑选入境的哈萨克斯坦小麦中截获的可疑小麦样品,用小麦叶疫病菌的特异性引物LJY1和LJY2对其进行PCR检测。
2结果与分析
2.1 小麦叶疫病菌引物ITS4/ITS5扩增结果
通用引物ITS4和ITS5对小麦叶疫病菌DNA进行PCR扩增后得到1条约580 bp的电泳条带,与预期结果一致(图1)。
2.2 重组质粒鉴定结果
经蓝白斑筛选、PCR鉴定,筛选出含有正确插入片段的重组质粒。试验结果表明:小麦链格孢菌重组质粒DNA经PCR扩增,得到约580 bp的片段,大小与插入片段相同(图2)。

图1 ITS4/ITS5扩增小麦叶疫病菌结果
Fig.1The results of ITS4/ITS5 clonesA.triticina
1:空白 Blank; 2:ATCC36205; M:DNA marker DL2000。
图2小麦叶疫病菌重组质粒PCR结果
Fig.2The PCR results ofA.triticinarecombinant plasmid
1: ATCC36205; M: DNA marker DL2000。
2.3 PCR反应体系优化结果
2.3.1退火温度对PCR扩增的影响从图3可以看出,退火温度对PCR的扩增影响较明显,引物在退火温度46.5~58.5 ℃均有扩增产物,在57.6 ℃时条带比较清晰且无二聚体,因此最佳退火温度为57.6 ℃。
2.3.2MgCl2浓度对PCR扩增的影响从图4可以看出,泳道1、2中没有条带出现,而泳道3到泳道8均出现特异性条带,随着MgCl2用量的增加,条带的亮度也不断增强,在泳道6达到最亮,因此最佳镁离子浓度是2.5 μL。
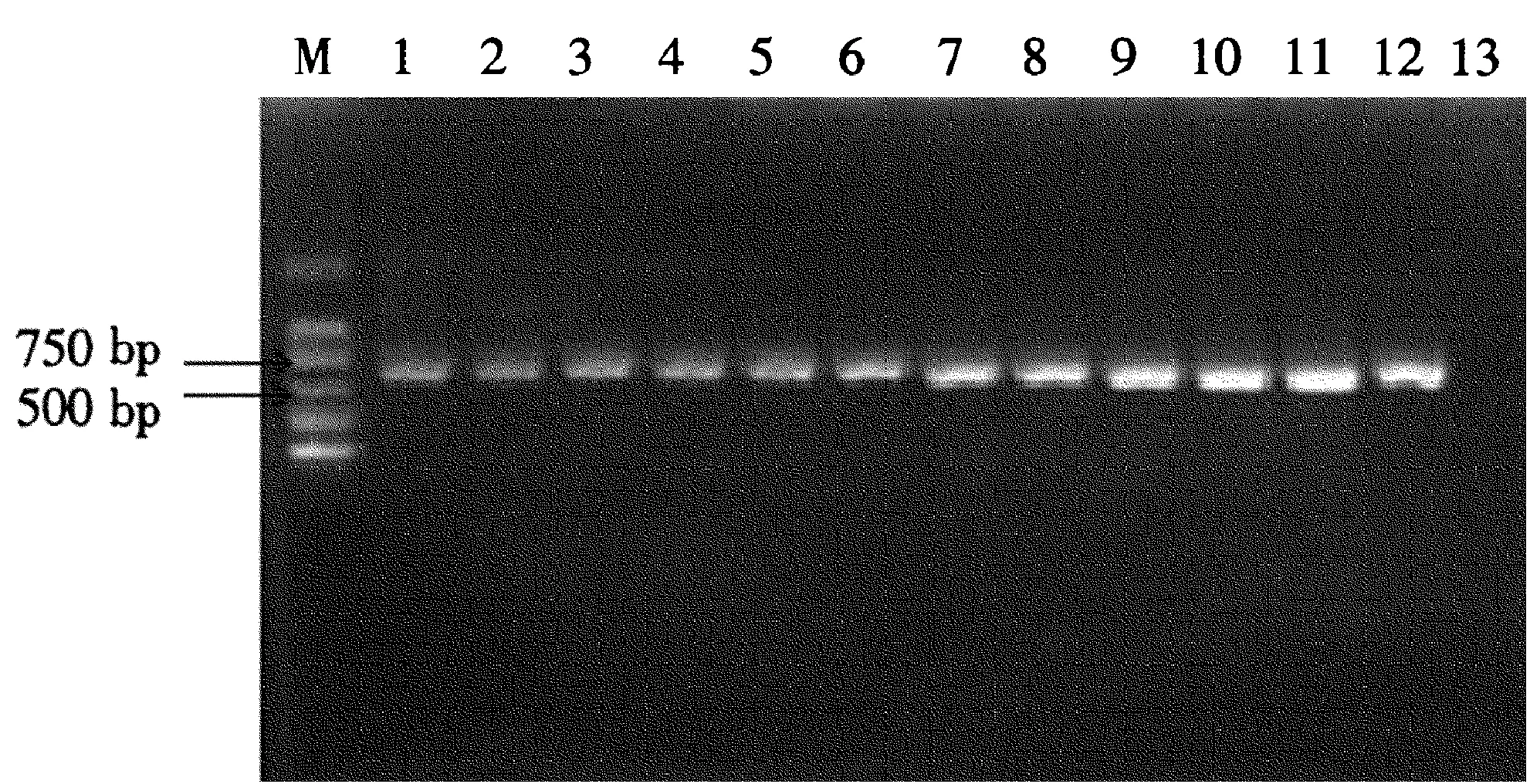
图3不同退火温度对PCR扩增的影响
Fig.3Effects of PCR amplificated at different temperatures
1~12泳道不同退火温度:46.5、48.4、49.5、50.8、51.2、52.6、53.4、54.2、55、56.8、57.6、58.5 ℃;13:CK; M:DNA marker DL2000。
Different temperatures of 1~12: 46.5, 48.4, 49.5, 50.8, 51.2, 52.6, 53.4, 54.2, 55, 56.8, 57.6, 58.5 ℃; 13: CK; M: DNA marker DL2000.
2.3.3dNTP浓度对PCR扩增的影响从图5可以看出,泳道2到泳道8均出现特异性条带,随着dNTP用量的增加,条带亮度和二聚体的量均无太大变化,所以dNTP用量的大小对PCR的影响不大,从节约成本的角度出发,选取dNTP的最佳用量为1.0 μL。
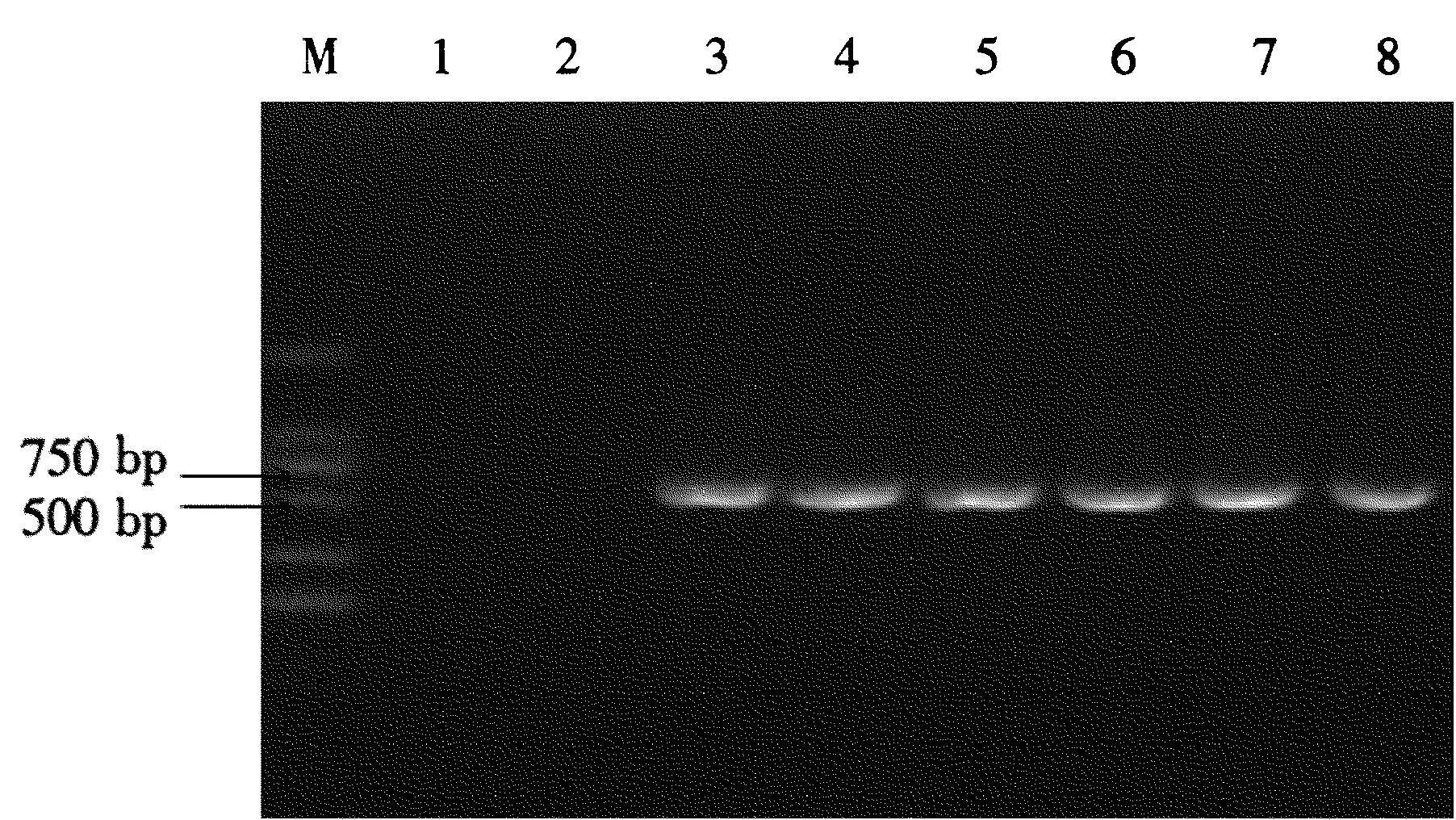
图4不同MgCl2用量对PCR扩增的影响
Fig.4Effects of PCR amplificated at different concentrations of MgCl2
1:CK;2~8泳道为MgCl2用量:0.5、1.0、1.5、2.0、2.5、3.0、3.5 μL;M:DNA marker DL2000。
1: CK; Different concentrations of MgCl2of 2~8: 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5 μL; M: DNA marker DL2000.
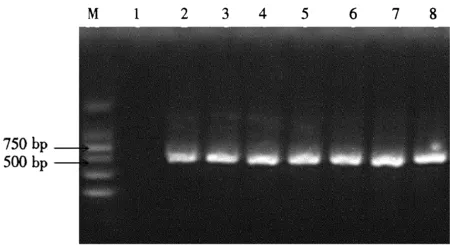
图5不同dNTP用量对PCR扩增的影响
Fig.5Effects of PCR amplificated at different amounts of dNTP
1:CK;2~8泳道为dNTP用量:0.5、1.0、1.5、2.0、2.5、3.0、3.5 μL;M:DNA marker DL2000。
1: CK; Different amounts of dNTP of 2~8: 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5 μL; M: DNA marker DL2000.
2.3.4引物浓度对PCR扩增的影响如图6所示,除泳道1没有出现条带以外,泳道2到泳道8均出现特异性条带,且在泳道5达到最亮且无二聚体。因此最佳引物用量是上下游引物共2.0 μL。
2.3.5不同模板浓度对PCR扩增的影响从图7可以看出,随着模板用量的增加,泳道2~9条带的亮度也不断增强,泳道9的条带最亮且二聚体最少,因此最佳模板浓度是8 ng。
2.4 特异性引物对不同链格孢菌的PCR扩增结果
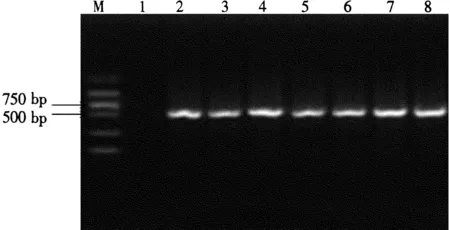
用LJY1和LJY2特异性引物对小麦叶疫病菌(ATCC36205)、黄瓜链格孢(H1309-1)、辣椒链格孢(H1309-2)、枣链格孢(H1309-3)、豌豆链格孢(DHF-11530)、茄子链格孢(H1309-4)、核桃链格孢(H1309-5)、苹果链格孢(ATCC34509)、鸭梨链格孢病菌(HYM038)进行PCR扩增,从图8可以看出,该对引物在小麦叶疫病菌种群中可以特异性地扩增约520 bp的产物,而其他链格孢属均未扩增出特异性条带。
图6不同引物用量对PCR扩增的影响
Fig.6Effects of PCR amplificated at different concentrations of primers
1:CK;2~8泳道为引物用量:0.5、1.0、1.5、2.0、2.5、3.0、3.5 μL;M:DNA marker DL2000。
1: CK; Different concentrations of primers of 2~8: 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5 μL; M: DNA marker DL2000.
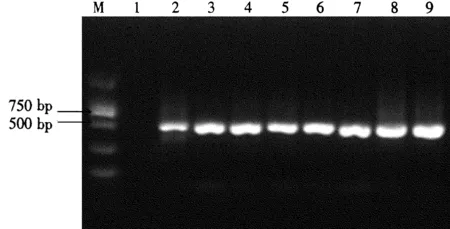
图7 不同模板浓度对PCR扩增的影响

图8 引物LJY1/LJY2进行 PCR扩增不同链格孢菌的结果
2.5 特异性引物对哈萨克斯坦小麦的PCR扩增结果
用LJY1和LJY2这对特异性引物对小麦叶疫病菌及入境的哈萨克斯坦小麦进行PCR扩增,从图9可以看出,该对引物在小麦叶疫病菌种群中可以特异性地扩增约520 bp的产物,而待测入境的哈萨克斯坦小麦均未扩增出特异性条带。

图9引物LJY1/LJY2进行PCR扩增哈萨克斯坦小麦的结果
Fig.9Result of PCR amplification using primers LJY1/LJY2 when grown on wheat of Kazakhstan
1:ATCC36205;2:阴性;3:H1;4:H2;5:H3;6:H4;7:H5;8:H6;9:H7;10:CK。
1: ATCC36205; 2: Fnminine; 3: H1; 4: H2; 5: H3; 6: H4; 7: H5;8: H6; 9: H7; 10: CK.
3讨论
植物病原菌快速、简便、精确的检测,能有效防止危险性检疫病害的传播蔓延,是边境口岸检疫的发展趋势,也是阻止有害病菌传入我国的有效方法(秦旭升等,2000)。PCR技术以其灵敏度高、特异性强、操作简便、快速准确的特点,不仅被广泛运用于医学领域和人类疾病的早期诊断、畜牧业动物重大疫情的快速诊断,近年来也已广泛应用于植物检疫性病害的诊断鉴定(何末军等,2009)。该技术在检疫性有害生物(段维军和郭立新,2008),如柑橘溃疡病菌Xanthomonascampestrispv.citri、梨火疫病菌Erwiniaamylovory、小麦印度腥黑病菌TilletiaindicaMitra、烟草环斑病毒Tobaccoringspotvirus、李坏死环斑病毒Prunusnecroticringspotilarvirus等的检测中,发挥了重要作用。谢云陆和Zeler(1996)应用PCR技术,准确、快速地检测出被梨火疫菌潜伏侵染的样品,检出样品中梨火疫菌的最低带菌量为50个细菌,未发现它与其他植病细菌有交叉反应,从PCR扩增、电泳分离到获得最后结果仅需8 h。黄国明等(2008)研究分析了黑麦草上冬孢子形态非常相似的3种腥黑粉菌的DNA序列差异,设计了TCK的特异引物,成功建立了TCK菌丝基因组DNA的特异PCR检测方法和冬孢子的套式特异PCR检测方法。张华等(2008)研究设计的水稻细菌性条斑病菌Xanthomonasoryzaepv.oryzicola(Fang) Swingetal.的PCR引物具有很强的专化性,其建立的PCR检测体系可专化性检测水稻细菌条斑病菌,而对水稻白叶枯病菌Xanthomonascampestrispv.oryzae(Ishiyama) Dye和其他菌株则没有扩增信号。
小麦叶疫病菌属链格孢属真菌,是多种农作物的病原菌,在该类病害的病原种类鉴定中,很难用分离培养和形态学方法进行快速、准确的鉴定(Perello & Sisterna,2006),为边境检疫工作带来了极大的不便。本研究通过对小麦叶疫病标准菌株的克隆和测序,将测序结果在NCBI上进行BLAST比对,找出高度保守序列,然后应用DNAMAN设计出该病菌的特异性引物LJY1和LJY2,能够将小麦叶疫病菌和其他病菌区分开。
特异性引物的设计对PCR检测的高效性具有决定性作用。除此之外,PCR方法在应用过程中还需注意一些问题,如退火温度过低,会产生非特异性扩增;模板量过大,会使DNA制剂中的污染物影响PCR反应效率。因此,在PCR反应体系中,退火温度、模板浓度等都会影响PCR反应的准确性。本研究在经历退火温度、Mg2+浓度、模板浓度等一系列体系优化后,建立了适用于检测小麦叶疫病菌的PCR反应体系。并通过一系列体系优化,最终确定最佳反应体系:退火温度57.6 ℃;镁离子浓度25 mmol·L-1Mg2+2.5 μL;dNTP用量10 mmol·L-1dNTP 1.0 μL;引物用量10 μmol·L-1引物各1.0 μL;模板浓度8 ng。应用该方法对不同种的链格孢菌以及对进口的哈萨克斯坦的小麦样品进行抽样检测,验证了该方法具有较好的特异性、稳定性和灵敏性,并且可以在较短的时间(5~6 h)内检测出该病菌,大大地缩短了检验小麦叶疫病的周期,为口岸检验检疫局对进口小麦中携带该病菌的检测提供了快速简便的方法。
参考文献
段维军, 郭立新. 2008. 基于PCR技术的植物病原真菌检测技术研究进展. 植物检疫, 22(6): 385-389.
何末军, 周国英, 李河. 2009. PCR技术在植物检疫性病害鉴定中的应用. 西南林学院学报, 29(1): 89-93.
黄国明, 罗加凤, 廖芳, 刘跃庭. 2008. 多年生黑麦草中小麦矮腥黑穗病菌PCR检测方法的建立. 植物检疫, 22(3): 144-147.
刘少华, 陆金萍, 朱瑞良, 戴富明. 2005. 一种快速简便的植物病原真菌基因组DNA提取方法. 生物安全学报, 35(4): 362-365.
秦旭升, 刘学敏, 周艳玲, 李立军. 2000. 植物病原真菌中DNA分子鉴定技术. 植物生理学通讯, 36(4): 342-347.
商鸿生, 王春江, 王树权. 1998. 小麦叶疫病检疫研究. 植物检疫, 12(2): 73-75.
商鸿生, 王春江, 王树权. 2000. 小麦链格孢叶枯病的病原学研究. 植物病理学报, 5(2): 129-132.
谢云陆, Zeler W. 1996. 应用聚合酶链反应技术检测梨火疫菌的研究. 植物检疫, 10(5): 262-267.
张华, 姜英华, 胡白石, 刘凤权, 许志刚. 2008. 利用PCR技术专化性检测水稻细菌性条斑病菌. 植物病理学报, 38(1): 1-5.
Perello A E and Sisterna M N. 2006. Leaf blight of wheat caused byAlternariatriticinain Argentina.PlantPathology, 55: 303.
Mercado V D, Renard M E, Duveiller E and Maraite H. 2006. Identification ofAlternariaspp. on wheat by pathogenicity assays and sequencing.PlantPathology, 55: 485-493.
(责任编辑:郭莹)
List of reviewers, 2014
We are grateful for the work of the following colleagues, who acted as reviewers for submitted manuscripts during 2014. Names with an asterisk indicates colleagues who reviewed more than one manuscript.
The Editors-in-Chief
Hong-mu AI(艾洪木)*
Dong CHU(褚栋)
Jin-jie CUI(崔金杰)*
Wei-dong FU(付卫东)
Xiao-jun GU(顾晓军)*
Fu-rong GUI(桂富荣)*
An-ping GUO(郭安平)*
Yu-rong HE(何余容)
Xue-nan HU(胡学难)
Fei LI(李飞)
Xin-hai LI(李新海)*
Jin-tian LIN(林进添)
以贵州习水案为例,此案中人们的普遍感受是,行为人主观恶性大,造成社会影响十分恶劣,行为上符合强奸罪构成要件,但也许摄于行为人手中掌握的公权力的强大,他们被定为嫖宿幼女罪,替换了强奸罪,免去了强奸罪的更高刑法处罚,拿到了免死牌。恶劣行径不能施以应有惩处,此罪因此被认为是让人钻了法律的漏洞。
Tong LIN(林同)
Guang-xu LIU(刘广绪)
Yong-yue LU(陆永跃)
De-ying MA(马德英)
Yan MA(马艳)*
Zheng-qiang PENG(彭正强)*
Pei QIN(钦佩)*
Yu-chuan QIN(秦玉川)
Zu-hua SHI(施祖华)
Jin-jun WANG(王进军)
Xu-bo WANG(王旭波)
Qi-yong WENG(翁启勇)
Mei-xiang WU(吴梅香)
Jin-han XU(徐金汉)*
Jun-xiang WU(仵均祥)*
Gong-yin YE(叶恭银)
Yi YU(于毅)
Cong-sheng ZENG(曾从盛)*
Dong-qiang ZENG(曾东强)
Ai-bin ZHAN(战爱斌)
Ai-bing ZHANG(张爱兵)
Gui-fen ZHANG(张桂芬)
Kai-chun ZHANG(张开春)*
Detection ofAlternariatriticinaPrasada & Prabhu using PCR techniques
Yan ZHANG1,2, Xiang-lin ZHANG1*, Chong WANG1, Ming LUO2, Hai-bo MA1,2, Yu ZHANG1
1XinjiangEntryandExitInspectionandQuarantineBureau,Urumqi,Xinjiang830063,China;
2CollegeofAgronomy,XinjiangAgriculturalUniversity,Urumqi,Xinjiang830052,China
Abstract:【Background】 After the Alternaria leaf blight infection of wheat in China in the 1960s, which spread rapidly and caused serious harm to the local economy, it become a constant threat for the production of China′s wheat. 【Method】 We designed specific primers in order to establish a rapid PCR detection method for Alternaria triticina Prasada & Prabhu. The fungal universal primers ITS4/ITS5 were used to amplify the A.triticina by PCR. The PCR products were cloned and sequenced .The bacteria specific primers LJY1 and LJY2 were designed by DNAMAN software. And the reaction system was optimized. 【Results】 PCR reaction was set up: 25 mmol·L-1MgCl22.5 μL, 10 mmol·L-1dNTP 1.0 μL, 10 μmol·L-1primers 0.5 μL respectively, the template of DNA was 8 ng, the best annealing temperature was 57.6 ℃. The rapid PCR detection method for the species was established. 【Conclusion and significance】 The testing of the method for detection on the 9 different strains showed that the primer can accurately distinguish wheat leaf blight from other Alternaria fungi. The results for the rapid detection of wheat leaf blight provide an experimental basis, which can effectively used to prevent the bacteria from entering China′s import and export trade of wheat.
Key words:Alternaria triticina; PCR; system optimization; primers LJY1 and LJY2

