螺旋粉虱的田间抗药性监测及其对毒死蜱的抗性风险评估
唐良德, 符悦冠, 曾东强*
1中国热带农业科学院环境与植物保护研究所,海南 海口 571101; 2广西大学农学院,广西 南宁 530005
螺旋粉虱的田间抗药性监测及其对毒死蜱的抗性风险评估
唐良德1,2, 符悦冠1, 曾东强1*
1中国热带农业科学院环境与植物保护研究所,海南 海口 571101;2广西大学农学院,广西 南宁 530005
摘要:【背景】螺旋粉虱是新入侵中国海南的一种危险性害虫,化学防治是目前最主要的防治手段和应急措施。【方法】采用POTTER喷雾法监测了海南各地理种群螺旋粉虱对毒死蜱、丙溴磷、高效氯氰菊酯、高效氯氟氰菊酯、吡虫啉、啶虫脒和阿维菌素等7种药剂的抗性水平,并运用Tabashnik域性状分析法估算了螺旋粉虱对毒死蜱的抗性现实遗传力。【结果】螺旋粉虱对各药剂均处于抗性敏感阶段,抗性倍数为1.03~4.29倍。螺旋粉虱对毒死蜱的抗性现实遗传力h2=0.2405;预测结果表明,当田间使用毒死蜱对螺旋粉虱的防治效果达90%时,螺旋粉虱对毒死蜱的抗性提高10倍所需代数为7.09代。田间试验表明,螺旋粉虱对毒死蜱的抗性发展速率要比模型预测缓慢。【结论与意义】本研究可为螺旋粉虱的化学防治及抗药性治理提供参考。
关键词:螺旋粉虱; 抗药性; 毒死蜱; 现实遗传力; 风险评估
螺旋粉虱AleurodicusdispersusRussell,隶属同翅目Homoptera粉虱科Aleyrodidae复孔粉虱属Aleurodicus。1905年首次报道于加勒比海与中美洲地区,目前已扩散至亚洲、非洲、欧洲、美洲、大洋洲约50个国家和地区,并继续向世界各热带及亚热带地区扩散(徐岩,1999; Russell,1905)。加勒比区域植物保护组织已将其列为A2检疫性有害生物,并系多个国家的检疫对象(温宏治等,1994; 徐岩,1999)。螺旋粉虱自2006年4月在海南陵水发现以来,迅速扩散至海南其他各县(市),并随时有向其他省份扩散的可能。螺旋粉虱年发生代数多,世代重叠严重,已对印度紫檀PterocarpusindicWilld、大叶榄仁TerminaliacatappaL.等海南主要的绿化树种造成严重危害,也成为番石榴PsidiumguajavaL.等热带果树发展的制约因素之一,并对大田作物构成威胁;其厚的蜡粉和蜡丝,严重影响了环境和观赏树种的价值。
目前,螺旋粉虱作为我国一种新入侵的危险性有害生物,化学防治仍是其最主要的防治手段和应急措施。国内外对螺旋粉虱化学防治方面缺乏系统研究,只见少量有关田间药效方面的文献报道(曹凤勤等,2011;林江等,2012; 林珠凤等,2007; 刘奎等,2007、2008; 吕朝军等,2009)。化学防治在控制害虫种群数量方面起着重要的作用,但杀虫剂的大量连续使用也会导致害虫抗药性越来越严重(何玉仙等,2007; Ahmadetal.,2002; Erdoganetal.,2008; Kranthietal.,2002; Prabhakeretal.,1988、1997; Roditakisetal.,2002)。但目前还没有关于螺旋粉虱对化学杀虫剂产生抗性的记录。因此,本试验拟从螺旋粉虱田间种群抗药性监测和抗药性选育等方面系统研究其抗药性,以期为制定螺旋粉虱的抗性治理措施提供理论依据。
1材料与方法
1.1 供试虫源
螺旋粉虱于2008年11月采自海南省陵水县吊罗山区(此地螺旋粉虱入侵早且无化学防治记录),在隔离网室内用无虫盆栽番石榴植株连续继代饲养,期间不喷施任何药剂,作为相对敏感品系,简称SS品系;以此品系作为毒死蜱室内抗药性选育的初始虫源,筛选后的品系即为毒死蜱室内抗性选育品系,简称EX-R品系;田间用毒死蜱筛选后获得的抗性品系,简称FI-R品系。各抗药性监测种群分别为不同时间在海南省采集的各地理种群(表1)。
1.2 供试药剂
95.7%毒死蜱原粉、89%丙溴磷原油、97%高效氯氰菊酯原粉、96.5%高效氯氟氰菊酯原粉、96.6%吡虫啉原粉、96.4%啶虫脒原粉和95%阿维菌素原粉(广东省农业科学院植物保护研究所提供),48%毒死蜱乳油(美国陶式益农公司生产)。
1.3 生物测定方法
采用POTTER喷雾法(陈立等,2001; Potter,1952)进行测定。首先将未被药剂污染的大叶榄仁树叶片剪成直径为60 mm的圆片,叶片正面朝下铺在直径为60 mm的培养皿中(事先用滤纸保湿)。螺旋粉虱成虫用CO2短暂麻醉后,转移到培养皿中的叶片上,每皿30~40头,然后用POTTER喷雾塔喷雾(喷雾压强为100 kPa,沉降时间为20 s),每个处理药液量为1 mL,喷雾后迅速盖上皿盖。当螺旋粉虱从麻醉状态苏醒后,将培养皿倒置于(25±1) ℃、光照14L∶10D、相对湿度65%的培养箱中,24 h后观察死亡情况(阿维菌素为48 h),统计死亡率。每个药剂配制5~7个浓度,每个浓度设4次重复,以丙酮处理作为对照。
1.4 抗药性风险评估
1.4.1室内抗药性选育抗性选育采取群体筛选法。用靶标药剂毒死蜱对室内饲养的螺旋粉虱种群成虫进行连续选育,每代以生物测定的LC50值为浓度进行喷雾处理,将存活个体转移到新的寄主植物上继续饲养,继代连续处理存活个体的子代,每代测定其LC50值。对初始筛选种群,在无药剂筛选条件下连续继代饲养,作为对照虫源。
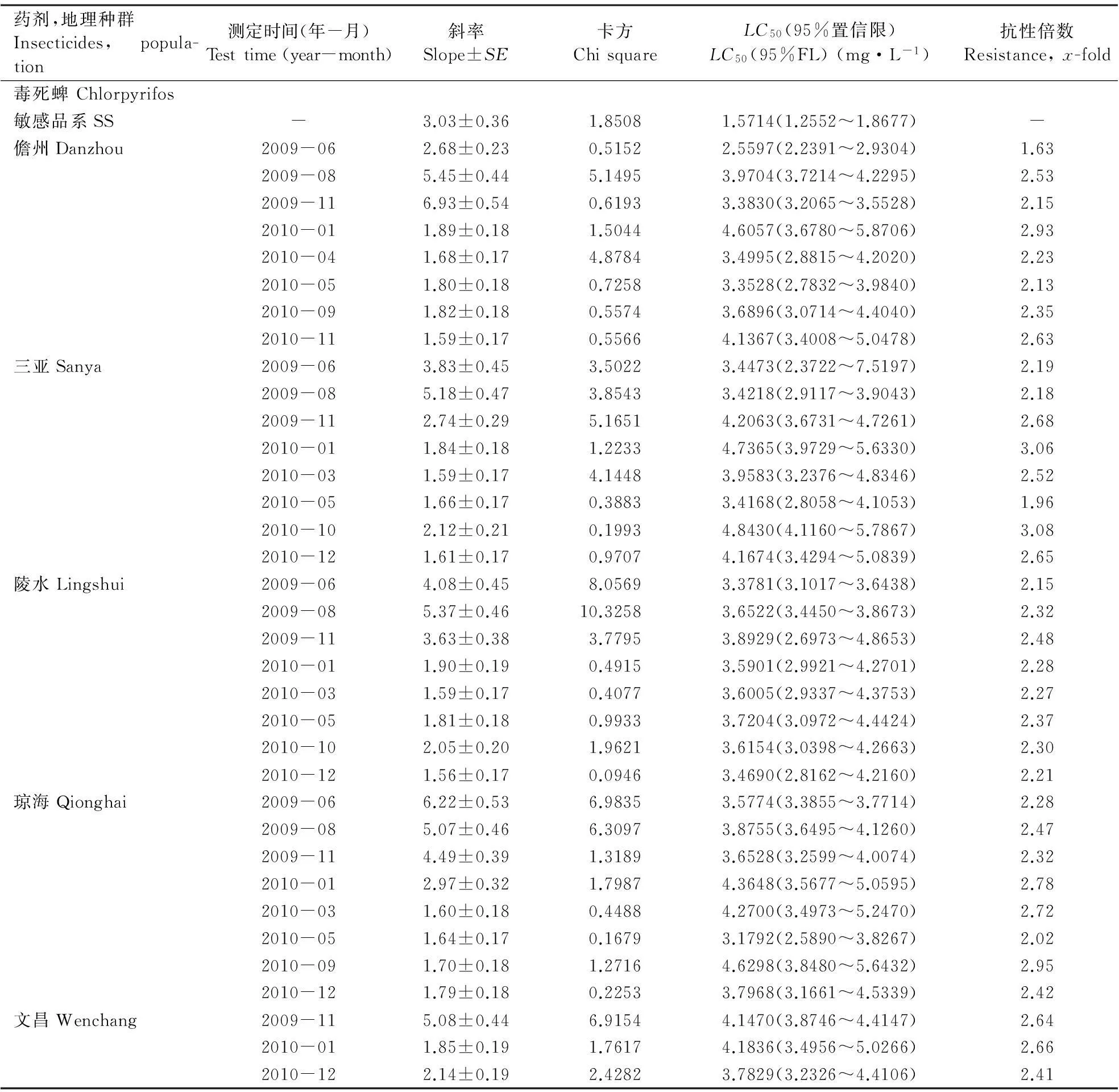
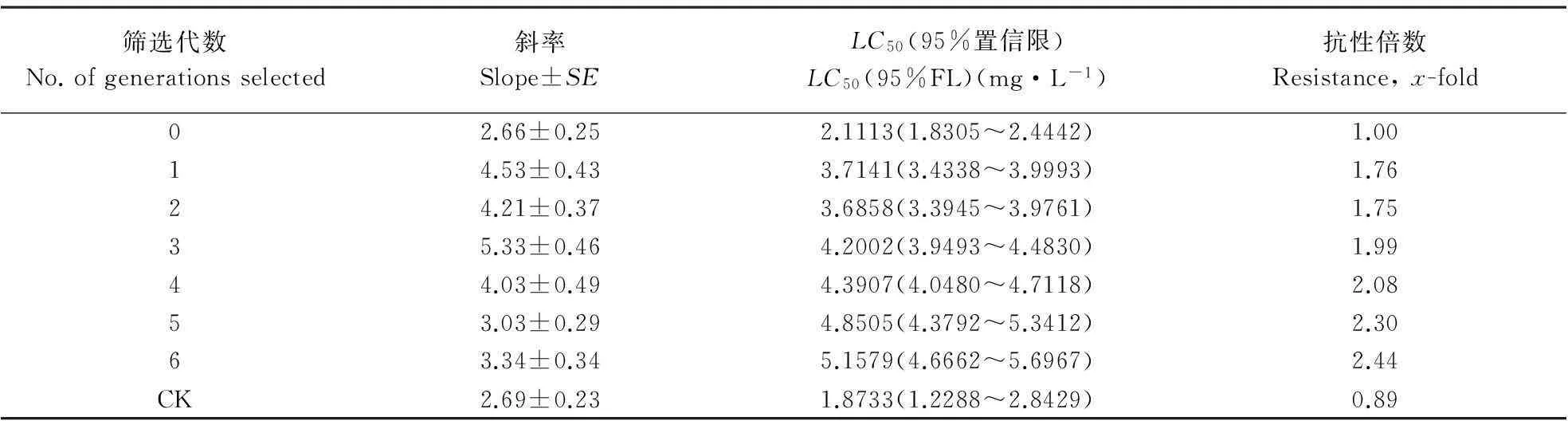
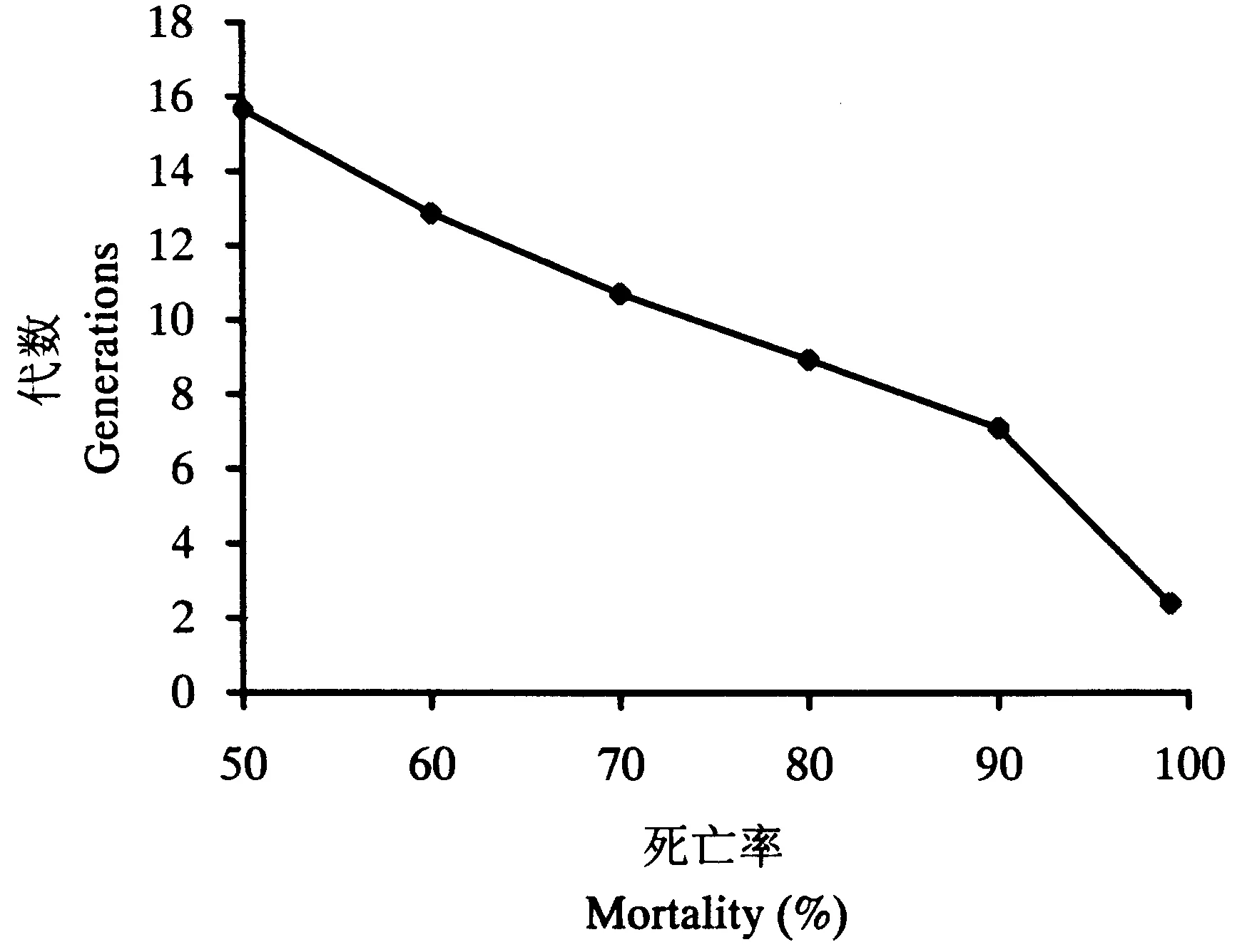
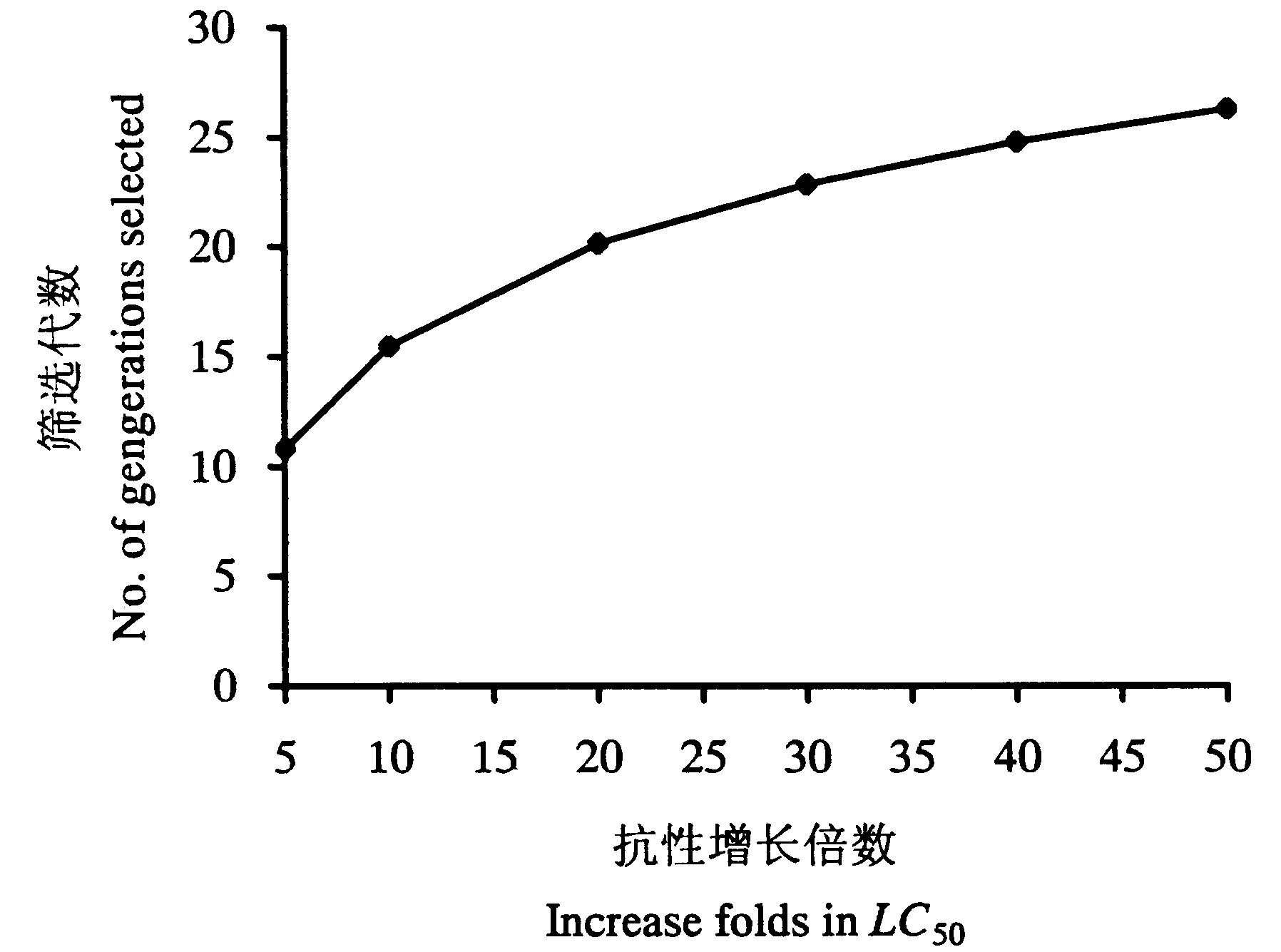
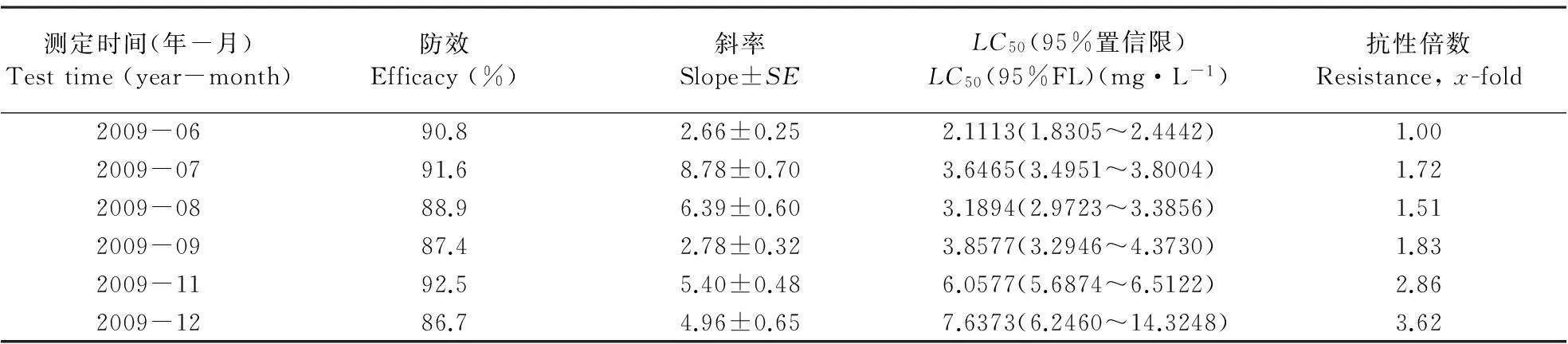
根据Tabshnik(1992)的方法,计算抗性现实遗传力h2(h2=R/S)。式中,R为选择反应,即筛选亲本的子代与筛选前的整个亲代间的平均表现型差异,由筛选前后的LC50、筛选的代数n决定,R=(筛选后第n代LC50的对数值-筛选前亲代LC50的对数值)/n;S为选择差异,是指用于筛选的亲本与整个亲代之间的平均表现型差异,由药剂筛选后平均每代存活率P、筛选前后毒力回归线的斜率来决定。S=iδp,i为选择强度,i≈1.583-0.0193336P+0.0000428P2+3.65194/P(10 通过抗性现实遗传力h2,可以预测筛选后抗性上升x倍所需代数[Gx=logx/(h2S)],以及不同选择压力下,抗性上升一定倍数所需的代数[G=R-1=1/(h2S)]。 1.4.2田间抗药性筛选在中国热带农业科学院儋州院区内种植一片番石榴果园,接入螺旋粉虱建立种群(虫源为室内抗药性选育同一种群),每月喷施1次毒死蜱进行防治,调查其防效,以便对其室内抗药性选育结果进行验证。 2结果与分析 抗药性测定结果均以相对敏感毒力基线为依据,计算出抗性倍数(各地区螺旋粉虱的LC50值除以相对敏感基线的LC50值)。监测结果(表1)表明,海南省各地区螺旋粉虱田间种群对防治药剂均未产生明显的抗性。其中,对有机磷类杀虫剂毒死蜱的抗性倍数为1.63~3.08倍,对丙溴磷的抗性倍数为1.03~1.88倍;对拟除虫菊酯类杀虫剂高效氯氰菊酯的抗性倍数为1.62~2.79倍,对高效氯氟氰菊酯的抗性倍数为1.50~2.58倍;对新烟碱类杀虫剂啶虫脒的抗性倍数为1.01~4.29倍,对吡虫啉的抗性倍数为1.91~3.26倍;对阿维菌素的抗性倍数为1.49~2.27倍。 2.2.1螺旋粉虱对毒死蜱的室内抗性选育从室内抗性筛选的结果(表2)来看,螺旋粉虱初始种群在室内连续6代用毒死蜱进行群体抗性筛选,LC50值从筛选前的2.1113 mg·L-1上升到筛选后5.1579 mg·L-1,其抗性水平上升了2.44倍;而无药剂筛选的对照处理6代后的LC50值为1.8733 mg·L-1,比筛选初始种群下降了0.2380 mg·L-1。 表1 螺旋粉虱田间种群抗药性 续表1 表2 螺旋粉虱试验种群对毒死蜱的抗性筛选 2.2.2螺旋粉虱对毒死蜱的抗性现实遗传力螺旋粉虱对毒死蜱的抗性现实遗传力h2=0.2405。遗传力的估计是指一个性状从一代遗传到下一代的程度,在影响表现型值的诸多因子中只有加性遗传值是可固定、遗传的,只有它才会对后代的性状产生影响,而不能够遗传到下一代的部分是由环境方差或其他因素引起(何林等,2002)。因此,狭义的现实遗传力被定义为加性遗传方差与整个表型方差的比率。可见,害虫对药剂的抗性现实遗传力越大,对药剂的抗性发展速率也越快。 2.2.3螺旋粉虱对毒死蜱的室内抗性风险评估由螺旋粉虱对毒死蜱的抗性现实遗传力(h2=0.2405),可以预测螺旋粉虱对毒死蜱产生抗性的风险。在相同汰选压下,抗性现实遗传力越大,害虫越容易产生抗性。假设田间螺旋粉虱不存在寄主之间的转移,并且每代螺旋粉虱都用毒死蜱防治1次,可以预测田间使用毒死蜱防治螺旋粉虱的防治效果达90%时,螺旋粉虱对毒死蜱的抗性水平提高10倍(根据筛选前后斜率相近的原则,假设筛选前后毒力回归线斜率均为3.0,即δp=0.3333时)所需代数为7.09代。在对螺旋粉虱不同防治效果下,抗性上升10倍所需的代数不同,所需代数随防治效果(即选择压)的增强而减少(图1)。 螺旋粉虱对毒死蜱的抗性倍数随着筛选代数的增加而缓慢上升。在与室内相同的选择压下,在上述相同假设条件下,抗性上升5倍所需代数为10.08代,抗性上升10、20和40倍所需代数分别为15.5、20.1和24.8代(图2)。 图1螺旋粉虱死亡率对抗性增长 10倍所需代数的影响 Fig.1Effectsofmortalitycausedbychlorpyrifos ongenerationsrequiredtodevelop10-fold resistancewithh2=0.2405 图2螺旋粉虱对毒死蜱抗性 增长倍数与筛选代数的关系 Fig.2RelationshipbetweenfoldofincreaseinLC50and generationsselectedbychlorpyrifos,whereP=46.3%, sameasthatinthelaboratory 2.2.4螺旋粉虱对毒死蜱的田间抗性风险评估经毒死蜱防治6代(约每月1代)的螺旋粉虱田间抗性发展情况见表3。结果表明,每代防效为90%左右,经过6代防治后,与其未施药前相比,抗性上升了3.62倍。利用上述模型,假设在田间螺旋粉虱不存在寄主之间的交流,并且每代螺旋粉虱都用毒死蜱防治1次,可以预测田间使用毒死蜱防治螺旋粉虱6代,防治效果达90%时,其抗性上升理论倍数值为5.52倍。 表3 螺旋粉虱田间防治情况下对毒死蜱的抗性 3结论与讨论 建立可靠的敏感毒力基线对于开展害虫的抗药性监测工作极其重要,只有具备了敏感毒力基线,才能准确地判断田间种群是否已经产生抗药性及产生抗药性的程度和范围(吴益东等,2001)。本文采用POTTER喷雾法建立了7种杀虫剂对螺旋粉虱的相对敏感毒力基线,确定了其LC50值,并以此为依据,报道了海南省各地区螺旋粉虱田间种群对防治药剂的抗性。从监测结果来看,目前海南省各地区螺旋粉虱对防治药剂都尚未形成抗性或抗性水平不明显,其可能与螺旋粉虱是一种新入侵海南的有害生物密切相关:(1)入侵前抗性尚未形成;(2)入侵后时间短,用药少或无化学药剂防治历史。 抗药性风险评估是抗药性研究中的重要内容,是在试验条件下预测害虫对防治药剂产生抗性的可能性。直接将室内测定的抗性发展速率、抗性水平或抗性种类推广到田间还存在一定的问题,但对指导田间用药和抗性治理仍具有重要意义。以往的研究多集中在害虫对药剂抗性发展速率的预测,而未对其田间实际情况下抗性发展速率进行验证。本研究通过螺旋粉虱对毒死蜱的室内抗性培育及运用域性状分析法计算现实遗传力,报道了螺旋粉虱对毒死蜱的抗性风险,并进一步对其田间实际抗性发展速率进行了验证,明确了田间螺旋粉虱对毒死蜱的抗性发展速率低于室内抗性理论预测值。这是因模型无法完全模拟田间条件的局限性所致。一方面,利用模型进行预测时需假定田间不存在寄主间虫源的相互交流,而事实上螺旋粉虱田间种群存在寄主间的相互交流,敏感种群对抗性基因具有一定稀释作用;另一方面,室内抗药性选育时只处理某一虫态(本试验处理的是成虫),而田间螺旋粉虱种群世代重叠严重,各个虫态均受药,且高龄若虫被厚的蜡粉和蜡丝覆盖,药剂无法正常到达靶标部位,从而降低了药剂的选择压。若在田间采用与毒死蜱无交互抗性的混剂或作用机理不同的药剂轮用进行防治,也会降低药剂对靶标昆虫的选择压,从而最终降低昆虫抗药性发展速率。 参考文献 曹凤勤, 林江, 刘万学, 程立生, 董存柱. 2011. 噻虫嗪对螺旋粉虱的室内毒力与田间药效. 植物保护, 37(1): 153-156. 陈立, 徐汉虹, 闻晏连, 赵善欢. 2001.Potter喷雾法操作因子对杀虫剂毒力的影响. 华南农业大学学报, 22(2): 31-34. 何林, 赵志模, 邓新平, 王进军, 刘怀, 刘映红. 2002. 朱砂叶螨对三种杀螨剂的抗性选育与抗性风险评估. 昆虫学报, 45(5): 688-692. 何玉仙, 翁启勇, 黄建, 梁智生, 林桂君, 吴咚咚. 2007. 烟粉虱田间种群的抗药性. 应用生态学报, 18(7): 1578-1582. 林江, 崔志富, 曹凤勤, 符悦冠. 2012. 常用杀虫剂对螺旋粉虱的活性及田间防效. 植物保护, 38(5): 189-193. 林珠凤, 肖彤斌, 谢圣华, 陈绵才, 王三勇. 2007. 8种杀虫剂对螺旋粉虱的防治效果. 农药, 46(9): 630-632. 刘奎, 姚刚, 符悦冠, 张方平, 覃华芳, 温丽娜, 刘静, 陈蕊. 2007. 常用杀虫剂对新入侵害虫螺旋粉虱的田间药效试验. 中国农学通报, 23(12): 333-337. 刘奎, 姚刚, 符悦冠, 张传海, 温丽娜, 刘静, 张方平, 陈蕊. 2008. 新入侵害虫螺旋粉虱的田间药效试验及防效. 热带作物学报, 29(2): 220-224. 吕朝军, 钟宝珠, 孙晓东, 覃伟权, 韩超文, 符悦冠, 马子龙. 2009. 几种植物源杀虫剂对螺旋粉虱的生物活性及田间防治效果. 热带作物学报, 30(12): 1865-1869. 温宏治, 许洞庆, 陈秋男. 1994. 螺旋粉虱(Aleurodicus dispersusRussell)之形态补述及寄主植物. 中华昆虫, (14): 147-161. 吴益东, 陈松, 净新娟, 林祥文, 沈晋良. 2001. 棉铃虫抗药性监测方法——浸叶法敏感毒力基线的建立及其应用. 昆虫学报, 44(1): 56-61. 徐岩. 1999. 警惕螺旋粉虱传入中国. 植物检疫, 13(4): 232-236. AhmadM,ArifMI,AhmadZandDenholmI. 2002.Cottonwhitefly(Bemisia tabaci)resistancetoorganophosphateandpyrethroidinsecticidesinPakistan. Pest Management Science, 58: 203-208. ErdoganC,MooresGD,GurkanMO,GormanKJandDenholmL. 2008.InsecticideresistanceandbiotypestatusofpopulationsoftobaccowhiteflyBemisia tabaci (Homoptera:Aleyrodidae)fromTurkey. Crop Protection, 27: 600-605. KranthiKR,JadhavDR,KranthiS,WanjariRR,AliSSandRussellDA. 2002.InsecticideresistanceinfivemajorinsectpestsofcottoninIndia. Crop Protection, 21: 449-460. PotterC. 1952.Animprovedlaboratoryapparatusforapplyingdirectspraysandsurfaceflims,whichdataintheelectrostaticchargeonatomizedsprayfluids. Annals of Applied Biology, 39: 1-29. PrabhakerN,CoudrietDLandToscanoNC. 1988.Effectofsynergistsonorganophosphateandpermethrinresistanceinasweetpotatowhitefly(Homoptera:Aleyrodidae). Journal of Economic Entomology, 81: 34-39. PrabhakerN,ToscanoNC,CastleSJandHenneberryTJ. 1997.SelectionforimidaclopridresistanceinsilverleafwhiteflyfromImperialValleyanddevelopmentofahydroponicbioassayforresistancemonitoring. Pesticide Science, 51: 419-428. RoditakisE,RoditakisNEandTsagkarakouA. 2002.InsecticideresistanceinBemisia tabaci (Homoptera:Aleyrodidae)populationsfromCrete. Pest Management Science, 61: 577-582. RussellLM. 1905.AnewspeciesofAleurodicus dispersusDouglasandtwocloserelatives(Homoptera:Aleyrodidae). Florida Entomologist, 48: 47-55. TabshnikBK. 1992.Resisanceriskassessment:realizedheritabilityofresistancetoBacillus thuringiensisindiamondbackmoth(Lepidoptera:Plutellidae),tobaccobudworm(Lepidoptera:Noctuidae),andcoloradopotatobeetle(Coleoptera:Chrysomelidae). Journal of Economic Entomology, 85: 1551-1559. (责任编辑:杨郁霞) Monitoring of resistance against insecticides in the whiteflyAleurodicusdispersusand an assessment of the consequences of chlorpyrifos Liang-de TANG1,2, Yue-guan FU1, Dong-qiang ZENG1* 1EnvironmentandPlantProtectionInstitute,ChineseAcademyofTropicalAgriculturalSciences,Haikou,Hainan571101,China; 2CollegeofAgriculture,GuangxiUniversity,Nanning,Guangxi530005,China Abstract:【Background】 The spiraling whitefly Aleurodicus dispersus Russell is a destructive invasive species first found in Hainan, China, in 2006. As a new quarantine pest, chemical control was considered the most effective measure to depress and eradicate the field population. 【Method】 By the method of a Potter bioassay, we monitored the insecticide resistance of field strains of A. dispersus to seven common used insecticides (chlorpyrifos, profenofos, beta-cypermethrin, lambda-cyhalothrin, acetamiprid, imidacloprid, abamectin). The realized heritability of resistance and resistance risk of A. dispersus to chlorpyrifos were evaluated using threshold trait analysis. 【Result】 The field strains tested displayed no resistance to insecticides, with a resistance ranging between 1.03 and 4.29. The realized heritability of resistance to chlorpyrifos was 0.2405. Theoretically, it requires 7.09 generations for A. dispersus to develop 10-fold resistance to chlorpyrifos under selective pressure of 90% mortality for each successive generation. Field trials revealed that the risk of resistance to chlorpyrifos was below that of the threshold trait analysis. 【Conclusion and significance】 This study indicated that chemical control may still be effective against this invasive pest. Key words:Aleurodicus dispersus; insecticide resistance; chlorpyrifos; realized heritability; risk assessment DOI:10.3969/j.issn.2095-1787.2015.01.009 通讯作者*(Author for correspondence), E-mail: fczhou@yzu.edu.cn 作者简介:周福才, 男, 副研究员, 博士。 研究方向: 蔬菜害虫综合治理 基金项目:江苏省农业科技自主创新资金[cx(12)1004]; 泰州市科技支撑项目(TN201429); 江苏省科技支撑计划项目(BE2012326); 江苏省农业三项工程项目[SXGC(2012)273] 收稿日期(Received): 2014-12-15接受日期(Accepted): 2015-01-132.1 螺旋粉虱对杀虫剂的抗性
2.2 抗药性风险评估