罗非鱼源Ia和Ib血清型无乳链球菌可溶性蛋白差异分析
石云良,李莉萍,王瑞,梁万文,甘西,
黄婷1,李健2、3,黄维义2、3,陈明1
(1.广西水产科学院 广西水产遗传育种与健康养殖重点实验室,南宁 530021;2.广西大学 动物科学技术学院,南宁 530005;
3.广西大学 食品质量与安全研究中心,南宁 530005)
罗非鱼源Ia和Ib血清型无乳链球菌可溶性蛋白差异分析
石云良1、2、3,李莉萍1,王瑞1,梁万文1,甘西1,
黄婷1,李健2、3,黄维义2、3,陈明1
(1.广西水产科学院 广西水产遗传育种与健康养殖重点实验室,南宁 530021;2.广西大学 动物科学技术学院,南宁 530005;
3.广西大学 食品质量与安全研究中心,南宁 530005)
摘要:前期研究表明,罗非鱼Oreochromis niloticus Ia和Ib血清型无乳链球菌Streptococcus agalactiae疫苗之间缺乏交叉保护力,为了从蛋白分子水平探讨其免疫原性差异的原因,在提取罗非鱼Ia和Ib血清型无乳链球菌可溶性蛋白后应用二维差异凝胶电泳(two dimension-Difference Gel Electrophoresis,2D-DIGE)分析其表达差异蛋白点,应用基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)鉴定这些差异蛋白,并使用DAVID生物学数据库预测经鉴定后获得的蛋白功能。结果表明:在2D-DIGE电泳上,Ia和Ib两种不同血清型无乳链球菌具有167个表达差异蛋白点,对这些蛋白点进行质谱分析获得32种蛋白,这些蛋白主要与氧化还原反应、代谢与能量前体物产生、糖代谢反应等生物学过程有关,主要参与糖解和糖异生作用、丙酮酸代谢与脂肪酸生物合成等通路;对蛋白功能的预测表明,GAPGH、半胱氨酸合成酶和锰依赖性锰超氧化物歧化酶的功能与免疫和疫苗研发相关。本研究首次证实,罗非鱼Ia和Ib血清型无乳链球菌存在较多的表达差异蛋白,部分表达差异蛋白的功能与免疫和疫苗研发相关,这可能与链球菌免疫原性有直接关系,但需要进一步地研究和证实。
关键词:罗非鱼;无乳链球菌;Ia和Ib血清型;可溶性蛋白;二维差异凝胶电泳(2D-DIGE); 差异分析
链球菌Streptococcosis病是罗非鱼Oreochromisniloticus养殖中危害最为严重的病害,呈全球性流行,每年给世界罗非鱼养殖造成巨大经济损失。据统计,在2009—2012年该病给中国罗非鱼养殖业造成的经济损失累计达16亿美元[1]。至今尚未找到有效的药物治疗方法和预防控制措施。
为了获得新的疫苗候选分子和新药物靶点,已有学者开始对鱼链球菌蛋白组进行相关的鉴定研究。Hughes 等[2]分离和提取无乳链球菌Streptococcusagalactiae可作为疫苗候选分子的菌体外层蛋白,用2D电泳分离后经质谱测定获得14种蛋白,其中6种为用无乳链球菌首次鉴定的蛋白。Shin等[3]对海豚链球菌的可溶性蛋白进行2D电泳分离,获得大约320个蛋白点,对部分高丰度表达的蛋白进行多肽质谱分析获得17种不同的蛋白,这些蛋白的鉴定为筛选诊断候选分子和疫苗候选分子奠定了良好的基础。
已有研究证实,罗非鱼Ia与Ib血清型无乳链球菌的全菌苗之间未能产生有效的交叉保护[4]。为此,本研究中拟从蛋白分子水平分析这两种不同血清型无乳链球菌可溶性蛋白的差异,通过蛋白功能预测初步探讨这些差异蛋白与免疫原性之间的关系。
1材料与方法
1.1材料
Ia血清型菌株分离自广西的罗非鱼(编号GX032),Ib菌株血清型分离自海南省的罗非鱼(编号HN016)。
1.2方法
1.2.1菌株的分离培养和鉴定无菌条件下采集患病罗非鱼的脑、肝和鳍条基部并划线接种于血平板上,28 ℃下培养24~48 h;对菌落进行革兰氏染色观察,并挑取染色结果为链球菌的单个菌落进行纯化;纯化培养的单个菌落于TSB中(28 ℃)培养24~48 h,加入20%甘油置于超低温冰箱(-80 ℃)中保存或直接使用。罗非鱼的GX032和HN016血清型无乳链球菌使用API 20 Strep系统(Bio Merieux, Marcyl’Etoile,France)进行鉴定,培养温度为25 ℃。
1.2.2细菌可溶性蛋白的提取将250 mL细菌培养液[密度为(2.0~5.0)×108cells/mL)]在4 ℃下以10 000 r/min离心10 min,沉淀用PBS洗涤3次后加入2 mL裂解缓冲液(包含7 mol/L尿素、2 mol/L硫尿、4% CHAPS、30 mmol/L Tris-HCl), 反复冻融6次,每次15 min,然后在冰上用超声波粉碎45 min (超声10 s,间隔20 s,振幅70%),在4 ℃下以15 000 r/min 离心30 min,收集上清可溶性蛋白于-80 ℃下保存备用。用Bradford法蛋白定量测定蛋白浓度[5],以牛血清白蛋白(BSA)作为标准蛋白,制作蛋白浓度标准曲线。
1.2.3两种不同血清型菌株可溶性蛋白的2D电泳分析2D 电泳参照Pressey等[6]的方法,具体如下:
(1)加样品水化。将50 μg蛋白与水化液(包含8 mol/L尿素、2% CHAPS、0.01 g DTT、0.5% Bio-Lyte)充分混匀过夜,将18 cm固定pH梯度胶条(pH 3~10,GE Life Sciences公司)在室温下放置10 min后加入样品,然后用IPGphor(Amersham)进行电泳。步骤如下:步骤1,30 V下运行6 h;步骤2,60 V下运行7 h;步骤3,200 V下运行1 h;步骤4,500 V下运行1 h; 步骤5,1000 V下运行1 h;步骤6,8000 V下运行1 h;步骤7,8000 V下运行6 h;步骤8,500 V下运行1 h,停止。
(2)胶条的平衡。胶条在含有64.8 mmol/L DTT 的 SDS 平衡缓冲液(包含50 mmol/L pH为 8.8的Tris-HCl、6 mol/L尿素、30%甘油、2% SDS、0.002%溴酚蓝)中还原10 min,然后在含135.2 mmol/L碘乙酰胺的平衡缓冲液中烷基化15 min。将 IPG胶条轻轻润洗,去除多余平衡缓冲液,再将IPG胶条转移至大试管中,加入平衡缓冲液Ⅰ(包含6 mol/L尿素、50 mmol/L Tris-HCl、20%甘油、2%SDS+0.1%DTT)后,将试管放在水平摇床上缓慢摇晃15 min。第一次平衡结束后,彻底倒掉胶条平衡缓冲液Ⅰ,并用滤纸吸取多余平衡液。再加入胶条平衡缓冲液Ⅱ(包含6 mol/L尿素、50 mmol/L Tris-HCl、20%甘油、2%SDS+4%碘乙酰胺),继续在水平摇床上缓慢摇晃15 min,平衡结束后,彻底倒掉样品水化盘中的胶条平衡缓冲液Ⅱ,并用滤纸吸取多余平衡液。将IPG胶条从试管移出,用镊子夹住胶条的一端使胶面完全浸没在1×电泳缓冲液中。然后将胶条胶面朝上放在凝胶的长玻璃板上。将制备好的15%丙烯酰胺SDS-PAGE胶用低熔点琼脂糖封顶,将IPG胶与聚丙烯酰胺凝胶胶面完全接触,放置5 min使低熔点琼脂糖封胶液彻底凝固。将凝胶转移至电泳槽中进行SDS-PAGE电泳(Ettan DALT Twelve system,Amersham)。起始时用低电流(5~10 mA/gel/17 cm)运行,待样品在完全跑出IPG胶条并浓缩成一条线后再加大电流(20~30 mA/gel/17 cm)运行,直到溴酚蓝指示剂达到底部边缘时即可停止电泳。电泳后的蛋白凝胶参照银染试剂盒(Thermo Scientific)说明书方法进行染色,然后在成像系统下进行成像。另外,制作一块主质胶(Master胶),分别加入150 μg GX032、HN016可溶性蛋白以及150 μg GX032与HN016等量混合且未标志的样品进行2D电泳后再银染,与2D-DIGE蛋白凝胶进行比较分析,找到相对应的差异蛋白点后,在Master胶上进行挖点和质谱分析。
1.2.4两种不同血清型菌株可溶性蛋白的2D-DIGE电泳
(1) 荧光标志。在荧光标志前将蛋白先用含有蛋白酶抑制剂的重泡张缓冲液(包含7 mol/L 尿素、2 mol/L硫脲、4% CHAPS、40 mmol/L二硫苏糖醇、0.5%两性电解质、0.002%溴酚蓝 2.5 mL)调节浓度为50 μg/125 μL。按照蛋白荧光标志试剂盒(GE Life Sciences公司)说明书中的方法进行标记。分别用400 pmol Cy3和Cy5标志50 μg的Ia和Ib血清型链球菌可溶性蛋白;50 μg等量混合的Ia和Ib血清型链球菌可溶性蛋白液则用Cy2标志,作为内参对照。
(2) 2D-DIGE电泳。与“1.2.3”节相同。
1.2.5差异蛋白点的分析SDS-PAGE凝胶用Typhoon 9410成像系统(Amersham)进行扫描,用DeCyder 2D 5.02软件(GE Life Sciences公司)分析不同血清型链球菌可溶性蛋白的各个差异点。用Typhoon 9410扫描仪分别在488 nm/520 nm、532 nm/580 nm、633 nm/670 nm波长下对Cy2、Cy3、Cy5荧光染料标志的图像进行扫描。用DeCyder 6.5软件对DIGE图像进行分析和差异点寻找。差异点判定条件:P≤0.05,差异倍数1.5倍以上。
1.2.6质谱的鉴定和分析根据Master胶比对2D-DIGE 图,有显著差异的蛋白点从Master 胶上挖出,用胰蛋白酶消化、还原,再烷基化, 最后置于基质上进行MALDI-TOF质谱分析(美国ABI-4800型反射式基质辅助激光解析飞行时间串联质谱)。扫描方式:反射式,蛋白质相对分子量的扫描范围为700~4000;激光能量,MS为5000,MSMS为5500;GPS软件检索,MS误差为0.2,MSMS误差为0.3;数据库搜索,NCBI_bacteria_protein_faa_2012_0704。数据取舍标准:取蛋白打分大于72分,置信水平在95%以上。鉴定获得蛋白使用在线软件DAVID Bioinformatics Resources 6.7(http://david.abcc.ncifcrf.gov)进行Gene Ontology分析和KEGG Pathway分析。
2结果与分析
2.1GX032(Ia)和HN016(Ib) 2D电泳结果
两种不同血清型链球菌可溶性蛋白的2D电泳和银染结果表明,在本试验条件下两种链球菌可溶性蛋白在2D电泳中得到了很好的分离(图1),为2D-DIGE电泳的进行奠定了良好的基础。
2.22D-DIGE 电泳结果
将GX032(Ia)和HN016(Ib)以及GX032与HN016等量混合的可溶性蛋白,分别标记后进行2D-DIGE电泳,结果表明,在分离蛋白等电点pI 为3~10 时的各种蛋白得到很好的分离(图2)。使用DeCyder 2D 5.02 软件进行差异蛋白点分析,根据差异点判定条件(P≤0.05,蛋白差异倍数1.5倍以上)判定,获得 167个差异表达蛋白点。
2.3Master胶差异蛋白点标志结果
分别将150 μg的GX032(Ia)和HN016(Ib)以及150 μg GX032与HN016等量混合且未标记的可溶性蛋白进行2D 电泳,银染后与2D-DIGE电泳凝胶比较,获得相对应的差异蛋白点,在Master胶上对差异蛋白点进行标志(图3)。
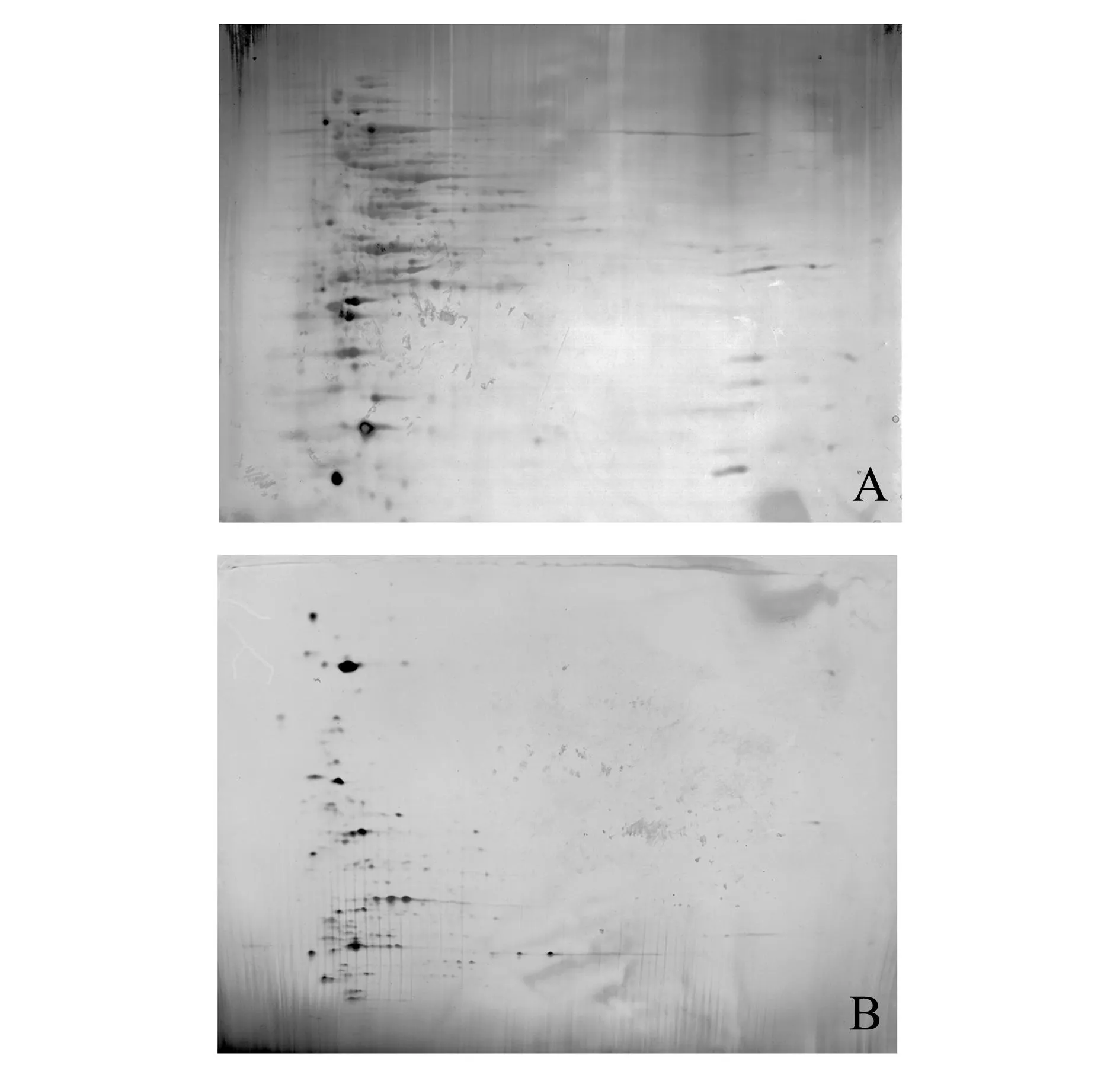
注:A为GX032(Ia)可溶性蛋白;B为HN016(Ib)可溶性蛋白Note:A,GX032(Ia)soluble protein;B,HN016(Ib)soluble protein图1 GX032(Ia)和HN016(Ib)可溶性蛋白的2D 电泳凝胶银染结果Fig.1 2D electrophoresis of GX032(Ia)and HN016(Ib)soluble protein with silver staining

注:50 μg Ia和Ib可溶性蛋白分别用 Cy3和Cy5进行标志,50 μg等量Ia和Ib混合样品用Cy2进行标志。蛋白点为紫色或是绿色说明蛋白浓度含量很高Note:50 μg Ia and Ib soluble protein is labeled with Cy3 and Cy5, respectively.50 μg equal volume of Ia and Ib mixture is labeled with Cy2.The abundance protein spots is shown in purple and green图2 Ia和Ib血清型无乳链球菌可溶性蛋白2D-DIGE结果Fig.2 2D-DIGE of soluble proteins extracted from Ia and Ib serotypes of Streptococcus agalactiae
2.4差异蛋白鉴定结果
对Master胶上的差异蛋白点进行MALDI-TOF-MS分析,并进行相关数据库的比对分析后,鉴定获得32种蛋白(表1)。这些蛋白大部分为酶类,主要为氧化还原酶[乙偶姻还原酶、L-2-羟基己酸脱氢酶、3-酮脂酰-(酰基载体蛋白)还原酶等]、合成酶[半胱氨酸合成酶、F0F1 ATP合酶γ亚基、3-氧化酰基-(酰基载体蛋白)合成酶Ⅱ]和转移酶(转酮醇酶、丙酮酸激酶和磷酸甘油酸激酶)。
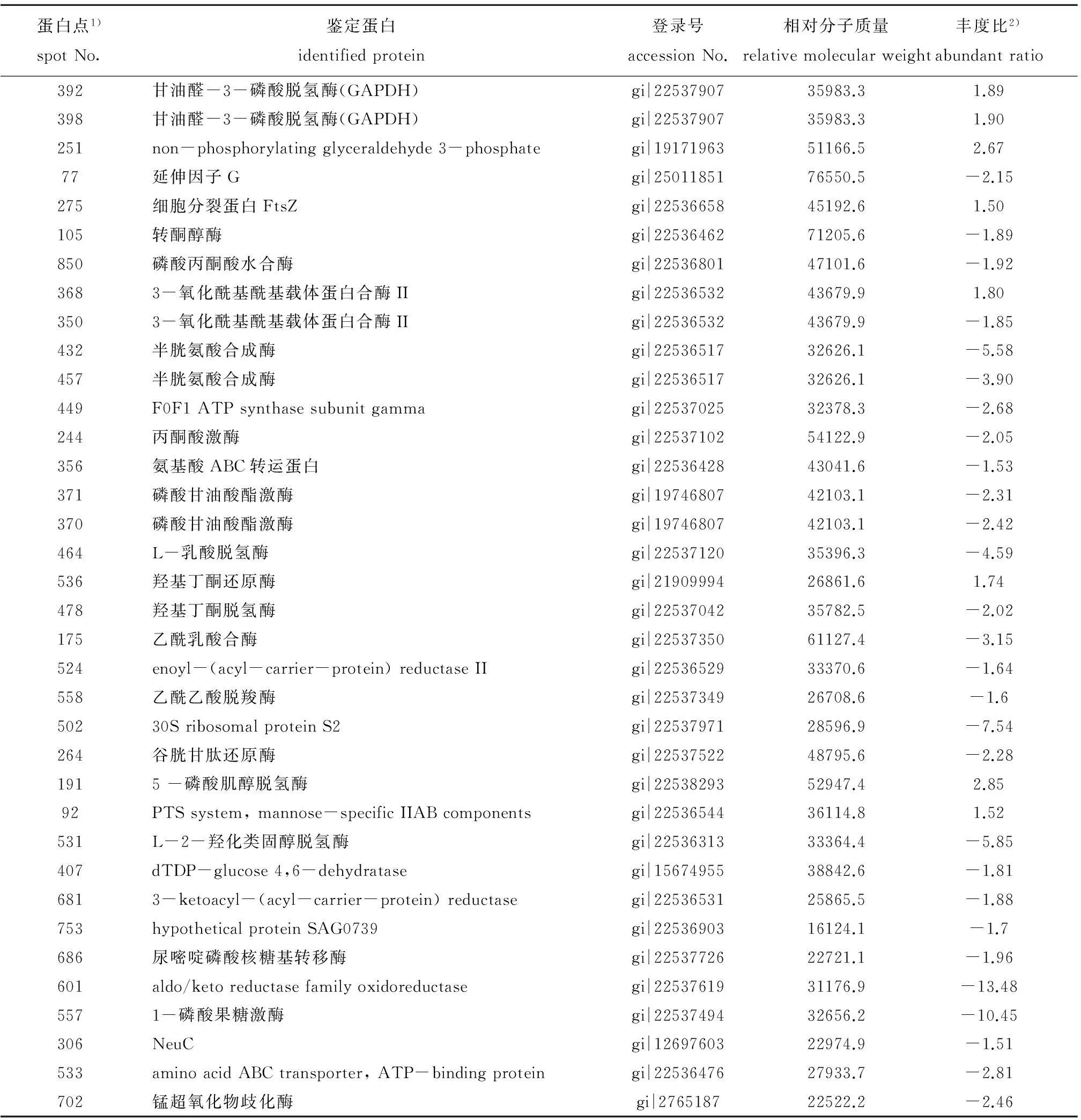
表1 Ia和Ib血清型无乳链球菌差异蛋白鉴定结果
注:1)Master胶内蛋白点的编号;2)Ib与Ia的蛋白丰度比值,负数表示下调
Note:1)Number of protein spots on the master gel;2)the ratio of Ib and Ia protein expression abundance;-,down regulated
2.5蛋白功能分析
根据DAVID Bioinformatics Resources 6.7在线软件分析结果表明,这32种差异蛋白(差异倍数>1.5,P≤0.05)主要与氧化还原反应、能量与代谢前体物产生、糖代谢反应等12个生物学过程有关(图4);主要参与糖解和糖异生作用、丙酮酸代谢、脂肪酸生物合成、丁酸甲酯代谢、半胱氨酸和蛋氨酸代谢和C5支链二元酸代谢6个通路(图5)。

注:分别以150 μg 的Ia、Ib可溶性蛋白以及150 μg的Ia与Ib等量混合蛋白先进行2D电泳后再进行银染,然后与2D-DIGE电泳图进行比对,找出相对应的表达差异蛋白点Note:150 μg Ia and Ib soluble protein is added into 150 μg equal volume of Ia and Ib mixture for master gel 2D electrophoresis. The 2D protein gel is stained with sliver, and then compared with 2D-DIGE gel to find out the differential expression protein spots on the master gel图3 Master胶 2D电泳结果Fig.3 Master gel 2D electrophoresis
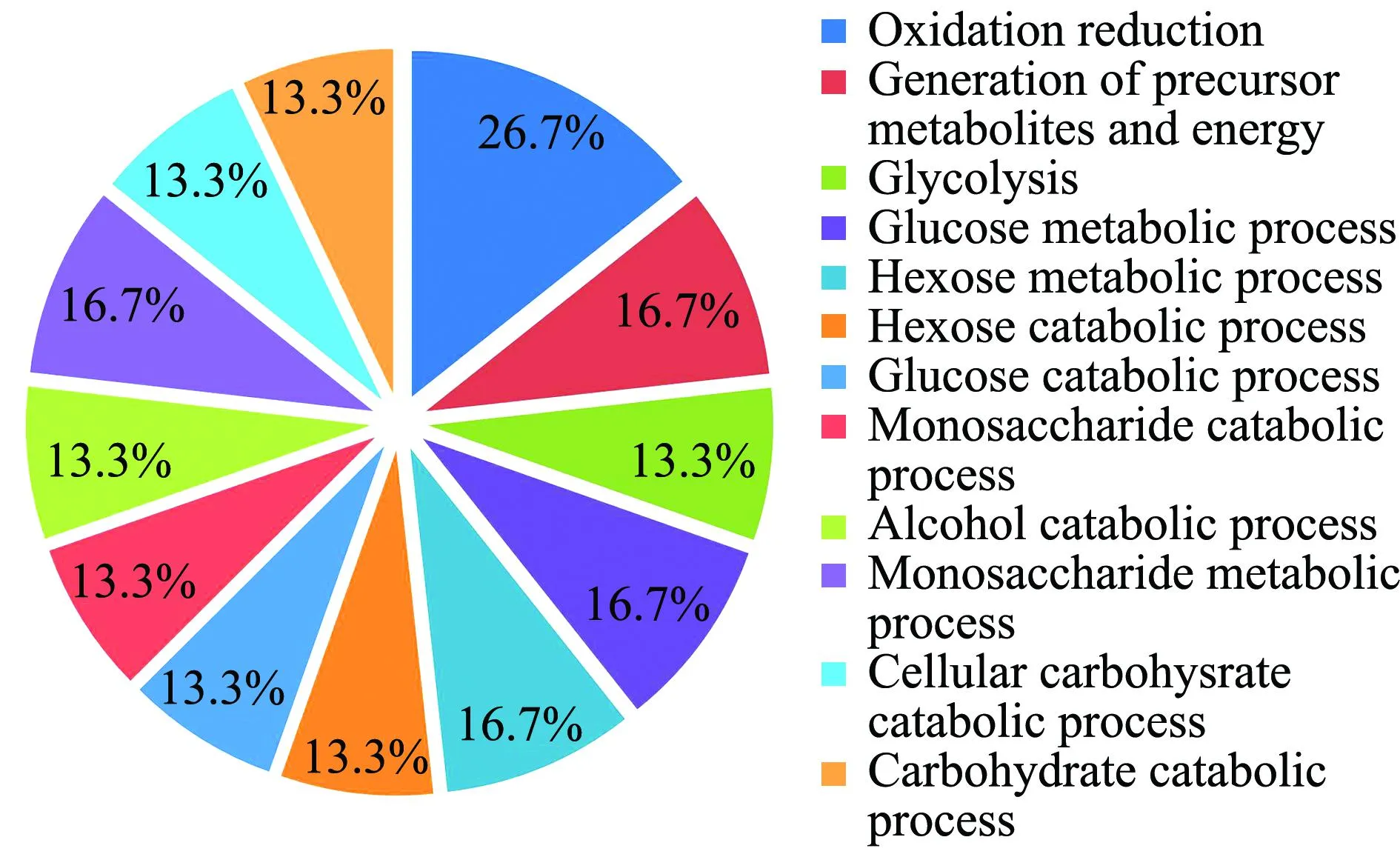
图4 差异蛋白生物学过程的Gene ontology分析Fig.4 Biological process analysis of different proteins by Gene ontology
3讨论
3.1Ia和Ib血清型无乳链球菌表达差异蛋白
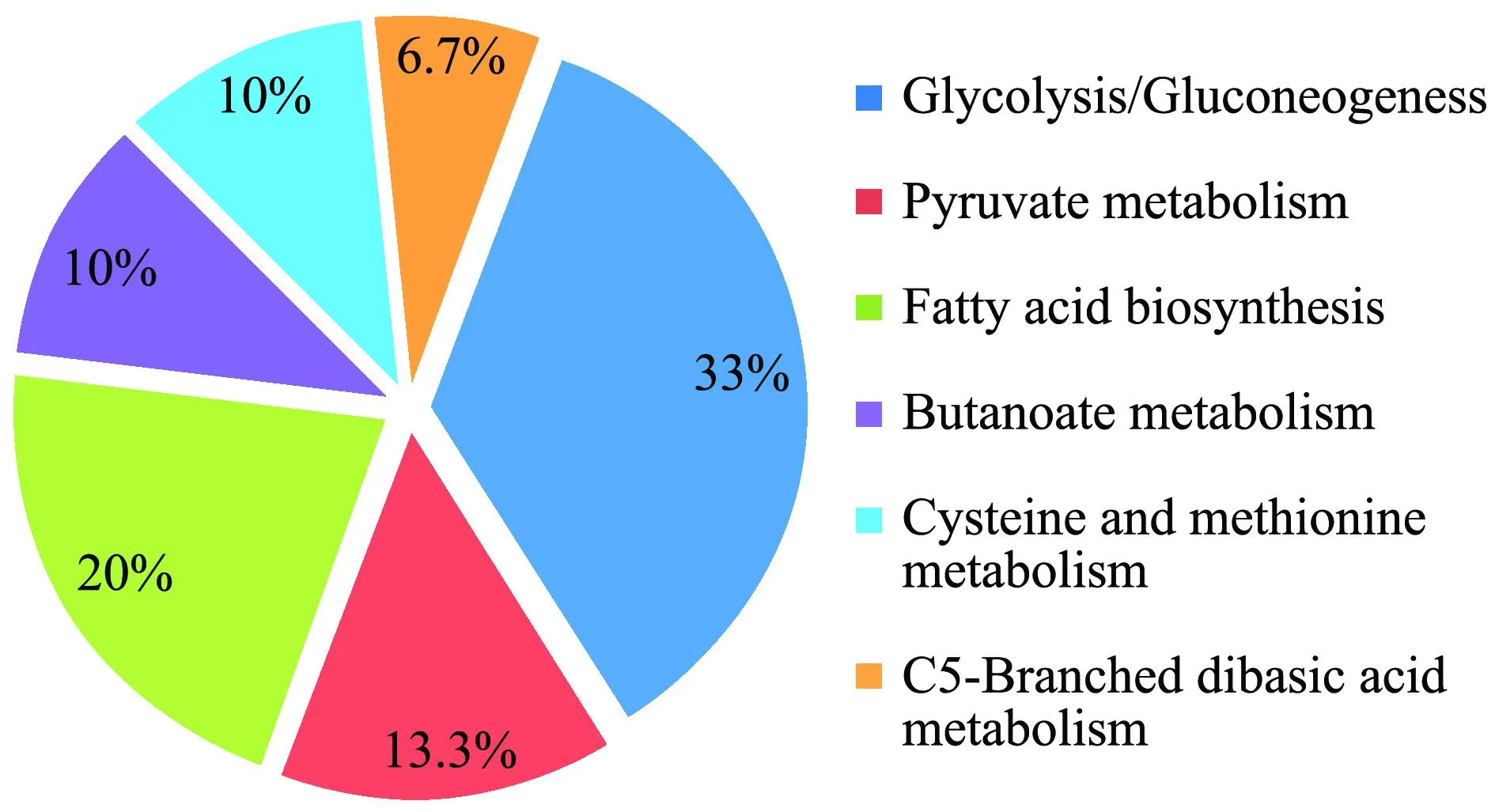
图5 差异蛋白的Pathway分析Fig.5 Pathway analysis of different proteins
目前,罗非鱼无乳链球菌病还没有有效的治疗药物。疫苗接种被认为是最有效的防控手段,但由于无乳链球菌存在很多种血清型[4,6-9],而且不同血清型链球菌疫苗之间缺乏有效的交叉保护力[4],这就阻碍了无乳链球菌病疫苗的研发,因此,揭示无乳链球菌不同血清型免疫原性存在差异的原因,对未来疫苗的研发有一定的指导作用。本研究中,应用2D-DIGE电泳技术分析罗非鱼Ia和Ib血清型无乳链球菌的表达差异蛋白,并用MALDI-TOF-MS鉴定了这些蛋白。蛋白双向荧光差异凝胶电泳(2D-DIGE)是一种新型的蛋白组分析技术, 它将统计学可信的蛋白组差异数据和2D的高分辨率完美结合,既保留了2D蛋白电泳的敏感性,又加入了新出现的荧光标记定量蛋白组学技术,可以在同一块胶中分析不同样品的蛋白表达。此外,由于引入了内标,显著减少了胶间差异和工作量,明显提高了检测差异蛋白的灵敏度、准确率和可重复性[10-11]。在动物医学方面,2D-DIGE 技术已经应用于不同类型, 不同个体的细胞、组织,或经过不同处理和不同生长条件下蛋白表达差异的分析[12-16]。
本试验中,应用DeCyder 2D差异分析软件全自动对一块胶内的多个样品进行扫描分析,并全自动进行匹配,得到蛋白丰度的准确变化。根据P≤0.05和蛋白表达差异倍数1.5倍以上的差异点判定条件,判定出表达差异蛋白。经扫描分析,Ia和Ib血清型无乳链球菌存在167个蛋白表达差异蛋白点,相对于Ia血清型菌株,Ib血清菌株有74个上调蛋白点,93个下调蛋白点。表达差异倍数>10以上的有14个蛋白点;5~10倍的有10个蛋白点;1~5倍的有143个蛋白点。这说明Ia和Ib血清型无乳链球菌的可溶性蛋白存在较大差异。
3.2差异表达蛋白的鉴定和分析
在获得的167个差异蛋白点中,共鉴定获得了32种不同的蛋白,其中部分蛋白点由于浓度太低未能检测到,还有部分差异蛋白点编码相同的蛋白。其中相对Ia血清型,Ib型菌株在32个鉴定的蛋白点中,只有8个上调蛋白,其他24个为下调蛋白;表达差异倍数>10以上的有2个蛋白;5~10倍的有3个蛋白;1~5倍的有27个蛋白(表1)。
在这32种差异表达蛋白中,大部分为酶类,如氧化还原酶、合成酶和转移酶。Gene ontology分析和KEGG Pathway通路分析表明,32种差异蛋白涉及12种生物学过程和6个通路代谢。对这些蛋白的功能进行预测和分析,发现部分酶可能与细菌免疫反应有关,如GAPGH、半胱氨酸合成酶和锰依赖性锰超氧化物歧化酶。研究表明,GAPGH能够与纤维蛋白酶原结合蛋白,是一种保护性抗原,可用于疫苗的研发[17],另外该蛋白能够诱导宿主的免疫应答对抗牛支原体的感染[18]。此外还发现,GAPDH作为链球菌血纤维蛋白溶酶的受体参与黏附和信号转导到宿主[19-20]。链球菌的半胱氨酸合成酶有两种类型:O-乙酰丝氨酸(硫醇)裂解酶-A(cysK)和O-乙酰丝氨酸(硫醇)裂解酶-B(cysM)[21]。研究证实,免疫重组的cysK能够产生高滴度的IgG1和IFN-γ,诱导Th2细胞免疫反应,并在对抗布鲁氏菌感染中起到一定的保护作用[22]。锰依赖性的锰超氧化物歧化酶(Mn-SOD)是金属酶催化过氧化氢和分子氧转化的超分子,在一些细胞系中Mn-SOD作为一种救援蛋白对抗TNFα的细胞毒性[23]。此外,Mn-SOD已被证明参与抗氧化应激反应[24]。这些与免疫和疫苗相关的差异表达蛋白是否与Ia和Ib血清型无乳链球菌的免疫原性相关,值得进一步研究。
参考文献:
[1]Chen M,Li L P,Wang R,et al.PCR detection and pfge genotype analyses of streptococcal clinical isolates from tilapia in China[J].Veterinary Microbiology,2012,159(3/4):526-530.
[2]Hughes M J G,Moore J C,Lane J D,et al.Identification of major outer surface proteins ofStreptococcusagalactiae[J].Infection and Immunity,2002,70(3):1254-1259.
[3]Shin G W,Palaksha K J,Yang H H,et al.Partial two-dimensional gel electrophoresis (2-DE) maps ofStreptococcusiniaeATCC29178 andLactococcusgarvieaeKG9408[J].Diseases of Aquatic Organisms,2006,70(1):71-79.
[4]Chen M,Wang R,Li L P,et al.Screening vaccine candidate strains againstStreptococcusagalactiaeof tilapia based on PFGE genotype[J].Vaccine,2012,30:6088-6092.
[5]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[6]Pressey J G,Pressey C S,Robinson G,et al.2D-difference gel electrophoretic proteomic analysis of a cell culture model of alveolar rhabdomyosarcoma[J].Journal of Proteome Research,2011,10:624-636.
[7]Evans J J,Bohnsack J F,Klesius P H,et al.Phylogenetic relationships amongStreptococcusagalactiaeisolated from piscine,dolphin,bovine and human sources:a dolphin and piscine lineage associated with a fish epidemic in Kuwait is also associated with human neonatal infections in Japan[J].Journal of Medical Microbiology,2008,57:1369-1376.
[8]Suanyuk N,Kong F,Ko D,et al.Occurrence of rare genotypes ofStreptococcusagalactiaein cultured red tilapiaOreochromissp.and Nile tilapiaO.niloticusin Thailand—relationship to human isolates[J].Aquaculture,2008,284(1/4):35-40.
[9]Ye X,Li J,Lu M X,et al.Identification and molecular typing ofStreptococcusagalactiaeisolated from pond-cultured tilapia in China[J].Fish Science,2011,77:623-632.
[10]Uenlue M,Morgan M E,Minden J S.Difference gel electrophores is:a single method for detecting changes in protein extracts[J].Electrophoresis,1997,18:2071-2077.
[11]Tonge R,Shaw J,Middleton B,et al.Validation and development of fluorescence two-dimensional differential gel electrophoresis proteomics technology[J].Proteomics,2001,1(3):377-396.
[12]Langereis J D,Prinsen B H,de Sain-van der Velden M G,et al.A 2D-DIGE approach to identify proteins involved in inside-out control of integrins[J].Journal of Proteome Research,2009,8(8):3824-3833.
[14]Briolant S,Almeras L,Belghazi M,et al.ResearchPlasmodiumfalciparumproteome changes in response to doxycycline treatment[J].Malaria Journal,2010,9:141.
[15]王筝扬.肺癌与炎症性胸腔积液蛋白质荧光差异双向电泳图谱分析[D].杭州:浙江大学,2008.
[16]Douette P,Navet R,Gerkens P.Steatosis-induced proteomic changes in liver mitochondria evidenced by two-dmiensional differential in-gel electrophoresis[J].Proteomics,2005,4:2024-2031.
[17]Rosinha G M S,Myioshi A,Azevedo V,et al.Molecular and immunological characterisation of recombinantBrucellaabortusglyceraldehyde-3-phosphate-dehydrogenase,a T-and B-cell reactive protein that induces partial protection when co-administered with an interleukin-12-expressing plasmid in a DNA vaccine formulation[J].Journal of Medical Microbiology,2002,51(8):661-671.
[18]Perez-Casal J,Prysliak T.Detection of antibodies against theMycoplasmabovisglyceraldehyde-3-phosphate dehydrogenase protein in beef cattle[J].Microbial Pathogenesis,2007,43(5):189-197.
[19]Bisno A L,Brito M O,Collins C M.Molecular basis of group A streptococcal virulence[J].The Lancet Infectious Diseases,2003,3(4):191-200.
[20]Cunningham M W.Pathogenesis of group A streptococcal infections[J].Clinical Microbiology Reviews,2000,13(3):470-511.
[21]Kredich N M. Biosynthesis of cysteine[M]//Neidehardt F C,Curtiss III R,Ingraham J L,et al.EscherichiacoliandSalmonellacellular and molecular biology.2nd ed.Washington,D.C.:ASM Press,1996: 514-527.
[22]Jain S,Afley P,Kumar S.Immunological responses to recombinant cysteine synthase A ofBrucellaabortusin BALB/c mice[J].World Journal of Microbiology and Biotechnology,2013,29(5):907-913.
[23]Kawaguchi T,Takeyasu A,Matsunobu K,et al.Stimulation of Mn-superoxide dismutase expression by tumor necrosis factor-α:quantitative determination of Mn-SOD protein levels in TNF-resistant and sensitive cells by ELISA[J].Biochemical and Biophysical Research Communications,1990,171(3):1378-1386.
[24]Yesilkaya H,Kadioglu A,Gingles N,et al.Role of manganese-containing superoxide dismutase in oxidative stress and virulence ofStreptococcuspneumonia[J].Infection and Immunity,2000,68(5):2819-2826.
Comparison of soluble protein between Ia and Ib serotypes of
Streptococcusagalactiaestrains from tilapiaOreochromisniloticus
SHI Yun-liang1,2,3,LI Li-ping1, WANG Rui1, LIANG Wan-wen1, GAN Xi1, HUANG Ting1,
LI Jian2,3, HUANG Wei-yi2,3, CHEN Ming1
(1.Guangxi Key Laboratory for Aquatic Genetic Breeding and Healthy Aquaculture, Guangxi Institute of Fisheries, Nanning 530021, China;2.College of Animal Science and Technology, Guangxi University, Nanning 530005, China;3.Center for Food Safety and Quality,Guangxi University, Nanning 530005, China)
Abstract:Our previous study showed that there was no cross protection in vaccines prepared from Streptococcus agalactiaestrains with different serotypes (Ia and Ib) isolated from Nile tilapia Oreochromis niloticus. Soluble protein of Ia and Ib serotypes S.agalactiae strains were extracted, isolated and analyzed using two dimension-Difference Gel Electrophoresis (2D-DIGE) and the differential expression protein spots and the differential expression proteins were identified by MALDI-TOF-MS in order to understanding of the reason for the immunogenicity difference between Ia and Ib serotypes tilapia S.agalactiae. The functional category of the identified protein was determined by DAVID bioinformatics database. The results showed that there were 167 differential expression protein spots between these two serotypes strains in the 2D-DIGE gel and 32 proteins were identified by MALDI-TOF-MS. Most of the identified proteins were involved in related biological processes including oxidation-reduction, generation of precursor metabolites and energy and glucose metabolic process, especially involved in glycolysis/gluconeogenesis, pyruvate metabolism and fatty acid biosynthesis pathways. Protein function prediction indicated that GAPGH, cysteine synthase and manganese-dependent superoxide dismutase were associated with immunity and vaccine developing. The findings firstly approve that there are lots of differential expression proteins between Ia and Ib serotypes of S.agalactiae strains, some of which are immune-related proteins and (or) vaccine-related proteins, which is contributed to the immunogenicity different between Ia and Ib serotypes of S.agalactiae strains, but still need further research.
Key words:Oreochromis niloticus; Streptococcus agalactiae; Ia and Ib serotype; soluble protein; two dimension-Difference Gel Electrophoresis (2D-DIGE); differential analysis
通信作者:陈明(1981—), 男, 副研究员,博士。E-mail:cm990919@163.com
作者简介:石云良(1982—), 男, 博士研究生。E-mail:syunliang2008@126.com
基金项目:广西科技发展“十二五”规划重大专项(14121004-2-4);广西壮族自治区“八桂学者”岗位专项资金资助项目(BGXZ-LFY-04);广西罗非鱼产业创新团队岗位科研经费(GXBY-03);广西自治区直属公益性科研院所基本科研业务费(GXIF-2014-010);广西水产遗传育种与健康养殖重点实验室开放课题(GXKL-AQUA-2013-C-02)
收稿日期:2014-06-27
中图分类号:Q954.4
文献标志码:A
文章编号:2095-1388(2015)02-0125-07
DOI:10.3969/J.ISSN.2095-1388.2015.02.003

