黄芪当归合剂对梗阻性肾病大鼠E-cadherin和α-SMA表达的影响①
李 丽 ,王长山,李怀荆,杨占双,聂 影,杨 松,聂 晶
(1.佳木斯大学附属第一医院, 黑龙江 佳木斯 154003;2.佳木斯大学基础医学院, 黑龙江 佳木斯 154007)
黄芪当归合剂对梗阻性肾病大鼠E-cadherin和α-SMA表达的影响①
李丽1,王长山2,李怀荆2,杨占双1,聂影1,杨松1,聂晶1
(1.佳木斯大学附属第一医院, 黑龙江 佳木斯 154003;2.佳木斯大学基础医学院, 黑龙江 佳木斯 154007)
摘要:目的:探讨黄芪当归合剂(A&A)在梗阻性肾病中抗纤维化的可能作用机制。方法: 将30只成年雄性大鼠随机分为: 假手术组( sham 组) 10只,模型组10只(单侧输尿管结扎, UUO组),治疗组(A&A组)10只。于术后14d处死,留取肾组织。光镜观察肾脏病理形态学改变,采用免疫组化检测肾组织E-cadherin和α-SMA蛋白表达。结果:① HE和Masson染色观察到UUO组出现明显的纤维化表现;②免疫组化结果显示:与假手术组比较,模型组和治疗组E-cadherin的下调伴有α-SMA表达上调(P<0.05);与模型组比较,治疗组14d E-cadhelin蛋白下降(P<0.05),E-cadhelin蛋白表达量升高(P<0.05)。结论: 黄芪当归合剂的抗纤维化作用机制,可能通过抑制EMT进程发挥作用。
关键词:肾小管间质纤维化; UUO; E-cadherin;α-SMA
梗阻性肾病(obstructive nephropathy)是由泌尿道结构和(或)功能改变,阻碍尿液的排出,导致肾实质病理和功能损害的临床综合征。据统计, 儿童梗阻性肾病占所有终末期肾脏疾病(end-stage renal disease, ESRD)的0.3%,占所有儿童肾移植的16.1%。病理学特征主要表现为肾小管萎缩和间质纤维化,肾小管上皮细胞-间充质细胞转化(epithelial-mesenchymal transition, EMT)是肾间质纤维化的重要发病机制之一[1,2]。单侧输尿管结扎(unilateral ureteral obstruction,UUO)制作的梗阻性肾病模型是诱导肾纤维化最经典的模型[1,2]。
在肾间质纤维化的防治方面, 祖国传统医学积累了许多宝贵经验[3],经临床和实验研究证实, 具有益气活血作用的黄芪和当归组方而成的黄芪当归合剂(Astragalus and Angelica, A&A ) 可明显改善肾脏病的蛋白质和脂质代谢紊乱、提高血浆白蛋白;减轻炎症细胞浸润、下调转化生长因子(TGF-β1)的高表达等不同途径和环节减轻肾间质纤维化[4,5]。但关于A&A在肾间质纤维化肾小管上皮细胞-间充质细胞转化中的研究相对较少,本实验需通过建立UUO大鼠模型,探讨A&A的治疗后,EMT细胞表型特异性标志物E-cadherin和α-SMA的变化情况,了解 A&A在肾间质纤维化中的作用机制,为临床进行肾间质纤维化防治提供实验性理论依据。
1 材料和方法
1.1模型制备及分组
雄性清洁级Wistar大鼠30只(由佳木斯大学实验动物中心提供)。以随机排列表法随机分为:假手术组(sham组)、模型组(UUO组)和治疗组(A&A组),每组10只,以10%的水合氯醛(300㎎/㎏)腹腔注射麻醉后,行左侧耻骨上切口,沿左肾下极寻找到左输尿管,用4-0号丝线上下结扎两处,从中剪断输,分层缝合关闭腹腔。假手术组,分离输尿管不结扎,随即缝合腹腔。动物清醒1h后,A&A组灌胃给药(3mL/d,黄芪、当归生药各0.7g/mL);sham组和 UUO组给予等量清水[1]。
1.2取材
每组大鼠于术后14d处死,取左侧肾脏,一部分置4%多聚甲醛中固定,石蜡包埋,待做病理形态学检测和免疫组化染色。
1.3病理形态学观察
通过HE染色,光镜下观察肾间质纤维化、蛋白管型、肾小管扩张和肾间质炎细胞浸润程度判定肾小管间质损伤的程度。每个参数分为4个等级: 0分为正常,1分为轻度受损,2分为中度受损,3分为重度受损,每个样本小管间质损伤评分总分为0~9分。通过Masson染色,借助图像分析软件定量分析肾间质纤维化程度。每例切片取10个不重复的400倍视野,以蓝色胶原沉积为阳性,计算蓝染面积占整个视野的百分比,得出肾间质胶原面积与视野内肾小管间质总面积(去除肾小管管腔)的比值,取其平均值为每例切片的肾间质相对面积[1]。
1.4免疫组化检测E-cadherin和α-SMA蛋白表达
取肾组织,制备5μm厚连续切片,按试剂盒操作,一抗E-cadherin和α-SMA。二抗为羊抗兔SP检测试剂盒,DAB显色,阳性结果为棕黄色。每张切片随机取10个400×高倍视野,阳性结果呈棕黄色或棕褐色颗粒,通过图像采集软件和图像分析软件,测出阳性部分平均光密度值,进行分析比较。
1.5统计学方法
采用SPSS17.0统计软件,数据采用均数±标准差表示,组间比较采用t检验,P<0.05有统计学意义。
2 结果
2.1HE染色
UUO组术后14 d肾小管结构严重破坏,肾小管萎缩,肾小管、集合管扩张呈囊状,管腔塌陷,上皮细胞大量坏死,肾间质弥漫性巨噬细胞、淋巴细胞浸润和成纤维细胞增生及胶原形成。sham组大鼠肾脏肾小管结构正常、排列紧密整齐,间质未见增宽,无炎性细胞浸润,小管基底膜光滑完整。两组肾小管损伤程度评分比较有统计学差异(P<0.05)[1]。 见表1。
2.2Masson染色
UUO术后14d可见胶原沉积,肾间质逐渐增宽,间质细胞及细胞外基质成分增多;sham组肾脏胶原染色主要位于小管基膜、肾小囊、系膜区和肾小管间的毛细血管周围,而小管周围间质染色较少。UUO组肾间质纤维组织相对面积较sham组明显增高(P<0.05)[1],见表1。
表1大鼠肾小管损伤程度评分和肾间质相对面积比较

肾小管损伤程度肾间质相对面积sham组0.15±0.101.89±0.30UUO组6.12±0.89a32.70±2.51a
aP<0.05与sham组比较。
2.3免疫组化检测E-cadherin 蛋白表达
E-cadherin是上皮细胞表面标志,阳性染色镜下呈棕黄色。sham组肾小管上皮细胞中可见大量E-cadherin表达;UUO组术后14d在肾小管上皮中E-cadherin表达大量消失,仅见片状、弱表达;A&A组在14d在肾小管上皮中E-cadherin表达部分消失,UUO组与sham组平均密度值比较有统计学差异(P<0.05);UUO组和A&A组平均密度值的比较(P<0.05),差异有统计学意义[1],见表2 。
2.4免疫组化检测α-SMA蛋白表达
α-SMA蛋白为细胞浆染色,阳性染色镜下呈棕黄色。在sham组大鼠肾小球、肾小管以及肾间质均未见表达,仅表达于肾动脉血管平滑肌细胞。UUO组术后14d在肾间质和肾小管上皮细胞见较多α-SMA表达; A&A组14d可见α-SMA,较UUO组表达量减少。UUO组与sham组平均密度值比较有统计学差异(P<0.05);A&A组与UUO组平均光密度值的比较,差异有统计学意义(P<0.05)[1],见表2。
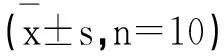
表2 免疫组化检测各组大鼠肾皮质E-cadherin和α-SMA蛋白的表达量
aP<0.05,与sham组比较;bP<0.05,UUO组内比较。
3 讨论
肾间质纤维化的过程包括肾小管的损伤、细胞外基质(ECM)的过多沉积、多个细胞因子参与的复杂过程[6]。肾间质纤维化(Renal Interstitial Fibrosis, RIF)是梗阻性肾病与其他各种慢性肾病发展至终末期肾功能衰竭的共同通路和重要原因。作为慢性肾功能衰竭的进行性发展过程中的始动因素,RIF被认为比肾小球病变更能反映慢性肾功能衰竭的进展速率及预后。RIF的发病机制是一复杂的慢性病理过程,临床上缺乏有效、可靠的治疗方法,RIF导致的ESRD需依赖透析治疗或肾脏移植,为此需要耗费巨大的财力、人力和物力,对患者、家庭和社会造成巨大负担。因而阻滞或延缓RIF进程是抑制或逆转进行性肾功能恶化的关键[1]。
UUO 是诱导肾纤维化最经典的模型,刘中柱等亦通过结扎大鼠单侧输尿管建立UUO模型,免疫组化等观察大鼠肾脏的病理变化[6~9],也有应用马兜铃酸引起肾病肾间质纤维化模型的[10]。在本研究中,通过HE和Masson染色观察UUO模型的尿路梗阻后肾脏纤维化表现,肾间质淋巴细胞浸润;肾小管扩张、肾间质胶原纤维沉积等。证明UUO模型造模成功[1]。
中药在慢性肾病的治疗中具有一定的作用。研究表明,由黄芪和当归组方的黄芪当归合剂通过抑制ECM 的生成而减轻肾脏纤维化。新近研究发现A&A 能够抑制间质纤维化肾脏中纤溶酶原激活物抑-1(plasminogen activator inhibitor-1,PAI-1) mRNA 的表达,提示A&A可能通过调控ECM降解,减轻肾脏纤维化[1],A&A 还能够下调结缔组织生长因子(CTGF)和纤黏连蛋白(FN)的表达, 抑制肾纤维化[11,12]。但是,对于A& A 的抗纤维化作用及其机制目前尚未完全明确。
E-cadherin是肾小管上皮细胞特征性标志,在EMT时首先消失;α-SMA是肌成纤维细胞标志性蛋白己得到公认[13]。本实验研究证实,在肾间质纤维化的UUO动物模型中存在着E-cadherin表达的下调,这与yang等[14]学者的研究结果相似。与此同时,α-SMA蛋白表达呈现明显的上调趋势,研究结果提示,UUO大鼠在肾间质纤维化的同时伴有E-cadherin的下调和标志物α-SMA表达增加,提示肾小管上皮细胞发生了EMT。本实验研究显示,经黄芪当归合剂治疗14d E-cadhelin蛋白表达量较UUO组下降,E-cadhelin蛋白表达量明显高于UUO组,这一结果说明黄芪当归合剂可抑制肾小管肾小管上皮细胞转分化的过程,延缓肾间质纤维化的进程。提示A&A 的抗纤维化作用机制,可能通过抑制EMT进程发挥作用,其具体分子机制及信号通路还有待进一步研究。
参考文献:
[1]李丽.PAX2基因沉默在梗阻性肾病肾小管上皮细胞转分化中作用机制的研究[J].中国医科大学博士论文,2010
[2]Picard N, Baum O, Vogetseder A, et al. Origin of renal myofibroblasts in the model of unilateral ureter obstruction in the rat[J]. Histochem Cel Biol,2008,130(1):141-155
[3]吴金玉, 康海艳, 覃柳菊. 中医药抗肾纤维化的研究进展[J].辽宁中医杂志,2008, 35(5):792-793
[4]Meng L, Qu L, Tang J, et al . A combination of Chinese herbs, Astragalus membranaceus var mongholicus and Angelica sinensis, enhanced nitric oxide production in obstructed rat kidney[J].Vascul Pharmacol,2007,47(2-3):174-183
[5]Song J, Meng L, Li S, et al . A combination of Chinese herbs, Astragalus membranaceus var. mongholicus and Angelica sinensis, improved renal microvascular insufficiency in 5/6 nephrectomized rats[J]. Vascul Pharmacol,2009,50(5-6): 185-193
[6]刘中柱,潘明阳,刘艳姝,等.厄贝沙坦对单侧输尿管梗阻大鼠肾间质纤维化干预作用[J].黑龙江医药科学,2014,37(2):50-51
[7]刘艳姝, 刘文思, 刘中柱,等.活性维生素D3 抑制UUO 模型大鼠肾间质纤维化作用的研究及其对TGF-B1, A-SMA 表达的影响[J].黑龙江医药科学,2013,36(2):72-73
[8]刘艳姝,李冬梅,刘中柱,等.活性维生素D3对单侧输尿管梗阻大鼠肾间质纤维化影响及OPN表达的影响[J].黑龙江医药科学,2014,37(4):66-67
[9]姚双,康晓明,李丽.雷帕霉素对大鼠慢性肾间质纤维化中HGF、TGF-β的表达的影响[J].黑龙江医药科学,2013,36(3):11-12
[10]牛效清, 张威, 刘中柱, 等.慢性马兜铃酸肾病肾间质纤维化大鼠TGF-β1及BMP-7蛋白的表达[J].黑龙江医药科学,2013,36(2):80-81
[11]W ang H,L i J,Yu L,et al.An tifib rotic effect of the C h inese herbs, Astragalu s mongholicus and Angelica sinen sis, in a rat model of chron ic purom ycin am inonucleos ide neph ros is [J] .Life Sci,2004,74(13):1645-1658
[12]黄海长,闵亚丽,李惊子,等.黄芪当归合剂及依那普利对结缔组织生长因子在肾间质纤维化中表达的比较研究[J].中华肾脏病杂志, 2003, 19(3):133-136
[13]Faulkner JL, Szcykalski LM, Springer F, et al.Origin of interstitial fibroblasts in an accelerated model of angiotensin II-induced renal fibrosis[J]. Am J Pathol, 2005,167(5):1193-1205
[14]Yang J, Liu Y.Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis[J]. J Am Soc Nephrol,2002 ,13(1):96-107
中图分类号:R285.6;R691.2
文献标识码:A
文章编号:1008-0104(2015)06-0004-02
基金项目:①1.黑龙江省青年科学基金项目,编号:QC2012C119;2.黑龙江省卫生厅项目,编号:2012-198;3.佳木斯大学科学技术重点项目,编号:Sz 2014-011。
作者简介:李丽( 1979~ )女,黑龙江佳木斯人,博士,副教授,硕士研究生导师。
通讯作者:王长山( 1977~ )男,黑龙江佳木斯人,博士,副教授,硕士研究生导师。E- mail: wcs0451@163.com。
(收稿日期:2015-07-08)

