二维高通量色谱分离制备海参来源真菌Epicoccum sp.的化学成分
齐君,夏雪奎,贾爱荣,刘新,张绵松,刘昌衡
(1.山东省科学院中日友好生物技术研究中心,山东省应用微生物重点实验室,山东 济南 250014;2. 山东省科学院生物研究所,山东 济南 250014)
二维高通量色谱分离制备海参来源真菌Epicoccumsp.的化学成分
齐君1,夏雪奎1,贾爱荣2,刘新2,张绵松1,刘昌衡2
(1.山东省科学院中日友好生物技术研究中心,山东省应用微生物重点实验室,山东 济南 250014;2. 山东省科学院生物研究所,山东 济南 250014)
摘要:建立了二维高通量色谱分离、纯化海参来源真菌Epicoccum sp.中的海松烷二萜化合物的新方法。以甲醇-水为溶剂体系梯度洗脱,在流速为40 mL/min、主分离检测波长为254 nm,二级分离检测波长为220 nm的条件下进行分离,从1.5 g海参来源真菌Epicoccum sp.乙酸乙酯提取物中分离制备得到海松烷二萜化合物,通过核磁共振氢谱和质谱鉴定化合物的结构。该方法简便、快捷且减少样品的不可逆吸附,为海松烷二萜化合物的制备型分离提供了新手段。
关键词:二维高通量分离制备色谱;海参来源真菌;海松烷二萜化合物
Separation and preparation of chemical components from sea
海参属于海洋低等无脊椎动物中的棘皮动物,含有海参黏多糖、海参皂苷和多肽等活性成分,具有提高机体免疫力、抗衰老以及抗肿瘤等多种生理功能[1-3]。海参具有丰富的共附生微生物,其共附生真菌可以代谢结构新颖、活性多样的次级代谢产物,近年来成为海洋活性天然产物研究的热点之一[4-8]。最近,从海参真菌中已分离到了二萜、大环内酯和环己醇类似物等类型的化合物[9-11],这些结构新颖的化合物多具有抗菌和细胞毒活性。其中海松烷二萜具有明显的细胞毒活性[9],是具有重要生物活性和药用前景的海洋天然产物。
目前海洋微生物次级代谢产物的分离、纯化方法主要是柱色谱法,如硅胶柱色谱、凝胶柱色谱和高效液相色谱等方法[12-13],但这些方法存在耗时长、溶剂消耗大、容易造成样品的不可逆吸附及样品回收率低等缺点。对于活性次级代谢产物的制备,利用传统分离方法,不能对其进行快速有效的分离。
二维高通量分离制备色谱技术是一种由高效液相色谱(HPLC)和固相萃取(SPE)精密串接的高通量分离制备色谱技术,适合复杂化合物的制备分离和纯化。该技术经优化后,通过 HPLC / SPE / HPLC 全自动串接,可以将一个复杂样品在 24 h内得到完全分离,耗时短,减少了溶剂消耗以及固定相对样品的不可逆吸附。本研究采用二维高通量分离制备色谱技术从海参来源真菌Epicoccumsp.中分离获得2个海松烷二萜化合物(结构式见图1),建立了一种快捷、简单的海松烷二萜化合物制备方法,为海洋微生物次级代谢产物的分离和纯化提供参考。
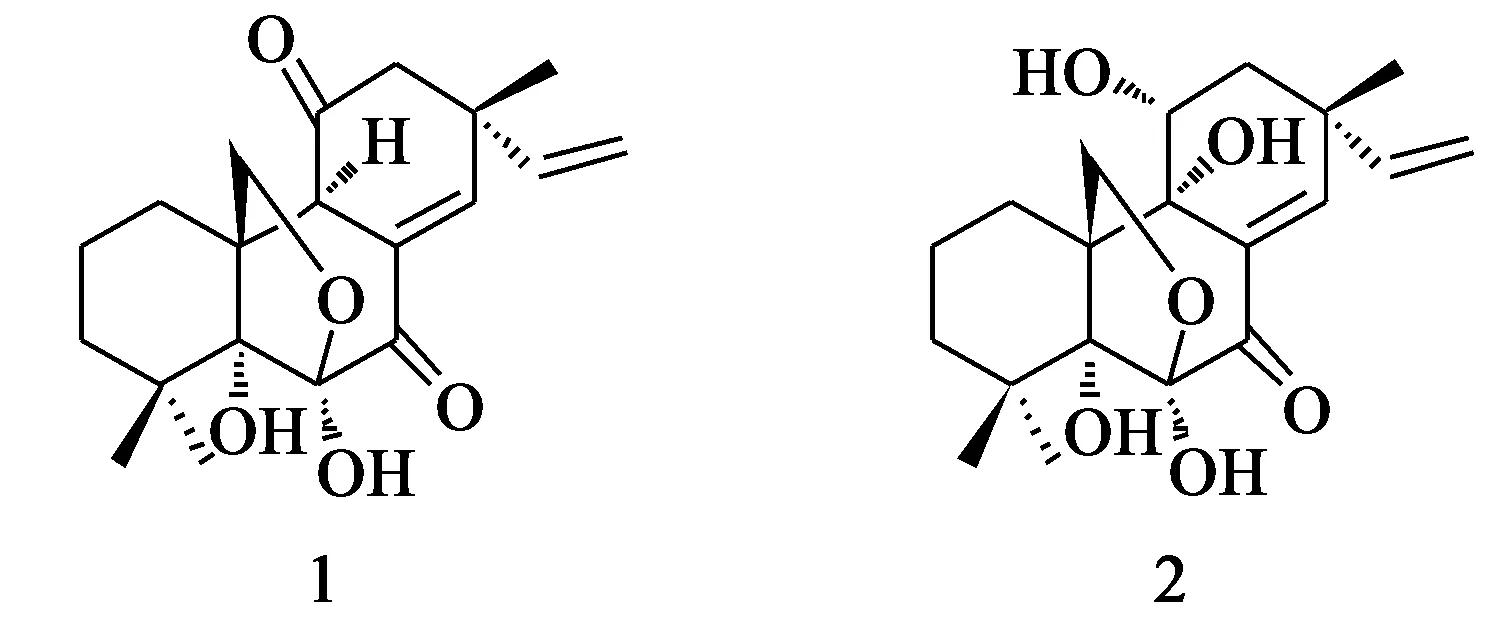
图1 海松烷二萜化合物1和2的化学结构式Fig.1 Chemical structures of pimaranediterpenes1 and 2
1材料与实验方法
1.1仪器与试剂
二维高通量分离制备色谱系统Sepbox 2D-2000,包括2个制备HPLC泵、1根进样柱、1根主分离柱、3根二次分离柱、15根捕获柱、1个紫外检测器(力扬企业有限公司);Waters 高效液相色谱系统(美国沃特世公司);赛多利斯电子天平Balance BSA124S-CW(德国赛多利斯集团)。
菌株Epicoccumsp. 分离自烟台芝罘岛海域仿刺参,由上海生工生物工程技术服务有限公司测序。所得序列在 Genebank 中用 Blast 进行相似性分析,用Clustal 进行排列比较,确定该菌株为Epicoccumsp.。
用于制备海参来源真菌Epicoccumsp. 提取物的试剂为分析纯乙酸乙酯;二维高通量分离制备色谱和高效液相色谱系统所用甲醇为色谱纯(赛默飞世尔科技有限公司),水为娃哈哈纯净水。
1.2海参来源真菌Epicoccumsp. 提取物的制备
1.2.1菌株的分离、发酵
将海参利用无菌水清洗 3 次,切成小块(1 cm×0.5 cm),-20 ℃速冻,打浆,在 PDA 培养基(80 mg/L,硫酸链霉素)涂布,28 ℃培养 20 d。该菌株保存于山东省科学院生物研究所食品生物技术研究室。利用液体培养基(土豆/海水0.2 g/mL,葡萄糖/海水0.02 g/mL),室温下摇床培养5 d,转速170 r/min,制备种子培养基。利用大米固体培养基(大米/海水0.6 g/mL,121 ℃,20 min 高温灭菌)培养15瓶,在室温下静置培养 28 d。
1.2.2乙酸乙酯提取物的制备
发酵28 d后,利用 3 倍体积的乙酸乙酯浸泡提取大米培养基发酵物,室温下连续萃取 3 次,合并萃取液后减压浓缩得到乙酸乙酯相浸膏 (1.5 g)。
1.3二维高通量色谱分离制备的过程
1.3.1样品的分析
将真菌提取物用色谱甲醇溶解,0.45 μL微孔滤膜过滤,待用。应用Waters 高效液相色谱系统进行分析,色谱柱:YMC(250 × 10 mm)。流动相:A为水,B为甲醇。流速:0.8 mL/min。检测波长:190~400 nm。柱温:25 ℃。进样量20 μL。按照以下梯度洗脱程序进行分析,洗脱程序:0~5 min,5%B;5~45 min,5%B~100%B;45~55 min,100%B;55~60 min,100%B~5%B。
1.3.2样品的制备
打开二维高通量分离制备色谱系统Sepbox 2D-2000,用100%色谱甲醇以40 mL/min的流速冲洗整个系统,然后用100% 水以28~40 mL/min的梯度流速平衡系统,待平衡完毕打开紫外检测器。
称取1.5 g真菌提取物用有机溶剂溶解,然后与4.5 g C4反相硅胶混合拌样,干燥后,装入进样柱,准备进样。经分析后,应用仪器的原默认方法(表1)即可对样品进行分离纯化。主分离检测波长为254 nm,二级分离检测波长为220 nm。
2结果与讨论
2.1样品的分析
考察了真菌Epicoccumsp.乙酸乙酯提取物在不同波长(190~400 nm)下的色谱图,在254 nm时,其HPLC色谱图色谱峰较多、强度较高且分离度好,因此本研究选择254 nm用于HPLC分析的检测波长,见图2。
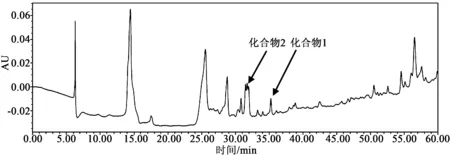
图2 样品在检测波长254 nm下的HPLC色谱图Fig.2 HPLC chromatogram of crude extract of Epicoccum sp.in 254 nmdetection wavelength
2.2样品的制备
根据样品的分析结果,应用仪器的原默认方法即可对样品进行分离纯化。主分离检测波长为254 nm。主分离洗脱条件如表1。样品通过主分离,分别被15根捕获柱捕获,待二次分离。主分离结果见图3。
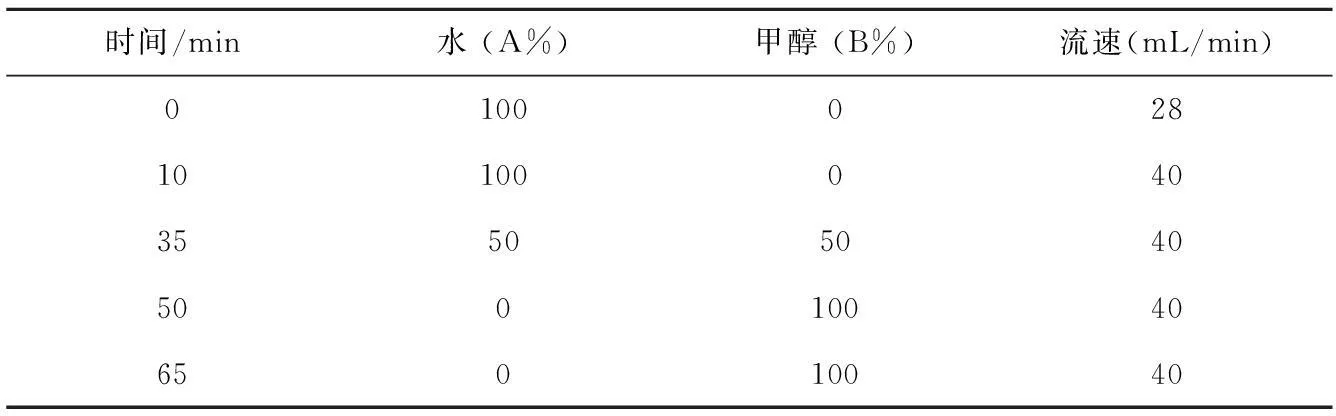
表1 二维高通量分离制备色谱系统Sepbox 2D-2000的主分离洗脱条件
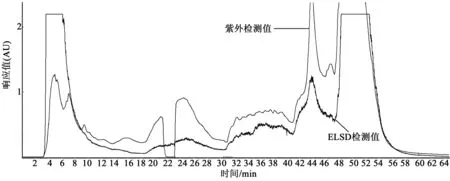
图3 二维高通量分离制备色谱系统对样品的主分离结果Fig.3 Main separation results of samples with two-dimensional high-throughput chromatography
接下来二维高通量分离制备色谱系统分别对15根捕获柱中的样品进行二级分离。二级分离检测波长为220 nm。经过24 h的完全分离,结果得到化合物1和化合物2。两个化合物的二级分离结果如图4。
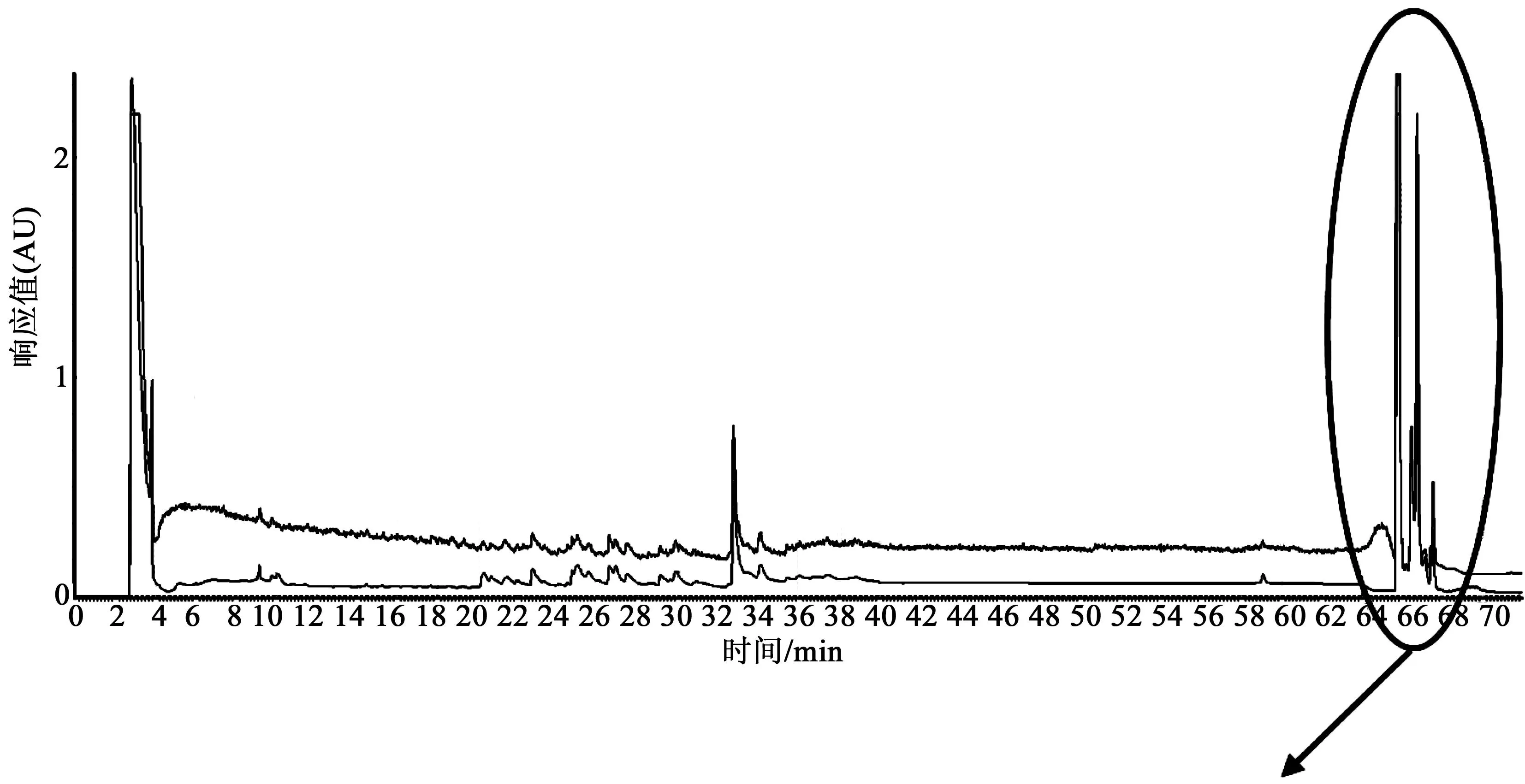

图4 二维高通量分离制备色谱系统对样品的二级分离结果Fig.4 Second-stage separation results of samples with two-dimensional high-throughput chromatography
2.3化合物结构鉴定
化合物1:无色晶体,熔点:195~200 ℃,IR (KBr) νmax3 395,2 926,1 701,1 628 cm-1; 1H (CDCl3, 600 MHz)δ: 6.98 (1H, s, H-14), 5.84 (1H, dd,J=17.4, 9.0 Hz, H-15), 5.05 (1H, d,J=10.2 Hz, H-16a), 5.10 (1H, d,J=10.2 Hz, H-16b), 4.18 (1H, dd,J= 9.6, 1.8 Hz, H-20a), 3.91 (1H, d,J= 9.6 Hz,H-20b),3.75 (1H, s, H-9), 2.50 (1H, dd,J=15.0, 1.8 Hz, H-1a), 2.28 (1H, d,J= 13.2 Hz, H-12a ), 2.25 (1H, d,J= 13.2 Hz, H-12b ), 1.56 (1H, m, H-3b), 1.51 (2H, m, H-2), 1.40 (3H, s, H-19), 1.32 (1H, ddd,J=13.8, 4.8, 4.8 Hz, H-1b), 1.24 (1H, m, H-3a), 1.24 (3H, s, H-18), 1.19 (3H, s, H-17)。HRTOFMS:m/z347.185 3 [M + H]+。以上数据和文献报导的基本一致[9],确定化合物1为Aspergilone A。
化合物2:无色晶体,熔点:197~218 ℃,IR (KBr) νmax3 418,2 927,1 703,1 624,1 392 cm-1; 1H (DMSO-d6, 600 MHz)δ: 6.81 (1H, s, H-14), 5.86 (1H, dd,J= 18.0, 10.2 Hz, H-15), 5.04 (2H, m, H-16), 4.05 (1H, m, H-11), 3.98 (1H, d,J=10.2 Hz, H-20b), 3.62 (1H,d,J=10.2 Hz, H-20a), 1.96 (1H, m, H-12b), 1.93 (1H, m, H-1b), 1.82 (1H, m, H-1a), 1.61 (1H, m, H-12a), 1.49 (1H, m, H-2b), 1.47 (1H, m, H-2a), 1.42 (1H, m, H-3b), 1.32 (3H, s, H-19), 1.17 (3H, s, H-17), 1.06 (3H, s, H-18), 1.00 (1H, m, H-3a)。HRESIMS:m/z387.178 9[M + H]+。以上数据和文献报导的基本一致[14],确定化合物2为Diaporthein B。
3结论
本研究运用二维高通量分离制备色谱技术从海参来源真菌Epicoccumsp. 的乙酸乙酯提取物中成功分离获得2个海松烷二萜化合物。结果表明,与传统分离技术相比,二维高通量分离制备色谱技术通过高效液相色谱和固相萃取有效结合,显著提高了天然产物纯化过程的速度,是分析、分离复杂组分物质的有效方法,能快速、高效地将微生物发酵液中的成分分离成纯化合物。本研究不仅为海松烷二萜化合物的分离制备提供了一种新型、实用的方法,而且为海洋微生物次级代谢产物的分离纯化提供了新的方法和思路。
参考文献:
[1]闫冰,李玲,易杨华. 海参多糖的生物活性研究概况[J]. 药学实践杂志,2004,22(2):101-103.
[2]ESMAT A Y, SAID A A, SOLIMAN A A, et al. Bioactive compounds,antioxidant potential, and hepatoprotective activity of sea cucumber (Holothuriaatra) against thioacetamide intoxication in rats [J]. Nutrition, 2013, 29(1): 258-267.
[3] 黄日明,王宾,刘永宏. 海参的化学成分及其生物活性的研究概况[J]. 中成药,2009,31(8):1263-1269.
[4] XIA X K, QI J, WEI F, et al. Isolation and characterization of a new benzofuran from the fungusAlternariasp. (HS-3) associated with a sea Cucumber[J]. Nat Prod Commun, 2011, 6(12): 1913-1914.
[5] 夏雪奎,齐君,刘昌衡,等. 仿刺参共附生真菌Aspergillusterreus来源的聚酮类化合物的研究[J]. 现代食品科技,2014,30(4): 10-14.
[6] 刘昌衡,夏雪奎,齐君,等. 海参共生微生物 HS-3Alternariasp. 次级代谢产物的研究[J]. 中药材,2010,33(12): 1875 - 1877.
[7] AFIYATULLOV S S, KALINOVSKY A I, KUZNETSOVA T A, et al. New glycosides of the fungus acremonium striatisporum Isolated from a sea cucumber[J]. J Nat Prod, 2004, 67(6): 1047-1051.
[8] WANG F Z, FANG Y C, ZHU T J, et al. Seven new prenylated indole diketopiperazine alkaloids from holothurian-derived fungusAspergillusfumigatus[J]. Tetrahedron, 2008, 64(34) :7986-7991.
[9] XIA X K, ZHANG J Y, ZHANG Y G, et al. Pimarane diterpenes from the fungusEpicoccumsp. HS-1 associated withApostichopusjaponicus[J]. Bioorg Med Chem Lett, 2012, 22(8): 3017-3019.
[10] SUN P, XU D X, MANDI A, et al.Structure,absolute configuration, and conformational study of 12-membered macrolides from the fungusDendrodochiumsp. associated with the sea cucumberHolothurianobilisselenka[J]. J Org Chem, 2013, 78(14): 7030-7047.
[11]XU D X, SUN P, KURTN T, et al. Polyhydroxy cyclohexanols from aDendrodochiumsp. fungus associated with the sea cucumberHolothurianobilisselenka[J]. J Nat Prod, 2014, 77(5): 1179-1184.
[12] 阮冲,肖小华,李攻科. 天然产物有效成分提取分离制备方法研究进展[J]. 化学试剂,2014,36(3):193-200.
[13] 陈尚钘,刘诚,范国荣,等. 天然产物中活性成分提取分离及分析技术[J]. 江西林业科技,2005(3):32-36.
[14] DETTRAKUL S, KITTAKOOP P, ISAKA M, et al. Antimycobacterial pimarane diterpenes from the fungusDiaporthesp.[J]. Bioorg Med Chem Lett, 2003, 13(7): 1253-1255.
【中药与天然活性产物】
cucumber-derived fungusEpicoccumsp.by two-dimensional
high-throughput chromatography
QI Jun1,XIA Xue-kui1,JIA Ai-rong2,LIU Xin2,ZHANG Mian-song1,LIU Chang-heng2*
(1.Shandong Provincial Key Laboratory of Applied Microbiology, Biotechnology Center, Shandong Academy
of Sciences, Jinan 250014, China;2.Biology Institute, Shandong Academy of Sciences, Jinan 250014, China)
Abstract∶We established a new method for separation and preparation of pimarane diterpenes from sea cucumber-derived fungus Epicoccum sp.by two-dimensional high-throughput chromatography.It was performed with MeOH-H2O as solvent, flow rate of 40 mL/min, main separation detection wavelength of 254 nm and second separation detection wavelength of 220 nm.Pimarane diterpenes were isolated from 1.5 g ethyl acetate extract fromsea cucumber-derived fungus Epicoccum sp.Their structureswere identified by spectroscopic data (1H NMR and MS).The method is simple and rapid, reduces irreversible sample adsorption,and provides a new approach for separation and preparation of pimarane diterpenes.
Key words∶two-dimensional high-throughput chromatography; sea cucumber-derived fungus; pimarane diterpenes
中图分类号:R284.2
文献标识码:A
文章编号:1002-4026(2015)04-0014-05
作者简介:齐君(1985-),女,博士,助理研究员,研究方向为海洋天然产物。Email: qljbgreat@163.com
基金项目:山东省科学院科学技术发展计划 (2014QN018);国家自然科学基金 (81202452);中韩国际合作交流项目 (81411140251)
收稿日期:2015-03-25
DOI:10.3976/j.issn.1002-4026.2015.04.003 10.3976/j.issn.1002-4026.2015.04.005

