伽玛刀照射对青霉素致癫痫猫脑组织中MDA水平、SOD活力的影响
董长征,孔艳莉,靳洪波,张素芳,郑杰,梁传栋,武江,岳向勇,李文玲(河北省人民医院,石家庄05005;石家庄市第二医院)
伽玛刀照射对青霉素致癫痫猫脑组织中MDA水平、SOD活力的影响
董长征1,孔艳莉1,靳洪波2,张素芳1,郑杰1,梁传栋1,武江1,岳向勇1,李文玲1(1河北省人民医院,石家庄050051;2石家庄市第二医院)
摘要:目的探讨伽玛刀照射对青霉素致癫痫猫脑组织中丙二醛(MDA)水平和超氧化物歧化酶(SOD)活力的影响。方法选择雄性成年猫30只,随机分为正常对照组、癫痫模型组和伽玛刀治疗4、8、12周组各6只。除正常对照组外,其余组通过向猫右额叶皮质注射青霉素制作癫痫模型,伽玛刀治疗4、8、12周组在造模成功后给予低剂量伽玛刀照射。采用Racine分级标准进行行为学观察。4周后正常对照组、癫痫模型组和伽玛刀治疗4周组均将猫处死,伽玛刀治疗8、12周组于治疗8、12周后分别将猫处死,处死后均立即取出猫右额叶脑组织,采用硫代巴比妥酸比色法检测脑组织中MDA水平,WST-1法检测SOD活力。结果癫痫模型组猫发作级别多达到Ⅳ~Ⅵ级;伽玛刀治疗4、8周组猫癫痫发作级别和持续时间与癫痫模型组比较无统计学变化;伽玛刀治疗12周组癫痫发作级别降低,多为Ⅰ~Ⅱ级。与正常对照组比较,癫痫模型组脑组织中MDA水平升高,SOD活力降低(P均<0.05);与癫痫模型组比较,伽玛刀治疗4周和8周组MDA水平及SOD活力无统计学变化,而伽玛刀治疗12周组MDA水平减低(P<0.05),SOD活力升高(P<0.05)。结论伽玛刀照射治疗能降低青霉素致癫痫猫脑组织中MDA水平,提高SOD活力,减轻实验猫癫痫发作后的氧化应激损伤。
关键词:癫痫;伽玛刀;氧化应激;丙二醛;超氧化物歧化酶
自由基与癫痫的发生、发展关系密切[1]。研究[2]发现,脑内脂质过氧化物显著增加、氧自由基清除剂相对减少是癫痫发生、发展的重要原因。伽玛刀照射对部分难治性癫痫的治疗取得一定疗效,为进一步研究其抗癫痫的作用机制,我们选用青霉素致癫痫猫模型,观察伽玛刀照射对青霉素致癫痫猫脑组织丙二醛(MDA)水平、超氧化物歧化酶(SOD)活力的影响,探讨伽玛刀照射是否对癫痫发作后脑损伤具有神经保护作用。
1 材料与方法
1.1实验动物健康雄性成年猫30只,体质量2.5~3.5 kg,河北医科大学实验动物中心提供。
1.2试剂及仪器注射用青霉素(华北制药股份有限公司,批号13020655);异丙酚(200mg/支,北京费森尤斯公司);伽玛刀(LEKSELL C型,瑞典ELEKTA公司);磁共振仪(美国GE公司); SOD、MDA试剂盒购自南京市建成生物工程研究所。
1.3动物分组、造模及干预将30只猫按随机数字表法分为正常对照组、癫痫模型组和伽玛刀治疗4、8、12周组,每组各6只。正常对照组不做任何处理;癫痫模型组和伽玛刀治疗组在猫额叶皮质多次注射青霉素制作癫痫模型,异丙酚静脉麻醉,猫右额头皮做直切口,长约3 cm,暴露猫右额叶皮层组织,用MS4000U-1生物信号定量记录分析系统刺激器刺激脑皮质,引起对侧后肢收缩的区域定为运动皮质。用微量注射器抽取青霉素1万U,以60°角斜刺入动物右额皮质的无血管区,缝合头皮。青霉素每间隔3d注射1次,共注射7次。伽玛刀治疗组在造模成功后给予伽玛刀照射,3%戊巴比妥钠(40mg/kg)腹腔注射麻醉实验用猫,将其头部安装于Leksell立体定向头架,用磁共振仪进行无间隔定位扫描,层厚2mm。
扫描图像经计算机网络传至Gamma Plan系统制定治疗计划,确定照射靶区位于右侧额叶的X、Y、Z坐标。然后将固定猫脑的Leksell框架按所定坐标安放于伽玛刀定位架上,用4mm准直器,对靶区脑组织实施照射,边缘剂量15 Gy,等剂量曲线50%。
1.4行为学观察参照Racine分级标准观察各组猫的癫痫发作行为。0级:无反应或抽搐停止;Ⅰ
级:节律性口角或面部抽动;Ⅱ级:点头或甩尾;Ⅲ级:单肢抽动;Ⅳ级:多肢抽动或强直;Ⅴ级:全面性强直阵挛发作。视频监控下观察实验猫的发作级别和持续时间。
1.5脑组织中MDA水平、SOD活力测定4周后正常对照组、癫痫模型组和伽玛刀治疗4周组均将猫处死,伽玛刀治疗8、12组于治疗8、12周后分别将猫处死,立即取出右额叶脑组织称重,用生理盐水作匀浆介质,充分匀浆,离心,取上清液放入-70℃冰箱保存待用。严格按照试剂盒说明书进行分步操作,分别采用硫代巴比妥酸比色法检测脑组织中MDA水平,WST-1法检测SOD活力。
1.6统计学方法采用SAS8.0统计软件。计量资料以珋x±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1行为学变化正常对照组无癫痫发作。癫痫模型组均有痫性发作,为间断性,发作级别达Ⅳ~Ⅵ级,全身强直阵挛发作多见,每次发作持续3~5min。伽玛刀治疗4、8周组癫痫发作级别和持续时间与癫痫模型组比较差异无统计学意义;伽玛刀治疗12周组癫痫发作级别减低,多为Ⅰ~Ⅱ级,表现为猫的面部抽搐或点头动作,发作时间为1~3min。
2.2各组猫脑组织中MDA水平、SOD活力比较伽玛刀治疗后,随着时间延长,MDA水平有减低趋势,SOD活力有上升趋势,伽玛刀治疗12周组MDA水平明显降低,SOD活力明显升高,与癫痫模型组比较,P均<0.05,见表1。
表1 各组猫脑组织中MDA水平及SOD活力比较()
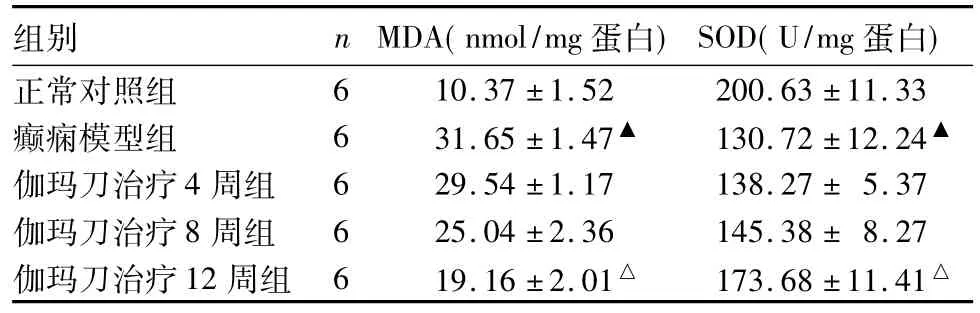
表1 各组猫脑组织中MDA水平及SOD活力比较()
注:与正常对照组比较,▲P<0.05;与癫痫模型组比较,△P<0.05。
组别 nmDA(nmol/mg蛋白)SOD(U/mg蛋白)正常对照组6 10.37±1.52 200.63±11.33癫痫模型组 6 31.65±1.47▲ 130.72±12.24▲伽玛刀治疗4周组 6 29.54±1.17 138.27±5.37伽玛刀治疗8周组 6 25.04±2.36 145.38±8.27伽玛刀治疗12周组 6 19.16±2.01△ 173.68±11.41△
3 讨论
自由基过量产生引起的氧化应激损伤参与了癫痫的发生和发展过程[3,4]。正常生理情况下,脑组织内氧化与抗氧化系统处于动态平衡状态。当机体发生癫痫时,脑组织氧代谢障碍产生大量氧自由基,氧自由基可使神经细胞膜中的多不饱和脂肪酸发生过氧化反应,且通过脂氢过氧化物的分解产物引起神经细胞损伤,导致神经细胞的内质网、线粒体、溶酶体等结构破坏,细胞膜对离子通透性的改变[5],与此同时,机体内抗氧化酶类活性减低,清除氧自由基的能力下降,脑内氧化与抗氧化系统平衡失调,活性氧增加,从而导致脑组织氧化应激反应,造成神经细胞过氧化损伤,神经细胞兴奋性增加,癫痫发作进一步加重,使氧自由基平衡系统进一步被破坏,氧自由基继续增多,神经细胞的损伤继续加重,形成恶性循环。
MDA是体内生物膜不饱和脂肪酸发生脂质过氧化反应的中间产物,其对机体的损害作用主要使不饱和脂肪酸过氧化,进而造成细胞膜的持续损害,因此其含量反映了脑内脂质过氧化程度,间接反映了氧自由基对神经细胞损伤的程度[6]。
SOD是机体内防御生命活动中氧自由基破坏损伤的抗氧化酶,为机体直接清除自由基的重要酶类,其主要功能是将氧的单价还原物超氧阴离子自由基歧化成H2O2和O2,能减轻缺血缺氧导致的神经元损伤,阻断氧自由基对机体的进一步损伤。其活力高低间接反映了机体清除氧自由基的能力[7]。
青霉素是脑内抑制性神经递质GABA的A受体拮抗剂,常被用来建立实验动物的癫痫模型。前期研究中,我们应用青霉素反复多次脑额叶皮质注射成功建立了猫的慢性癫痫模型,适于伽玛刀治疗癫痫的模型研究[8]。本研究结果显示,低剂量伽玛刀照射12周后抑制了青霉素诱导猫的癫痫发作,对控制和预防癫痫的发作有一定作用,与我们既往结果大致相同。本研究结果还显示,与正常对照组比较,癫痫模型组MDA水平升高,而SOD活力较正常对照组明显降低,说明癫痫反复发作后脑组织内氧化和抗氧化系统平衡被打乱,产生过量的氧自由基,SOD过量耗损而明显减少,导致神经细胞氧化损伤,兴奋性增高,异常放电增加,癫痫发作进一步发展。蔡红卫等[9]研究认为大鼠腹腔注射戊四氮诱发抽搐发作后大鼠海马组织中MDA水平明显升高,SOD含量明显减少。刘凤英等[10]研究表明,成人癫痫存在SOD的代谢紊乱,下降的SOD可能通过损伤线粒体,增加脑内兴奋性神经递质的合成,促进神经元凋亡,进而参与成人癫痫的病理生理过程。以上研究与本研究结果相一致。与癫痫模型组比较,伽玛刀照射12周组中MDA水平明显降低,SOD活力明显升高,猫的癫痫发作级别减低;伽玛刀照射4、8周组MDA水平和SOD活力虽有变化,但变化不明显,无统计学意义,说明伽玛刀照射治疗癫痫需一定时间后才能显现效果;伽玛刀照射可降低癫痫脑组织中MDA水平,提高SOD活力,从而降低脑内氧自由基含量,重建氧化和抗氧化系统的平衡,进而
实现神经保护作用,抑制猫的癫痫发作。
总之,伽玛刀治疗癫痫的机制尚不十分清楚,可能与伽玛刀照射降低致痫灶内谷氨酸的水平[11]、抑制神经元的凋亡及相关凋亡基因的表达[12]等有关。本研究提示,抑制氧自由基引起的脂质过氧化反应,增加自由基的清除可能参与了伽玛刀治疗癫痫的生理机制,为进一步伽玛刀治疗癫痫提供了充分的实验依据。
参考文献:
[1]王飞凤,温玉梅,孙俊岩,等.尼莫地平辅助治疗难治性癫痫对血自由基水平的影响[J].贵阳医学院学报,2013,38(2): 171-172.
[2]Rowley S,Patelm.Mitochondrial involvement and oxidative stress in temporal lobe epilepsy[J].Free Radic Biolmed,2013,62(9): 121-131.
[3]孙锡波,韩玉香,韩涛,等.二氮嗪对氯化锂-匹鲁卡品致痫大鼠海马神经元超微结构及自由基的影响[J].山东大学学报(医学版),2011,49(2): 19-23.
[4]段晓秋,王浩.癫痫过程中脑组织自由基的变化与细胞损伤关系的研究[J].现代中西医结合杂志,2012,21(18): 1961-1962.
[5]Shin EJ,Jeong JH,Chung YH,et al.Role of oxidative stress in epileptic seizures[J].Neurochem Int,2011,59(2): 122-137.
[6]Bajpai A,Verma AK,Srivastavam,et al.Oxidative stress andmajordepression[J].J Clindiagn Res,2014,8(12): 4-7.
[7]张笑天,郑晓瑛.氧化自由基清除剂超氧化物歧化酶与疾病[J].中国公共卫生,2014,30(10): 1349-1352.
[8]董长征,李文玲,董秀芳,等.适合伽玛刀照射的猫功能区慢性点燃癫痫模型制作及其致痫机制[J].中国老年学杂志,2013,33(20): 5063-5065.
[9]蔡红卫,冯娟娟.三氟拉嗪对癫痫大鼠NO、NOS、SOD、MDA的影响[J].世界中西医结合杂志,2010,5(7): 585-587.
[10]刘凤英,蔡学坤,张琪,等.成人癫痫患者血清超氧化物歧化酶的水平变化及意义[J].山东医药,2013,53(12): 12-14.
[11]董长征,岳向勇,赵文清,等.低剂量伽玛刀照射对功能区癫痫猫模型的治疗作用及机制研究[J].中国全科医学,2011,14(4B): 1219-1221.
[12]董长征,李文玲,赵文清,等.低剂量伽玛刀照射治疗对功能区癫痫动物行为及其皮层神经元显微结构的影响[J].山东医药,2011,51(2): 24-25.
收稿日期:( 2015-04-08)
基金项目:河北省卫生厅指令性计划项目(20120009)。
文章编号:1002-266X(2015)33-0025-03
文献标志码:A
中图分类号:R742.1
doi:10.3969/j.issn.1002-266X.2015.33.008

