黑液焦CO2气化及动力学研究
李许生,卫 威,农光再,覃程荣,王双飞
(1.广西大学化学化工学院, 广西南宁530004; 2.广西大学轻工与食品工程学院, 广西南宁530004)
黑液焦CO2气化及动力学研究
李许生1,卫威2,农光再2,覃程荣2,王双飞2
(1.广西大学化学化工学院, 广西南宁530004; 2.广西大学轻工与食品工程学院, 广西南宁530004)
摘要:为了掌握甘蔗渣黑液焦CO2气化特性和动力学数据,开展甘蔗渣黑液焦CO2气化研究。通过改变温度、[CO]和[CO2]研究其对黑液焦转化的影响。采用试验数据与兰格缪尔-修斯伍德吸附动力学方程拟合的方法求解动力学方程参数。研究表明,在升高气化温度和增加[CO2]时可以加速气化反应,而在增加[CO]时则会抑制气化反应的发生;表观气化速率的倒数分别与[CO]和[CO2]-1成线性关系,但与[CO]/[CO2]的比值不成线性关系;在研究的操作条件范围内甘蔗渣黑液焦CO2气化过程可以采用兰格缪尔-修斯伍德吸附非催化动力学方程描述,平均活化能为153.5 kJ/mol。研究数据表明活性点位数可作为M/C摩尔比值的函数而不是常数。引入M/C摩尔比值对动力学模型修正后,获得的气化反应常数、CO吸附常数和CO2吸附常数均可视为恒定值,其值分别为0.158 9 m3/(mol·min)、-1.048 7 m3/mol和-0.323 8 m3/mol。
关键词:黑液焦;CO2;气化;动力学
0引言
黑液是化学纸浆生产中主要含生物质的废液,一直以来是制浆厂的重要燃料来源(约占制浆厂35%的能源)[1]。由于林木资源的匮乏,非木材制浆一直是我国制浆造纸工业重要的组成部分。然而非木材制浆黑液含硅量高,使得从黑液中回收化学品和能量变得困难,不得不承受更高的成本付出和更低的热回收效率。因此,为解决非木材纤维的制浆黑液回收特定问题在不断开发新的技术,包括汤姆林森锅炉的优化改进,但无法改变热效率低和成本高的问题。为此,制浆工业正在投入大量资金努力发展新的回收系统。黑液气化有望成为未来替代或补充传统汤姆林森回收锅炉的系统,重要的是黑液气化联合循环发电厂可以在传统的蒸汽循环电厂发电量的基础上增加一倍的电力输出,有助于改善纸浆厂热电平衡[2-3]。
CO2持续大量的排放带来的温室效应引起了各国的普遍关注,CO2的转化利用成为当前的研究热点之一。关于CO2在煤炭、生物质和有机固废物气化的成果的报道文献越来越多[4]。尽管已经有文献报道硫酸盐法木材制浆黑液的CO2气化,但是一些涉及黑液热解特性和溶胀性能的基础研究发现非木材制浆黑液和木材制浆黑液存在差异。兰格缪尔-修斯伍德(Langmuir-Hinshelwood)吸附动力学模型能很好的描述煤焦和硫酸盐法木浆黑液焦的CO2和水蒸气气化动力学过程,其中包括催化和非催化气化模型。有趣的是对于这两种模型仍然存在争议,例如,文献[5-6]认为可以采用催化动力学模型来描述黑液焦CO2气化动力学过程,文献[7-8]则认为采用非催化动力学模型更合理。涉及甘蔗渣制浆黑液焦CO2气化特性及动力学数据仍然缺乏,为支撑开发适用于甘蔗渣制浆黑液焦CO2气化新的燃烧器和气化炉,开展相关的气化及动力学研究具有现实意义。
1实验与方法
1.1 原料
①黑液焦制备:取自于南宁糖业蒲庙制浆厂的烧碱法甘蔗渣黑液,固含量约为45%。将半浓黑液浓缩至约60%,以3~5 mm厚度分布在平板上,在105 ℃干燥48 h制成粉末。将黑液粉末置入反应器中,在N2(100 cm3/min)的保护下,90 min从25 ℃升至500 ℃;然后改用CO(100 cm3/min)保护,温度升至850 ℃,并保持60 min。冷却后,碾磨成细粉,过200目筛,封存备用。
②所用气体均为市场采购。瓶装N2等级为化学纯,含量99.99%;瓶装CO2等级为食品级,含量99.9%;瓶装CO等级为化学纯,含量99.9%。
1.2 试验装置
实验装置主要由加热单元、耐高温耐腐蚀反应管和温度控制装置等组成,如图1。反应管选用耐高温、耐腐蚀的钛合金材料,加热单元的电热套最高能提供1 200 ℃的温度,金属格栅选用60目钛合金网。
1.3 气化实验
精确称取1 g黑液焦,高纯氧化铝槽中。将装有试样的氧化铝槽置入反应器,在CO气体保护下,升温到反应温度,然后通过调节气瓶开关控制其流量达到某一比例混合的气化剂(N2、CO和CO2)进行气化,气化达到预定时间,改通CO气体终止气化并保护冷却。通入气体总流量为100 cm3/min。精确称取剩余黑液焦炭的质量。尾气做燃烧处理以避免CO中毒。
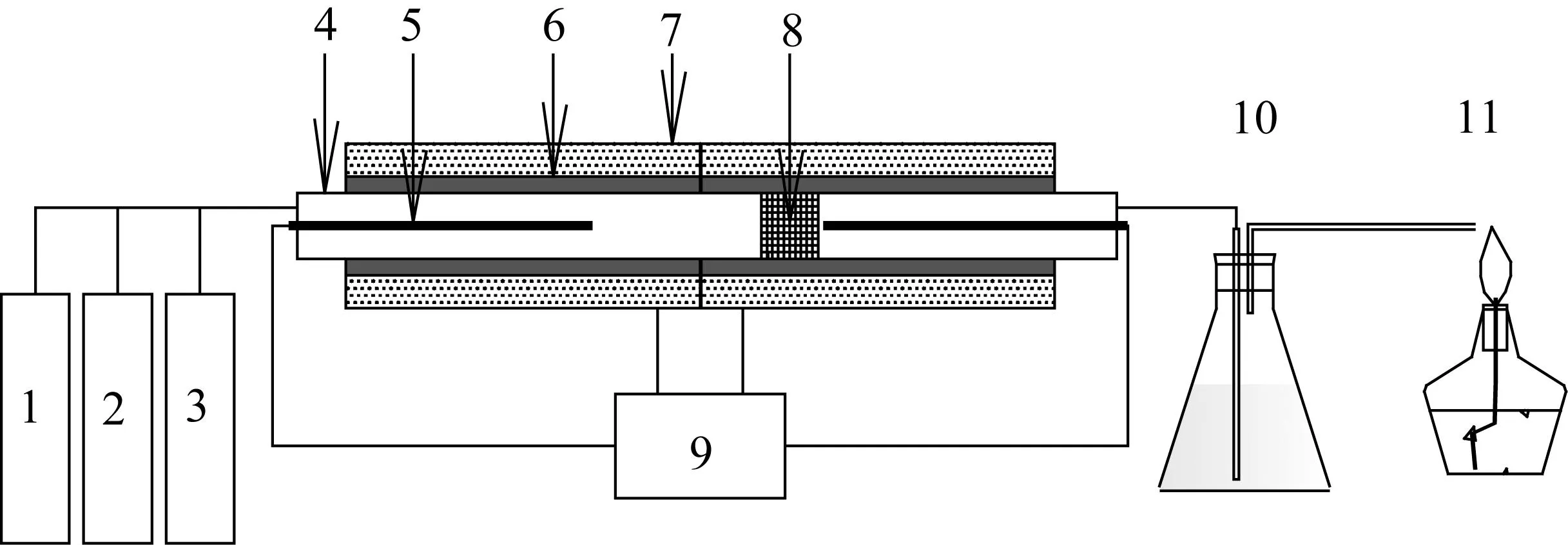
1.N2气瓶;2.CO2气瓶;3.CO气瓶;4.反应管;5.温度计;6.外部加热单元;
1.4 分析方法
①CO和CO2浓度分析:采用GASBOARD-3100型红外煤气分析仪的NDIR 双光红外法。
②黑液焦采用PE 2400II型元素分析仪测量结果为:Na为33.05 %,C为27.39 %,H为0.07 %,O和其他为36.42 %,K为3.07 %。
1.5 计算方法
①转化率的计算:为了消除黑液中碱性物质质量差异给分析带来的不便,特定义:

(1)
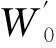
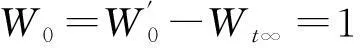
r=100(1-Wt),
(2)
式中,r为气化转化率,单位为%。
②气化速率:为了进一步规避各实验研究采用不同质量带来参考的不便,定义:

(3)
式中,β为气化速率,单位为%/min;rt为气化至t时黑液焦的转化率,单位为%;t为气化时间,单位为min。将式(1)代入式(2)可得:
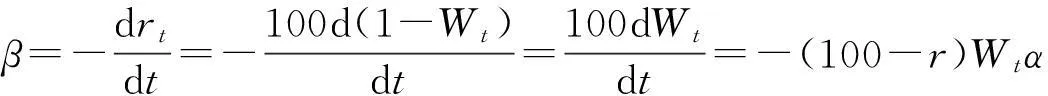
(4)
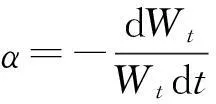
③表观气化速率:
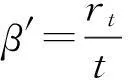
(5)
式中,β′为表观气化速率,单位为%/min;rt为气化至t时黑液焦的转化率,单位为%;t为气化时间,单位为min。
2黑液焦CO2气化及兰格缪尔-修斯伍德吸附动力学模型
2.1 黑液焦CO2气化
甘蔗渣黑液在高温下热解形成黑液焦,其主要由碳酸盐与固定碳组成。碳酸盐与固定碳在高温下发生物理化学反应形成碳基碱性化合物见式(6)[6]。
M2CO3(s)+C(s)⟺—COM(s)+ —CO2M(s),
(6)
式中,M为碱金属,主要是Na和K。
碳基碱性化合物也形成在减法制浆过程中,氢氧化钠作为蒸煮剂溶解木素,由于化学作用Na+与木素中的酚羟基(—OH)和羧酸基 (—COOH)通过化学键结合,形成酚钠(—CONa)和羧酸钠(—COONa)[9-11]。碳基碱性化合物进一步反应释放CO和金属气体,可能的方式见式(7)、式(8)和式(9)[12-13]。
—CO2M(s)+C(s)⟺-COM(s)+CO(g),
(7)
—COM(s)+C(s)⟺-CM(s)+CO(g),
(8)
—CM(s)⟺-C(s)+M(g)。
(9)
根据兰格缪尔-修斯伍德动力学提出机制,基于吸附和脱附原理黑液焦CO2气化动力学过程描述为:碳基碱性化合物表面吸附CO2形成吸附态碳基碱性化合物,发生表面反应形成CO吸附态碳基碱性化合物,CO从催化剂表面脱附扩散到气流;并形成新的碳基碱性化合物,见式(10)。
—COM(s)+CO2(g)⟺—COM·CO2(s)⟺—CO2M·CO(s)⟺—CO2M(s)+CO(g)。
(10)
很显然,这一过程并不能实现气化转化,因为这一过程的转化并没有使质量减少。新的碳基碱性化合物被固定碳还原形成CO吸附态碳基碱性化合物,CO从碳基碱性化合物表面脱附扩散到气流中,碳基碱性化合物恢复到原来的状态,继续着下一个过程,见式(11)。
—CO2M(s)+C(s)→—COM·CO(s)⟺—COM(s)+CO(g)。
(11)
由于式(6)反应产生两种活性碳基碱性化合物,反应(10)和反应(11)可以同时进行,并不存在前后依存关系。气—固反应要比固—固反应快得多,因此化学反应(11)是气化过程的限速步骤。活性点位是指黑液焦中具有吸附气体并发生表面化学反应功能的部位,其中可能包括木素结构上存在的羧酸盐和酚盐等表面功能基团[7]。吸附反应发生依赖活性点位的存在,因此活性点位的数量直接影响到气化反应速率。活性点位数等于黑液焦表面[—CO2M]、[—COM]和[—CM]的总和[6]。
黑液焦CO2气化质量损失总反应如下:
C+CO2→2CO。
(12)
2.2 兰格缪尔-修斯伍德吸附动力学模型
首先假设碳基碱性化合物表面[C]和活性点位数在反应过程中保持恒定,并且过程产生CO和消耗CO2对反应气氛的浓度影响不大,甚至可以忽略。黑液焦CO2气化动力学方程根据催化和非催化机制提出了两种不同的表达式:催化动力学方程(13)和非催化动力学方程(14)[5-6,8]。
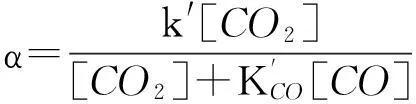
(13)
式中,k′是气化反应常数,min-1;K′CO是CO的平衡吸附常数,无量纲。
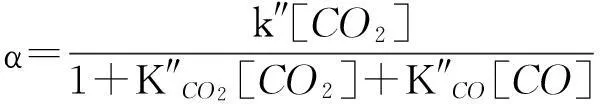
(14)
式中,k″是气化反应常数, m3/(mol·min);K″CO2是CO2的平衡吸附常数, m3/mol;K″CO是CO的平衡吸附常数, m3/mol。
将式(13)和式(14)分别代入式(5),并取倒数简化分别得式(15)和式(16)。
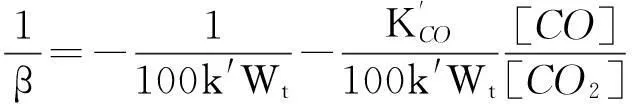
(15)
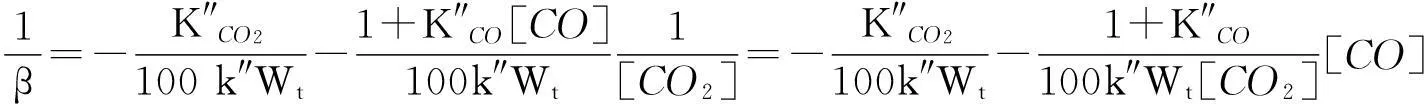
(16)
当转化率相同的情况下,可用表观气化速率β′代替气化速率β进行直线拟合[14-15]。那么:式(15)显示,表观气化速率的倒数与[CO]/[CO2]成线性关系;式(16)显示,在[CO]不变时转化率相同的情况下,表观气化速率的倒数与[CO2]-1成线性关系;或在[CO2]不变时转化率相同的情况下,表观气化速率的倒数与[CO]成线性关系。
3结果与讨论
3.1 黑液焦CO2气化影响因素分析
3.1.1温度
式(11)显示,黑液焦CO2气化是吸热反应,因此温度是影响气化反应的重要因素之一。甘蔗渣制浆黑液焦在不同气化温度(750 ℃~850 ℃)下CO2气化表观气化速率随转化率分布如图2。
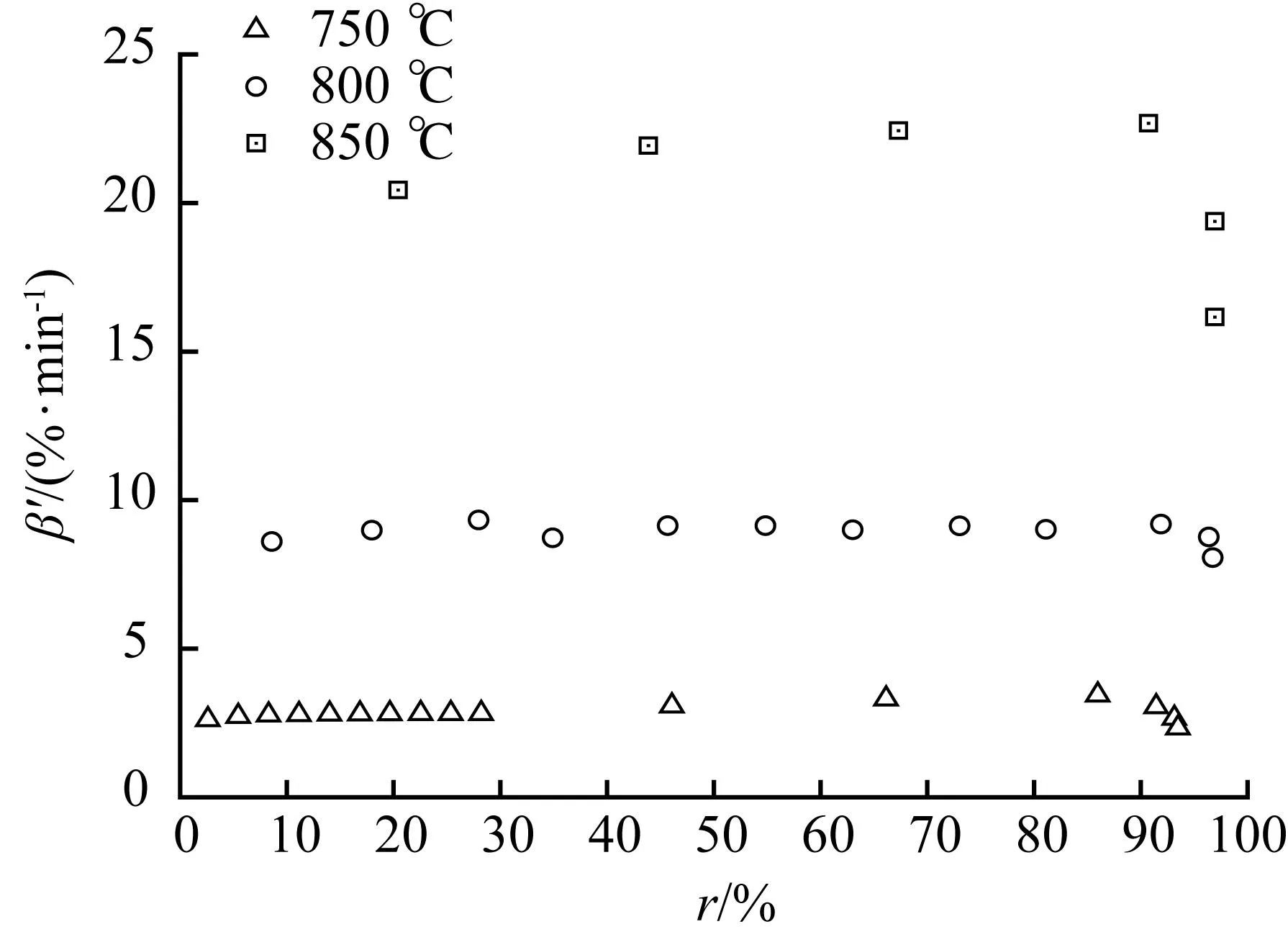
图2 表观气化速率β′对转化率r的分布Fig.2 The distribution of apparent gasification rate β′ vs conversion rate r
图2显示,温度对黑液焦气化速率和程度都有影响。气化温度越高,表观气化速率越大,且最大转化率越大。如图2所示,750 ℃、800 ℃和850 ℃的最大转化率分别为93.5%、96.74%和96.93%,最大转化率从750 ℃到800 ℃最大转化率增加超过3%,而800 ℃到850 ℃的最大转化率非常接近。碳基碱性化合物释放金属蒸气和CO主要发生在温度超过750 ℃时[6,12]。温度从750 ℃升高到850 ℃,平均表观气化速率从2.85%/min上升到20.51%/min,增加了约7.2倍。
3.1.2气氛
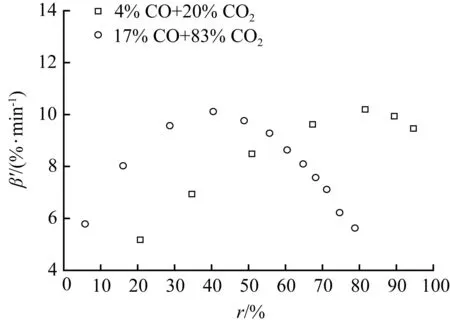
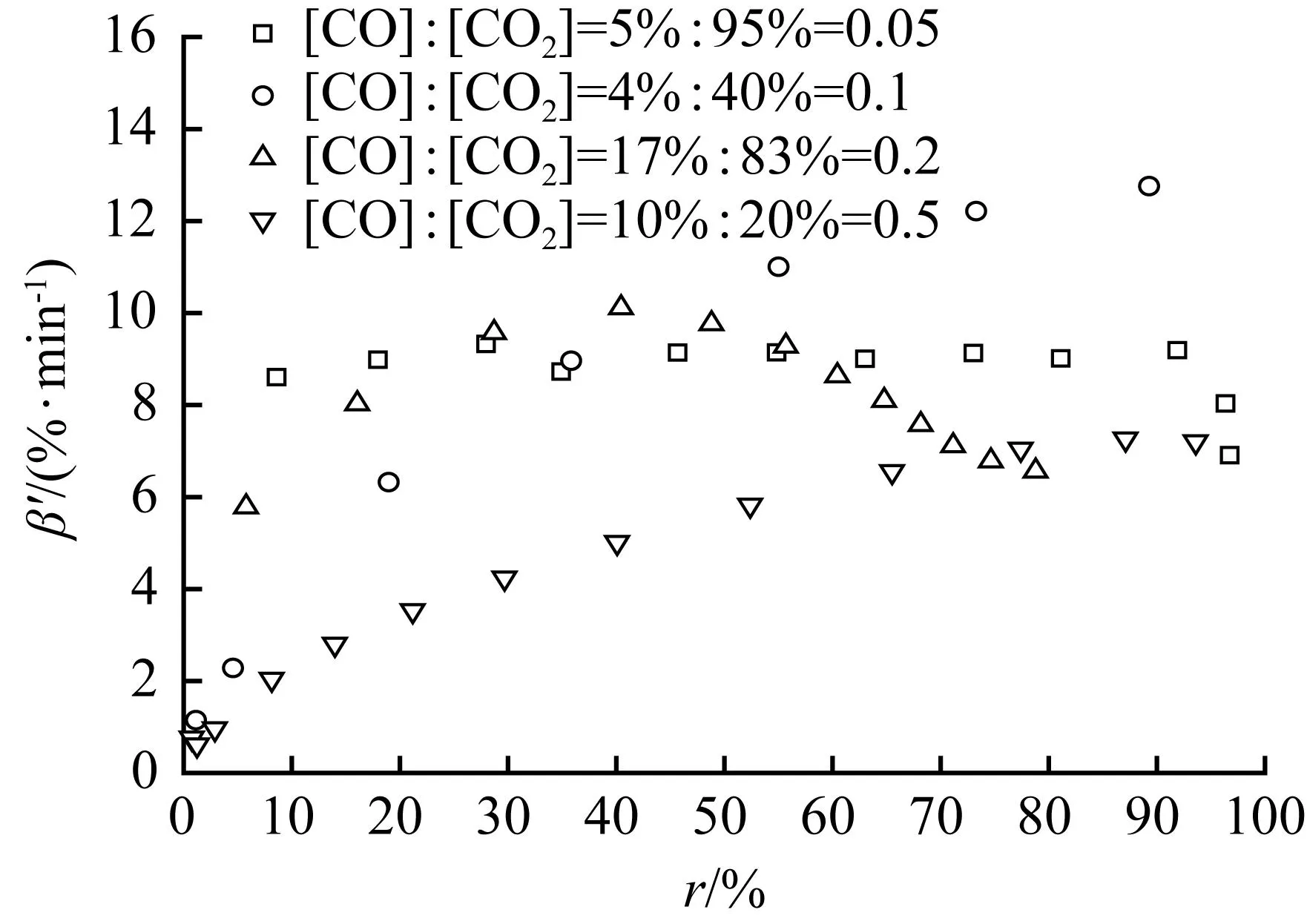
在气化温度为800 ℃下:固定[CO2]为20%不变,改变[CO](4%~20%)的表观气化速率随转化率的分布见图3(a);固定[CO]为4%不变,改变[CO2](10%~50%)的表观气化速率随转化率的分布见图3(b);[CO]/[CO2]比值为0.2的两组气氛下的表观气化速率随转化率的分布见图3(c);不同[CO]/[CO2]比值气氛下的表观气化速率随转化率的分布见图3(d)。
图3(a)显示,黑液焦气化速率随着[CO]的增加而下降明显,说明CO对黑液焦气化有明显的抑制作用。[CO]从4%提高到20%,平均表观气化速率从6.63%/min下降到2.49%/min。CO的浓度增加会阻碍式(10)和式(11)的CO脱附过程的发生,从而减少了活性点位数复原;另一方面会与CO2竞争活性点位,阻碍CO2的吸附过程的发生[16]。意味着在高[CO]产品中需要更长停留时间才能保障气化的完成,这对气化工艺的选择和气化器内部构造提出了更高的要求。图3(a)显示,达到最大表观气化速率之前不同[CO]气氛下的表观气化速率之间的差距随着转化率的增加而拉大,在达到最大的表观气化速率时气化转化率相近,这与兰格缪尔-修斯伍德吸附动力学方程是吻合。图3(b)显示的不同[CO2]气氛下存在类似情况,黑液焦气化速率随[CO2]的增加而加快,说明提高[CO2]可以加速气化反应。
图3(c)显示两组实验的[CO]/[CO2]比值均为0.2,表观气化速率随转化率的分布曲线差异明显。图3(d)显示,表观气化速率和转化率与[CO]/[CO2]比值之间,无明显规律性变化关系。达到最大表观气化速率时的转化率也各不相同。
综上所述,当提高气化温度和增加[CO2]时可以加速黑液焦气化反应,而[CO]升高则抑制气化反应的发生。

(a) [CO]
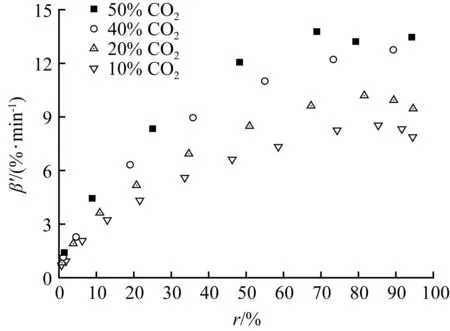
(b) [CO2]
(c) [CO]∶[CO2]=0.2
(d) [CO]∶[CO2]
图3表观气化速率β′随转化率r的分布
Fig.3The distribution of apparent gasification rateβ′ vs conversion rater
3.2 模型验证
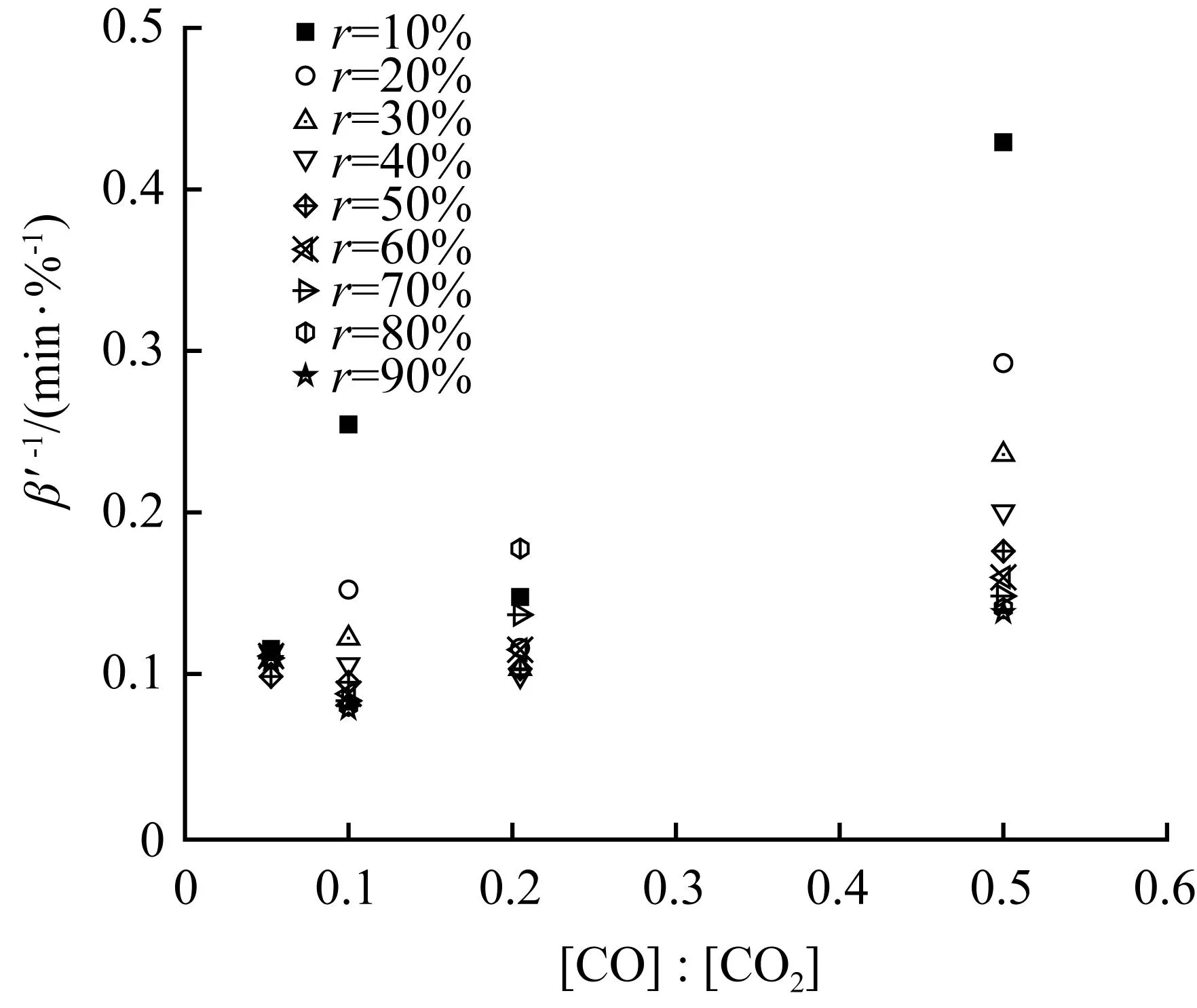
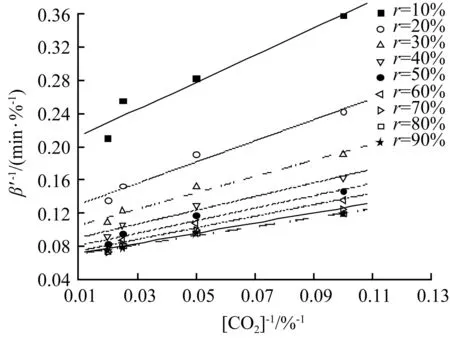
为了验证动力学模型方程,进行多套试验数据在转化率相同的情况下不同[CO]/[CO2]、[CO]和[CO2]-1的值的表观气化速率倒数值的分布见图4。
从图4(a)可以看出,显而易见表观气化速率的倒数值和[CO]/[CO2]比值之间不存在线性关系,说明[CO]和[CO2]对表观气化速率方程的反应级数是不同的。因此,认为所谓的催化动力学方程并不适用于黑液焦CO2气化过程的描述。
图4(b)和(c)显示,在转化率相同的情况下,表观气化速率的倒数值与[CO]和[CO2]-1之间存在良好的线性关系,与式(16)吻合,其直线拟合参数见表1。
(a) [CO]∶[CO2]

(c) [CO2]-1
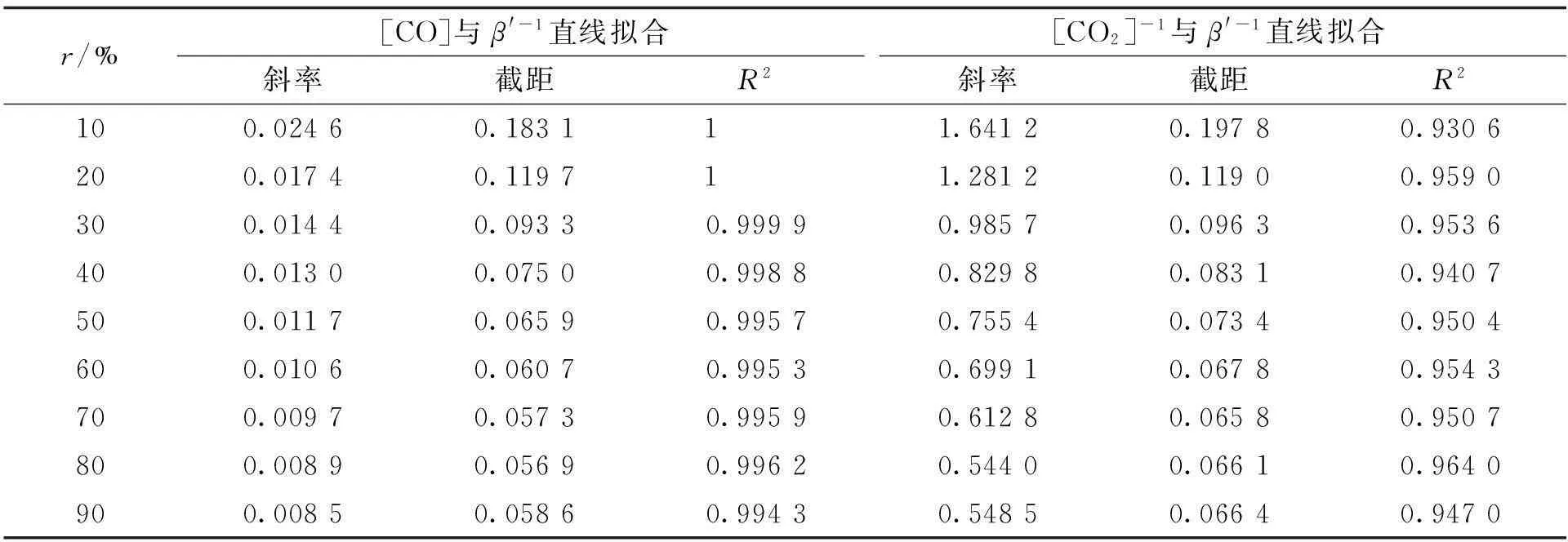
r/%[CO]与β'-1直线拟合[CO2]-1与β'-1直线拟合斜率截距R2斜率截距R2100.02460.18311 1.64120.19780.9306200.01740.11971 1.28120.11900.9590300.01440.09330.99990.98570.09630.9536400.01300.07500.99880.82980.08310.9407500.01170.06590.99570.75540.07340.9504600.01060.06070.99530.69910.06780.9543700.00970.05730.99590.61280.06580.9507800.00890.05690.99620.54400.06610.9640900.00850.05860.99430.54850.06640.9470
在生物质和煤炭气化过程中添加碱金属化合物,以及添加黑液都起到很好的催化效果[17-18]。因此,往往把黑液焦中固定碳作为气化对象,而碱金属作为催化剂,更容易接受催化动力学方程。而实验结果却并不是如此,黑液焦固定碳和碱金属化合物的关系不同于煤炭与碱金属化合物的关系。黑液在焦化过程中被催化剂活化可能已经完成[12],黑液焦成为一个被活化了的整体——碳基碱金属化合物,不再被区分开是固定碳还是碱金属化合物。虽然从整个气化历程来看,碱金属仍然是催化剂。
综上所述,黑液焦CO2气化表观气化速率的倒数与[CO]和[CO2]-1存在线性关系,而与[CO]/[CO2]的比值不存线性关系。因此,认为黑液焦CO2气化过程描述采用非催化动力学方程而不是催化动力学方程。
3.3 模型参数分析
根据反应式(16)结合表1中直线拟合参数值,经过计算获得不同转化率时的模型的常数值。令[CO]与β′-1直线拟合的斜率为X1和截距为J1,[CO2]-1与β′-1直线拟合的斜率为X2和截距为J2。根据反应式(16),则有:
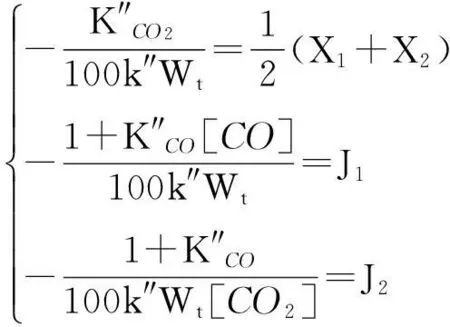
(17)
将相关数据代入式(17),获得不同转化率下的模型参数值见表2。
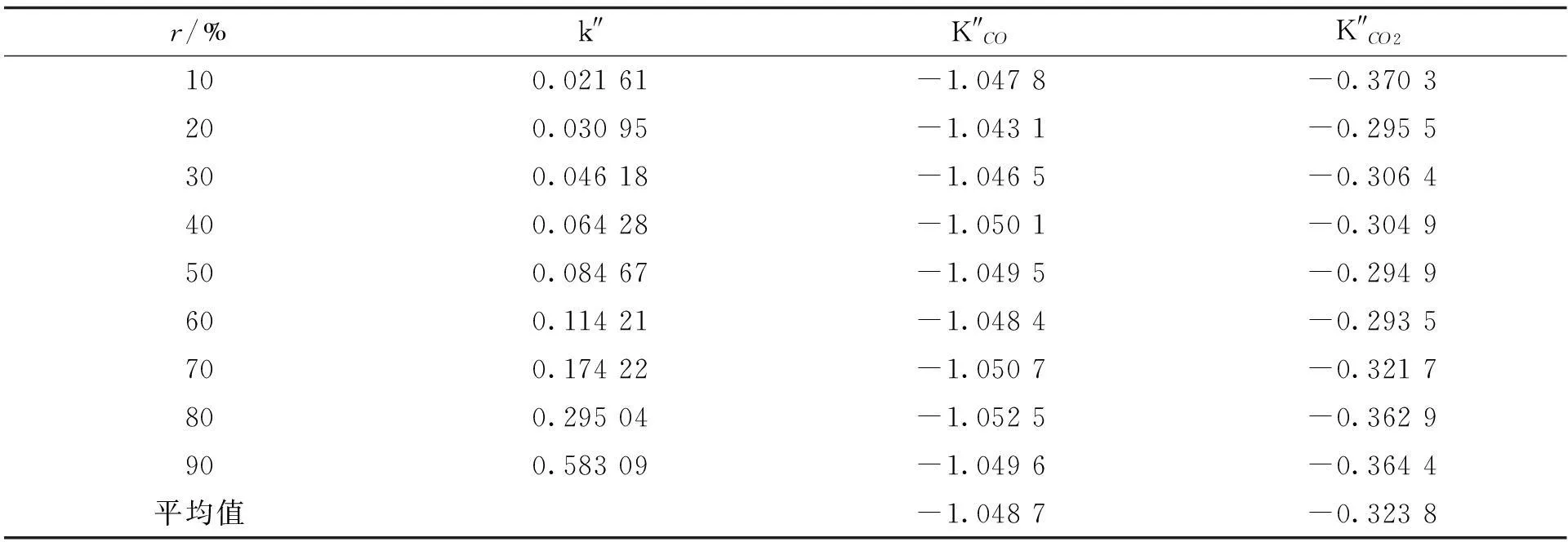
表2 模型参数值
表2数据显示, K″CO为-1.048 7 m3/mol, K″CO2为-0.323 8 m3/mol,均可视为恒定的,这与兰格缪尔-修斯伍德吸附动力学方程的假设是一致的。但k″的值并不是恒定的常数,而是随着转化率的增加而越来越大,说明气化反应速率随着气化进程越来越快。加快反应速率的因素主要有温度、[CO2]、活性点位数、比表面积以及[C]等。气化反应常数是温度的函数,由于反应温度是恒定的,因此,温度的因素可以排除。CO2作为反应物,已经被考虑在模型当中,可以认为与反应常数的变化无关。
由于动力学方程的假设碳基碱性化合表面的活性点位数、表面积和[C]保持恒定,因此,作为常数处理的项目一并包含在反应常数中。目前从数据看来这种假设并不成立,但这并不妨碍结果的可靠性及其过程分析。我们在样品布置时尽可能的保持同样的形状和厚度,以保障表面积的恒定,当样品质量大量丢失的情况下,特别是在气化反应快要结束时,表面积的减少将是必然的,这一现象可以解释图2和图3显示接近最大转化率表观气化速率下降的结果。活性点位的数量取决于黑液焦表面的碱金属含量或者M/C摩尔比值。
黑液焦气化过程中M/C摩尔比值与反应常数具有同样的变化趋势,M/C摩尔比值的变化现象是最适合解释这一结果的。并且模型所描述的过程认为黑液焦表面积及其碱金属含量在气化过程中都保持恒定。实验原料处理过程中,做了有针对性的处理,包括同组实验原料来自同一批样品,干燥、碾磨和筛选过程中进行了充分的混合,保障碱金属在黑液焦中均匀分布,表面的碳的数量也可以认为是恒定的。已经有报道显示,[CO]和气化温度对黑液焦活性点位数有影响[5-6]。因此,活性点位数在试验过程中是变化的,而不是常数。研究表明,黑液焦CO2气化体系中CO的存在能抑制碱性化合物被还原,从而减少碱金属因气化而损失。CO对气化率具有双重效应:一方面,作为产物可以抑制气化反应的进行;另一方面,CO抑制碱性化合物的还原反应,避免了碱金属的丢失。因此,CO提高了用于气化步骤的活性点位数,反过来起到了增加反应物浓度,从而使气化反应加速。随着碳基表面碱性化合物气化进行,反应(6)在高温下不断的发生,导致碱性化合物的数量越来越多,当新碳基碱性化合物暴露在表面时其活性点位数比原来的多。黑液焦化时从温度上升至500 ℃时就通入了CO,且在850 ℃下保留60 min,使活性点位数增加到最大值,降低CO和温度对气化速率的影响。
因此,最有可能导致k″越来越大的因素是黑液焦表面的M/C摩尔比值。起初碱金属在黑液焦中均匀分布,由于固定碳被气化速率比碱金属大的原因,碱金属从混合物中裸露出来。其中部分裸露的碱金属通过式(9)被气化逃逸黑液焦表面,剩余裸露的碱金属均匀分布在黑液焦的表面。这时黑液焦炭表面的M/C摩尔比值发生了变化。假设每气化1%的黑液焦表面的M损失率为ψ,那么跟气化进程有关的黑液焦表面的M/C摩尔比值可通过下式计算:
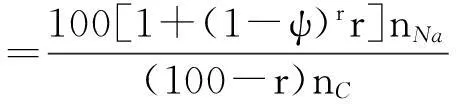
(18)
其中,nNa和nC分布是初始时黑液焦中Na和C的摩尔比值,只与黑液焦的初始组成有关,为常数值。那么:
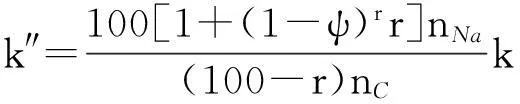
(19)

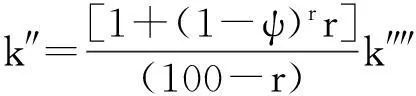
(20)
令:
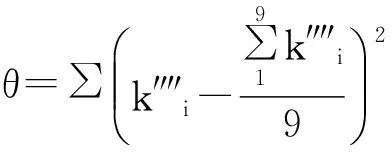
(21)
式中,k″″为常数值,θ值应为0或近似于0。
采用EXCEL中规划求解功能可得:ψ=0.010 44时,θ有最小值为2.744×10-7,可以认为近似于0。令:
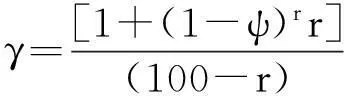
(22)
将ψ=0.010 44代入式(22),可计算出不同转化率下的γ值。根据式(20)可知,k″″为常数的情况下,k″和γ成线性关系。k″和γ值直线拟合图见图5。
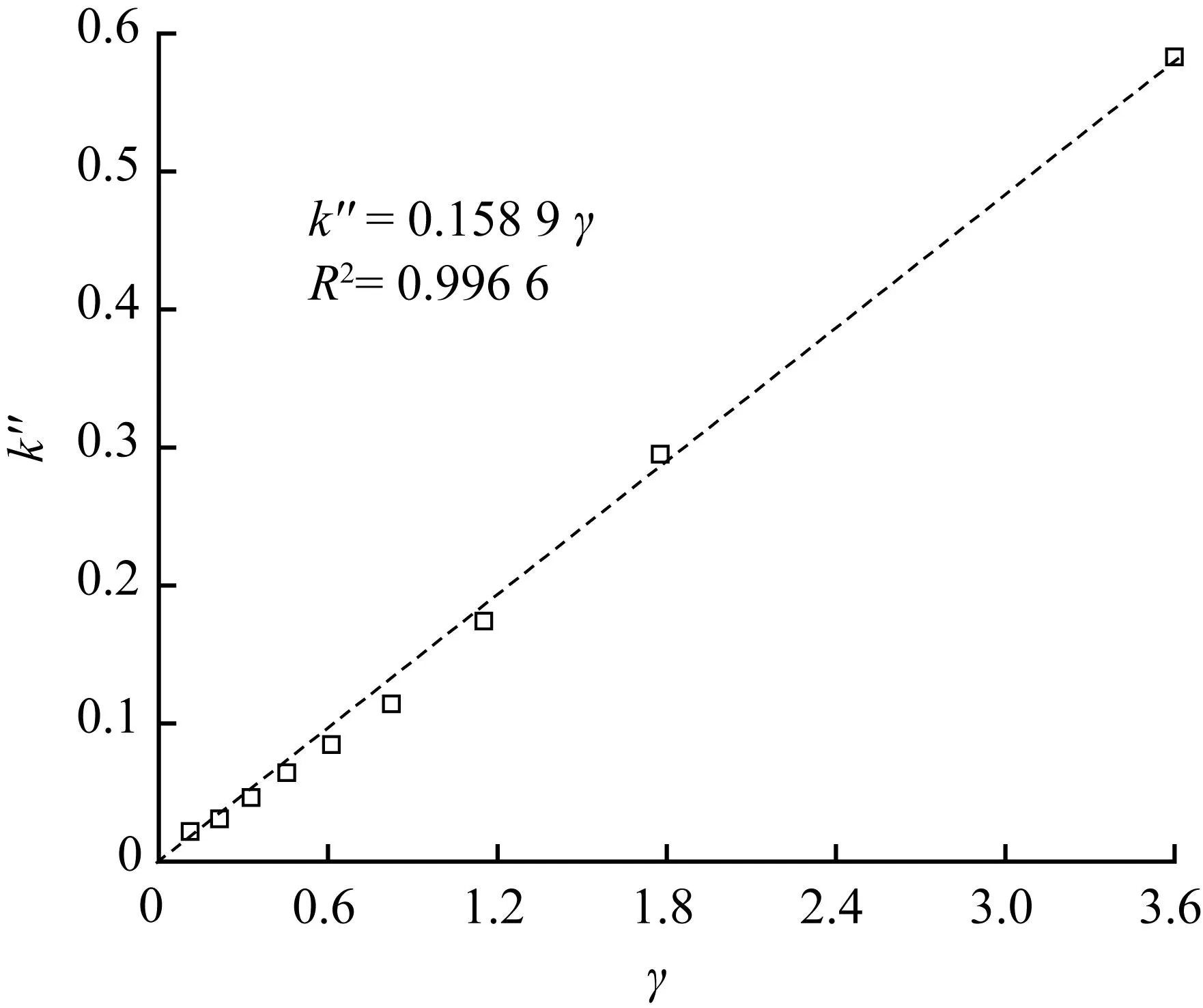
图5 γ与反应常数Fig.5 γ vs reaction constant
图5显示,在截距为零的情况下,γ值与反应速率常数存在良好的线性关系,那么斜率为0.158 9,即为新的气化反应速率常数k″″的数值,可视为恒定值,与动力学方程恒定值的假设完全符合。反应速率常数为温度的函数,根据阿伦尼乌斯经验方程有:
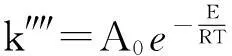
(23)
式中:A0为指前因子;E为反应活化能,J/mol;R为气体常数,8.314 J/(mol·K),T为气化温度,K。
3.4 活化能
根据式(14),在相同气氛条件下,当转化率相同时,表观气化速率与反应常数成线性关系。根据阿伦尼乌斯方程则有:
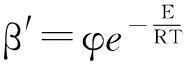
(24)

表3 黑液焦在750~850 ℃下CO2气化的活化能
甘蔗渣黑液焦平均活化能为153.50 kJ/mol,比较接近麦草黑液焦平均活化能169.5 kJ/mol[18],比报道的木浆黑液焦约200 kJ/mol要低[19]。
由于平衡速率常数仅是温度的函数,将气化温度为1 073 K时速率常数值和平均活化能代入方程式(23),可求得A0=4.7197×106,那么黑液焦CO2气化兰格缪尔-修斯伍德吸附动力学方程为:
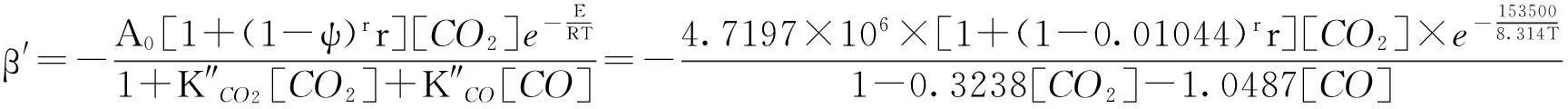
(25)
为了进一步求证黑液焦CO2气化兰格缪尔-修斯伍德吸附动力学方程的可靠性,特将该动力学方程预测值与实验值做对比,见图6。
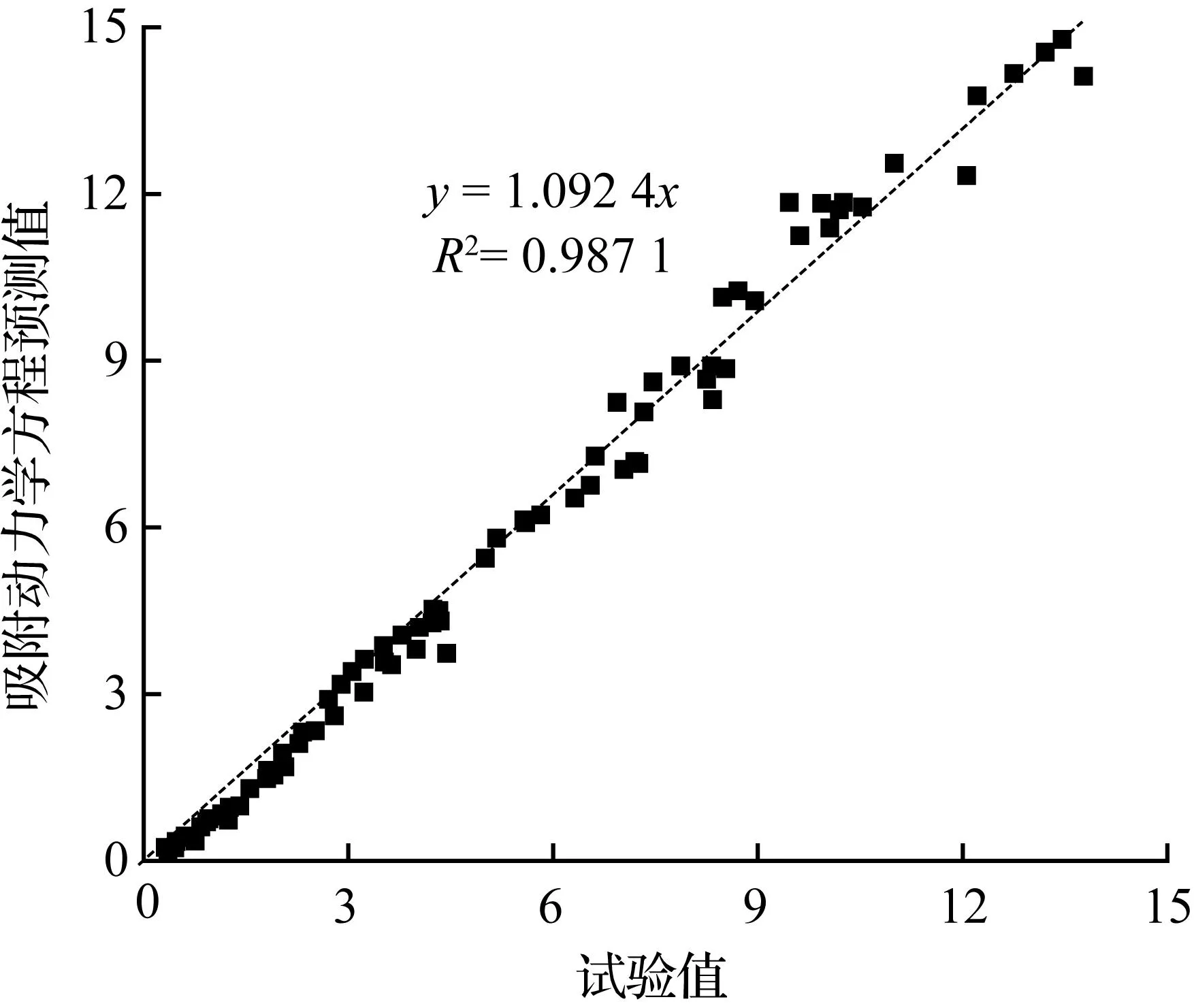
图6 试验值与动力学方程预测值Fig.6 Relationship between the experiment measured value and the kinetics equation predicted
从图6看出,预测值非常接近试验值。因此,该方程能很好的描述甘蔗黑液焦CO2气化动力学过程。
4结论
文献[12]采用即时气化速率对兰格缪尔-修斯伍德吸附动力学方程进行拟合,发现仅在特定转化率范围内具有线性关系。文献[13]活性点位数作为热解过程中最终温度以及[CO]的函数而不是常数。文献[20]气化速率常数决定于催化剂与碳比值的变化,直到催化剂与碳比值达到饱和才决定于表面积的变化。可惜的是这些重要的发现并没有与动力学方程建立有效的联系。本研究采用表观气化速率对兰格缪尔-修斯伍德吸附动力学方程进行线性拟合,取得了良好效果,获得主要结论如下:
①黑液焦CO2气化表观气化速率的倒数与[CO]和1/[CO2]有良好的线性关系,而与[CO]/[CO2]无线性相关性。因此,黑液焦CO2气化动力学宜采用兰格缪尔-修斯伍德非催化动力学方程描述,而不是催化动力学方程。
②通过兰格缪尔-修斯伍德吸附动力学方程与实验数据拟合可得,CO吸附常数为-1.048 7 m3/mol,CO2吸附常数为-0.323 8 m3/mol,吻合于动力学模型对其为常数的假设。但平衡速率常数却如同银行存款具有加息效应,相悖于动力学模型对其为常数的假设。活性点位数是M/C摩尔比值的函数,而不是常数。当黑液焦中的总碳每气化1%黑液焦表面的M损失为1.044%时,气化反应速率常数为0.158 9 m3/(mol·min),吻合于动力学模型对其为常数的假设。
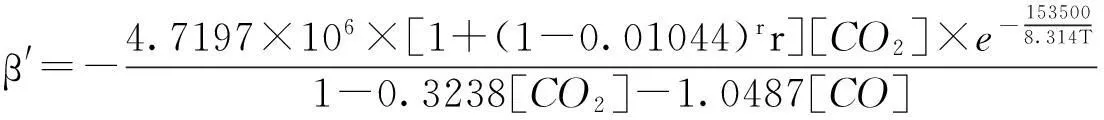
参考文献:
[1]王兴祥.浆纸厂黑液气化技术研究进展[J]. 国际造纸,2012,31(6):62-68.
[2]李许生,农光再,覃程荣,等.黑液等离子体二氧化碳气化平衡模型及效率[J]. 广西大学学报:自然科学版,2015, 40(2):483-491.
[3]粟重怡,黄惠兰,王耀东,等.某纸厂能源利用的优化与废料再利用分析[J]. 广西大学学报:自然科学版,2015, 40(3):651-659.
[4]王燕杰,应浩,江俊飞.生物质二氧化碳气化综述[J]. 林产化学与工业,2013,33(6):121-127.
[5]LI J, VAN HEININGEN A R P.Kinetics of CO2gasification of fast pyrolysis black liquor char[J]. Ind Eng Chem Res, 1990,29:1776-1783.
[6]GLORIA G, MARA B M, JESUS A.Thermal degradation of alkaline black liquor from straw: Thermogravimetric study[J]. Ind Eng Chem Res,2002,41:4714-4721.
[7]杨卿,阴秀丽,吴创之,等.钠离子对芦苇硫酸盐黑液木素CO2气化特性的影响[J]. 农业机械学报,2013,44(3):137-142.
[8]FREDERICK W J, WÅG K, HUPA M.Rate and mechanism of black liquor char gasification with CO2at Elevated pressures[J]. Ind Eng Chem Res, 1993,32:1747-1756.
[9]KUMAR V.Pyrolysis and gasfication of lignin and effect of alkali addition[D]. Georgia: Georgia Institute of Technology, 2009.
[10]CONNOLLY T S.CO2pyrolysis and gasfication of kraft black liquor char[D]. Orono: The University of Maine, 2006.
[11]GUO D L, WU S B, LOU R, et al.Effect of organic bound Na groups onpyrolysis and CO2-gasfication of alkali lignin[J]. Bio Resources, 2011,6(4):4145-4157.
[12]GEA G.Thermochemical behaviour of alkaline blackliquor from straw[D]. Zaragoza, Spain: University of Zaragoza, 2000.
[13]GLORIA G, JOSÉ L S, MARA B.Kinetics of CO2gasification of alkaline black liquor from wheat straw: Influence of CO and CO2concentrations on the gasification rate[J]. Ind Eng Chem Res, 2004,43:3233-3241.
[14]翟华敏,LAI Y Z.改进的深度脱木素的硫酸盐蒸煮:第一部分 用硫化钠预处理的桉树硫酸盐蒸煮[J]. 中国造纸,1996(3):6-10.
[15]李许生,韦天辉, 陈祖鑫.硫酸盐法蒸煮黑液预煮技术及其动力学研究的现状与思考[J]. 西南造纸,2004(6):15-18.
[16]任轶舟,王亦飞,朱龙雏,等.高温煤焦气化反应的Langmuir-Hinshelwood动力学模型研究[J]. 化工学报,2014,65(2): 3906-3915.
[17]JAFFRI G R, ZHANG J Y.Catalytic gasification of fujian an thracite in CO2with black liquor by therm ogravim etry[J]. Fuel Chemistry and Technology, 2007, 35(2):129-136.
[18]林荣英,张济宇,陈峰,等.低活性无烟煤固定床二氧化碳催化气化反应动力学研究[J]. 燃料化学学报,2005,33(2):677-683.
[19]GLORIA G, JOSÉ L S, MARA B, et al.Murillo, kinetics of CO2gasification of alkaline black liquor from wheat straw.2.Evolution of CO2reactivity with the solid conversion and influence of temperature on the gasification rate[J]. Ind Eng Chem Res, 2005, 44(17): 6583-6590.
(责任编辑梁健)
Research on black liquor char CO2gasification and kinetics
LI Xu-sheng1, WEI Wei2, NONG Guang-zai2, QIN Cheng-rong2, WANG Shuang-fei2
(1.School of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004, China;
2.College of Light Industry and Food Engineerting ,Guangxi University, Nanning 530004, China)
Abstract:To get the bagasse black liquor char CO2gasification characteristics and kenetic data, the bagasse black liquor char CO2gasification was studied. The effects on black liquor char gasification transformation was researched by changing the temperature,[CO], and [CO2]. It was used to solve kinetics equation parameters by fitting on the experimental data with Langmuir-Hinshelwood kinetic equation. The results showed that the gasification rate increases when the gasification temperature and [CO2] increase, and the gasification rate decreases when [CO] increase. The reciprocal of apparent gasification rate was linearly related to [CO] and [CO2]-1respectively. But it was not linear with the ratio of [CO]/[CO2]. The process of the bagasse black liquor char CO2gasification may be described by a Langmuir-Hinshelwood non-catalyzed kinetic equation for a specific range of operating conditions,and the average activation energy of the bagasse black liquor char CO2gasification is 153.5 kJ/mol. The data obtained suggested that this operational range could be broader if the number of active sites is considered as a function of M/C rather than as constant. By introducing the factors of M/C mole ratio on the kinetics revised model, the gasification reaction constant, carbon monoxide adsorption constant and carbon dioxide absorption constant can be regarded as a constant value, which were 0.158 9 m3/(mol·min), -1.048 7 m3/mol and -0.323 8 m3/mol, respectively.
Key words:black liquor char; carbon dioxide; gasification; kinetics
中图分类号:TS71+3
文献标识码:A
文章编号:1001-7445(2015)06-1577-11
doi:10.13624/j.cnki.issn.1001-7445.2015.1577
通讯作者:王双飞(1963—),男,湖南攸县人,广西大学教授,博士生导师;E-mail:wangsf@gxu.edu.cn。
基金项目:国家自然科学基金资助项目(31200459); 广西自然科学基金创新研究团队项目(2013GXNSFFA019005)
收稿日期:2015-09-07;
修订日期:2015-10-26

