育成期水貂不同铜源相对生物学利用率和血清生化指标的研究
吴学壮张铁涛于 淼刘 志郭俊刚高秀华∗杨福合邢秀梅(.中国农业科学院饲料研究所,北京0008;.中国农业科学院特产研究所,吉林省特种经济动物分子生物学省部共建重点实验室,长春30)
育成期水貂不同铜源相对生物学利用率和血清生化指标的研究
吴学壮1,2张铁涛2于 淼2刘 志1郭俊刚1高秀华1∗杨福合2邢秀梅2
(1.中国农业科学院饲料研究所,北京100081;2.中国农业科学院特产研究所,吉林省特种经济动物分子生物学省部共建重点实验室,长春130112)
摘 要:本试验旨在研究饲粮不同铜源及水平对育成期水貂血清铜、锌和铁含量及血清氮代谢、脂类和抗氧化指标影响,以及水貂对不同铜源的相对生物学利用率。选择60日龄健康、体重接近的水貂240只,随机分成10组,每组24个重复,每个重复1只貂。试验采用3×3+1试验设计,对照组饲喂基础饲粮,试验组分别在基础饲粮中添加3种铜源(硫酸铜、碱式氯化铜、蛋氨酸铜)和3个铜添加水平(10、25、40 mg/kg),预试期7 d,正试期45 d。结果表明:水貂血清铜含量随饲粮铜添加水平增加呈极显著线性增加(P=0.000 4)。水貂血清总胆固醇(P=0.001 5)、甘油三酯(P=0.002 1)和高密度脂蛋白胆固醇(P=0.010 1)含量随饲粮铜添加水平增加呈显著或极显著线性降低,然而水貂血清低密度脂蛋白胆固醇含量却未受饲粮铜添加水平的影响(P=0.579 0)。水貂血清铜蓝蛋白和铜锌超氧化物歧化酶活性均随饲粮铜添加水平增加呈极显著线性升高(P=0.000 1)。以血清铜蓝蛋白活性为指标,以硫酸铜为参比标准物(100%),碱式氯化铜和蛋氨酸铜的相对生物学利用率分别为109.93%和131.06%。以血清铜锌超氧化物歧化酶活性为指标,以硫酸铜为参比标准物(100%),碱式氯化铜和蛋氨酸铜的相对生物学利用率分别为111.01%和118.10%。由此可见,饲粮添加40 mg/kg的铜(基础饲粮铜含量8.05 mg/kg)能提高育成期水貂血清抗氧化酶的活性;育成期水貂3组铜源的相对生物学利用率为:蛋氨酸螯合铜>碱式氯化铜>硫酸铜。
关键词:水貂;硫酸铜;碱式氯化铜;蛋氨酸铜;相对生物学利用率;血清生化指标
铜作为动物的必需微量元素之一,在动物生长发育、营养物质的代谢繁殖、免疫、凝血等许多方面发挥着重要作用。饲粮中铜缺乏或过量都会对动物产生不良影响。铜作为金属酶组成部分参与体内代谢,这些酶包括超氧化物歧化酶、铜蓝蛋白(CRE)、酪氨酸酶和细胞色素氧化酶等。Aulerich等[1]研究表明,水貂饲粮中添加25 mg/kg铜(硫酸铜)具有促生长作用。吴学壮等[2]研究表明,饲粮铜添加水平为32 mg/kg时(总铜含量达到39 mg/kg),可促进育成期水貂的生长,提高营养物质消化率。水貂对不同铜源相对生物学利用率的研究目前未见报道。斜率比法是评定微量元素生物利用率最常用的方法[3],它简单易行,适用于各种元素生物学利用率的测定,且采用多元线性回归法比简单线性回归法更精确[4-5],但所测定的结果是相对生物学利用率。Hansen等[6]采用斜率比法,以血清铜浓度、肝脏铜浓度和CRE活性为判定指标,以硫酸铜为参比标准物的研究表明,甘氨酸螯合铜的相对生物学利用率分别为144%(血清铜)、150%(肝脏铜)和157%(CRE)。国内外专家认为,氨基酸鳌合铜比无机铜(硫酸铜、氧化铜)有更高的消化吸收率和独特的生理作用[7];也有一些学者报道有机铜与无机铜饲喂动物没有显著差异[8-9]。此外,饲粮中铜的添加水平越高,粪便中铜的排泄量也越大,自然环境受到污染也越严重。所以选用高效铜源替代传统的硫酸铜,对于生态环境的改善具有良好的促进作用。迄今为止,国内外关于畜禽适宜铜源的研究主要集中在猪、鸡等动物,而对水貂适宜铜源的研究报道较少。因此,本试验拟研究饲粮中硫酸铜、蛋氨酸铜和碱式氯化铜3种铜源及其不同水平对水貂血清铜、锌和铁含量及血清氮代谢、脂类和抗氧化指标的影响,旨在比较不同铜源的相对生物学利用率,为不同铜源在水貂饲粮中的应用提供理论依据和参考。
1 材料与方法
1.1 试验设计
试验采用3×3+1试验设计,设1个对照组(饲喂基础饲粮,不添加铜),3种铜源(硫酸铜、碱式氯化铜、蛋氨酸铜)和3个铜水平(10、25、40 mg/kg)。在农业部长白山野生生物资源重点野外科学观测试验站的毛皮动物生产基地随机选择240只健康、体重相近的(60±3)日龄水貂,随机分成10个组,每组24个重复(公母各占1/2),每个重复1只水貂,试验处理与动物分组见表1。
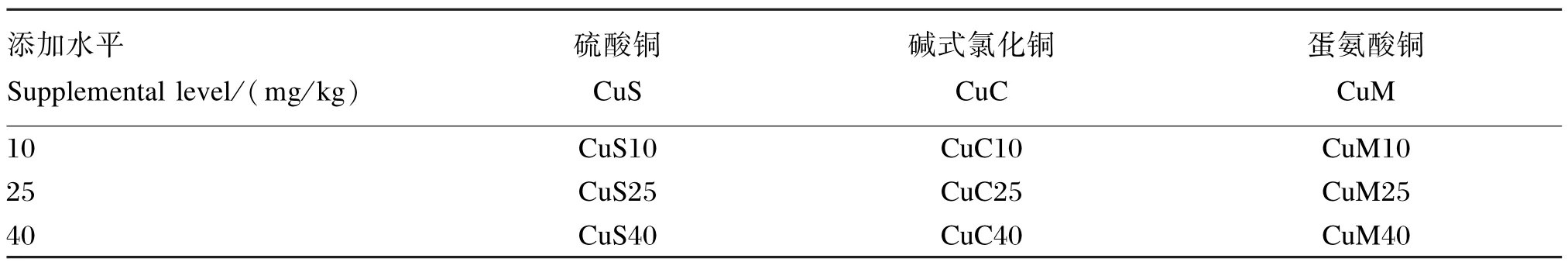
表1 试验处理与动物分组Table 1 Experimental treatments and animal grouping
试验水貂均单笼(40 cm×40 cm×60 cm)饲养,每日07:30与15:30各饲喂1次,自由采食,自由饮水,常规免疫。预试期7 d,正试期45 d。水貂目前没有统一的饲养标准,参照国内近几年水貂营养需要量的研究[2,10-12],配制育成期水貂基础饲粮,其组成及营养水平见表2。
1.2 测定指标及方法
饲养试验结束后,每组分别选取8只水貂,断指采血并消毒。每只采血6 mL,置于促凝固管中,静置待血清析出后3 500 r/min、4℃离心10 min,将分离出的血清分装在1.5 mL的Eppendorf管中,置于-80℃中保存,备用。
1.2.1 血清铜、锌和铁含量
用移液器取2 mL血清于100 mL锥形瓶中,加10 mL优级纯硝酸,盖上表面皿放置12 h,置于可调电炉上低温消煮至近干,将溶液无损失地转移到10 mL容量瓶中,使用VARIAN SpectrAA⁃240原子吸收分光光度计进行铜、锌和铁含量的测定。
1.2.2 血清氮代谢指标
血清尿素氮(UN)、总蛋白(TP)和白蛋白(ALB)含量及天门冬酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)活性测定用试剂盒均购自中生北控有限公司,按照试剂盒说明书操作使用VITALIB⁃E全自动生化分析仪测定。
1.2.3 血清脂类指标及血清抗氧化指标
甘油三酯(triglyceride,TG)测定试剂盒(GPO⁃PAP法)检测血清TG含量;总胆固醇(total choles⁃terol,TC)检测试剂盒(COD⁃PAP法)检测血清TC含量;选择性清除法测定血清高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL⁃C)、低密度脂蛋白胆固醇(low density lipoprotein choles⁃terol,LDL⁃C)含量。试剂盒均购自中生北控生物科技股份有限公司。
血清铜锌超氧化物歧化酶(Cu⁃Zn SOD)活性采用抽提法测定,血清CRE活性采比色法测定,以上血清指标均采用南京建成生物工程研究所试剂盒,通过分光光度计测定。别进行单因素方差分析(one⁃way ANOVA)进行差异显著性检验,组间差异采用Duncan氏法多重比较进行检验;铜添加水平的处理效应同时也进行一次线性和二次回归分析;铜源、铜添加水平以及铜源和铜添加水平的互作效应采用双因素方差分析进行差异显著性检验。其中P<0.05为差异显著,P<0.01为差异极显著。参照Littell等[5],采用多元线性回归斜率比法计算铜源相对于硫酸铜的相对生物学利用率。分别以血清CRE和Cu⁃Zn SOD活性为指标,建立的回归方程为:Y=d+aX1+bX2+cX3,Y为血清CRE活性(U/L)或Cu⁃Zn SOD活性(U/mL),X1、X2和X3分别为硫酸铜、碱式氯化铜、蛋氨酸铜的添加水平(以铜元素计算,mg/kg),以硫酸铜为参比标准物(100%),碱式氯化铜和蛋氨酸铜的相对生物学利用率分别为b/a×100%和c/a×100%。

表2 基础饲粮组成及营养水平(风干基础)Table 2 Composition and nutrient levels of the basal diet(air⁃dry basis) %
1.3 数据处理
试验数据采用SAS 9.13软件GLM程序进行统计分析,性别、铜添加水平和铜源的处理效应分
2 结 果
2.1 饲粮铜源及水平对育成期水貂血清铜、锌和铁含量的影响
饲粮铜源及水平对育成期水貂血清铜、锌和铁含量影响的结果见表3。3种铜源、性别及铜源及水平的交互作用对育成期水貂血清铜、锌和铁含量均没有显著影响(P>0.05)。40 mg/kg铜水平组水貂血清铜含量极显著高于对照组(P<0.01),显著高于10 mg/kg铜水平组(P<0.05)。线性和二次分析结果显示,育成期水貂血清铜含量随铜水平增加呈极显著线性增加(P=0.000 4)。
2.2 饲粮铜源及水平对育成期水貂血清氮代谢指标的影响
饲粮铜源及水平对育成期水貂血清氮代谢指标影响的结果见表4。雄性水貂血清ALT活性极显著高于雌性水貂(P<0.01),然而雄性水貂血清TP和ALB含量却显著或极显著低于雌性水貂(P<0.05或P<0.01)。线性和二次分析结果显示,育成期水貂血清UN含量随饲粮铜水平增加呈显著线性降低(P=0.034 4)。双因素方差分析结果显示,铜源、铜水平及铜源与水平的交互作用对育成期水貂血清生化指标均没有显著影响(P>0.05)。

表3 铜源及水平对育成期水貂血清铜、锌和铁含量的影响Table 3 Effects of dietary Cu sources and levels on serum Cu,Zn and Fe content of minks in late growing period mg/L
2.3 饲粮铜源及水平对育成期水貂血清脂类和抗氧化指标的影响
饲粮铜源及水平对育成期水貂血清脂类指标和抗氧化指标影响的结果见表5。铜源与水平的交互作用对育成期水貂血清血清脂类和抗氧化指标均没有显著影响(P>0.05)。雌性水貂血清CRE活性显著高于雄性水貂(P<0.05)。对照组水貂血清CRE活性极显著低于CuS组、CuC组和CuM组(P<0.01)。对照组水貂血清Cu⁃Zn SOD活性极显著低于CuM组(P<0.01),并显著低于CuS组和CuC组(P<0.05)。随饲粮铜添加水平增加水貂血清TC(P=0.001 5)、TG(P=0.002 1)和LDL⁃C(P=0.010 1)含量呈显著或极显著线性降低,然而血清HDL⁃C含量却未受饲粮铜添加水平的影响(P=0.579 0)。育成期水貂血清CRE和Cu⁃Zn SOD活性均随饲粮铜添加水平增加呈极显著线性升高(P=0.000 1)。

表4 铜源及水平对育成期水貂血清氮代谢指标的影响Table 4 Effects of dietary Cu sources and levels on serum nitrogen metabolism indices of minks in late growing period
2.4 育成期水貂对不同铜源的相对生物学利用率
参照Littell等[5]的方法,采用多元线性回归斜率比法计算铜源相对于硫酸铜的相对生物学利用率。结果显示,育成期水貂血清CRE和Cu⁃Zn SOD活性与铜添加水平之间存在极显著的线性回归关系(P<0.01)。
以血清CRE活性为指标,建立的回归方程为:
Y=18.222 9+0.322 3X1+0.354 3X2+0.422 1X3 (R2=0.584 0,P<0.01)。
式中:Y为血清CRE活性(U/L),X1、X2和X3分别为硫酸铜、碱式氯化铜、蛋氨酸铜的添加水平(以铜元素计算)。以血清CRE活性为指标,以硫酸铜为参比标准物(100%),碱式氯化铜和蛋氨酸铜的相对生物学利用率分别为109.93%和131.06%。
以血清Cu⁃Zn SOD活性为指标,建立的回归方程为:
Y=30.470 0+0.577 4X1+0.641 0X2+0.681 9X3 (R2=0.278 8,P<0.01)。
式中:Y为血清Cu⁃Zn SOD活性(U/mL),X1、X2和X3分别为硫酸铜、碱式氯化铜、蛋氨酸铜的添加水平(以铜元素计算)。以血清Cu⁃Zn SOD活性为指标,以硫酸铜为参比标准物(100%),碱式氯化铜和蛋氨酸铜的相对生物学利用率分别为111.01%和118.10%。

表5 铜源及水平对育成期水貂血清脂类代谢指标和抗氧化酶活性的影响Table 5 Effects of dietary Cu sources and levels on serum lipid metabolism parameters and antioxidant enzyme activities of minks in late growing period

图1 血清铜蓝蛋白活性与饲粮铜添加水平的线性回归关系Fig.1 Linear regression relationship of serum CRE activity and dietary Cu supplemental level

图2 血清铜锌超氧化物歧化酶活性与饲粮铜添加水平的线性回归关系Fig.2 Linear regression relationship of serum Cu⁃Zn SOD activity and dietary Cu supplemental level
3 讨 论
3.1 饲粮铜源及水平对育成期水貂血清铜、锌和铁含量的影响
Klevay等[13]在研究小鼠铜营养状态时指出,肝脏铜对饲粮铜添加水平较敏感,是评价小鼠铜营养状态的最好指标,但肝脏的取样却不方便。血浆铜在饲粮铜添加水平达到某一临界值时,会发生可检测的变化[14]。因此,血清铜含量或铜蓝蛋白活性是反映铜营养状态的一个相对敏感的指标[15-16]。在正常生理条件下,血清铜含量主要受饲粮铜添加水平的影响[17]。水貂正常生理条件下血清铜含量为0.4~1.5 mg/L[18-19],与本试验结果基本一致。Wu等[20]研究水貂铜需要量时发现,水貂肝脏和血清铜含量都随饲粮铜添加水平增加而增加。崔伟等[21]发现血清铜含量随饲粮铜添加水平增加而显著增加。
3.2 饲粮铜源及水平对育成期水貂血清氮代谢指标的影响
关于饲粮铜添加水平对水貂血清氮代谢指标影响的研究较少。AST和ALT是反映肝功能的2项重要指标,同时,这2种酶活性的高低是反映蛋白质合成和分解代谢的重要指标。蒋清奎[22]研究表明,谷草转氨酶(GOT)活性呈现出随饲粮蛋白质水平升高而增大的趋势。前期研究表明,水貂饲粮中铜添加水平超过200 mg/kg,会导致血清ALT和AST活性升高[20]。本研究中铜最大添加水平为40 mg/kg,结果表明没有影响血清ALT和AST活性。前期研究和本研究都表明,正常状态下水貂血清的ALT和AST活性分别为150~170 U/L和160~200 U/L。然而,人类正常血清ALT和AST活性分别为5~40 U/L和8~40 U/L,这可能与物种或饲粮(食物)组成有关。水貂为肉食动物,饲粮中蛋白质水平较高,蛋白质合成和分解代谢旺盛,导致血清ALT和AST活性较高。铜与TP、ALB之间相关性的研究报道很少,本次试验也未发现铜与它们之间有明显的关系,此结果与前人的报道[23]一致。血清UN是衡量动物体内蛋白质代谢和氨基酸平衡的一个重要指标[24]。血清UN含量过高会导致尿氮的增加,从而降低了机体对氮的利用率,所以血清UN也是衡量氮沉积的重要指标。本研究表明,饲粮铜元素能够显著降低育成期水貂的血清UN含量。
3.3 饲粮铜源及水平对育成期水貂血清脂类指标和抗氧化指标的影响
铜是CRE和Cu⁃Zn SOD的辅助因子[25-26]。大多数动物(除鸟类),铜在血清中主要以CRE的形式存在,并且主要以CRE的形式输送到肝脏外的其他组织[27-28]。本研究表明,血清CRE和Cu⁃Zn SOD活性随饲粮铜添加水平增加而增强,国内外其他研究结果与本研究结果一致[17,29-30]。
徐晨晨等[32]研究表明,随饲粮中铜添加水平的增加,血清中TC、TG和LDL⁃C含量有先降低后升高的趋势,而HDL⁃C含量呈现先升高后降低的趋势。本试验结果表明,随饲粮中铜添加水平的增加,血清中TC、TG和LDL⁃C含量都呈现降低的趋势,而饲粮中铜的添加没有影响血清HDL⁃C含量。崔学平等[33]研究表明,饲粮中添加铜显著降低了血清中TG含量。铜通过调节动物体内胆固醇的合成和分解,进而影响体内胆固醇的含量。首先,Kim等[34]研究发现,小鼠饲喂低铜饲粮时,肝脏细胞中3-羟-3-甲基戊二酰-CoA还原酶(HMG⁃CoA还原酶)活性增加,HMG⁃CoA还原酶是肝细胞合成胆固醇过程中的限速酶[35],因此,饲喂低铜饲粮时刻导致小鼠血浆胆固醇含量显著增加。其次,铜影响胆固醇的降解。胆固醇向胆汁酸的转化是胆固醇降解最重要的机制,胆固醇7α-羟化酶是在肝脏合成并促使胆固醇转化成胆酸的限速酶[36]。Tang等[37]研究表明,成年大鼠饲喂低铜饲粮时,胆固醇7α-羟化酶基因相对表达量降低80%,胆固醇7α-羟化酶活性降低,因此胆固醇排出障碍,导致高总胆固醇血症。
3.4 育成期水貂对不同铜源的相对生物学利用率
硫酸铜是饲粮中最常见的、应用最普遍的铜源。诸多试验表明,动物对无机铜的利用率较低,使用无机铜添加剂不但会造成铜元素的浪费,而且在某种程度上也会造成环境的铜污染。近年来氨基酸螯合铜等有机铜产品则因其相对生物学利用率高,可能成为未来饲粮铜元素的主要来源。然而,现有相关文献报道差异较大,一些学者认为氨基酸鳌合铜比无机铜(硫酸铜、氧化铜)有更高的消化吸收率和独特的生理作用[7];也有一些学者报道有机铜与无机铜饲喂动物没有显著差异[8-9]。李清宏等[38]研究发现,甘氨酸铜对断奶仔猪的生物学活性与无机硫酸铜无明显差异。林月霞等[39]研究表明,碱式氯化铜生物学有效性优于硫酸铜,并且碱式氯化铜源饲料中维生素E的氧化稳定性明显优于硫酸铜源饲料,碱式氯化铜对肉仔鸡的生物安全性明显高于硫酸铜。
水貂对不同铜源相对生物学利用率的研究未见报道,其他动物对不同铜源相对生物学利用率的研究较多。Luo等[4]研究表明,肉鸡对碱式氯化铜相对硫酸铜(100%)的生物学利用率为109%。Guo等[40]研究了赖氨酸铜、蛋白质螯合铜A和蛋白质螯合铜B的相对生物学利用率,发现赖氨酸铜、蛋白质螯合铜A和蛋白质螯合铜B相对硫酸铜(100%)的生物学利用率分别为111%、109%和105%。本研究与前人的试验研究结果一致,育成期水貂对有机铜中铜的生物学利用率显著高于硫酸铜。但也有试验研究表明,动物对有机铜与无机铜的相对生物学利用率没有显著差异[41]。
肝脏铜含量对饲粮铜添加水平较敏感,是评价铜源相对生物学利用率的最好指标,但肝脏的取样却不方便。Hansen等[6]采用斜率比法,以CRE活性为判定指标,以硫酸铜为参比标准物的研究表明,甘氨酸螯合铜的相对生物学利用率为157%(CRE)。本研究血清CRE活性是反映育成期水貂铜营养状况的敏感指标,其与饲粮铜供应量呈正线性相关关系。采用血清CRE活性为判定指标,评价不同铜源的相对生物学利用率是一种较为可靠的方法。此外,有机铜源的相对生物学利用率还与络合强度有关,因此,在进一步研究中要着重考虑有机铜源的质量。
4 结 论
①在基础饲粮铜含量为8.05 mg/kg时,饲粮添加40 mg/kg的铜能提高育成期水貂血清CRE 和Cu⁃Zn SOD的活性。
②育成期水貂3组铜源的相对生物学利用率为:蛋氨酸螯合铜>碱式氯化铜>硫酸铜。以血清CRE活性为指标,以硫酸铜为参比标准物(100%),碱式氯化铜和蛋氨酸铜的相对生物学利用率分别为109.93%和131.06%。以血清Cu⁃Zn SOD活性为指标,以硫酸铜为参比标准物(100%),碱式氯化铜和蛋氨酸铜的相对生物学利用率分别为111.01%和118.10%。
参考文献:
[1] AULERICH R J,RINGER R K.Can copper sulphate in mink feed give advantages?[J].Vara Palsdjur,1977,48(3):103-105.
[2] 吴学壮,张铁涛,崔虎,等.饲粮添加铜水平对育成期水貂生长性能、营养物质消化率及氮代谢的影响[J].动物营养学报,2012,24(6):1078-1084.
[3] 王群,刘艳芬.饲料矿物质微量元素生物学效价评定的研究[J].饲料工业,2006,27(12):42-46.
[4] LUO X G,JI F,LIN Y X,et al.Effects of dietary sup⁃plementation with copper sulfate or tribasic copper chloride on broiler performance,relative copper bio⁃availability,and oxidation stability of vitamin E in feed [J].Poultry Science,2005,84(6):888-893.
[5] LITTELL R C,HENRY P,LEWIS A J,et al.Estima⁃tion of relative bioavailability of nutrients using SAS procedures[J].Journal of Animal Science,1997,75 (10):2672-2683.
[6] HANSEN S L,SCHLEGEL P,LEGLEITER L R,et al.Bioavailability of copper from copper glycinate in steers fed high dietary sulfur and molybdenum[J].Journal of Animal Science,2008,86(1):173-179.
[7] GHEISARI A A,SANEI A,SAMIE A,et al.Effect of diets supplemented with different levels of manga⁃nese,zinc,and copper from their organic or inorganic sources on egg production and quality characteristics in laying hens[J].Biological Trace Element Re⁃search,2011,142(3):557-571.
[8] MILES R D,HENRY P R,SAMPATH V C,et al.Rel⁃ative bioavailability of novel amino acid chelates of manganese and copper for chicks[J].The Journal of Applied Poultry Research,2003,12(4):417-423.
[9] CHENG J B,MA H,FAN C Y,et al.Effects of differ⁃ent copper sources and levels on plasma superoxide dismutase,lipid peroxidation,and copper status of lambs[J].Biological Trace Element Research,2011,144(1/2/3):570-579.
[10] 张铁涛,张志强,任二军,等.饲粮蛋白质水平对育成期水貂营养物质消化率及生长性能的影响[J].动物营养学报,2010,22(4):1101-1106.
[11] 杨颖,刘汇涛,曲勃,等.不同能量水平的干粉料对生长期母貂生长性能、毛皮质量及血清生化指标的影响[J].吉林农业大学学报,2014,36(2):205-212.
[12] 吴学壮,张铁涛,杨颖,等.饲粮锌添加水平对繁殖期雄性水貂繁殖性能、营养物质消化率及氮代谢的影响[J].动物营养学报,2013,25(8):1817-1824.
[13] KLEVAY L M,SAARI J T.Comparative responses of rats to different copper intakes and modes of supple⁃mentation[J].Experimental Biology and Medicine,1993,203(2):214-220.
[14] O'DELL B L,SUNDE R A.Handbook of nutritionally essential mineral elements[M].Florida,USA:CRC Press,1997.
[15] KEGLEY E B,SPEARS J W.Bioavailability of feed⁃grade copper sources(oxide,sulfate,or lysine)in growing cattle[J].Journal of Animal Science,1994,72(10):2728-2734.
[16] ARTHINGTON J D,PATE F M,SPEARS J W.Effect of copper source and level on performance and copper status of cattle consuming molasses⁃based supplements [J].Journal of Animal Science,2003,81(6):1357-1362.
[17] FENG J,MA W Q,GU Z L,et al.Effects of dietary copper(Ⅱ)sulfate and copper proteinate on perform⁃ance and blood indexes of copper status in growing pigs[J].Biological Trace Element Research,2007,120(1/2/3):171-178.
[18] 王夕国.雌性水貂繁殖期饲粮中锰适宜需要量的研究[D].硕士学位论文.镇江:江苏科技大学,2012.
[19] MEJBORN H.Effect of copper addition to mink feed during the growth and moulting period on growth,skin production,and copper retention[J].Scientifur,1989,13(3):229-234.
[20] WU X Z,LIU Z,ZHANG T T,et al.Effects of dietary copper on nutrient digestibility,tissular copper deposi⁃tion and fur quality of growing⁃furring mink(Mustela vison)[J].Biological Trace Element Research,2014,158(2):166-175.
[21] 崔伟,李敏,彭西,等.高铜对雏鸡肾脏组织结构及生化指标影响的研究[J].畜牧兽医学报,2010,41 (1):86-91.
[22] 蒋清奎.繁殖期雌性水貂日粮中适宜蛋白质水平的研究[D].硕士学位论文.北京:中国农业科学院,2011.
[23] 周明荣,王金法,王宗元,等.铜、锌、锰、硒对肉鸡生长性能和血液中某些生理生化指标等影响的研究[J].畜牧兽医学报,1993,24(5):412-422.
[24] 张铁涛,张志强,刘汇涛,等.饲粮蛋白质水平对冬毛期水貂部分血清生化指标的影响[J].动物营养学报,2011,23(6):1052-1057.
[25] VIVOLI G,BERGOMI M,ROVESTI S,et al.Zinc,copper,and zinc⁃or copper⁃dependent enzymes in hu⁃man hypertension[J].Biological Trace Element Re⁃search,1995,49(2/3):97-106.
[26] SANTI E,VIERA I,MOMBRÙ A,et al.Synthesis and characterization of heteroleptic copper and zinc com⁃ plexes with saccharinate and aminoacids.Evaluation of SOD⁃like activity of the copper complexes[J].Biolog⁃ical Trace Element Research,2011,143(3):1843-1855.
[27] MEYER L A,DURLEY A P,PROHASKA J R,et al.Copper transport and metabolism are normal in aceru⁃loplasminemic mice[J].The Journal of Biological Chemistry,2001,276(39):36857-36861.
[28] DAS D,TAPRYAL N,GOSWAMI S K,et al.Regula⁃tion of ceruloplasmin in human hepatic cells by redox active copper:identification of a novel AP⁃1 site in the ceruloplasmin gene[J].The Biochemical Journal,2007,402(1):135-141.
[29] KIRCHGESSNER M,KIM J J,GRASSMANN E.Contents of copper and iron and activities of cerulo⁃plasmin and catalase in blood of growing rats receiv⁃ing different amounts of iron and copper[J].Zentralbl Veterinarmed A,1983,30(1):15-25.
[30] DISILVESTRO R A.Influence of dietary copper,cop⁃per injections and inflammation on rat serum cerulo⁃plasmin activity levels[J].Nutrition Research,1990,10(3):355-358.
[31] 钟伟,刘凤华,赵靖波,等.不同铜源对育成期雌性银狐生长性能、营养物质消化率及血液生化指标的影响[J].动物营养学报,2013,25(10):2489-2496.
[32] 徐晨晨,王宝维,葛文华,等.饲粮中不同水平铜对5~16周龄五龙鹅脂类代谢、抗氧化能力与免疫功能的影响[J].动物营养学报,2014,26(4):908-917.
[33] 崔学平,陈代文,余冰.日粮添加高铜对产蛋鸡生产性能和脂质代谢的影响[J].中国畜牧杂志,2007,43(21):30-33.
[34] KIM S,CHAO P Y,ALLEN K G.Inhibition of elevat⁃ed hepatic glutathione abolishes copper deficiency cholesterolemia[J].The Faseb Journal,1992,6(7):2467-2471.
[35] RANJI P,RAUTHAN M,PITOT C,et al.Loss of HMG⁃CoA reductase in C.elegans causes defects in protein prenylation and muscle mitochondria[J].PloS One,2014,9(2):e100033.
[36] 曹扬,贝伟剑.胆固醇7α-羟化酶调节的研究进展[J].广东药学院学报,2011,27(6):658-661.
[37] TANG Z R,GASPERKOVA D,XU J,et al.Copper defi⁃ciency induces hepatic fatty acid synthase gene transcrip⁃tion in rats by increasing the nuclear content of mature sterol regulatory element binding protein 1[J].The Jour⁃nal of Nutrition,2000,130(12):2915-2921.
[38] 李清宏,罗绪刚,刘彬,等.饲粮甘氨酸铜对断奶仔猪血液生理生化指标和组织铜含量的影响[J].畜牧兽医学报,2004,35(1):23-27.
[39] 林月霞,吕林,罗绪刚,等.碱式氯化铜对肉仔鸡的生物学有效率、饲料中维生素E的氧化稳定性和生物安全性研究[J].畜牧兽医学报,2006,37(2):141-145.
(责任编辑 武海龙)
[40] GUO R,HENRY P R,HOLWERDA R A,et al.Chemical characteristics and relative bioavailability of supplemental organic copper sources for poultry[J].Journal of Animal Science,2001,79(5):1132-1141.[41] LIU S B,LU L,LI S F,et al.Copper in organic pro⁃teinate or inorganic sulfate form is equally bioavailable for broiler chicks fed a conventional corn⁃soybean meal diet[J].Biological Trace Element Research,2012,147(1/2/3):142-148.
A Study of Different Copper Sources Relative Bioavailability and Serum Biochemical Indices of Minks in Late Growing Period
WU Xuezhuang1,2ZHANG Tietao2YU Miao2LIU Zhi1GUO Jungang1GAO Xiuhua1∗YANG Fuhe2XING Xiumei2
(1.Institute of Feed Research,Chinese Academy of Agriculture Science,Beijing,100081,China;2.State Key Laboratory for Molecular Biology of Special Economic Animals,Institute of Economic Animal and Plant Science,Chinese Academy of Agriculture Science,Changchun 130112,China)
∗Corresponding author,professor,E⁃mail:xiuhuagao@126.com
Abstract:This experiment was conducted to study the effects of different copper sources and levels on serum copper,zinc and iron contents,nitrogen metabolism,lipid and antioxidant indices of minks in late growing pe⁃riod,and different copper sources relative bioavailability of minks.Two hundred and forty 60⁃day⁃old minks were randomly divided into 10 groups with 24 replicates per group and 1 mink per replicate.The experiment was used in a 3×3+1 factorial experiment design,minks in the control group were fed a basal diet,and minks in other nine groups were fed basal diets supplemented with 3 sources(copper sulfate,tribasic copper chloride and copper methionine)and 3 levels(10,25,and 40 mg/kg).The pre⁃test period lasted for 7 days,and the trial lasted for 45 days.The results showed as follows:the serum copper content of minks was significant linear increased with dietary copper supplemental level increased(P=0.000 4),the contents of total cholesterol(P=0.001 5),triglyceride(P=0.002 1)and high density lipoprotein cholesterol(P=0.010 1)in serum of minks were significant linear decreased with dietary copper supplemental level increased,but dietary copper supple⁃mental level had no significant effect on serum high density lipoprotein cholesterol content of minks(P=0.579 0).The activities of ceruloplasmin(CRE)and copper zinc superoxide dismutase(Cu⁃Zn SOD)in ser⁃um of minks were significant linear increased with dietary copper supplemental level increased(P=0.000 1).Compared with copper sulfate(100%),the relative bioavailability of tribasic copper chloride and copper me⁃thionine were 109.93%and 131.06%based on serum CER activity,respectively.Compared with copper sul⁃fate(100%),the relative bioavailability of tribasic copper chloride and copper methionine were 111.01%and 118.10%based on serum Cu⁃Zn SOD activity,respectively.The results indicate that dietary supplemented with 40 mg/kg copper(copper content in basal diet is 8.05 mg/kg)can improve serum antioxidant enzyme activity of minks in late growing period,the relative bioavailability of 3 copper sources is copper methionine>tribasic copper chloride>copper sulfate.[Chinese Journal of Animal Nutrition,2015,27(2):485⁃494]
Key words:minks;copper sulfate;tribasic copper chloride;copper methionine;relative bioavailability;ser⁃um biochemical indices
通信作者:∗高秀华,研究员,博士生导师,E⁃mail:xiuhuagao@126.com
作者简介:吴学壮(1985—),男,山东聊城人,博士研究生,从事单胃动物营养研究。E⁃mail:wuxuezhuang@126.com
基金项目:国家自然资源平台专项“特种经济动物种质资源共享平台”(2005DKA21102)
收稿日期:2014-09-28
doi:10.3969/j.issn.1006⁃267x.2015.02.019
文章编号:1006⁃267X(2015)02⁃0485⁃10
文献标识码:A
中图分类号:S816.7

