亚急性瘤胃酸中毒对奶山羊血浆细胞因子和激素含量的影响
胡红莲谢天宇杨淑青高 民姚焰础(.内蒙古农牧业科学院动物营养与饲料研究所,呼和浩特0003;.内蒙古农业大学动物科学学院,呼和浩特0008;3.重庆市畜牧科学院动物营养研究所,重庆40460)
亚急性瘤胃酸中毒对奶山羊血浆细胞因子和激素含量的影响
胡红莲1谢天宇2杨淑青2高 民1姚焰础3∗
(1.内蒙古农牧业科学院动物营养与饲料研究所,呼和浩特010031;2.内蒙古农业大学动物科学学院,呼和浩特010018;3.重庆市畜牧科学院动物营养研究所,重庆402460)
摘 要:本试验旨在研究以递增饲粮非纤维性碳水化合物与中性洗涤纤维比(NFC/NDF)方式诱导奶山羊发生亚急性瘤胃酸中毒(SARA)后,血浆细胞因子和激素含量的变化。选取9只体况良好,体重接近的泌乳期莎能奶山羊,随机分为3组(对照组、SARA组、恢复组,n=3),对照组饲喂基础饲粮,SARA组和恢复组先后饲喂NFC/NDF为1.40、1.79、2.31、3.23的4种试验饲粮诱导SARA发生,每种饲喂15 d,恢复组奶山羊诱导SARA后自由采食青干草30 d。对照组3只羊分别在饲养30、60(与SARA组同时)和90 d(与恢复组同时)屠宰。结果表明:1)SARA长期提高了血浆LPS浓度,恢复组与SARA组差异不显著(P>0.05)。2)与对照组相比,SARA组奶山羊血浆中促炎性细胞因子肿瘤坏死因子-α(TNF⁃α)、白细胞介素(IL)⁃1β和IL⁃6含量呈升高趋势(P>0.05),IL⁃2含量显著升高(P<0.05),IL⁃8含量呈降低趋势(P>0.05),γ-干扰素(IFN⁃γ)含量显著降低(P<0.05),抗炎性细胞因子IL⁃4和IL⁃10含量均呈降低趋势(P>0.05);SARA组奶山羊血浆中生长激素、胰岛素样生长因子-Ⅰ、胰岛素含量变化不显著(P>0.05),催乳素(PRL)和皮质醇(COR)含量均显著升高(P<0.05)。3)与SARA组相比,恢复组奶山羊血浆中TNF⁃α、IL⁃1β、IL⁃2、IL⁃6这些促炎性细胞因子的含量仍持续性升高,其中IL⁃1β和IL⁃2含量显著升高(P<0.05);恢复组奶山羊血浆中PRL含量仍维持与SARA组同一水平(P>0.05),而COR含量则回归到对照组水平(P>0.05)。本研究结果显示,SARA可引起奶山羊血浆中长时间含有一定量的LPS,引发机体免疫和炎症反应,并引起内分泌激素的变化,这一系列变化导致奶山羊长期处于应激状态。
关键词:亚急性瘤胃酸中毒;奶山羊;细胞因子;激素
随着集约化、规模化养殖的扩大和优质牧草的缺乏,以及对短期利润的追求,亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)已经成为危害奶牛的一种群发性常见营养代谢性疾病,多发于泌乳初期和高峰期,对高产奶牛尤为严重,它能使其产奶量下降、生产率降低,更为严重的是会继发一系列病征,使奶牛淘汰率大幅提高,使用年限缩短,治疗成本增加,这给我国奶牛业造成了很大的经济损失。近年来在奶牛[1-3]、肉牛[4]、山羊[5-6]的诸多研究结果显示,使用高精料诱导SARA发生时,瘤胃会产生大量细菌内毒素脂多糖(lipopolysaccharide,LPS),高浓度的LPS可转运入血[7-8],进入血液的LPS可促进体内产生多种炎性细胞因子和急性期蛋白,诱发细胞因子的连锁反应,使动物机体处于免疫应激状态[1,8-9],而且LPS也能通过改变体内激素等水平来调节机体的物质代谢[10],这一系列的变化使动物机体处于一种慢性应激状态,进而加剧了机体对疾病的易感性[11]。目前,国内外关于SARA的研究主要集中于瘤胃发酵模式、微生物区系、异常代谢产物和血液参数的改变,对免疫、内分泌及应激反应的研究较少。本研究旨在以奶山羊为动物模型,探讨以递增饲粮非纤维性碳水化合物与中性洗涤纤维比(NFC/NDF)方式诱发泌乳期山羊产生SARA后,血浆内分泌激素、炎性细胞因子与抗炎性细胞因子含量的变化,初步揭示SARA所导致的应激反应以及对机体免疫系统和内分泌系统的长期影响作用,为本病的深入研究提供试验基础与理论依据。
1 材料与方法
1.1 试验动物与饲养
选用健康状况良好,体重接近(35~40)kg的泌乳期莎能奶山羊9只,手术安装永久性瘤胃瘘管,恢复期20 d,于2013年6月至2013年10月饲养于内蒙古自治区农牧业科学院动物试验基地动物房,单笼饲养。
1.2 试验设计
采用单因子试验设计,随机分成3组,即对照组(n=3)、SARA组(n=3)和恢复组(n=3)。对照组饲喂基础饲粮(NFC/NDF为1.40),SARA组和恢复组通过先后饲喂NFC/NDF为1.40、1.79、2.31、3.23的试验饲粮诱导SARA发生,每种饲粮持续饲喂15 d;恢复组奶山羊待SARA诱导成功后自由采食青干草30 d,使其逐渐恢复。对照组3只羊分别在饲养30、60(与SARA组同时)和90 d(与恢复组同时)屠宰。
试验饲粮参照NRC(1981)奶山羊营养需求配制。试验饲粮组成及营养水平见表1。整个试验期,每日06:00和18:00分2次等量饲喂,自由饮水。
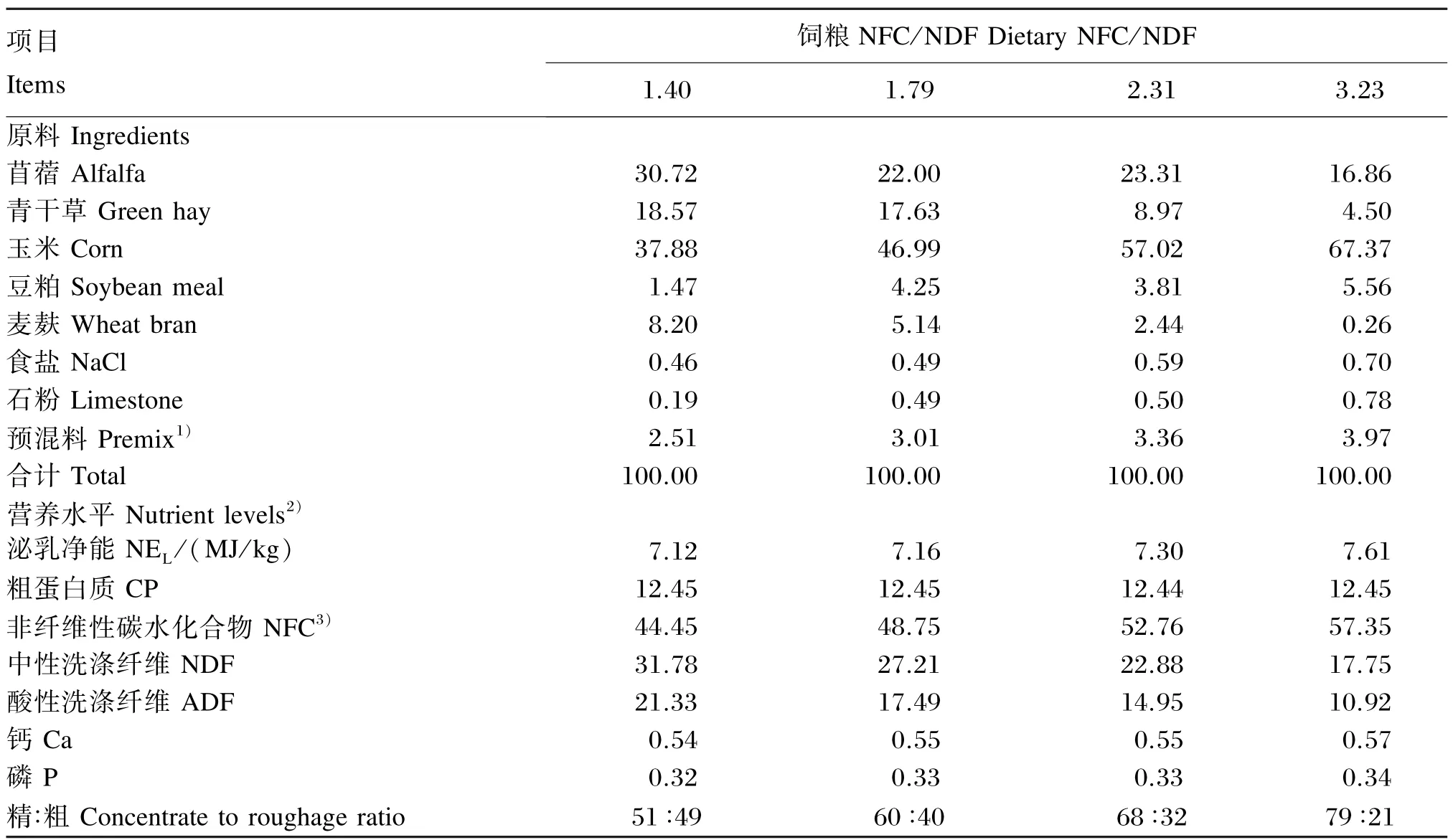
表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
1.3 主要试剂及仪器
白细胞介素(IL)-1β、IL⁃2、IL⁃4、IL⁃6、IL⁃8、IL⁃10、肿瘤坏死因子-α(TNF⁃α)、γ-干扰素(IFN⁃γ)试剂盒购自美国R&D公司,生长激素(GH)、催乳素(PRL)、胰岛素样生长因子-Ⅰ(IGF⁃Ⅰ)、胰岛素(INS)、皮质醇(COR)及LPS试剂盒购自北京华英生物技术研究所。
主要仪器有:pH电极(S651CD,美国Sensorex公司)、pH变送器(692,美国Jenco公司)、无纸记录仪(R4100,浙大中控仪表有限公司)、多功能酶标仪(Synergy H4,美国BioTek仪器公司)、全自动放免计数仪(γ⁃911,中国科技大学实业总公司)。
1.4 试验方法
1.4.1 瘤胃液pH连续监测
采用动态pH连续监测记录系统对瘤胃液pH进行24 h连续监测,具体方法见文献[12]。以瘤胃液pH作为判定SARA发生的主要参数,当瘤胃液pH<5.5每天持续时间>3 h即认为SARA模型建立。
1.4.2 血浆的采集和处理方法
各组饲养试验结束,晨饲前用加有促凝剂的真空采血管从颈静脉处采集20 mL,静置30 min,3 000 r/min离心15 min,制得的血浆转移至离心管中,置于-20℃冰箱中保存。
1.4.3 血浆激素和细胞因子测定方法
采用放射性免疫法(RIA)测定GH、PRL、IGF⁃Ⅰ、INS、COR含量及LPS浓度;采用酶联免疫吸附测定法(ELISA)测定TNF⁃α、IFN⁃γ、IL⁃1β、IL⁃2、IL⁃4、IL⁃6、IL⁃8及IL⁃10等细胞因子含量。严格按照试剂盒说明书进行测定。
1.5 数据统计
所有数据首先采用Excel进行整理,采用SPSS 11.5软件ANOVA程序进行单因素方差分析,用Duncan氏法进行多重比较,试验数据用平均值±标准误表示。
2 结 果
2.1 不同NFC/NDF饲粮对瘤胃液pH的影响
由表2可知,逐渐递增饲粮NFC/NDF对奶山羊瘤胃液pH影响较大。随着饲粮NFC/NDF增大,瘤胃液pH平均值从6.20降至5.76,降低了0.44(P<0.05),最大值从6.59降至5.98,降低了0.61(P<0.05),最小值则从5.87降至5.51,降低了0.36(P<0.05),且每日瘤胃液pH<5.5的持续时间由0 h延长至3.83 h(P<0.05)。根据SARA的定义(瘤胃液pH<5.5的持续时间大于3 h以上),饲粮NFC/NDF由1.40逐渐递增至3.23时,成功诱导了SARA。

表2 不同NFC/NDF饲粮对奶山羊瘤胃液pH的影响Table 2 Effects of different dietary NFC/NDF on rumen fluid pH in dairy goats
2.2 SARA对奶山羊血浆LPS浓度与细胞因子含量的影响
由表3可以看出,血浆中LPS浓度SARA组为0.77 EU/mL、恢复组为0.63 EU/mL,均高于对照组的0.59 EU/mL,但差异不显著(P>0.05)。与对照组相比,SARA组奶山羊血浆中TNF⁃α、IL⁃1β和IL⁃6含量呈升高趋势(P>0.05),IL⁃2含量显著升高(P<0.05),而IL⁃4、IL⁃8和IL⁃10含量呈降低趋势(P>0.05),IFN⁃γ含量显著降低(P<0.05)。恢复组TNF⁃α、IL⁃1β、IL⁃2、IL⁃6这些细胞因子的含量仍持续升高,IL⁃1β和IL⁃2含量显著高于SARA组和对照组(P<0.05),IL⁃8含量仍呈持续性降低趋势(P>0.05),IL⁃4和IFN⁃γ含量低于对照组略高于SARA组,差异不显著(P>0.05),IL⁃10含量与SARA组无差异,略低于对照组,但均无显著性差异(P>0.05)。
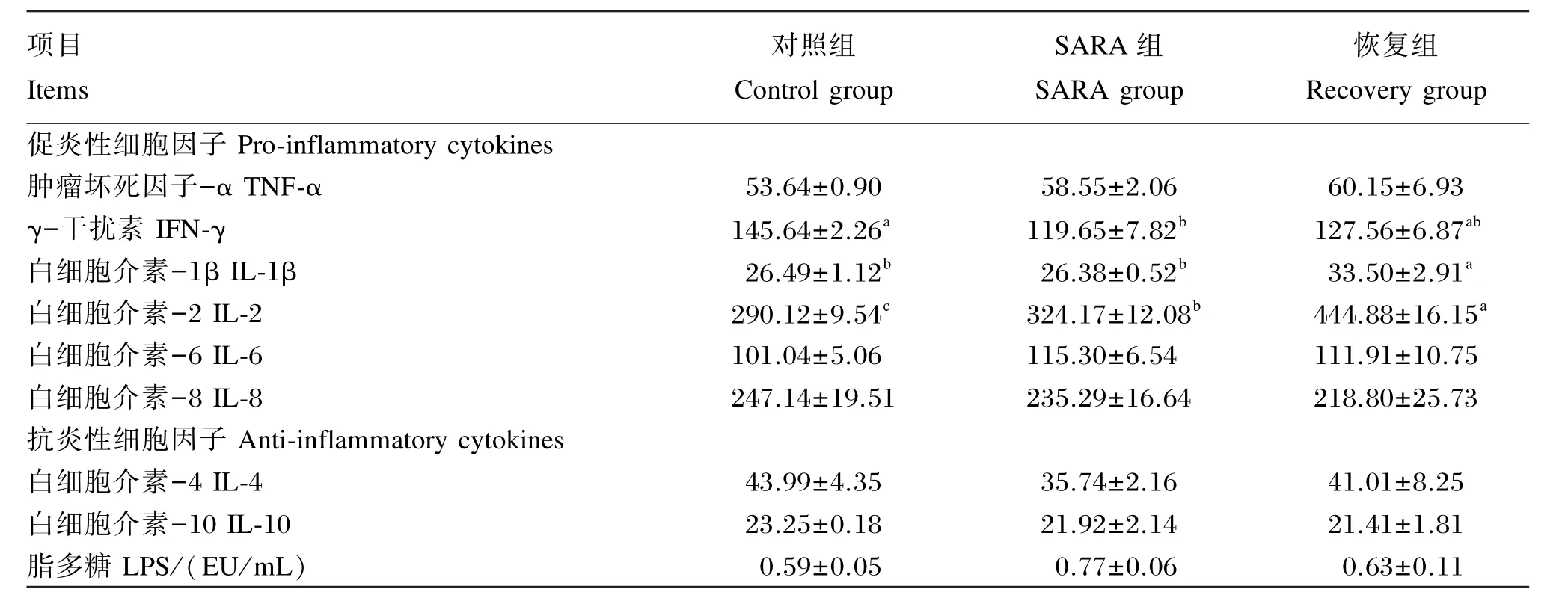
表3 SARA对奶山羊血浆脂多糖浓度与细胞因子含量的影响Table 3 Effects of subacute ruminal acidosis on levels of plasma LPS and cytokines in dairy goats ng/L
2.3 SARA对奶山羊血浆激素含量的影响
由表4可以看出,SARA组奶山羊血浆中GH、IGF⁃Ⅰ含量与对照组无显著差异(P>0.05),INS含量略低于对照组(P>0.05),PRL和COR含量显著高于对照组(P<0.05)。恢复组奶山羊血浆中GH、IGF⁃Ⅰ、INS含量与SARA组奶山羊基本一致(P>0.05),COR含量则回归到对照组水平(P>0.05),而PRL含量与SARA组一样维持较高水平(P>0.05)。血浆激素含量的变化说明SARA对血浆GH、IGF⁃Ⅰ含量没有影响,对INS含量影响很小,而主要影响了PRL和COR 2种激素的含量。

表4 SARA对奶山羊血浆激素含量的影响Table 4 Effects of subacute ruminal acidosis on plasma hormone contents in dairy goats
3 讨 论
3.1 饲粮NFC/NDF对瘤胃液pH的影响
SARA是一种以瘤胃液pH较低为典型特征的营养代谢病,因此常把瘤胃液pH作为衡量SARA发生与否及中毒程度最有效、最直接、最常用的指标[13]。瘤胃液pH长时间处于5.5~5.8之间为轻度SARA,pH长时间处于5.2~5.5之间为中度SARA,pH<5.2为急性瘤胃酸中毒[14]。Gozho等[15]研究认为,瘤胃液pH在5.2~5.6之间波动时间每天长达3~5 h可作为SARA发生的判定标准。本研究结果表明,随着饲粮NFC/NDF增加,瘤胃液pH下降速率和幅度随之增大,当饲粮NFC/NDF由1.40、1.79、2.31递增至3.23时,瘤胃液pH显著下降,饲喂NFC/NDF为3.23的饲粮2周后瘤胃液pH<5.5每日连续3 h以上,且pH<5.5曲线面积大于1,成功诱导了SARA的产生。作者及本研究团队前期研究表明,当饲粮NFC/NDF达2.58时,瘤胃液pH在5.2~5.5之间持续时间长达7.5 h以上[5,16]。出现以上差异的原因一方面可能是由于试验动物品种的不同,本试验选用的是莎能奶山羊,而前期研究选用的是关中奶山羊;另一方面可能由于饲粮营养水平及非纤维性碳水化合物(NFC)摄入量不同所致,本试验中当饲粮NFC/NDF=3.23时,NFC摄入量为577.5 g/d,而前期研究中NFC/NDF=2.58时,NFC摄入量为610.5 g/d。同时也可能与诱导时间长短不同有关,本试验诱导期为60 d,前期研究诱导期为40 d,诱导时间的长短与NFC摄入量不同可能是产生差异的关键。由于以上因素导致诱导SARA的严重程度不同,尽管在诱导SARA严重程度上存在差异,但这些研究结果皆表明,通过递增精料的方式饲喂奶山羊易发生SARA。
3.2 SARA对奶山羊血浆LPS浓度与细胞因子含量的影响
LPS是革兰氏阴性菌的细胞壁结构成分,是诱发炎症反应的主要致病成分。最近的许多研究均表明,饲喂高精料饲粮诱导反刍动物发生SARA时,瘤胃会产生大量细菌内毒素LPS,使瘤胃液中LPS浓度升高[1-6]。由于酸性环境和LPS的存在致使胃肠道黏膜上皮细胞屏障功能受损,上皮细胞通透性增加[17-18],LPS可通过感染受损的瘤胃上皮转运入血,使血液中的LPS浓度大幅增加,LPS激增反过来又会进一步加剧SARA的发展[1,15]。可见,LPS是参与SARA发病过程的主要致病因素之一。本试验研究结果表明,SARA组奶山羊血浆中LPS浓度(0.77 EU/mL)高于健康对照组(0.59 EU/mL),与作者前期研究及众多研究者报道相一致,进一步印证了LPS在SARA发病的关键作用。同时本试验研究结果显示,恢复组奶山羊血浆中LPS浓度(0.63 EU/mL)较SARA组虽有所下降但仍显著高于健康对照组,提示SARA引起奶山羊血浆中长时间含有高浓度LPS,必引起机体系统性炎症反应的存在。
细胞因子是一类由活化的淋巴细胞和单核巨噬细胞产生的一类非抗体、非补体的免疫活性介质,在调节免疫应答、炎症反应、物质代谢和神经内分泌等多个方面发挥着重要作用,它们构成了机体复杂的免疫调节网络。在医学研究中根据其在调节炎症反应等过程中致炎作用和抗炎作用,将其分为促炎性细胞因子与抗炎性细胞因子,IL⁃1、IL⁃2、IL⁃6、IL⁃17、IL⁃18、IL⁃23、IL⁃27、TNF⁃α、TNF⁃β、IFN⁃γ等属于促炎性细胞因子,主要由单核细胞以及巨噬细胞产生,参与细胞免疫反应;抗炎性细胞因子包括IL⁃4、IL⁃10和IL⁃13等,主要由T细胞产生,参与体液免疫反应[19]。在促炎性细胞因子中,TNF⁃α是机体应激反应中产生最早且作用最重要的炎性细胞因子,TNF⁃α不仅能介导LPS的多种生物学效应,而且通过诱导其他炎症介质的协同作用,扩大其生物学效应,从不同环节在体内产生炎性反应和组织损伤。许多研究结果证实,机体在受到LPS刺激后,体内TNF⁃α含量升高,这与本试验结果一致。IFN⁃γ是机体细胞经病毒诱导而产生的一种重要的细胞因子,具有抗病毒、抗肿瘤和免疫调节作用[20]。本试验中SARA组奶山羊血浆IFN⁃γ含量显著低于健康奶山羊,这可能是奶山羊容易发生细菌感染的重要原因。IL⁃1是一种具有炎症介导活性和免疫调节作用的细胞因子,以IL-1α和IL⁃1β 2种形式存在,其中IL⁃1β属于介导炎症反应的前炎症介质。IL⁃2是细胞免疫调节中重要的细胞因子,其含量的高低是机体细胞免疫水平的重要标志[21]。IL⁃6是一种促炎递质,大量产生会加剧体内炎性反应,甚至导致一些疾病的恶化。IL⁃8是奶牛体内发生炎症反应的重要趋化因子。在抗炎性细胞因子中,IL⁃4是一种重要的免疫活性调节因子,是B细胞增殖活化,合成产生免疫球蛋白E(IgE)的绝对必需因子,最大用途是作为Th2细胞的标志性因子,其含量显著升高提示机体免疫处于Th2细胞主导状态;IL⁃10是炎症和免疫反应的强有力控制者,可下调IL⁃2、IFN⁃γ等促炎性细胞因子,具有广泛的免疫抑制活性[22]。以往研究表明,进入机体中的LPS能刺激单核巨噬细胞释放大量的细胞因子,如TNF⁃α、IL⁃1、IL⁃6、IL⁃8等,这些细胞因子会引起“瀑布式炎症级联反应”,造成细胞和器官的多种损伤。在本试验中,SARA发生使血液中LPS浓度增加,机体受到LPS刺激后,使促炎性细胞因子IL⁃1β、IL⁃6和TNF⁃α含量升高,IL⁃2含量显著升高,IL⁃8含量降低,IFN⁃γ含量显著降低;同时使抗炎性细胞因子IL⁃4、IL⁃10含量下降,但差异不显著,总体表现为促炎作用,机体免疫处于细胞免疫主导状态。且自然恢复组中TNF⁃α、IL⁃1β、IL⁃2、IL⁃6这些促炎性细胞因子仍持续性升高,特别是IL⁃1β和IL⁃2含量显著升高,出现过度的炎症反应,并持续性引起组织损伤,进一步加重对机体的损害。这些试验结果提示,SARA影响了机体的免疫功能,使细胞免疫起主导作用,促进了炎性细胞因子的大量分泌,引起促炎性细胞因子与抗炎性细胞因子的失衡,使动物长期处于免疫应激状态。
3.3 SARA对奶山羊血浆内分泌激素含量的影响
动物血液激素水平在某种程度上可反映动物生理调节特点。在本试验中,血浆中GH、IGF⁃Ⅰ和INS 3种激素含量各组间差异均不显著,从数值上看,对照组、SARA组、恢复组奶山羊血浆GH、IGF⁃Ⅰ含量呈依次升高趋势,但几乎接近,INS含量呈降低趋势,SARA组和恢复组INS含量几乎一致,表明SARA对血浆中GH和IGF⁃Ⅰ2种激素含量没有影响,对INS含量影响很小,这与张树坤等[23]报道的泌乳期山羊发生SARA时血浆IGF⁃I、INS含量变化较大,GH含量变化不大的研究结果不一致,这可能与SARA诱导方式、严重程度不同等有关。INS是调节三大营养物质代谢、降低血糖的重要激素。本试验中SARA引起INS含量呈降低趋势,INS这种变化可能与SARA导致机体发生炎症反应,抑制了营养物质的代谢,从而应对外界的不良环境有关。本试验中SARA对血浆PRL和COR含量产生了显著影响。PRL是由下丘脑分泌的,是机体免疫-神经-内分泌调节网络中的一个非常重要的激素,对淋巴细胞的增殖有着促进的作用,其含量升高有利于免疫反应的发生[24]。本试验中,SARA组奶山羊血浆PRL含量显著高于健康对照组,且自然恢复组仍维持较高PRL含量,这与张树坤等[23]报道,泌乳期山羊处于SARA状态时其血浆PRL含量升高的研究结果接近,表明在SARA条件下,机体的免疫水平增强,积极对抗应激反应。COR是体内重要的应激和代谢激素,不仅参与机体内分泌调节,而且与动物的免疫功能和炎症反应密切相关,其含量升高有利于动物抵御应激反应,特别是针对由炎症引起的应激反应。本试验中,SARA组奶山羊血浆COR含量均显著高于健康对照组,这与贾媛媛等[6]所报道的采用高精料饲粮诱导泌乳期山羊发生SARA时血浆COR含量明显升高的研究结果相一致,COR这种变化可能与下丘脑-垂体-肾上腺皮质轴(hypo⁃thalamie⁃pituitary⁃adrenalaxis,HPA)被激活有关。Sapolsky等[25]指出,LPS引起机体免疫反应,免疫细胞释放大量细胞因子,部分细胞因子能够影响下丘脑-垂体-肾上腺的内分泌功能,最终导致血浆COR含量升高,从而有利于机体及早消除血浆中的LPS。血液中COR含量升高可作为评价HPA激活的标志,本试验中SARA组奶山羊血浆COR含量显著升高,但恢复组COR含量又回归到健康对照组水平,这些结果提示SARA期奶山羊HPA被激活,使COR分泌显著增加,此时机体处于一种应激状态,随着时间的进一步延长,机体从应激中有所恢复,HPA反应降低,进而导致COR分泌减弱,逐渐恢复到正常水平。
4 结 论
递增饲粮NFC/NDF方式诱导奶山羊发生SARA,伴随血浆中LPS浓度升高,不仅影响了机体免疫功能,使细胞免疫处于主导作用,促进了炎性细胞因子持续性大量分泌,机体产生慢性炎症,同时影响了内分泌激素含量,引起内分泌紊乱,这些变化导致机体长期处于应激状态,从而可能造成奶山羊对疾病的易感性增加,以致损害奶山羊的健康与生产性能。
参考文献:
[1] KHAFIPOUR E,KRAUSE D O,PLAIZIER J C.A grain⁃based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflam⁃mation[J].Journal of Dairy Science,2009,92(3):1060-1070.
[2] GOZHO G N,KRAUSE D O,PLAIZIER J C.Rumen lipopolysaccharide concentration and inflammatory re⁃sponse during grain⁃induced subacute ruminal acidosis in dairy cows[J].Journal of Dairy Science,2007,90 (2):856-866.
[3] LI S,KHAFIPOUR E,KRAUSE D O,et al.Effects of subacute ruminal acidosis challenges on fermentation and endotoxins in the rumen and hindgut of dairy cows[J].Journal of Dairy Science,2012,95(1):294-303.
[4] GOZHO G N,KRAUSE D O,PLAIZIER J C.Rumen lipopolysaccharide and inflammation during grain ad⁃aptation and subacute ruminal acidosis in steers[J].Journal of Dairy Science,2006,89(11):4404-4413.
[5] 胡红莲,刘大程,卢德勋,等.日粮不同非纤维性碳水化合物与中性洗涤纤维的比值对奶山羊瘤胃液和血液中内毒素、组织胺含量的影响[J].中国畜牧兽医,2012,39(3):104-109.
[6] 贾媛媛,王绍庆,常广军,等.高精料诱导的SARA对泌乳期山羊血液和瘤胃液中皮质醇的影响[J].草业学报,2012,21(4):259-266.
[7] SRISKANDAN S,ALTMANN D M.The immunology of sepsis[J].The Journal of Pathology,2008,214 (2):211-223.
[8] ZEBELI Q,AMETAJ B N.Relationships between ru⁃men lipopolysaccharide and mediators of inflammatory response with milk fat production and efficiency in dairy cows[J].Journal of Dairy Science,2009,92 (8):3800-3809.
[9] PLAIZIER J C,KHAFIPOUR E,LI S,et al.Subacute ruminal acidosis(SARA),endotoxins and health con⁃sequences[J].Animal Feed Science and Technology,2012,172(1/2):9-21.
[10] JOHNSON R W,PROPES M J,SHAVIT Y.Corticos⁃terone modulates behavioral and metabolic effects of lipopolysaccharide[J].American Journal of Physiolo⁃gy,1996,270(1):R192-R198.
[11] ALLEN M S.Effects of diet on short⁃term regulation of feed intake by lactating dairy cattle[J].Journal of Dairy Science,2000,83(7):1598-1624.
[12] 胡红莲.奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2008:26.
[13] NOCEK J E,ALLMAN J G,KAUTZ W P.Evaluation of an indwelling ruminal probe methodology and effect of grain level on diurnal pH variation in dairy cattle [J].Journal of Dairy Science,2002,85(2):422-428.
[14] PENNER G B,BEAUCHEMIN K A,MUTSVANG⁃WA T.Severity of ruminal acidosis in primiparous Holstein cows during the periparturient period[J].Journal of Dairy Science,2007,90(1):365-375.
[15] GOZHO G N,PLAIZIER J C,KRAUSE D O,et al.Subacute ruminal acidosis induces ruminal lipopo⁃lysaccharide endotoxin release and triggers an inflam⁃matory response[J].Journal of Dairy Science,2005, 88(4):1399-1403.
[16] 邬宇航.亚急性瘤胃酸中毒对瘤胃、瓣胃上皮细胞增殖与凋亡的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2013.
[17] CHIN A C,FLYNN A N,FEDWICK J P,et al.The role of caspase⁃3 in lipopolysaccharide⁃mediated dis⁃ruption of intestinal epithelial tight junctions[J].Cana⁃dian Journal of Physiology and Pharmacology,2006,84(10):1043-1050.
[18] 杨淑青.亚急性瘤胃酸中毒对奶山羊瘤胃上皮屏障功能影响机制的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2014.
[19] 杨勇,张巍,王丽英.炎症性肠病免疫发病机制的研究进展[J].中国实验诊断学,2012,16(1):181-183.
[20] SEN G C.Viruses and interferons[J].Annual Review of Microbiology,2001,55:255-281.
[21] ANTONY P A,PAULOS C M,AHMADZADEH M,et al.Interleukin⁃2⁃dependent mechanisms of tolerance and immunity in vivo[J].The Journal of Immunolo⁃gy,2006,176(9):5255-5266.
[22] 彭树灵,杨淑君.九味白术汤对实验性溃疡性结肠炎大鼠血清白介素-1β及白介素-10的影响[J].中国医药导报,2013,10(19):40-42.
[23] 张树坤,姜雪元,谢正露,等.精料饲喂对泌乳山羊血浆激素水平及产乳性能的影响[J].畜牧与兽医,2012,44(增刊):142.
[24] ARKINS S,DANTZER R,KELLEY K W.Somatolac⁃togens,somatomedins,and immunity[J].Journal of Dairy Science,1993,76(8):2437-2450.
(责任编辑 王智航)
[25] SAPOLSKY R M,ROMERO L M,MUNCK A U.How do glucocorticoids influence stress responses?Integrating permissive,suppressive,stimulatory,and preparative actions[J].Endocrine Reviews,2000,21 (1):55-89.
Effects of Subacute Ruminal Acidosis on Plasma Cytokine and Hormone Contents in Dairy Goats
HU Honglian1XIE Tianyu2YANG Shuqing2GAO Min1YAO Yanchu3∗
(1.Institue of Animal Nutrition and Feed,Inner Mongolia Academy of Agricultural&Animal Husbandry Sciences,Hohhot 010031,China;2.College of Animal Science,Inner Mongolia Agriculture University,Hohhot 010018,China;3.Institute of Animal Nutrition,Chongqing Academy of Animal Sciences,
Chongqing 402460,China)
∗Corresponding author,associate professor,E⁃mail:yc1223@163.com
Abstract:This experiment was conducted to investigate the effects of subacute ruminal acidosis(SARA)in⁃duced by gradually increasing dietary non⁃fiber carbohydrate/neutral detergent fiber ratios(NFC/NDF)on plasma hormone and cytokine contents in dairy goats.Nine healthy lactating Saanen dairy goats with similar body weight were randomly allocated to three groups(control group,SARA group and recovery group,n=3).Dairy goats in control group were fed a basal diet;those in SARA group and recovery group were fed diets with different NFC/NDF(1.40,1.79,2.31 and 3.23,respectively,each for 15 days),which gradually in⁃duced SARA;those in recovery group were ad libitum fed green hay for 30 days after SARA.The three goats in control group were slaughtered on days 30,60(together with SARA goup)and 90 of feeding(together with recovery group).The results showed as follows:1)plasma lipopolysaccharide(LPS)concentration was increased for a long time as a result of SARA challenge,and there was no significant difference between SARA group and recovery group(P>0.05).2)Compared with control group,the contents of plasma tumor necrosis factor⁃α(TNF⁃α),interleukin(IL)⁃1β and IL⁃6 tended to be increased(P>0.05),and IL⁃2 content was significantly increased(P<0.05),but interferon⁃γ(IFN⁃γ)content was significantly decreased(P<0.05),and the contents of plasma IL⁃4,IL⁃8 and IL⁃10 tended to be decreased in SARA group(P>0.05);the con⁃tents of plasma growth hormone,insulin⁃like growth factor⁃Ⅰand insulin were not changed(P>0.05),and the contents of prolactin and cortisol were significantly increased(P<0.05).3)Compared with SARA group,the contents of plasma TNF⁃α,IL⁃1β,IL⁃2,IL⁃6 in recovery group were still persistently increased,in which IL⁃1β and IL⁃2 contents were significantly increased(P<0.05);plasma prolactin content stayed at the same level as SARA group(P>0.05),and plasma cortisol content was back to the same level as control group(P>0.05).These results indicate that SARA can increase plasma LPS concentration of dairy goats,which can lead to systemic immune and inflammatory responses,endocrine hormones alterations.These changes will result in stress of dairy goats for a long time.[Chinese Journal of Animal Nutrition,2015,27(2):418⁃425]
Key words:SARA;dairy goat;cytokine;hormone
通信作者:∗姚焰础,副研究员,E⁃mail:yc1223@163.com
作者简介:胡红莲(1977—),女,内蒙古乌拉特前旗人,副研究员,博士,主要从事反刍动物营养调控技术研究。E⁃mail:honglianhu2010@163.com
基金项目:国家自然科学基金项目(31101739);现代农业(奶牛)产业技术体系建设专项资金(CARS⁃37)
收稿日期:2014-09-02
doi:10.3969/j.issn.1006⁃267x.2015.02.012
文章编号:1006⁃267X(2015)02⁃0418⁃08
文献标识码:A
中图分类号:S826

