黄枝油杉ISSR-PCR反应体系的建立与优化
谢伟玲, 柴胜丰, 蒋运生, 唐健民, 邹 蓉, 韦 霄
(1.广西喀斯特植物保育与恢复生态学重点实验室,广西壮族自治区中国科学院广西植物研究所, 桂林541006;2.广西师范大学生命科学院, 桂林541004)
黄枝油杉(Keteleeria calcarea Cheng et L.K.Fu)系松科(Pinaceae)油杉属(Keteleeria)常绿乔木[1],是我国特有的珍稀濒危树种、国家三级保护植物[2],主要分布于我国贵州南部、广西北部和湖南江永县等地。因其树形美观、耐干旱,可用于庭院和石山绿化;树干通直、木材坚硬,可用于造船、建筑和家具等[3],具有较高的研究价值和实用性。
ISSR是基于PCR技术、以简单重复序列为引物的一种分子标记技术,1994年由Zietkiewicz等[4]提出,具有多态性水平高、产物特异性强、DNA用量少以及稳定性好等优点。已广泛应用于构建遗传图谱、植物品种鉴定、遗传多样性和亲缘关系以及基因定位等方面的研究[5-7]。
虽然ISSR分子标记技术原理简单,但不同的物种适合的反应条件不同。因此,在对黄枝油杉进行ISSR分析之前,首先要优化ISSR-PCR反应条件和程序。本试验先运用正交设计进行初步筛选,再用单因素设计逐一优化对ISSR-PCR扩增效果有影响的Mg2+、Taq DNA 聚合酶、dNTP、引物、模板 DNA、循环次数及退火温度。建立了黄枝油杉的最佳反应体系和程序,为进一步研究黄枝油杉种群的遗传多样性奠定了基础。
1 材料与方法
1.1 材 料
2014年9月至12月,分别在桂林临桂县沉桥村(L)、桂林恭城县三江乡(G)、贺州富川县栎尾村(F)、柳州融水县都木(R)、河池南丹县里湖乡(N)、贵州平塘县者密镇(P)、贵州独山县尧棒乡(D)共7个黄枝油杉分布地采集生长良好的、健康的黄枝油杉叶片,硅胶干燥保存。样品经广西植物研究所蒋运生研究员鉴定。
1.2 试剂与仪器
ISSR-PCR 引物(引物855序列为:ACA CAC ACA CAC ACA CYT,Y=C,T)、Mg2+、dNTP、Taq DNA聚合酶、10×PCR buffer、DNA Marker S(生工生物工程(上海)股份有限公司);PCR仪(美国BIORAD伯乐公司,Model:PTC-200);NanoDrop 2000c超微量分光光度计(赛默飞世尔科技);CDYY-6C型电泳仪(北京市六一仪器厂);UVP凝胶成像系统;离心机(珠海黑马医学仪器有限公司);DYCP-34型电泳槽(北京市六一仪器厂)。
1.3 方 法
1.3.1 黄枝油杉总DNA的提取
采用CTAB法提取黄枝油杉的总DNA,但在水浴前用-20℃预冷的丙酮洗2次[8]。用浓度为0.8%的琼脂糖凝胶电泳检验DNA的质量和完整性,DNA的纯度和浓度用NanoDrop 2000c超微量分光光度计检测,存储在-20℃冰箱备用。
1.3.2 ISSR-PCR反应体系正交试验
用正交试验设计(L16(45))来初步确定各因素之间扩增效果较好的水平组合,研究的5个因素分别为Mg2+、Taq DNA 聚合酶、dNTP、引物、模板 DNA,每个因素设定4个梯度的浓度,具体见表1、表2。除表中的5个因素及其不同的浓度外,每个体系还含有2.5 μL 10×PCR buffer,其余的用灭菌的ddH2O补够25 μL,每个处理设置3次重复,选用引物855(序列为ACA CAC ACA CAC ACA CYT,Y=C,T)。
预扩增程序为94℃预变性5min;94℃变性30s,50℃退火45s,72℃延伸90s,以上3个步骤循环40次;最后72℃延伸7min。PCR扩增产物用浓度为1.5%的琼脂糖凝胶电泳1~1.5h,溴化乙锭(0.5μg/mL)染色20min,用UVP凝胶成像系统拍照保存。

表1 ISSR-PCR反应体系正交试验的各因素与水平
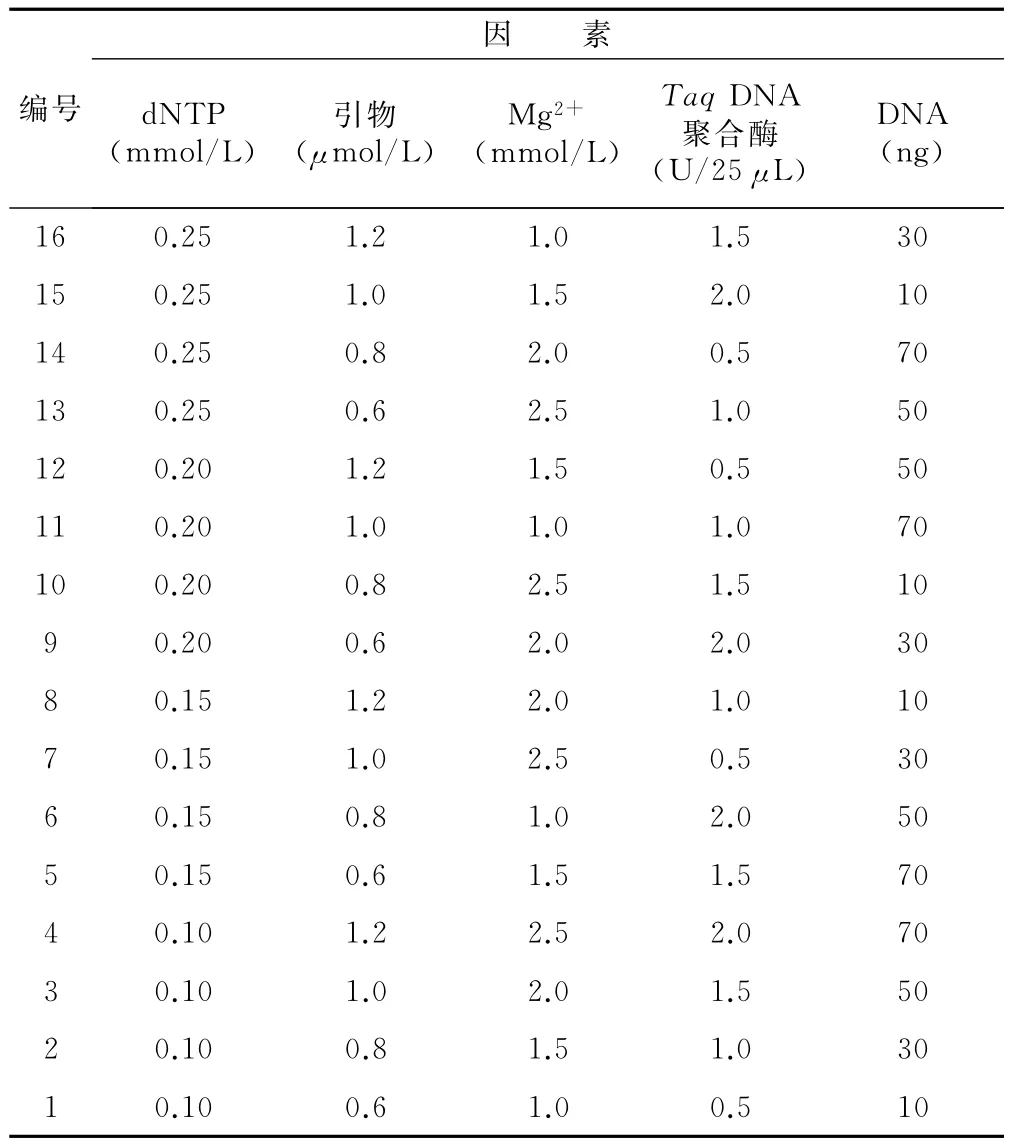
表2 ISSR-PCR正交试验L16(45)
1.3.3 ISSR-PCR反应体系单因素试验
根据正交试验的结果初步选出扩增条带最清晰的组合进行单因素试验,以该组合为基础,改变其中一个因素的浓度(改变的浓度采用相应因素设定的6个梯度浓度),而其他因素及其浓度不变,每一个因素确定最佳浓度后,以该最佳浓度进行下一步研究,直到所有因素的最佳浓度被确定。每个因素设定6个梯度浓度,Mg2+浓 度 为 3.0,2.5,2.0,1.5,1.0,0.5mmol/L;Taq DNA 聚合酶浓度为2.5,2.0,1.5,1.0,0.5,0.25U/25μL;dNTP 为 0.30,0.25,0.20,0.15,0.10,0.05 mmol/L;引物为1.4,1.2,1.0,0.8,0.6,0.4μmol/L;模板DNA为90,70,50,30,10,5ng。每个处理至少重复2次。
1.3.4 优化ISSR-PCR反应程序
通过正交试验和单因素试验确定反应体系后,优化退火温度及循环次数。退火温度的设定范围为引物的理论退火温度的正负5℃,如(51±5)℃,PCR仪便会自动形成12个温度:56.0,55.7,55.0,54.0,52.8,51.6,50.4,49.2,48.0,47.0,46.3,46.0 ℃;循 环 次 数 设为50、45、40、35、30、25次。以上每个处理至少重复2次。
1.3.5 验证反应体系和程序
从黄枝油杉的每个居群中随机选取2个个体的DNA样品,用已确定的反应体系及程序进行扩增,检验扩增效果的好坏及其稳定性。
2 结果与分析
2.1 ISSR-PCR正交试验结果
ISSR-PCR正交试验结果见图1。如图1所示,组合1、2、5、6、13、16扩增条带少,且强度弱;组合3、4、7扩增出来的条带强度弱,而且背景模糊;虽然组合8、9、10、12、14、15的条带较多,但强度弱,而且背景模糊,弥散难辨;组合11扩增出来的条带多且效果好,背景清晰,条带清晰可辨。故选用组合11进行下一步研究。即25μL的反应体系中含有 Mg2+1.0mmol/L、Taq DNA 聚合酶1.0U/25μL、dNTP 0.2mmol/L、引物1.0μmol/L、模板DNA 70ng。

图1 ISSR-PCR正交试验结果
2.2 Mg2+浓度与ISSR-PCR扩增效果的关系
Taq DNA聚合酶在PCR反应中的作用可直接受Mg2+浓度的影响,而且非常敏感[9]。如图2所示,组合1~3(Mg2+0.5~1.5mmol/L)几乎没有扩增产物;随着Mg2+浓度升高,条带数量和清晰度先是增加,后下降;当Mg2+的浓度为2.0mmol/L时扩增出来的条带最多,也最清晰,扩增效果最好,故选择2.0mmol/L的Mg2+浓度进行下一步研究。

图2 不同Mg2+浓度的ISSR-PCR扩增结果
2.3 dNTP浓度与ISSR-PCR扩增效果的关系
底物dNTP浓度过高,会导致聚合酶错误掺入,浓度过低,产物合成率低[10]。如图3所示,每个处理都可以扩增出条带,但dNTP浓度过高或过低的扩增条带数量少而且强度弱,随着dNTP浓度的逐渐升高,条带的清晰程度与数量呈现先升后降的趋势。浓度为0.10mmol/L时效果最好,故选择0.10mmol/L为dNTP的最佳浓度。
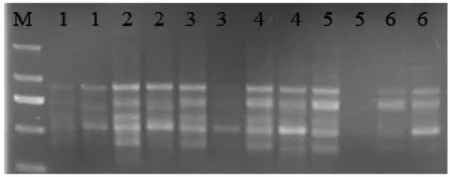
图3 不同dNTP浓度的ISSR-PCR扩增结果
2.4 Taq DNA聚合酶用量与ISSR-PCR扩增效果的关系
Taq DNA聚合酶用量过多,容易扩增出非特异性产物,而且成本高;但用量过少又会导致产物合成效率降低[10]。如图4所示,25μL体系中,Taq DNA 聚合酶用量为0.25~1.0U时,几乎没有扩增产物;Taq DNA聚合酶用量大于2.0U时,扩增条带少,背景模糊;故选择1.5UTaq DNA聚合酶为最佳用量。
2.5 引物浓度与ISSR-PCR扩增效果的关系
引物浓度过低,扩增产物少;而浓度过高时,不仅成本较高,而且容易形成引物二聚体[11]。如图5所示,每个处理均有扩增产物,引物浓度逐渐增加,扩增条带的数目先逐渐增加后减少。引物浓度为0.4,0.6,0.8,1.4μmol/L时,扩增条带少;当引物的浓度为1.0,1.2μmol/L时,虽然扩增出来的条带数目相同,但前者的条带和背景都较后者的清晰。故而选择1.0 μmol/L的引物浓度继续下一步研究。

图4 不同Taq DNA聚合酶用量的ISSR-PCR扩增结果

图5 不同引物浓度的ISSR-PCR扩增结果

图6 不同模板DNA浓度的ISSR-PCR扩增结果
2.6 模板DNA浓度与ISSR-PCR扩增效果的关系
过低含量的模板DNA,没有扩增产物或扩增产物不稳定;模板含量过高,非特异性产物合成率增加[12]。如图6所示,除10ng/25μL没有扩增产物外,其余处理均有扩增产物。处理1、处理5、处理6(5,70,90ng/25μL)扩增条带较少,强度较弱;处理3、处理4(30,50 ng/25μL)扩增效果相当,选择30ng/25μL为模板DNA最佳浓度。
2.7 循环次数与ISSR-PCR扩增效果的关系
如图7所示,PCR扩增反应循环25次时,没有扩增产物或扩增产物的量很少,导致检测不出来;当循环次数为30、35、40、45时,扩增产物的量较少,而且扩增条带少,强度弱;当循环次数为50次时,扩增产物的量足够,扩增条带数目较多,故选择50次为最佳循环次数。
2.8 引物的退火温度与ISSR-PCR扩增效果的关系
如图8所示,过低或过高的引物退火温度扩增出来的条带数量都较少,而且条带强度弱,背景模糊;退火温度为50.4℃时,扩增条带最多,主带明显,副带清晰。故选择50.4℃为该引物的最适退火温度。同样地,通过温度梯度筛选的方法确定其他引物的最佳退火温度。

图8 引物的不同退火温度的ISSR-PCR扩增结果
2.9 ISSR-PCR反应体系的验证
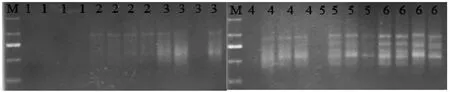
图7 不同循环次数的ISSR-PCR扩增结果
从黄枝油杉7个居群分别随机选取2个个体的DNA样品对优化获得的最佳反应体系及扩增程序进行检验,结果见图9。由图9可见:除贵州平塘县者密镇居群(P)没有扩增出条带,其余各居群均有扩增产物。没有扩增产物的部分样品,可能的原因是加入反应体系的DNA很少或者没有,导致扩增产物很少,检测不出来,或者没有扩增产物。有扩增产物的样品,扩增效果较好,条带数目、清晰度均较佳,可见建立的反应体系和扩增程序不仅稳定,还具有较高的检测能力。

图9 不同居群的黄枝油杉样品扩增效果
3 讨 论
虽然ISSR分子标记具有多态性水平高、产物特异性强、稳定性好、DNA用量少等优点,但是ISSR扩增易受Taq DNA聚合酶、Mg2+、引物、退火温度等因素的影响,不同的物种,各组分所需的浓度也不同。因此,在对一个物种进行遗传多样性分析前有必要对反应体系和程序进行优化,以保证扩增出来的条带清晰、重复性好。前人大多数是采用单一的单因素设计法或正交设计法来优化ISSR-PCR反应体系。精细地研究各因素的影响是单因素设计的优点,但不能分析各因素之间的相互作用;快速地分析各因素之间的相互作用是正交设计法的一大优点,但其处理水平有限,而且结果不够精细[13-15],而且工作量大。本研究将这2种方法结合起来使用,恰能互补,既可以精细地研究各因素的影响,还考虑到了各因素之间的相互作用,使结果更精确、更可靠,从而快速准确地建立了黄枝油杉ISSR-PCR反应体系,即25μL体系中含2.0mmol/L的 Mg2+、1.5UTaq DNA 聚合酶、0.10mmol/L 的dNTP、1.0μmol/L的引物、30ng的模板 DNA 以及2.5μL 10×PCR buffer,其余的用灭菌的ddH2O补够25μL。
此外,ISSR-PCR扩增效果还受扩增程序中的循环次数和引物的退火温度的影响。在一定范围内,循环次数增加,产物合成率也随之增加[10]。但循环次数过多,非特异性产物合成率也会随之增加[16]。退火温度过低或过高,扩增条带少、强度弱、背景模糊,退火温度过高还会扩增出非特异性条带。为了提高扩增的特异性,在扩增效果结果差不多的几个退火温度中,应选择较高的退火温度作为最佳退火温度[17]。故本研究选择50次为最佳循环次数,最终确定的扩增程序为:94℃预变性5min;94℃变性30s,48~56℃(不同的引物,其退火温度不同,根据具体引物而定)退火45s,72℃延伸90s,以上3个步骤循环50次;最后72℃延伸7min;4℃保存扩增产物。
[1]何平.珍稀濒危植物保护生物学[M].云南:西南师范大学出版社,2005.
[2]国家环境保护局.中国珍稀濒危保护植物名录[M].北京:科学出版社,1987.
[3]黄立铨.石山绿化优良树种——黄枝油杉[J].广西植物,1982,2(2):98,103-104.
[4]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[5]朴红梅,李万良,穆楠,等.ISSR标记的研究与应用[J].吉林农业科学,2007,32(5):28-30.
[6]王建波.ISSR分子标记及其在植物遗传学研究中的应用[J].遗传,2002,24(5):613-616.
[7]李海生.ISSR分子标记技术及其在植物遗传多样性分析中的应用[J].生物学通报,2004,39(2):19-20.
[8]代文娟.资源冷杉的保护遗传学研究[D].桂林:广西师范大学,2006:8-9.
[9]邹喻苹,葛颂,王晓东.系统与进化植物学中的分子标记[M].北京:科学出版社,2001:36-41,68.
[10]周俊亚,宾晓芸,彭云滔,等.罗汉果ISSR-PCR反应体系的建立[J].广西师范大学学报(自然科学版),2004,22(3):81-84.
[11]李忠超.特有濒危植物八角莲遗传多样性研究[D].杭州:浙江大学,2002:57-58.
[12]卢圣栋.现代分子生物实验技术(2版)[M].北京:中国协和医科大学出版社,1999:458-463.
[13]廖丽,郭巧生.夏枯草ISSR分子标记技术的建立与体系优化[J].中草药,2009,40(7):1 131-1 135.
[14]史艳财,邹蓉,孔德鑫,等.战骨ISSR-PCR反应条件的筛选与优化[J].种子,2011,30(7):31-34.
[15]唐健民,陈宗游,韦霄,等.东兴金花茶SSR-PCR反应体系的优化及引物筛选[J].基因组学与应用生物学,2014,33(2):398-404.
[16]刘立军,孙珍夏,彭定祥.苎麻ISSR-PCR体系的优化[J].中国农学通报,2006,22(7):64-68.
[17]余艳,陈海山,葛学军.简单重复序列区间(ISSR)引物反应条件优化与筛选[J].热带亚热带植物学报,2003,11(1):15-19.

