乌贼墨黑色素对铅中毒小鼠的排铅作用及其对体内钙、锌和铜含量的影响*
吕 玲 李和生 郑 丽 李 密 金 洋
(宁波大学海洋学院 宁波 315211)
乌贼(Cuttlefish)本 名乌 鲗 , 通常也称墨鱼, 属于软体动物门(Phylum Mollusca)、头足纲(Class Cephalopode)、乌贼目(Sepioidea Naef)的海洋动物(李和生等, 2012)。它是我国近海主要的头足类动物, 是我国四大海洋渔业之一, 年产量为145万吨左右。乌贼具有较高的经济价值(吴常文等, 2010)和营养价值,除了乌贼肉为可食部分(大约为 80%), 内脏、皮以及墨汁均视为加工废弃物, 通常的处理方法为就地掩埋,这不仅浪费资源, 还可能会污染人类的生活环境。
铅是常见重金属元素之一, 不仅污染环境, 而且严重危害人类健康, 尤其是儿童。铅易通过消化道和呼吸道进入人体, 其半衰期长, 对人体内各个系统均有毒害作用, 特别是对儿童神经系统造成损伤, 导致其神经性心理障碍(Campbell et al, 2011)甚至影响智力发育(Pichery et al, 2011; Yuan et al, 2006)。目前, 常用的排铅药物主要是 EDTA类金属螯合剂和二巯基丁二酸类竞争性解毒剂。这些药物排铅效果明显, 但副作用较大, 经常出现过敏反应以及体内微量元素的流失(陈自然, 2012)甚至致死。因此, 寻找一种天然安全的排铅产品具有重要意义。
目前, 黑色素的应用已成为研究热点(Araújo et al, 2014; Fernandez et al, 2014; Petrosyan et al, 2014),它有抗氧化(Cuevas-Juárez et al, 2014)、抗辐射(Ye et al, 2014)等多种生理活性, 还有学者发现黑色素能够吸附重金属离子(Hong et al, 2006; Saini et al, 2013)。而乌贼墨的化学成分主要是黑色素, 结构中存有-COOH、-NH2和-OH 基团, 可与金属结合。有研究表明, 乌鸡黑色素对果蝇体内的铅有明显的促排作用(王哲鹏等, 2007); 有学者将合成黑色素喂食于小鼠, 结果表明小鼠体内锌离子和钴离子的分布及排出有显著变化(Nogaj et al, 1995); 然而对乌贼墨在排铅及对微量元素的影响方面还鲜为报道。因此, 本实验利用乌贼墨黑色素对铅中毒小鼠进行灌胃治疗,研究其排铅效果和对铅中毒小鼠体内微量元素的影响, 为天然安全脱毒剂的研究提供一定的基础, 同时也为水产品废弃物的开发利用提供理论基础。
1 材料与方法
1.1 实验材料与主要仪器
1.1.1 原料 金乌贼(Sepia esculenta), 购于宁波路林市场。
1.1.2 试剂 醋酸铅(上海化学试剂总厂); 浓硝酸(国药集团化学试剂有限公司); 高氯酸(天津市鑫源化工有限公司); 碱性蛋白酶(江苏锐阳生物科技有限公司); 二巯基丁二酸(上海晶纯生化科技股份有限公司); 实验用水均为超纯水。
1.1.3 仪器和设备 GL-21MC型冷冻离心机(长沙湘仪离心机设备有限公司), SCIENTZ- 18N型冷冻干燥机(宁波新芝生物科技股份有限公司), KDN-08型消化炉(上海新嘉电子有限公司), TAS-990型原子吸收分光光度计(北京普析通用仪器有限责任公司),DK型电热恒温水浴锅(上海精宏实验设备有限公司),AFX-2001-U超纯水机(上海纯浦实业有限公司)。
1.1.4 实验动物 20—24g ICR 小鼠(清洁级), 由宁波大学医学院动物中心提供, 合格证编号:No.201403447。
1.2 乌贼墨黑色素的提取
实验室自制金乌贼墨黑色素, 采用酶法(李晓等,2010)提取。取墨囊, 挤墨汁→用0—4°C等体积水浸泡过夜→10000r/min离心10min→冷冻干燥→于粉末中加超纯水(质量比1:50)→调节pH至7.4→加入碱性蛋白酶 4200U/g→50°C 保温酶解 8h→90°C 加热10min使酶失活→10000r/min离心10min→反复离心水洗4次→沉淀物冷冻干燥→得到乌贼墨黑色素。
1.3 动物实验方法
1.3.1 动物分组及铅模型的建立 选取 20—24 g的雄性ICR小白鼠48只, 随机分成6组, 每组8只小鼠, 各组名称分别为阴性对照组, 醋酸铅模型对照组(简称模型对照组), 醋酸铅-乌贼墨黑色素低剂量组(简称低墨组)、醋酸铅-乌贼墨黑色素中剂量组(简称中墨组)、醋酸铅-乌贼墨黑色素高剂量组(简称高墨组)以及阳性对照组(醋酸铅-DMSA)。之后, 除阴性对照组外其余各组每日腹腔注射醋酸铅溶液, 剂量为7mg/kg, 连续注射 10d, 建立铅中毒模型。阴性对照组每日注射等量超纯水, 每组每日自由进标准饲料,自由饮水。
1.3.2 给药方法 铅中毒模型建立后, 用不同剂量的乌贼墨黑色素悬浮液以及二巯基丁二酸溶液灌胃排出小鼠体内的铅离子。其中, 低墨组、中墨组以及高墨组灌胃乌贼墨黑色素, 剂量分别为50、100和200mg/kg; 阳性对照组灌胃二巯基丁二酸, 每日灌胃剂量为 1.5g/60kg, 连续灌胃 3天, 停 4天(给药方式与剂量同临床)(陈玉柱等, 2010), 连续治疗4周。阴性对照组和模型对照组灌胃超纯水, 除阳性对照组外, 其余各组每日灌胃1次, 连续4周。根据每周小鼠体重调整灌胃体积。每组小鼠每日自由进标准饲料,自由饮水。
1.4 样品采集与处理
实验期间每周灌胃前称量小鼠体重一次。末次给药之后, 停止饲料供给, 24 h后称小鼠体重, 摘取眼球血, 然后脱颈处死; 采集脑、肝脏以及肾脏并称重,计算各组织的脏器系数。取一定重量的样品, 用浓硝酸和高氯酸加热消化(两者体积比为5 : 1), 采用原子吸收光谱检测样品中铅(石墨炉)、钙、铜及锌的含量,以及各组小鼠钙、铜和锌元素的流失率。本文所用公式如下:
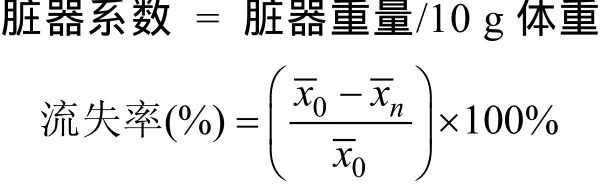
实验数据采用 SPSS17.0统计软件统计分析, 数据结果以表示。多组间比较采用方差分析, 两组间比较用t检验, P<0.05为差异显著, P<0.01为差异极显著。
2 结果与分析
2.1 小鼠体重变化
小鼠实验过程中的体重变化见表1。用SPSS17.0处理数据, 结果显示各组小鼠初始体重、第 11天灌胃前的体重、第18天灌胃前的体重、第25天灌胃前的体重、第32天灌胃前的体重以及第39天处死前的体重均无统计学差异(P>0.05)。
表1 实验期间小鼠体重变化(, g, n=8)Tab.1 Variation in the weight of the mice during the experiment (, g, n=8)
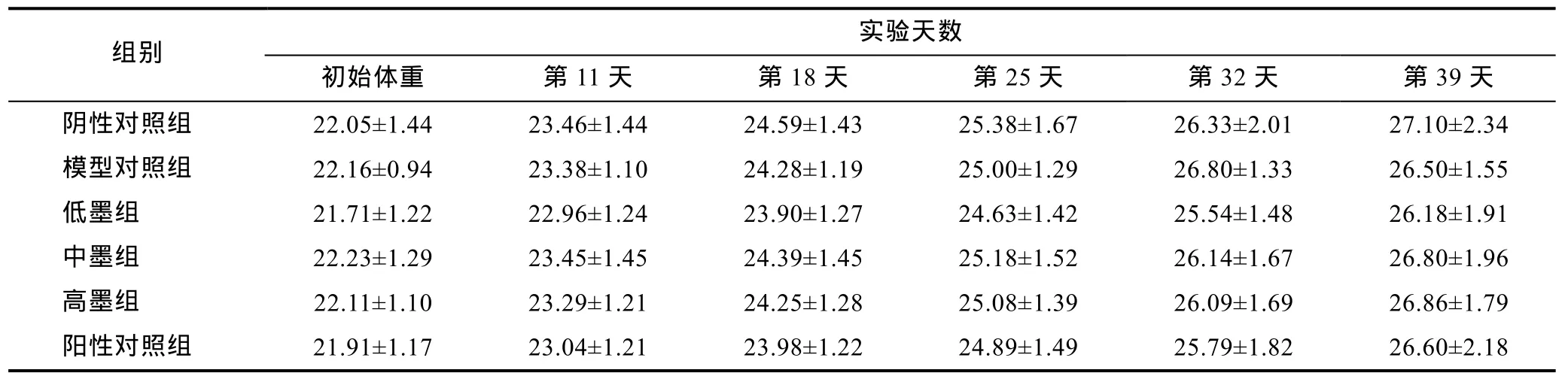
表1 实验期间小鼠体重变化(, g, n=8)Tab.1 Variation in the weight of the mice during the experiment (, g, n=8)
组别 初始体重 第11天 第18天 第25天 第32天 第39天实验天数阴性对照组 22.05±1.44 23.46±1.44 24.59±1.43 25.38±1.67 26.33±2.01 27.10±2.34模型对照组 22.16±0.94 23.38±1.10 24.28±1.19 25.00±1.29 26.80±1.33 26.50±1.55低墨组 21.71±1.22 22.96±1.24 23.90±1.27 24.63±1.42 25.54±1.48 26.18±1.91中墨组 22.23±1.29 23.45±1.45 24.39±1.45 25.18±1.52 26.14±1.67 26.80±1.96高墨组 22.11±1.10 23.29±1.21 24.25±1.28 25.08±1.39 26.09±1.69 26.86±1.79阳性对照组 21.91±1.17 23.04±1.21 23.98±1.22 24.89±1.49 25.79±1.82 26.60±2.18
2.2 小鼠脏器系数的变化
各组小鼠肝脏、脑及肾脏的脏器系数如表 2所示。由表知, 模型对照组中肝脏的脏器系数与阴性对照组相比有显著性差异(P<0.05), 表明铅离子对肝脏的生长有不良影响。与其余各组无统计学差异(P>0.05)。小鼠各组间脑与肾脏的脏器系数没有统计学差异(P>0.05)。有研究表明铅元素能进入细胞, 抑制酶活, 造成细胞结构受损, 可使肝细胞变性甚至坏死(金毓芳等, 2001; 赵翠莉等, 2014)。
2.3 乌贼墨黑色素对小鼠血液及脏器中铅的影响
血液和器官中铅含量的高低是判断模型动物是否铅中毒的主要指标之一, 本实验以脑、肝脏及肾脏作为铅含量测定器官的主要原因是脑为中枢神经系统最重要的器官, 肝脏是动物进行代谢的主要器官而肾脏是动物排泄的主要器官。乌贼墨黑色素对小鼠血液、肝脏、脑及肾脏脏器中铅含量的影响见表3。
表2 小鼠脏器系数(/×10–2, n=8)Tab.2 Organ coefficient of mice (/×10–2, n=8)
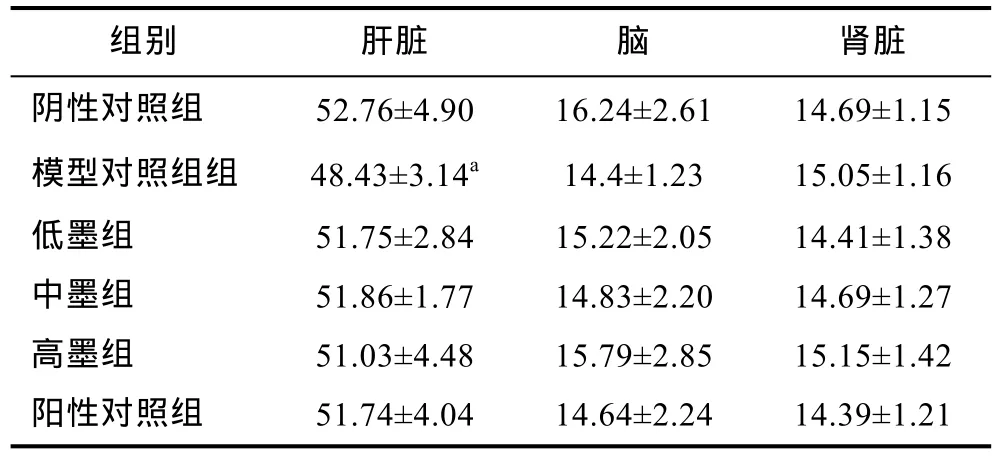
表2 小鼠脏器系数(/×10–2, n=8)Tab.2 Organ coefficient of mice (/×10–2, n=8)
a表示与阴性对照组比较差异极显著(P<0.01)
组别 肝脏 脑 肾脏阴性对照组 52.76±4.90 16.24±2.61 14.69±1.15模型对照组组 48.43±3.14a 14.4±1.23 15.05±1.16低墨组 51.75±2.84 15.22±2.05 14.41±1.38中墨组 51.86±1.77 14.83±2.20 14.69±1.27高墨组 51.03±4.48 15.79±2.85 15.15±1.42阳性对照组 51.74±4.04 14.64±2.24 14.39±1.21
表3 小鼠血液及各脏器中的铅含量(, μg/g, n=8)Tab.3 The content of lead in blood and organ of mice (, μg/g, n=8)
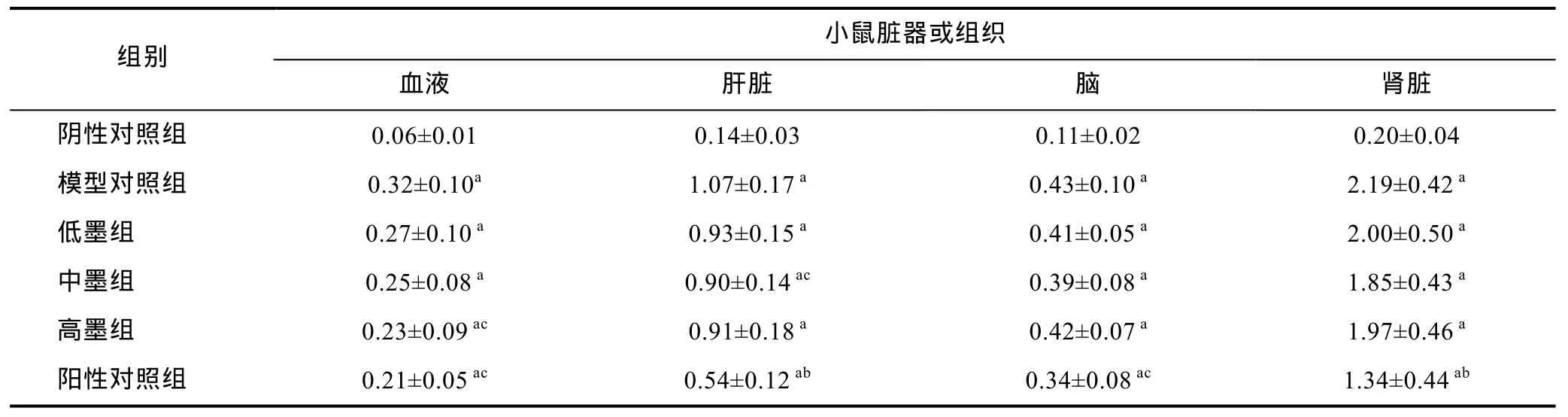
表3 小鼠血液及各脏器中的铅含量(, μg/g, n=8)Tab.3 The content of lead in blood and organ of mice (, μg/g, n=8)
a与阴性对照组比较P<0.01; b与模型对照组比较P<0.01, c与模型对照组比较P<0.05
组别小鼠脏器或组织血液 肝脏 脑 肾脏阴性对照组 0.06±0.01 0.14±0.03 0.11±0.02 0.20±0.04模型对照组 0.32±0.10a 1.07±0.17 a 0.43±0.10 a 2.19±0.42 a低墨组 0.27±0.10 a 0.93±0.15 a 0.41±0.05 a 2.00±0.50 a中墨组 0.25±0.08 a 0.90±0.14 ac 0.39±0.08 a 1.85±0.43 a高墨组 0.23±0.09 ac 0.91±0.18 a 0.42±0.07 a 1.97±0.46 a阳性对照组 0.21±0.05 ac 0.54±0.12 ab 0.34±0.08 ac 1.34±0.44 ab
由表3可知, 小鼠血液和各脏器的模型对照组中铅含量与阴性对照组中铅含量差异极显著(P<0.01),表明小鼠铅中毒模型成功。小鼠肾脏中的铅含量高于血液、肝脏及脑中的铅含量, 表明铅离子易积蓄在肾脏中。乌贼墨黑色素高剂量组显著降低了血液中的铅含量, 与模型对照组相比铅含量下降 28.15%, 低墨组和高墨组的铅含量与模型组相比无统计学差异,铅含量分别下降了15.62%和21.88%。乌贼墨黑色素中剂量组显著降低了肝脏中的铅含量, 与模型对照组相比肝铅含量下降 15.89%, 低墨和中墨组的肝铅含量与模型组相比无统计学差异(P>0.05)。不同剂量的乌贼墨黑色素使肾脏中的铅含量下降范围在8%—16%之间, 而其对脑铅促排效果较小, 与模型组相比肾铅和脑铅均未有统计学差异(P>0.05)。阳性对照组中血液与脏器中的铅含量与模型对照组相比均有显著差异(P<0.01或P<0.05), 铅含量下降明显, 排铅效果比各墨剂量组效果显著。综合以上分析结果表明乌贼墨黑色素高剂量和中剂量分别对铅中毒小鼠血液和肝脏有明显的促排效果。
2.4 乌贼墨黑色素对铅中毒小鼠血液及脏器中钙、锌和铜的影响
铅元素的毒性机理主要是其取代多价阳离子(尤其是二价的钙离子与锌离子), 这些相互作用影响了金属的运输、能量代谢、细胞凋亡、细胞内外信号的传递以及不同的酶促过程等重要的生物过程(Garzaet al, 2006)。小鼠对铅的吸收会影响其对其它元素的吸收, 本实验中检测血液、肝脏、脑和肾脏中钙、锌和铜3种微量元素含量及计算3种元素的流失率来观察各组小鼠体内钙、锌和铜含量的变化。
表4结果表明, 模型对照组中的钙、锌及铜的含量与阴性对照组相比差异均显著(P<0.05), 模型对照组钙、铜及锌的流失率分别为 7.55%、20.02%和38.30%, 说明铅的吸收导致了血液中钙、锌和铜元素流失。乌贼墨各剂量组与阴性对照组中钙、铜和锌含量无显著性差异(P>0.05)。阳性对照组血液中铜和锌含量低于阴性对照组, 且差异显著(P<0.05), 其与模型组相比无显著差异(P>0.05), 说明DMSA对血液中的铜和锌无保护作用。
表4 小鼠血液中的钙、锌和铜含量(, n=8)Tab.4 Contents of calcium, zinc and copper in blood of mice (, n=8)
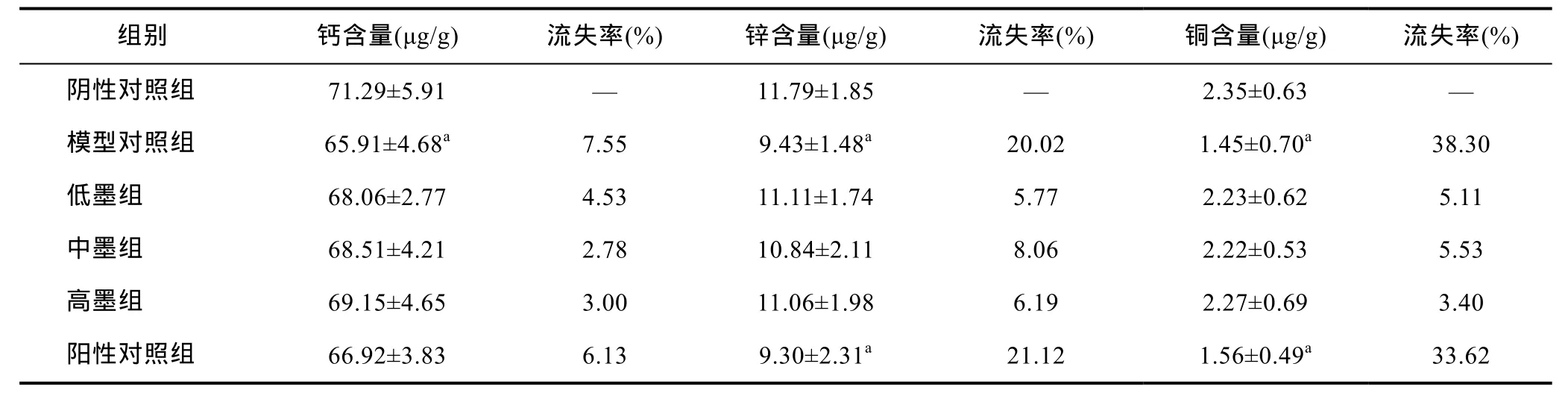
表4 小鼠血液中的钙、锌和铜含量(, n=8)Tab.4 Contents of calcium, zinc and copper in blood of mice (, n=8)
a表示与阴性对照组比较P<0.05
组别 钙含量(μg/g) 流失率(%) 锌含量(μg/g) 流失率(%)阴性对照组 71.29±5.91 — 11.79±1.85 —模型对照组 65.91±4.68a 7.55 9.43±1.48a 20.02低墨组 68.06±2.77 4.53 11.11±1.74 5.77中墨组 68.51±4.21 2.78 10.84±2.11 8.06高墨组 69.15±4.65 3.00 11.06±1.98 6.19阳性对照组 66.92±3.83 6.13 9.30±2.31a 21.12铜含量(μg/g) 流失率(%)2.35±0.63 —1.45±0.70a 38.30 2.23±0.62 5.11 2.22±0.53 5.53 2.27±0.69 3.40 1.56±0.49a 33.62
由表 5知模型对照组肝脏中的锌和铜的含量低于阴性对照组(锌铜流失率分别为13.69%和32.88%),其差异有统计学意义(P<0.05)。三个实验组中铜含量均高于模型对照组, 差异均有统计学意义(P<0.05)。阳性对照组中肝脏铜含量虽与阴性对照组差异不显著(P>0.05), 但铜元素流失率高达 20.65%, 比模型对照组的流失率低12.23%。表5结果说明铅离子显著降低了小鼠肝脏中锌和铜的含量, 但乌贼墨黑色素对铅中毒小鼠肝脏中钙、锌和铜的含量无显著影响。
表6为铅中毒小鼠肾脏中钙、锌及铜的含量。模型对照组中的锌与钙的含量均低于阴性对照组, 且差异显著(P<0.05), 两元素流失率分别为 5.94%和12.43%。高墨组中的锌含量高于模型对照组, 差异显著(P>0.05), 但其与阴性对照组相比无显著差异(P<0.05)。阳性对照组钙、锌和铜与阴性对照组相比虽有降低, 但未有显著性差异(P>0.05), 其流失率分别为1.82%、4.60%和25.59%。结果说明高剂量的乌贼墨黑色素对肾脏中的锌元素有保护作用。
表5 小鼠肝脏中的钙、锌和铜含量(, n=8)Tab.5 Contents of calcium, zinc and copper in liver of mice (n=8)
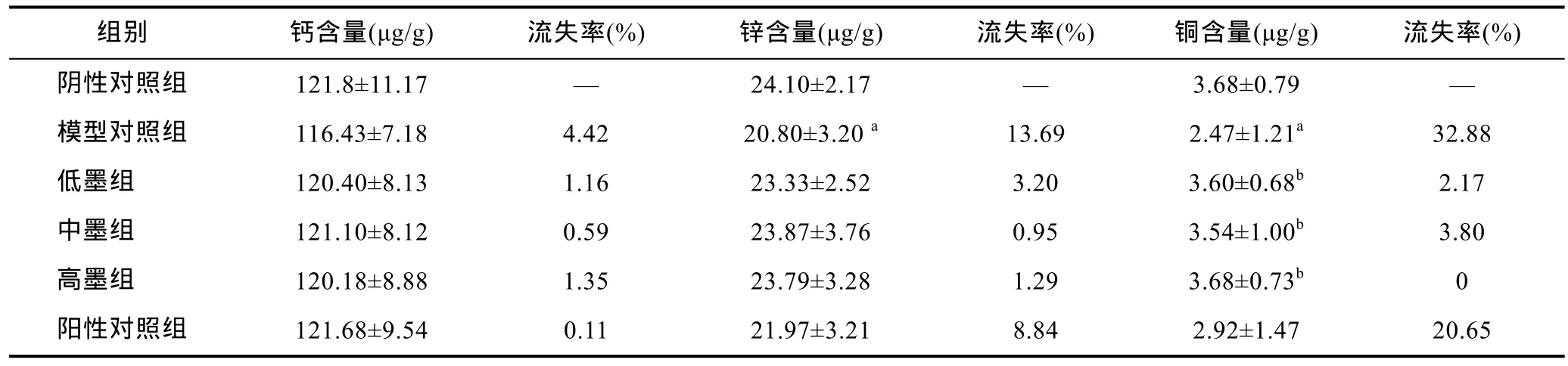
表5 小鼠肝脏中的钙、锌和铜含量(, n=8)Tab.5 Contents of calcium, zinc and copper in liver of mice (n=8)
a表示与阴性对照组比较P<0.05; b表示与模型对照组比较P<0.05
组别 钙含量(μg/g) 流失率(%) 锌含量(μg/g) 流失率(%) 铜含量(μg/g) 流失率(%)阴性对照组 121.8±11.17 — 24.10±2.17 — 3.68±0.79 —模型对照组 116.43±7.18 4.42 20.80±3.20 a 13.69 2.47±1.21a 32.88低墨组 120.40±8.13 1.16 23.33±2.52 3.20 3.60±0.68b 2.17中墨组 121.10±8.12 0.59 23.87±3.76 0.95 3.54±1.00b 3.80高墨组 120.18±8.88 1.35 23.79±3.28 1.29 3.68±0.73b 0阳性对照组 121.68±9.54 0.11 21.97±3.21 8.84 2.92±1.47 20.65
表6 小鼠肾脏中的钙、锌和铜含量(, n=8)Tab.6 Contents of calcium, zinc and copper in kidney of mice (, n=8)
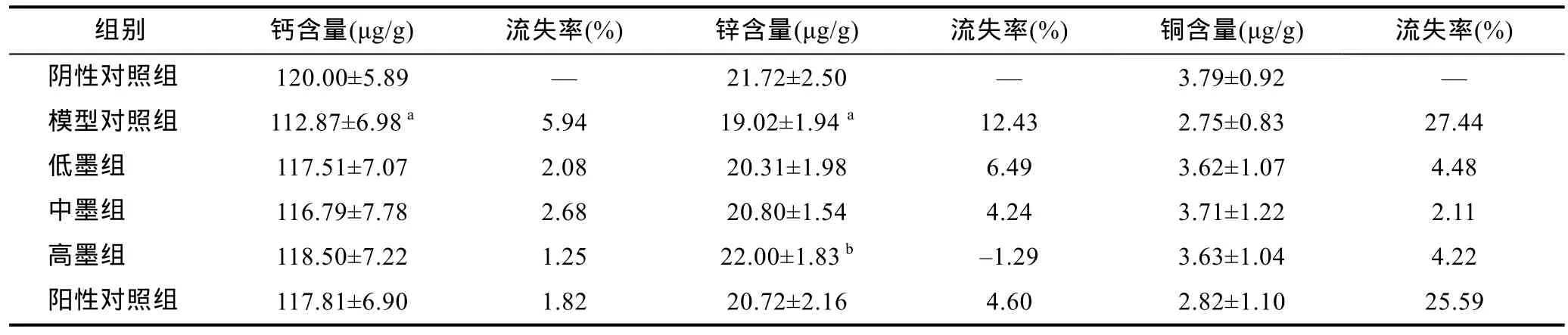
表6 小鼠肾脏中的钙、锌和铜含量(, n=8)Tab.6 Contents of calcium, zinc and copper in kidney of mice (, n=8)
a表示与阴性对照组比较P<0.05; b表示与模型对照组比较P<0.05
组别 钙含量(μg/g) 流失率(%) 锌含量(μg/g) 流失率(%) 铜含量(μg/g) 流失率(%)阴性对照组 120.00±5.89 — 21.72±2.50 — 3.79±0.92 —模型对照组 112.87±6.98 a 5.94 19.02±1.94 a 12.43 2.75±0.83 27.44低墨组 117.51±7.07 2.08 20.31±1.98 6.49 3.62±1.07 4.48中墨组 116.79±7.78 2.68 20.80±1.54 4.24 3.71±1.22 2.11高墨组 118.50±7.22 1.25 22.00±1.83 b –1.29 3.63±1.04 4.22阳性对照组 117.81±6.90 1.82 20.72±2.16 4.60 2.82±1.10 25.59
由表 7知模型对照组和阳性对照组中脑锌显著低于阴性对照组(P<0.05), 说明脑组织铅中毒的导致了锌元素流失。高墨组中脑锌显著高于模型对照组中脑锌含量(P<0.05), 与阴性对照组脑锌相比无显著性差异(P>0.05), 说明高剂量的乌贼墨黑色素对能够保护脑中的锌元素。
表7 小鼠脑中的钙、锌和铜含量(, n=8)Tab.7 Contents of calcium, zinc and copper in brain of mice (, n=8)

表7 小鼠脑中的钙、锌和铜含量(, n=8)Tab.7 Contents of calcium, zinc and copper in brain of mice (, n=8)
a表示与阴性对照组比较P<0.05; b表示与模型对照组比较P<0.05
组别 钙含量(μg/g) 流失率(%) 锌含量(μg/g) 流失率(%)阴性对照组 136.42±9.49 — 20.81±1.76 —模型对照组 129.01±10.42 5.43 17.76±2.00a 14.66低墨组 133.45±10.51 2.18 19.64±2.50 5.62中墨组 134.21±9.39 1.62 20.16±3.04 3.12高墨组 135.16±7.49 0.92 20.92±2.60b –0.53阳性对照组 132.92±6.48 2.56 19.76±2.73a 5.04铜含量(μg/g) 流失率(%)2.88±0.87 —3.04±1.00 –5.56 2.87±0.71 0.35 2.61±0.72 9.38 2.69±0.82 6.60 2.57±0.68 12.06
3 讨论
本实验模型参阅金毓芳等的方法(金毓芳等,2001), 采用皮下注射醋酸铅溶液7mg/kg, 染铅10 d,建立小鼠铅中毒模型。由表3知醋酸铅模型组小鼠血液和脏器(肝脏、肾脏及脑)中铅含量与阴性对照组之间均有显著性差异(P<0.01), 表明小鼠铅中毒模型构建成功。
铅元素主要从呼吸道和消化道进入机体, 随血液循环分布各个器官和组织, 取代器官或组织中的多价阳离子尤其是钙、锌和铜等二价离子进行生物代谢过程, 诱发自由基对机体造成氧化损伤以及抑制体内的抗氧化物酶活性来加剧损害作用(Sainiet al,2013)。生物体内的黑色素有“伪超氧化物歧化酶”的美称, 它在清除重金属和电离辐射诱发的自由基方面发挥重要作用(Ortonne, 2002)。黑色素与重金属阳离子的螯合作用已经被许多体外实验证实, 结构中至少有3个基团(-COOH, -NH2和-OH)能与阳离子结合。本次研究中采用乌贼墨黑色素作为解毒剂, 设低、中、高三个剂量组灌胃铅中毒小鼠, 灌胃4周, 其中血液(高剂量)和肝脏(中剂量)的铅含量出现显著下降, 其余组含量虽有下降, 但未达到显著水平。王哲鹏等(2007)利用乌鸡黑色素对铅中毒的果蝇进行治疗,治疗后铅含量下降了32.9%。黑色素的来源不同, 作用的生物不同, 但均具有一定的排铅效果。
本次实验中, 模型对照组小鼠血液中的钙、锌和铜含量低于阴性对照组, 差异显著(P<0.05), 模型对照组小鼠肝脏中锌和铜、肾脏中的钙和锌含量显著低于阴性对照组, 小鼠脑组织中锌含量也出现显著降低, 这些结果说明铅的吸收对小鼠组织和器官中的钙、铜和锌的吸收造成不良影响。Zakrgynska-Fontaine等(1998)研究表明体内钙与铅呈负相关性, 过量铅元素会影响铜、锌和铁的吸收(麦剑平等, 2003)。本实验中模型组的脑铜含量高于阴性对照组, 原因可能是铅中毒使体内锌含量降低, 而铜与锌又是互为抑制元素(李瑞等, 2011), 而其余器官和组织中铜含量均低于阴性对照组, 说明铅对铜也有较强的抑制作用。乌贼墨各剂量组对小鼠血液及脏器中的钙、锌和铜含量与阴性对照组相比均无显著差异, 表明乌贼墨黑色素对器官和组织中的钙、锌和铜的吸收无不良影响。阳性对照组中各脏器组织中的微量元素与阴性对照组相比均有降低, 尤其是血锌、血铜和脑锌(P<0.05)。这些结果表明二巯基丁二酸虽能有效排铅,但体内对钙、锌和铜无保护作用, 甚至还有促排作用。国外有学者研究证明 DMSA促进体内铜的排泄(Cantilena et al, 1982), 我国也有文献指出DMSA对人体有一定副作用, 如食欲降低、白细胞减少及全身肌肉酸痛等(关贵民等, 1986)。
4 结论
本文研究了乌贼墨黑色素作为解毒剂对铅中毒小鼠体内铅的清除效果以及小鼠体内钙、锌和铜的变化。研究结果表明, 乌贼墨黑色素对铅中毒小鼠体重及脏器无不良影响; 乌贼墨黑色素高剂量组中血液中的铅含量有显著降低, 与模型对照组相比下降了28.15%; 中剂量组中肝脏中的铅含量有显著降低, 与模型对照组相比下降了 15.89%。这些结果表明乌贼墨黑色素对铅中毒小鼠血液和肝脏有明显的排铅效果。另外, 铅中毒小鼠经灌胃高剂量的乌贼墨黑色素后, 肝铜、脑锌及肾锌显著高于模型组, 表明乌贼墨黑色素在一定程度上对铅中毒小鼠肝脏中的铜元素、脑组织中的锌元素及肾脏中的锌元素有保护作用。本文的研究结果可为开发治疗铅中毒的天然药物提供一些科学依据。
王哲鹏, 邓学梅, 吴常信, 2007. 乌鸡黑色素在果蝇体内排铅解毒的研究. 中国畜牧杂志, 43(7): 50—52
关贵民, 1986. 重金属中毒的解毒药-二巯基丁二酸. 中华劳动卫生职业病杂志, 4(1): 47—52
麦剑平, 韦拔雄, 2003. 铅接触引起体内其他元素变化的初探.职业与健康, 19(10): 41—42
李 晓, 李和生, 2010. 酶法提取金乌贼墨汁中黑色素的工艺条件研究. 天然产物研究与开发, 22: 159—162, 166
李 瑞, 陈玉柱, 张惠英, 2011. 排铅食品对铅中毒小鼠的排铅作用及对矿物质的影响. 中国食品卫生杂志, 23(1):76—80
李和生, 李 晓, 董亚辉等, 2012. 乌贼墨黑色素的超微结构及抗氧化活性研究. 中国食品学报, 12(10): 62—66
吴常文, 董智勇, 迟长凤等, 2010. 曼氏无针乌贼(Sepiella maindroni)繁殖习性及其产卵场修复的研究. 海洋与湖沼,41(1): 39—46
陈玉柱, 张惠英, 汪 岭等, 2010. 排铅食品对铅中毒小鼠的排铅作用. 中国食品卫生杂志, 22(3): 254—257
陈自然, 2012. 依地酸钙钠与二巯基丁二酸钠驱铅效果观察.疾病监测与控制, 6(5): 270—271
金毓芳, 晏 菁, 2001. 立得益片对铅中毒小鼠(生殖系统、脑、血液、心脏)促排铅的作用. 广东微量元素科学, 8(9):30—35
赵翠莉, 马吉飞, 葛秀国等, 2014. 千世杨对铅中毒小鼠脏器的保护作用研究. 黑龙江畜牧兽医, (2): 31—34
Araújo M, Viveiros R, Correia T R et al, 2014. Natural melanin:A potential pH-responsive drug release device. Int J Pharm,469(1): 140—145
Campbell C, Tran M, Gracely E et al, 2011. Primary prevention of lead exposure: the Philadelphia lead safe homes study.Public Health Rep, 126(S1): 76—88
Cantilena Jr L R, Klaassen C D, 1982. The effect of chelating agents on the excretion of endogenous metals. Toxicology and Applied Pharmacology, 63(3): 344—350
Cuevas-Juárez E, Yuriar-Arredondo K Y, Pío-León J F et al,2014. Antioxidant and α-glucosidase inhibitory properties of soluble melanins from the fruits of Vitex mollis Kunth,Randia echinocarpa Sessé et Mociño and Crescentia alata Kunth. J Funct Foods, 9: 78—88
Fernandez C W, Koide R T, 2014. Initial melanin and nitrogen concentrations control the decom- position of ectomycorrhizal fungal litter. Soil Biol Biochem, 77:150—157
Garza A, Vega R, Soto E, 2006. Cellular mechanisms of lead neurotoxicity. Med Sci Monit, 12(3): RA57—RA65
Hong L, Simon J D, 2006. Insight into the binding of divalent cations to sepia eumelanin from IR absorption spectroscopy.Photochem Photobiol, 82(5): 1265—1269
Nogaj P, Buszman E, Swiatkowska L et al, 1995. The effect of endo- and exogenous melanin on Zn2+and Co2+elimination and distribution in mice. Acta Biochim Pol, 42(1): 83—88
Ortonne J P, 2002. Photoprotective properties of skin melanin. Br J Dermatol, 146(S61): 7—10
Petrosyan T R, Gevorkyan O V, Chavushyan V A et al, 2014.Effects of bacterial melanin on motor recovery and regeneration after unilateral destruction of Substantia Nigra pars compacta in rats. Neuropeptides, 48(1): 37—46
Pichery C, Bellanger M, Zmirou-Navier D et al, 2011. Childhood lead exposure in France: benefit estimation and partial cost-benefit analysis of lead hazard control. Environ Health,10: 44
Saini A S, Melo J S, 2013. Biosorption of uranium by melanin:kinetic, equilibrium and thermodynamic studies. Bioresour Technol, 149: 155—162
Ye M, Guo G Y, Lu Y et al, 2014. Purification, structure and anti-radiation activity of melanin from Lachnum YM404. Int J Biol Macromol, 63: 170—176
Yuan W H, Holland S K, Cecil K M et al, 2006. The impact of early childhood lead exposure on brain organization: a functional magnetic resonance imaging study of language function. Pediatrics, 118(3): 971—977
Zakrgynska-Fontaine V, Doré J C, Ojasoo T et al, 1998. Study of the age and sex dependence of trace elements in hair by correspondence analysis. Biol Trace Elem Res, 61(2):151—168

