活血消异方对子宫内膜异位症模型小鼠体外受精胚胎发育的影响
崔阳阳,孙伟伟,赵瑞华,徐 彩,吴天思,2
(1.中国中医科学院广安门医院妇科,北京 100053;2.北京中医药大学,北京 100029)
活血消异方对子宫内膜异位症模型小鼠体外受精胚胎发育的影响
崔阳阳1,孙伟伟1,赵瑞华1,徐彩1,吴天思1,2
(1.中国中医科学院广安门医院妇科,北京100053;2.北京中医药大学,北京100029)
【摘要】目的评估活血消异方子宫内膜异位症模型小鼠体外受精胚胎发育的影响。方法通过体外受精的方法,观察中药组、模型组和假手术组的小鼠的促排卵数、受精率、二细胞分裂率、四细胞分裂率、桑葚胚形成率及最终桑葚胚形成率,观察对子宫内膜异位症模型小鼠体外受精胚胎发育的影响。探讨内异症对小鼠体外受精后胚胎发育的影响及活血消异方对胚胎发育的作用。结果中药组、模型组和假手术组,共三组。三组的平均促排卵数、体外受精率和二细胞分裂率差异有显著性意义(P<0.05),平均促排卵数、体外受精率和二细胞分裂率由高到低均依次为假手术组、中药组和模型组;三组的四细胞分裂率差异有显著性意义(P<0.05),桑葚胚形成率差异无显著性差异(P>0.05),桑葚胚最终形成率差异有显著性差异(P<0.05)。结论子宫内膜异位症可降低模型小鼠促排卵数、体外受精率及卵裂率,影响胚胎发育质量,活血消异方可改善胚胎发育质量。
【关键词】子宫内膜异位症;不孕;体外受精;胚胎发育
子宫内膜异位症(endometriosis, EM,)简称内异症,是指具有生长功能的子宫内膜组织在宫腔以外的部位的一种雌激素依赖性疾病。是育龄妇女的常见病、多发病,以引发疼痛、不孕为特点。EM的发病率逐年上升且趋于年轻化,内异症是引起女性不孕的原因之一。内异症患者并发不孕高达40%~60%[1]而在不孕症患者中也有40%~50%存在子宫内膜异位症,内异症患者不孕为非内异症人群的20倍[2]。可见,内异症与不孕有密切的联系。2000年Buyalos等[3]首次提出“endometriosis-associated infertility”,即“内异症相关不孕症”。
目前,手术治疗是EM相关不孕的首要基本措施,随着辅助生殖技术(ART)的发展及临床应用,已成为EM相关不孕患者最理想的助孕方式和治疗手段。但在行体外受精-胚胎移植(IVF-ET)中,其胚胎移植率达85%,而妊娠率仅为20%左右[4]。因此,如何提高EM相关不孕患者IVF妊娠率成为关注的热点问题。由内异症患者行IVF-ET的高移植率和低妊娠率可见,胚胎着床则成为影响IVF-ET结局的关键性问题。本研究以中医理论为指导,结合IVF技术,在前期工作的基础上,通过建立子宫内膜异位症小鼠模型,观察子宫内膜异位症对模型小鼠体外受精后胚胎发育的影响,探讨活血消异方对子宫内膜异位症相关不孕患者胚胎发育的影响,为中医药进入辅助生殖领域奠定基础,为EM不孕症提供更完善的治疗方法。
1材料和方法
1.1实验动物
SPF级雌性昆明小鼠300只,7周龄,体重(25±3)g,用于模型小鼠的供体与受体;雄性昆明小鼠50只,10周龄,体重(33±2)g,用于精子供体及假孕鼠制作。购自中国医学科学院医学实验动物研究所【SCXK(京)2009-0007】。饲养于中国中医科学院广安门医院动物实验室【SYXK(京)2009-0034】。日间照明交替(12L:12D),室温22℃。实验所需物品均经过高压灭菌。昆明小鼠雌鼠,昆明小鼠雄鼠。
1.2试剂和药物
HTF和KSOM 培养液购自ARK-Resource(规格:2 mL/支,日本,熊本县熊本市)。HTF用于体外受精,KSOM用于培养受精卵直到桑葚胚期,二种培养液使用前皆于5% CO2,恒温37℃湿度饱和的培养箱中过夜预热平衡;hCG(批号:110251282,规格:1000 IU×10支)和PMSG(批号:110254564,规格:1000 IU × 5支,宁波第二激素厂,中国);矿物油购自(批号:101181433,规格:1 L/瓶Sigma,德国);其他实验用药物(包括中药)及试剂全部来自于中国中医科学院广安门医院制剂室提供。
中药活血消异方由莪术、丹参、赤芍、鸡内金、生薏仁组成,由中国中医科学院广安门医院制剂室提供。以上生药加10倍量水,煎煮3次,每次1 h,合并煎液、过滤,放置24 h,浓缩。药物浓度为1.8 g生药/mL,药液4℃冰箱保存。
1.3实验分组和用药剂量
将实验雌性昆明小鼠分为中药组,模型组和假手术组进行子宫内膜异位症小鼠模型的建立。其中,除子宫内膜供体小鼠130只外,中药组小鼠60只,死亡3只;模型组小鼠60只,死亡8只;空白组小鼠50只,死亡2只。
依据换算公式计算,小鼠等剂量的给药量约为临床成人每公斤体重用药量的10倍。每只小鼠每次灌胃量为0.2 mL/10 g,连续3个周期(5 d为1周期)。模型组、空白组依据体重予等量0.5%羧甲基纤维素钠(CMC)灌胃。
1.4子宫内膜异位症小鼠模型的建立
造模前,连续1周每日定时作阴道涂片检查[5](如图1~2),动情周期为3~5日,选择动物周期正常的小鼠。通过内膜碎片注射法[6,7]建立子宫内膜异位症模型小鼠,假手术组给予注射等量生理盐水。模型建立2周后,开始进行中药干预。
1.5超数排卵及卵子的采集
各组分别取供卵鼠腹腔注射PMSG,10 IU/只,48 h后腹腔注射hCG,10 IU/只。在注射hCG 14 h后进行取卵。脱颈处死供卵小鼠置于体视显微镜下(ZOOM2000,Leica,Germany),打开小鼠腹腔,用镊子将输卵管、卵巢和脂肪垫拉出,再用小剪刀在输卵管和卵巢之间剪开,然后再靠近输卵管的子宫部剪开。将输卵管和带着的子宫部分转移入培养皿中的矿物油中,在体视显微镜下,用16号针轻轻划破输卵管膨大的壶腹部,随即云雾状的卵子及卵丘团会释放出来,将卵丘团引入HTF培养中。将取出的卵子置于5% CO2、恒温37℃、湿度饱和的培养箱中等用。
1.6精子的采集
脱颈处死雄鼠,在体视显微镜下,开腹进入腹腔找出睾丸,剪下睾丸及附睾,迅速分离出附睾尾和输精管,尽可能去除脂肪和血管,置于矿物油中,使用26号针于附睾尾远端小管处刺破,慢慢挤出精子,挑出精子置于HTF培养滴中,将培养皿放入培养箱中静置1 h使精子获能。受精时,精子的浓度约为(1~2)× 106个/mL。
1.7体外受精
精子获能后,将精子加入卵子培养皿中,5 μL/滴,重新置于培养箱中静置6 h。6 h后使用HTF 冲洗受精卵2~3次,冲洗后将受精卵置于新的KSOM培养液中,在倒置显微镜下对受精卵进行计数后,重新置于培养箱中进行培养。受精24 h后,可见到较早卵裂的2细胞。这些2细胞用于培养至桑葚胚,观察卵裂及胚胎发育情况和进行2细胞移植的2细胞供体。
1.8统计学方法
采用SPSS 17.0软件包分析,计数资料采用χ2检验,①在总频数n≥40且所有理论频数≥5时,用Pearson χ2统计量;②在总频数n>40但≥1时,用校正χ2统计量;③在总频数n<40或理论频数<1时,用Fisher确切概率法检验,组间比较采用两两四格表的χ2检验。按α=0.05水准,P<0.05为差异显著,有统计学意义;P>0.05为差异不显著,无统计学意义。
2实验结果
2.1子宫内膜异位症小鼠模型建立
建模2周后,小鼠腹部皮下可触及米粒大小的结节。子宫内膜异位症小鼠模型的建立结果显示(图1~2):在皮下和腹腔均见有病灶生成,异位病灶生长良好,小鼠皮下病灶,肉眼观多为白色、红色或淡黄色的米粒大小的结节或囊状病灶,活动度小;小鼠腹腔内病灶,肉眼观多为隆起囊状,囊内充满淡黄色清亮透明或混浊粘稠积液,表面血管清晰可见,病灶2 mm3~5 mm3大小不等。小鼠皮下及腹腔有不同程度的粘连。病灶的HE染色(图3,见彩插2)可见:切片中可见有血管生成,并有大量腺体存在。可见,子宫内膜异位症小鼠“腹腔+皮下”注射法建立模型的成功率达90%以上。
2.2活血消异方对子宫内膜异位症模型小鼠促排卵数的影响三组小鼠的促排卵情况(表1)。通过单因素方差分析,三组平均促排卵数差异有显著性意义(P<0.05)。通过LSD法进行两两比较,模型组平均促排卵数明显低于中药组与假手术组(P<0.05);而假手术组和中药组的平均促排卵数无显著性差异(P>0.05)。促排卵数由高到低依次为:假手术组、中药组、模型组。
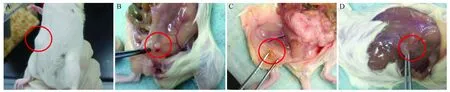
图1 子宫内膜异位症小鼠模型皮下内异位症灶Fig.1 Ectopic subcutaneous lesions in the mouse models of endometriosis
图2 子宫内膜异位症小鼠模型腹腔内异位症灶Fig.2 Ectopic lesions in the abdominal cavity of mouse models of endometriosis
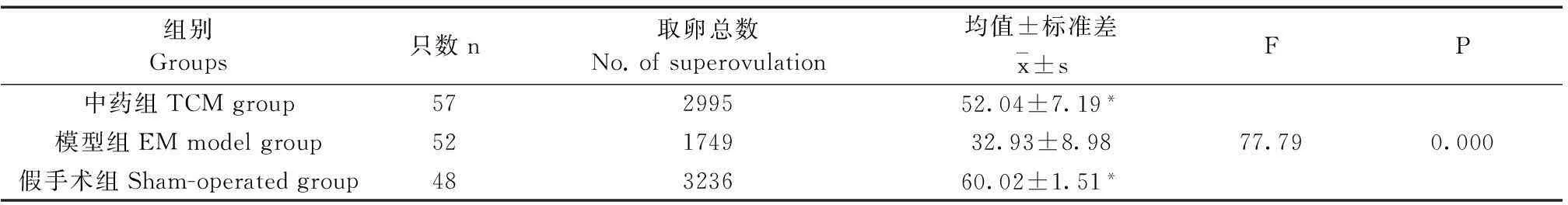
组别Groups只数n取卵总数No.ofsuperovulation均值±标准差x-±sFP中药组TCMgroup57299552.04±7.19*模型组EMmodelgroup52174932.93±8.9877.790.000假手术组Sham-operatedgroup48323660.02±1.51*
Note. Data were expressed in mean±SD. *Compared with the EM model group (P<0.05).
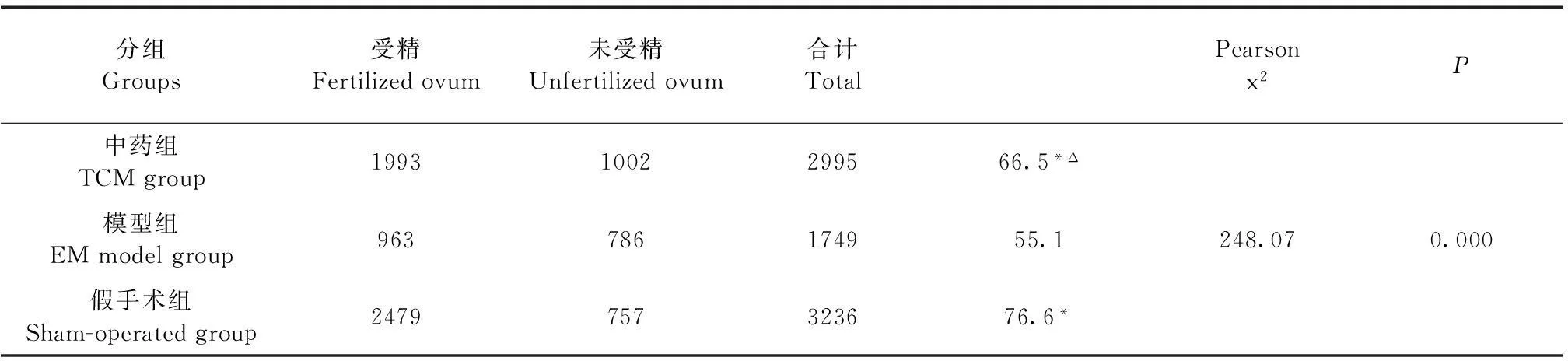
表2 三组体外受精率的比较(%)
*与模型组比较,P<0.05 Δ与假手组比较,P<0.05
Note. *Compared with the EM model group (P<0.05); Δ Compared with the sham-operated group (P<0.05).

表3 三组卵细胞的二细胞分裂率比较(%)
*与模型组比较,P<0.05Δ与假手组比较,P<0.05
Note.*Compared with the EM model group (P<0.05);ΔCompared with the sham-operated group (P<0.05).
2.3活血消异方对内异症模型小鼠体外受精率的影响
三组小鼠的体外受精情况(表2)。通过χ2检验,三组受精率差异有显著性意义(P<0.05)。通过四格表的χ2检验两两比较:中药组与模型组、模型组与假手术组、中药组与假手术组的体外受率差异均有显著性意义(P<0.05)。体外受精率由高到低依次为:假手术组、中药组、模型组。
2.4活血消异方对内异症模型小鼠胚胎发育的影响
三组小鼠体外受精后二细胞分裂情况(表3,图4见彩插2)。通过χ2检验,三组卵细胞的二细胞分裂率差异有显著性意义(P<0.05)。通过四格表的χ2检验两两比较:模型组卵细胞的二细胞分裂率明显低于中药组与假手术组(P<0.05);中药组二细胞分裂率明显低于假手术组(P<0.05)。
三组小鼠体外受精后四细胞分裂率(图5见彩插2,表4)。 通过χ2检验,三组卵细胞的四细胞分裂率差异有显著性意义(P<0.05)。通过四格表的χ2检验两两比较:中药组与模型组卵细胞的四细胞分裂率明显低于假手术组(P<0.05);模型组与中药组的四细胞分裂率无显著性差异(P>0.05)。
三组小鼠体外受精后桑葚胚形成率(图6见彩插2、表5)。通过χ2检验,三组桑葚胚形成率差异无显著性(P>0.05)。
通过观察三组小鼠体外受精后,胚胎发育的情况,其总取卵数、受精数、二细胞分裂数、四细胞分裂数、桑葚胚形成数情况见图7。

表4 三组卵细胞的四细胞分裂率比较(%)
*与模型组比较,P<0.05Δ与假手组比较,P<0.05
Note.*Compared with the EM model group (P<0.05);ΔCompared with the sham-operated group (P<0.05)
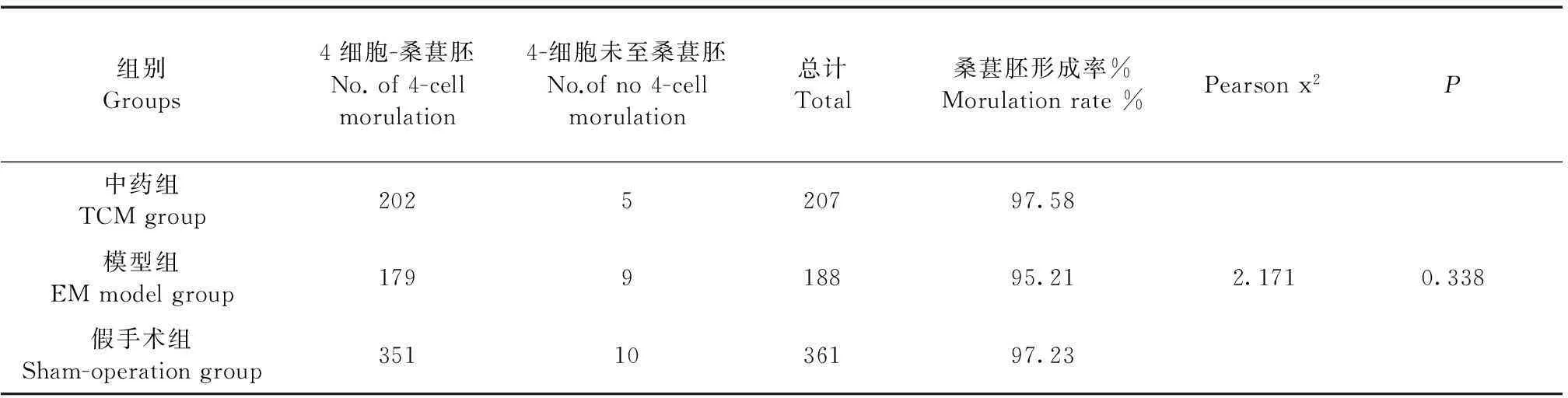
表5 三组桑葚胚形成率比较(%)
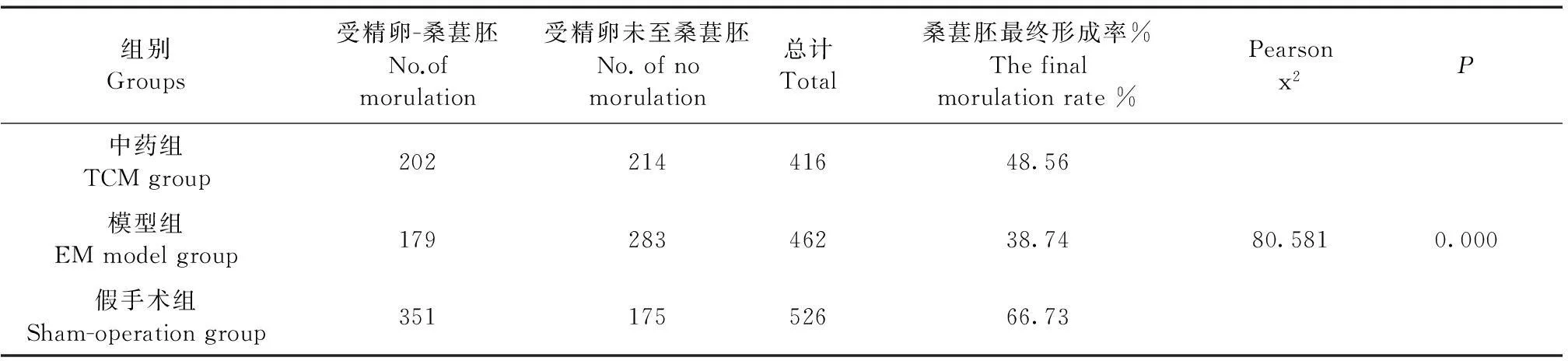
表6 三组桑葚胚最终形成率比较(%)
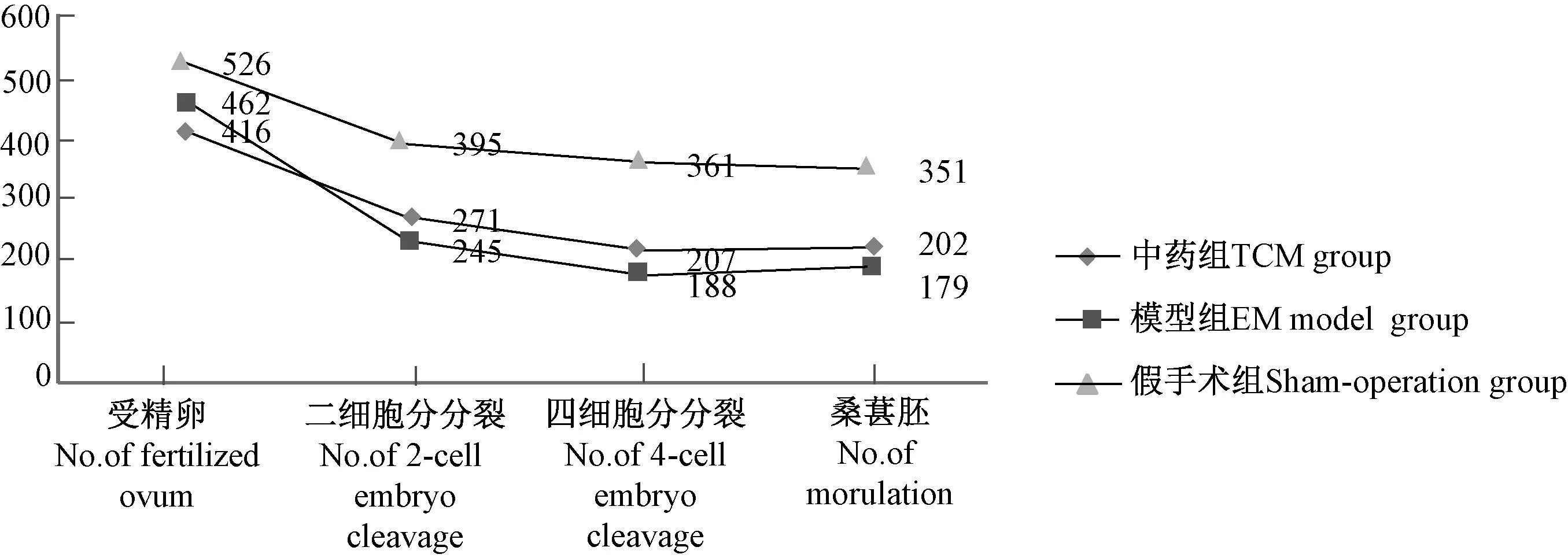
图7 三组体外受精后胚胎发育情况 Fig.7 The embryonic development after IVF
三组小鼠体外受精后,由受精卵最终形成桑葚胚的桑葚胚形成率见表6。通过χ2检验,三组桑葚胚最终形成率差异有显著性(P<0.05)。
3讨论
古代文献中未对子宫内膜异位症的病名进行记载,但根据本病的病因、病机及临床表现可归于“痛经”“癥瘕”“不孕”“月经不调”等疾病的范畴。
中医认为血瘀为子宫内膜异位症的公认病机。瘀血是本病的主要致病因素和病理产物。瘀血阻滞,不通则痛;血瘀日久,可成癥积。我院李光荣教授以“离经之血”立论,组成系列方药,其中核心药物(丹参、赤芍、莪术等)组成活血消异方,临床疗效显著。方中丹参,有活血调经、祛瘀止痛之功效。赤芍,出自《神农本草经》,有活血祛瘀、散瘀止痛之功。莪术,始载于《药性论》,能入气分血分而行气血之滞,有破血祛瘀、行气消积止痛之功。活血消异方中,以丹参、赤芍、莪术相伍,共奏活血化瘀、散结止痛之效。
前期临床研究发现活血法对EM不孕患者有助孕疗效,实验研究显示活血消异方能缩小异位内膜体积,改善EM的组织病理形态;有效降低血清及异位内膜组织中ICAM-1、MMP-9、VEGF的蛋白表达。临床研究表明[8,9],补肾活血治疗可以提高EM患者子宫内膜容受性,诱发成熟卵泡排卵,促进黄体发育,提高黄体功能。谈勇[10]认为EM患者IVF-ET周期的各阶段采用补肾活血法治疗,可获得良好的妊娠率。同时,结合目前临床西医使用阿司匹林改善患者子宫内膜容受性的治法,我们认为活血化瘀治疗EM的助孕机理,可能从改善胚泡质量而提高妊娠率。
本研究通过建立子宫内膜异位症小鼠模型,结合IVF技术,通过观察小鼠体外受精以及受精后胚胎卵裂和发育情况,研究发现EM可降低模型小鼠的平均促排卵数、体外受精率、受精后二细胞及四细胞卵裂率和桑葚胚最终形成率,而对体外受精后四细胞发育至桑葚胚期的桑葚胚形成率无影响。活血消异方可提高模型小鼠的平均促排卵数、体外受精率、受精后二细胞及四细胞卵裂率和桑葚胚最终形成率,而对体外受精后四细胞发育至桑葚胚期的桑葚胚形成率无影响。因此,EM影响胚胎早期发育,降低胚胎发育质量,而活血消异方可能通过改善胚胎发育环境,从而提高胚胎质量,从而提高EM相关不孕的妊娠率。
子宫内膜异位症会影响卵泡发育过程的不同阶段:引起卵泡生长缺陷;卵细胞质量差;卵泡发生黄体化不破裂;输卵管周边受到侵蚀,功能受损;精子在宫腔内活动性减弱;卵细胞受精能力下降;胚胎卵裂减慢;胚胎着床能力下降。
在排卵过程中,卵泡液随着卵细胞一起从卵泡中被释放出来,因而有可能对受精过程和胚胎的发育产生一定影响。李新玲等[11]研究结果表明,EM患者的卵泡液与鼠胚共培养,发现各期胚胎的发育受到抑制,提示EM患者卵泡液可能抑制早期胚胎的发育并存在毒性作用。EM患者在位子宫内膜与鼠胚共培养,发现各期胚胎发育均受到明显抑制,推测内异症可能影响胚胎发育,降低胚胎质量,这可能是导致内异症相关不孕的原因之一。
胚泡植入是建立妊娠的第一步,目前己知性激素、细胞因子、免疫因子、糖类、肽类以及酶类等物质对植入的调控至关重要,其中基质金属蛋白酶(MMPs)及其天然抑制剂(TIMPs)这一组锌依赖性的蛋白水解酶与胚泡植入密切相关。故MMPs在胚泡植入时溶解ECM以利着床,在月经期分解ECM以利内膜剥脱。在此过程中,MMPs对宿主ECM的溶解作用受TIMPs的调控。Tabibzadeh等[12]发现在植入的小鼠胚泡中主要的蛋白酶是MMP-9,而在这一过程中小鼠宫内膜产生的TIMP是TIMP-3,使用定量RT-PCR可以检测植入过程中TIMP-3 mRNA表达。Wang等[13]通过RT-PCR检测了植入前胚胎发育的不同阶段TIMPs mRNA的表达,发现TIMP-1,-3mRNA在胚胎发育的全部阶段中都检测到,而在接近植入前的阶段,表达TIMP-1,-3mRNA的胚胎数量明显增加。因此,我们认为,EM可能导致胚泡种植过程中对子宫内膜ECM的过度溶解,从而导致着床失败。活血消异方能通过调整胚泡MMP-9/TIMP-3的平衡,改善胚泡着床情况。但本研究尚未对胚胎及子宫内膜进行分子和基因相关的检测,尚待进一步深入研究。
随着辅助生殖技术的发展,造福了一大批EM相关不孕的患者。但辅助生殖技术并不能解决所有问题。如何安全、有效地提高EM患者妊娠率,是中西医共同面临的难题。本研究通过行体外受精观察胚胎发育情况来探讨活血消异方对EM相关不孕患者的胚胎质量,为中医药提高EM妊娠率提供科学依据,并为进一步探讨中医药在EM辅助生殖领域中的作用及调控机制奠定基础。
参考文献:
[1]张惜阴. 实用妇产科学(第2版)[M]. 北京: 人民卫生出版. 2003: 745- 749.
[2]Bininghan A. Endometriosis and infertility[J]. Fertil Steril, 2004, 82:(1): 40-45.
[3]Buyalos RP, Agaiwal SK.Endometriosis-associated infertility [J]. Curr Opin Obstet Gynecol, 2000, 12(5): 377-381.
[4]Bamhart K, Dunsmoor-Su R, Coutifaris C. Effect of endometriosis on in vitro fertilization [J]. Fertil Steril, 2002, 77(6): 1148-1155.
[5]李靖, 李炫诚, 吴云霞. 确定小鼠动情周期的三种方法 [J]. 实验动物科学, 2007, 24(3): 63-64, 62.
[6]马丽, 谢淑武, 朱焰, 等. 注射法小鼠下下子宫内膜异位症模型及组织学观察 [J]. 中国实验动物学报, 2008, 16(3): 192-195.
[7]郭方, 徐丛剑. 腹腔注射甲氨蝶呤对小鼠异位内膜生长的影响 [J]. 中国实用妇科与产科杂志, 2007, 23(9): 692-693.
[8]杨桂云, 刘红林. 补肾活血方对子宫内膜异位症不孕腹腔液微环境改善作用的实验研究 [J]. 中医药学刊, 2003, 21(1): 58-59.
[9]具春花, 陈玲. 补肾活血方对内异症伴不孕患者子宫内膜的影响 [J]. 辽宁中医杂志, 2008, 35(5): 722-723.
[10]王艳妮, 谈勇. 补肾活血法在子宫内膜异位症不孕患者行试管婴儿术中的应用体会[J]. 实用中医药杂志, 2010, 26(4): 264.
[11]李新玲, 连方, 刘延荷. 祛瘀解毒颗粒治疗子宫内膜异位症患者卵泡液对小鼠胚胎发育的影响 [J]. 中国中西医结合杂志, 2009, 29(11): 1001-1004.
[12]Tabibzadeh S. Decoding implantation and menstruation: the tale of two opposing signals [J]. Front Bio Sci, 2002, 7: 475-486.
[13]Wang H, Wen Y, Mooney S, et al. Matrix metalloproteinase and tissue inhibitor of matrix metalloproteinase expression in human preimplantation embryos [J]. Fertil Steril, 2003, 80(Suppl 2): 736-742.
〔修回日期〕2015-06-13
研究报告
Effects of a Chinese traditional medicine, Huoxue Xiaoyi Fang, on embryo
development after in vitro fertilization in mouse models of endometriosis
CUI Yang-yang1, SUN Wei-wei1, ZHAO Rui-hua1, XU-Cai1, WU Tian-si1,2
(1. Department of Gynecology, Guang’anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China;
2. Beijing University of Chinese Medicine, Beijing 100029)
【Abstract】ObjectivesTo evaluate the effect of a Chinese traditional medicine, Huoxue Xiaoyi Fang, on the embryo development after in vitro fertilization (IVF) in mouse models of endometriosis. Methods To observe the quantity of oocytes including the average number of superovulation, fertility rate, 2-cell and 4-cell embryo cleavage rates at different stages in vitro fertilization, and morulation rate among the traditional Chinese medicine group (TCM group), endometriosis model group (EM model group) and sham-operated group. To explore the influence of endometriosis and the effect of Huoxue Xiaoyi Fang on the quantity of oocytes and embryonic development after IVF in the mouse models of endometriosis. Results All the average number of superovulation, fertility rate, 2-cell and 4-cell embryo cleavage rates in the three groups showed significant differences (P<0.05), and the average number of superovulation was in an order of sham operated group>TCM group>model group. There were no significant differences in the morulation rates in the three groups (P>0.05). There were significant differences among the IVF rates of the three groups (P<0.05), and to be in an order of sham operated group>TCM group>model group. There were significant differences in the final morulation rate among the three groups (P<0.05). ConclusionsEndometriosis may influence the quality of embryonic development of EM model mice, including reduced average number of superovulation, fertility rate, and embryo cleavage rate. The Chinese traditional medicine Huoxue Xiaoyi Fang can improve the the quantity of embryonic development after IVF.
【Key words】Endometriosis; Infertility; in vitro fertilization; Embryos quality; Mice
doi:10.3969.j.issn.1671.7856. 2015.008.007
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2015) 08-0031-06
[通讯作者]赵瑞华,女,博士生导师, 研究方向: 子宫内膜异位症、不孕症、月经失调方向。 E-mail: rhzh801@126.com。
[作者简介]崔阳阳(1987-),女,硕士,专业:中医妇科学,E-mail: cuiyang870216@163.com。
[基金项目]国家自然科学基金(No:81173297)。

