香蕉抗坏血酸过氧化物酶基因的克隆及表达分析
王卓+徐碧玉+贾彩红+李健平

摘 要 抗坏血酸过氧化物酶(Ascorbate peroxidase, APX)是植物重要的过氧化氢(Hydrogen peroxide, H2O2)清除酶之一。通过RACE(Rapid-amplification of cDNA ends)方法从香蕉根系cDNA均一化全长文库中获得一个抗坏血酸过氧化物酶基因,命名为MaAPX2基因。MaAPX2基因是香蕉APX基因编码框全长cDNA,包含一个750 bp的最大开放阅读框(Open Reading Frame, ORF),编码249个氨基酸的蛋白质。蛋白质序列结构域比对发现,在MaAPX2 N端具有典型的APX活性位点(APLMLPLAWHSA)和过氧化物酶近端血红素配体序列(DIVALSGGHTL)的保守结构域,属于典型的APX蛋白。系统进化树比对分析表明,MaAPX2与马蹄莲ZaAPX(AAC08576.1)的亲缘关系较近。组织特异性研究表明,MaAPX2基因组成型表达于香蕉各个组织,在叶片中表达量最大。在耐病和感病品种中,MaAPX2基因均上调表达,但在耐病品种中MaAPX2基因在所有时间点相对于对照增加的倍数均高于感病品种,表明该基因在香蕉的抗病性中起着重要作用。MaAPX2基因可以作为一个新的响应枯萎病侵染的标记基因。
关键词 香蕉 ;抗坏血酸过氧化物酶 ;基因克隆 ;表达分析
分类号 S668.1
Molecular Cloning and Expression of Ascorbate Peroxidase Gene
from Banana(Musa acuminata L. AAA group,cv. Cavendish)
WANG Zhuo1) XU Biyu1) JIA Caihong1) LI Jianping1)
LIU Juhua1) ZHANG Jianbing1) MIAO Hongxia1) JIN Zhiqiang1,2)
(1 Institute of Tropical Bioscience and Biotechnology, CATAS, Haikou, Hainan 571101, China;
2 Haikou Experimental Station, CATAS, Haikou, Hainan 570102 China)
Abstract Ascorbate peroxidase (APX) is one of the key enzymes of hydrogen peroxide scavenging in plants. In this study,we reported the molecular characteristics of APX gene cloned from banana (Musa acuminata L. AAA group,cv. Cavendish) using a RACE-PCR-based strategy. MaAPX2 contained an open reading frame (ORF) of 750 bp which encoded a polypeptide of 249 amino acids. Protein alignment showed that MaAPX2 contain the complete typical conserved APX active-site signature and proximal heme-ligand motif, which belongs to a typical APX protein. Phylogenetic analysis showed that the deduced amino acid sequences of MaAPX2 also have high similarity to ZaAPX (AAC08576.1) from Zantedeschia aethiopica. Tissue-specific studies showed that the expression of MaAPX2 was constitutively expressed in various tissues of banana seedling. In resistant and susceptible varieties of banana after inoculation Foc TR4, the expression of MaAPX2 was decreased. While in resistant varieties the time point of MaAPX2, compared to control, increased higher than that in susceptible varieties at time points,indicated that this gene played an important role in banana resistance. MaAPX2 could be a new marker gene in banana seedling under the infection of Foc TR4.
Keywords banana ; ascorbate peroxidase ; gene clone ; expression analysis
在正常生理活动时,活性氧(Reactive oxygen species, ROS)含量处于一定的动态平衡。低浓度的ROS可作为胞内信号分子,调控相关基因的表达;然而过量的ROS则会引起胞内膜脂过氧化、膜蛋白聚合等反应,损伤植物细胞膜[1]。过氧化氢(Hydrogen peroxide, H2O2)是ROS的一种[2],参与植物对病原菌的防卫反应[3],是植物与病原菌互作时形成的产物[4-5]。抗坏血酸过氧化物酶(Ascorbate peroxidase, APX)(EC 1.11.1.11)属于Ⅲ类过氧化物酶,以抗坏血酸(Ascorbic acid, AsA)为底物将H2O2转化为H2O,进而维持植物体内H2O2含量处于正常水平[6]。在植物中,APX基因编码的蛋白根据在细胞中分布的位置可分为细胞质、叶绿体、线粒体和过氧化物酶体四种类型[7]。在植物-病原菌互作中,如烟草和烟草花叶病毒[8]、水稻和稻瘟菌[9]、葡萄和白粉病菌[10]、甜瓜和白粉菌[11],APX基因的表达均受病原菌侵染的诱导,表明APX基因在植物-病原菌互作中起着重要作用。到目前为止,MaAPX1基因参与香蕉果实采后成熟,受乙烯和ABA的调控[12]。在香蕉A基因组中预测出12个APX基因[13],表明香蕉APX基因的克隆及功能分析还需进一步完善。然而到目前为止,还没有进一步研究APX基因与枯萎病关系的相关报道。
香蕉是热带、亚热带发展中国家重要的农作物之一。其果实由于富含丰富的蛋白质和碳水化合物,是部分热区的主要粮食和国民收入的主要来源[14]。然而香蕉枯萎病严重威胁香蕉的正常生产[15]。抗病育种是克服香蕉枯萎病的方法之一[16],目前生产上主栽的品种‘巴西蕉由于是三倍体且生长周期长,杂交育种方法很难开展抗病育种,因此筛选及鉴定基于射线诱变、化学诱变及自然突变体抗枯萎病株系是有效的途径。目前在香蕉中参与香蕉抗病的重要的标记基因报道较少。本研究从香蕉中分离并克隆一个MaAPX基因,利用生物信息学网站分析了该基因的结构特性,采用荧光定量技术分析了该基因的表达模式,进一步了解MaAPX基因参与香蕉抗枯萎病过程的调控机理,开发可供进一步使用的香蕉抗枯萎病种质鉴定的标记基因,具有重要的理论和实践意义。
1 材料与方法
1.1 材料
供试香蕉品种为‘巴西蕉(cv. Cavendish)和‘农科1号(cv. Nongke No.1),购自中国热带农业科学院组培中心,苗龄为移栽大棚后约60 d的健康杯苗,其中‘巴西蕉为枯萎病菌感病品种,‘农科1号为耐病品种。香蕉枯萎病菌4号生理小种[Fusarium Oxysporum f specialis (f. Sp) cubense Tropical Race 4, Foc TR4],为中国热带农业科学院环境与植物保护研究所张欣博士馈赠。
1.2 方法
1.2.1 MaAPX2基因克隆及分析
在香蕉根系cDNA全长均一化文库随机测序的克隆中[17],获得一条APX基因序列,设计5'RACE引物,按照SMARTTM RACE cDNA Amplification Kit(Clontech)说明书进行RACE反应,获得完整的ORF。将该基因序列在经过NCBI核酸数据库B进行同源检索、分析其核酸序列及其编码蛋白质的结构特点;并利用MEGA4.0软件分析该基因编码的蛋白序列与NCBI数据库(http://www.ncbi.nlm.nih.gov/blast)和香蕉A基因组数据库(http://banana-genome.cirad.fr/tools.html)中相应蛋白序列的进化关系。
1.2.2 MaAPX2基因在香蕉不同器官的表达分析
选取生长8个月的香蕉根、球茎、假茎、叶、花和果实,参照略作修改的Wan和Wilkins[18]报道的方法提取上述各组织总RNA。利用Invitrogen SuperScript TMⅢ Reverse Transcriptase试剂盒合成cDNA。在MaAPX2基因5′端非保守区域设计引物,引物为P1(5′-GAGAAGGGAGAACGGAGTC-3′)和P2(5′-TCCCACCTTGAAGTTGCT-3′)。MaActin1引物为NP1(5′-CGAGGCTCAATCAAAGA-3′)和NP2(5′-ACCAGCAAGGTCCAAAC-3′)。以MaActin1基因片段为内参,采用荧光定量PCR方法对其进行组织特异性表达分析,反应程序如下:95℃预变性3 min;95℃变性7 s,60℃退火15 s,72℃延伸20 s,循环40次。实时定量PCR采用SYBR Green染料,在吉泰生物科技公司Mx 3005P荧光定量PCR仪上进行。
1.2.3 MaAPX2基因在香蕉接种Foc TR4后的表达分析
将Foc TR4孢子悬浮液,接种于马铃薯葡萄糖琼脂培养基(PDA)上,28 ℃培养7 d,收集Foc TR4孢子。将‘巴西蕉(cv. Cavendish AAA)和‘农科1号(cv. Nongke No.1)分为2组,每组60株幼苗。以蘸根接菌法接种Foc TR4,接种浓度为每毫升为1×106个孢子。接种后2、4、6 d取样,以未接种的0 d为对照。以接种后不同时间点的香蕉根系cDNA第一链为模板,引物同“1.2.2”,采用实时荧光定量PCR检测MaAPX2基因的表达,反应程序同“1.2.2”。
1.3 数据统计分析
每个实验组均做3次生物重复,利用SAS软件(SAS 9.0 for Windows)进行显著性分析,“**”、“*”分别表示差异达到极显著(p<0.01)和显著水平(p<0.05)。结果用KyPlot软件进行绘图。
2 结果与分析
2.1 MaAPX2基因克隆与序列分析
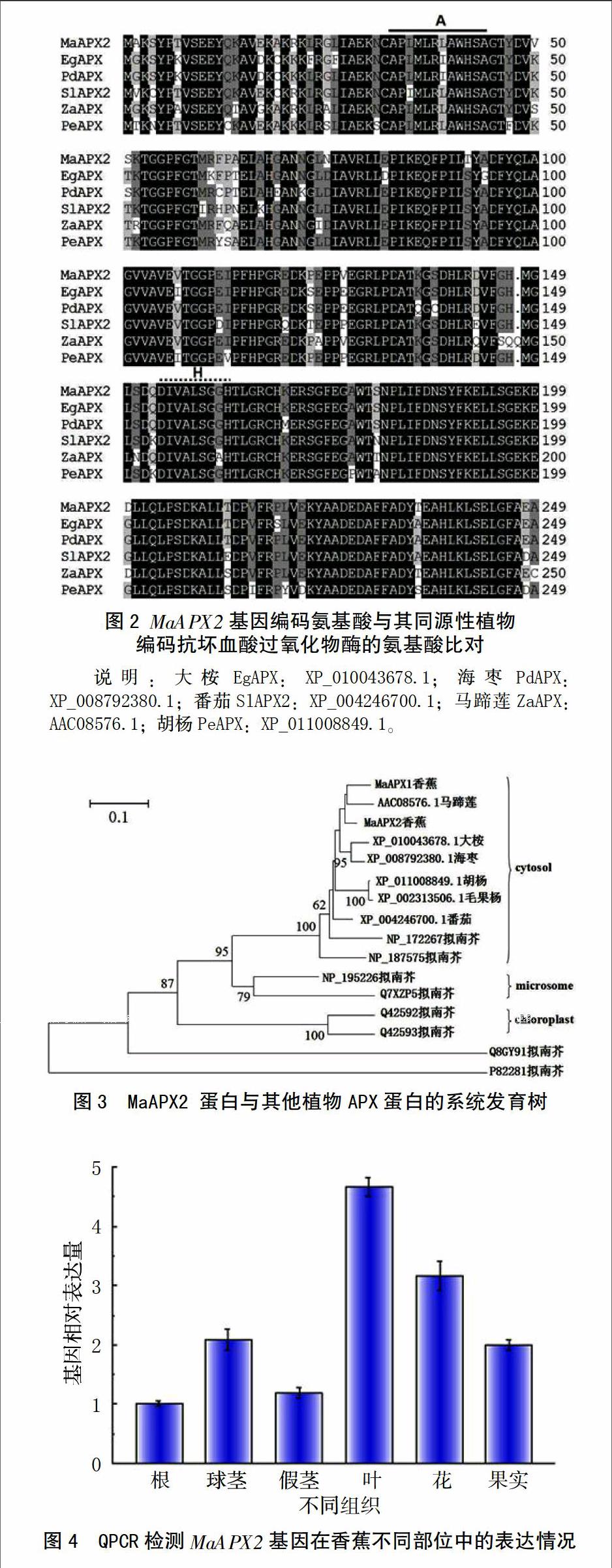
测序后经BLAST比对发现,该序列与其他植物APX基因序列具有较高的同源性,表明该序列是香蕉APX基因编码框全长cDNA,命名为MaAPX2。MaAPX2基因序列全长为990 bp,其中5′非翻译区48 bp,3′非翻译区181 bp,含有一个750 bp的ORF,编码249个氨基酸残基(图1)。MaAPX2基因推导的蛋白质分子量为27.37 ku,等电点为5.31。在推导的蛋白序列方面,MaAPX2与其他植物的APX的蛋白序列具有较高的相似性(图2)。MaAPX2基因在香蕉A基因组[13]进行比对,找到与其高度同源的GSMUA_Achr5P07280_001基因,二者仅有2个核苷酸存在差异,分别位于第455、521号位点;进一步比较发现,二者氨基酸序列一致。在GenBank中对MaAPX2蛋白质进行保守结构域搜索和同源性分析,它的氨基酸序列在N端具有典型的APX活性位点(APLMLPLAWHSA)(图2 A区域)和一个过氧化物酶近端血红素配体序列(DIVALSGGHTL)(图2 H区域),表明MaAPX2蛋白属于APX家族成员。为了研究MaAPX2与其它各物种间的进化关系,将MaAPX2的氨基酸序列和其它植物的APX氨基酸序列利用软件MEGA4.0中的N-J的方法构建系统进化树,由图3可见,所有APX蛋白可以分为4个类型。MaAPX2分属于细胞质型APX蛋白,它与马蹄莲(Zantedeschia aethiopica)的ZaAPX(AAC08576.1)同源关系最近(图3)。
2.2 MaAPX2基因组织特异性表达分析
MaAPX2在根中表达量最低;叶中表达量最高,是根中的4.7倍;花、球茎和果实中表达量较高,其表达量是根系中相对表达量的3.2和2.1倍(图4)。
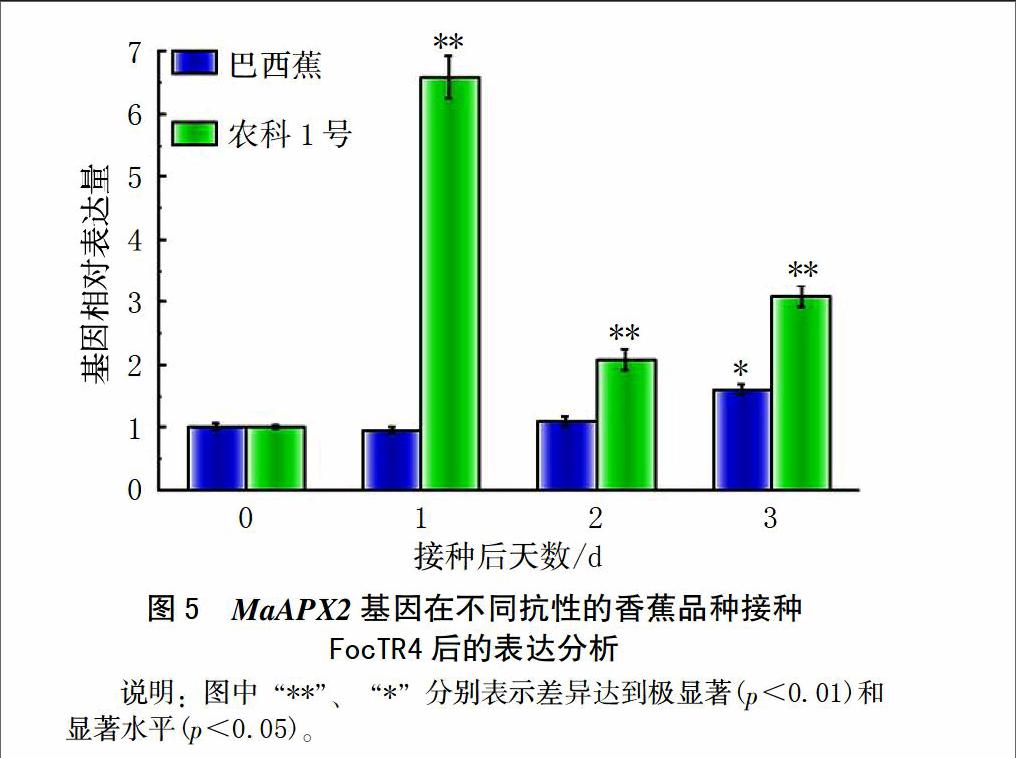
2.3 MaAPX2基因在不同抗性的香蕉品种接种Foc TR4后的表达分析
在感病品种中,MaAPX2基因的相对表达量在接种Foc TR4后1和2 d变化不大,在接种后3 d,其相对表达量是对照的1.6倍(图5)。在耐病品种中MaAPX2基因的相对表达量在接种Foc TR4后显著增加,在1 d达到最大,是对照的6.6倍;虽然在接种2和3 d有所降,但其表达量还是高于对照,同样其相对表达量也高于感病品种。因此,从相对表达量的变化上看,MaAPX2基因在感病品种中变化不显著,而在耐病品种中被显著激活,而且耐感品种中表达模式与抗性相关,表明该基因可能参与香蕉抗枯萎病的过程。
3 讨论
活性氧物质的生成是植物防御反应重要步骤[1,19],APX是与H2O2亲和力最强的过氧化物酶,在植物响应病原菌侵染过程中具有重要的作用[8]。本研究获得一个全长香蕉APX基因。在序列分析方面,该基因与其他植物的APX基因具有较高的同源性。MaAPX2基因编码的蛋白质在氨基酸的数目、分子量和等电点等方面,与已报道的MaAPX1相似[12],同样也与其它植物APX蛋白特征相似[9-11]。MaAPX2基因推导氨基酸序列中包含一个APX活性位点(AP-LMLPLAWHSA,图2A区域)和一个过氧化物酶近端血红素配体序列(DIVALSGGHTL)[20]。同时MaAPX2基因与香蕉A基因组中预测出的chr5T07280_001高度同源,表明栽培的巴西蕉品种(AAA group)与测序的DH-Pahang品种(AA group)亲缘关系很近,同样结果也表明,2个品种的APX基因是同源基因,其差异主要是序列间的SNP形成的(结果未列出),这些SNP可以作为潜在的分子标记为后续的香蕉育种服务。植物APX基因家族由4个亚家族组成,分别为细胞质、叶绿体、线粒体和过氧化物酶体基因亚家族[7]。在拟南芥中包含8个APX基因成员[21-23],APX1、APX2和APX6基因编码的蛋白位于细胞质,sAPX基因编码的蛋白存在于叶绿体基质,结合在类囊体膜上的tAPX基因编码的蛋白位于叶绿体,APX3、APX4和APX5基因编码的蛋白存在于过氧化物酶体。聚类分析结果显示,MaAPX2与其他植物的细胞质型APX亲缘关系相近,表明MaAPX2是一个典型的香蕉细胞质型抗坏血酸过氧化物酶。
在多种植物如蝴蝶兰[24]、茶树[25]、黄芩[26]和甘蔗[27]中,APX基因在根、茎、叶和花等组织中均有表达,同样在本研究中供试的根、球茎、假茎、叶、花和果实中均检测到MaAPX2基因的表达,表明MaAPX2基因在香蕉组织中属于组成型表达,推测MaAPX2基因可能在香蕉的生长和发育过程中起着重要作用。APX基因与植物抗病密切相关[8-11],APX对H2O2高度亲和[6],因此在植物和病原菌互作时,APX酶活性对H2O2的含量起着重要的调控作用,进而影响植物的抗病性。在香蕉与枯萎病菌互作中APX酶活作为一个抗病指标水平,参与香蕉抗枯萎病的过程[28]。MaAPX2基因在感病品种中的基因表达被抑制,而在耐病品种中被激活,MaAPX2基因表达与香蕉抗病性正相关,说明该基因可能参与香蕉响应Foc TR4侵染的过程。目前,香蕉抗病种质的创制与筛选是解决香蕉枯萎病的有效方法之一,然而缺乏有效的抗病种质的鉴定方法。MaAPX2基因在耐病品种中表达趋势与感病品种相反且相对表达量的倍数高于感病品种,因此该基因可以当作一个新的检测枯萎病菌侵染的标记基因。今后将深入研究MaAPX基因参与香蕉抗枯萎病的内在机制,以期揭示APX在香蕉抗枯萎病中的生理作用。
参考文献
[1] Dat J, Vandenabeele S, Vranova E, et al. Dual action of the active oxygen species during plant stress responses[J]. Cellular and Molecular Life Sciences, 2000, 57(5): 779-795.
[2] Slesak I, Libik M, Karpinska B, et al. The role of hydrogen peroxide in regulation of plant metabolism and cellular signalling in response to environmental stresses[J]. ACTA BIOCHIMICA POLONICA-ENGLISH EDITION, 2007, 54(1): 39.
[3] Walters, D. Resistance to plant pathogens:possible roles for free polyamines and polyamine catabolism[J]. New Phytologist, 2003, 159(1): 109-115.
[4] Shetty N, Kristensen B, Newman M, et al. Association of hydrogen peroxide with restriction of Septoria tritici in resistant wheat[J]. Physiological and Molecular Plant Pathology, 2003, 62(6): 333-346.
[5] Unger C, Kleta S, Jandl G, et al. Suppression of the defence-related oxidative burst in bean leaf tissue and bean suspension cells by the necrotrophic pathogen Botrytis cinerea[J]. Journal of Phytopathology, 2005, 153(1): 15-26.
[6] Asada K. Ascorbate peroxidase-a hydrogen peroxide-scavenging enzyme in plants[J]. Physiologia Plantarum, 1992, 85(2): 235-241.
[7] Shigeoka S, Ishikawa T, Tamoi M, et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany, 2002, 53(372): 1 305-1 319.
[8] Mittler R, Lam E, Shulaev V, et al. Signals controlling the expression of cytosolic ascorbate peroxidase during pathogen-induced programmed cell death in tobacco[J]. Plant molecular biology, 1999, 39(5): 1 025-1 035.
[9] Agrawal G, Jwa N, Iwahashi H, et al. Importance of ascorbate peroxidases OsAPX1 and OsAPX2 in the rice pathogen response pathways and growth and reproduction revealed by their transcriptional profiling[J].Gene, 2003, 322: 93-103.
[10] Lin L, Wang X, Wang Y. cDNA clone, fusion expression and purification of the novel gene related to ascorbate peroxidase from Chinese wild Vitis pseudoreticulata in E. coli[J]. Molecular biology reports, 2006, 33(3): 197-206.
[11] Cheng H, He Q, Huo Y, et al. Molecular cloning, characterization and expression analysis of CmAPX[J]. Molecular biology reports, 2009, 36(6):1 531-1 537.
[12] Wang Z, Jin Z, Wang J, et al. Cloning and characterization of an ascorbate peroxidase gene regulated by ethylene and abscisic acid during banana fruit ripening[J]. African Journal of Biotechnology, 2012, 11(43):10 089.
[13] D'Hont A, Denoeud F, Aury JM, et al. The banana (Musa acuminata) genome and the evolution of monocotyledonous plants[J]. Nature, 2012, 488(7410):213-217.
[14] Aurore G, Parfait B, Fahrasmane L. Bananas, raw materials for making processed food products[J]. Trends in Food Science & Technology, 2009, 20(2):78-91.
[15] Hwang SC, Ko WH. Cavendish banana cultivars resistant to Fusarium wilt acquired through somaclonal variation in Taiwan[J]. Plant disease, 2004, 88(6):580-588.
[16] 魏岳荣,黄秉智,杨 护,等. 香蕉镰刀菌枯萎病研究进展[J].果树学报,2005,22(2):154-159.
[17] 王 卓,殷晓敏,王家保,等. 香蕉根系均一化全长cDNA文库的构建和鉴定[J]. 园艺学报,2011,38(9):1 667-1 674.
[18] Wan CY, Wilkins T A. A modified hot borate method significantly enhances the yield of high-quality RNA from cotton (Gossypium hirsutum L.)[J]. Analytical biochemistry, 1994, 223(1):7-12.
[19] Mittler R, Vanderauwera S, Suzuki N, et al. ROS signaling:the new wave?[J]. Trends in plant science, 2011, 16(6):300-309.
[20] Bairoch A. PROSITE:a dictionary of sites and patterns in proteins[J]. Nucleic Acids Research, 1991, 19(Suppl):2241.
[21] Mittler R, Vanderauwera S, Gollery M, et al. Reactive oxygen gene network of plants[J]. Trends in plant science, 2004, 9(10):490-498.
[22] Panchuk I, Volkov R, Schoffl F. Heat stress-and heat shock transcription factor-dependent expression and activity of ascorbate peroxidase in Arabidopsis[J]. Plant Physiology, 2002, 129(2):838-853.
[23] Narendra S, Venkataramani S, Shen G, et al. The Arabidopsis ascorbate peroxidase 3 is a peroxisomal membrane-bound antioxidant enzyme and is dispensable for Arabidopsis growth and development[J]. Journal of experimental botany, 2006, 57(12):3033-3042.
[24] 许传俊,孙叙卓,李 玲,等. 蝴蝶兰抗坏血酸过氧化物酶基因克隆及其表达研究[J]. 园艺学报,2012,39(4):769-776.
[25] 孙 云,江春柳,赖钟雄,等. 茶树鲜叶抗坏血酸过氧化物酶活性的变化规律及测定方法[J]. 热带作物学报,2009,29(5):562-566.
[26] 谢小群,高山林. 黄芩过氧化酶同工酶电泳和抗坏血酸过氧化物酶活性分析[J]. 植物资源与环境学报,2002,11(1):5-8.
[27] 王竹青,陈 云,杨玉婷,等. 甘蔗抗坏血酸过氧化物酶基因(ScAPX)的克隆及表达分析[J]. 农业生物技术学报,2015,23(2):170-180.
[28] Borges A, Borges-Perez A, Fernandez-Falcon M. Induced resistance to Fusarial wilt of banana by menadione sodium bisulphite treatments[J]. Crop Protection, 2004, 23(12):1 245-1 247.

