基于IFCC参考测量程序实现常规检测系统量值溯源的可行性探索
基于IFCC参考测量程序实现常规检测系统量值溯源的可行性探索
邓拥军1,石英1,周俊2,吴立山2,沈敏2
(1. 湖北省中医院检验科,湖北 武汉 430074;
2. 宁波美康生物科技股份有限公司参考实验室,浙江 宁波 315104)
摘要:目的探讨基于国际临床化学与检验医学联合会(IFCC)参考测量程序对常规检测系统实现量值溯源的可行性分析。方法以乳酸脱氢酶(LDH)为例,采用IFCC参考测量程序和常规检测系统(以下简称A法)同时测定20份不同浓度冷冻人混合血清样本。按《临床检验质量管理技术基础》中判定依据和偏移图分析法进行评价常规检测系统测量结果的正确度,对存在系统偏移的常规方法通过回归分析进行厂家校准品认定值校正,并测定20份不同浓度的新鲜单人份血清验证校正后该方法(以下简称B法)测量结果的正确性。结果A法与IFCC参考测量程序测定结果的直线回归方程为Y=1.092X-4.529,平均偏移为7.24%,B法校准品校正值为174 U/L。经验证B法与IFCC参考测量程序测定结果的直线回归方程为Y=0.988X-0.470,平均偏移降为-1.37%。结论A法测量结果明显偏高于参考测量程序测量结果,经校正建立的B法与参考测量程序测定结果一致。
关键词:乳酸脱氢酶;常规方法;参考测量程序
中图分类号:
文章编号:1673-8640(2015)10-1039-05Q554
文献标志码:A
DOI:10.3969/j.issn.1673-8640.2015.10.018
Abstract:ObjectiveTo investigate the feasibility for metrological traceability of conventional determination system based on the International Federation of Clinical Chemistry and Laboratory Medicine(IFCC)reference measurement procedure. MethodsThe 20 frozen serum samples with different concentrations were determined for lactate dehydrogenase(LDH)according to IFCC reference measurement procedure and routine method (as A method). The accuracy was evaluated according to the guideline of the Basic Quality Management Practice in Clinical Laboratory and the offset graph graphical-analysis. If the routine method existed bias, the calibration value was corrected by regression analysis. The fresh single serum samples of LDH were determined simultaneously by IFCC reference measurement procedure and routine method (as B method) in order to verify the accuracy measured by A method. ResultsThe regression equation with A method and IFCC reference measurement procedure was Y=1.092X-4.529, and the average bias value was 7.24%. B method calibrators′ correction value was 174 U/L. The regression equation with B method and IFCC reference measurement procedure was Y=0.988X-0.470, and the average bias value was -1.37%. ConclusionsThe results of A method are significantly higher than those of IFCC reference measurement procedure, and the results of B method established through amendments are consistent with those of IFCC reference measurement procedure.
作者简介:邓拥军,1970年生,硕士,副主任技师,主要从事临床化学检验工作。
收稿日期:(2014-11-08)
Investigation on the feasibility for metrological traceability of conventional determination system based on IFCC reference measurement procedureDENGYongjun1,SHIYing1,ZHOUJun2,WULishan2,SHENMin2.(1.DepartmentofClinicalLaboratory,HubeiHospitalofTraditionalChineseMedicine,HubeiWuhan430074,China; 2.ReferenceLaboratory,NingboMedicalSystemBiotechnologyCo.,Ltd.,ZhejiangNingbo315104,China)
Key words: Lactate dehydrogenase;Routine method;Reference measurement procedure

血清乳酸脱氢酶(lactate dehydrogenase,LDH)是临床实验室检测频率极高的项目之一,是心肌梗死、肝病和某些恶性肿瘤等疾病诊断、治疗监测的重要指标。既往研究表明血清LDH常规方法测定结果各实验室之间缺乏可比性[1-2],已影响临床诊断和治疗。根据ISO15189要求[3],各实验室测定结果应准确并可溯源。按ISO18153文件要求[4],血清LDH测定结果应溯源至国际临床化学与检验医学联合会(the International Federation of Clinical Chemistry and Laboratory Medicine,IFCC)参考测量程序[5]。在我国,临床实验室多采用自动生化分析仪的常规方法测定血清LDH活性,这类方法测定结果的正确度与校准品直接相关[6-8]。
我们采用厂家校准品认定值校准的常规方法与IFCC参考测量程序2种模式同时测定20份不同浓度冷冻人混合血清样本,判定常规方法测定结果的正确性。对存在系统偏倚的常规方法通过回归分析进行厂家校准品认定值校正,并采用20份不同浓度的新鲜单人份血清验证校正后该方法测定结果的正确度。
材料和方法
一、材料
1. 仪器(1)参考测量程序仪器:UV-2450 紫外可见分光光度计(日本SHIMADZU公司)、1523型点温度计(美国FLUKE公司)、XS205DU型分析天平(瑞士METTLER TOLEDO公司)、SevenMulti型pH计(瑞士METTLER TOLEDO公司)、移液器(德国Eppendorf AG公司),所用仪器均通过相关部门鉴定或参考实验室内部文件校准;(2)常规检测方法仪器:雅培C-8000全自动生化分析仪(美国雅培公司)。
2 .试剂(1)参考测量程序试剂:NAD锂盐(95%)、N-甲基-D-葡萄糖胺(99%)、β-NAD游离酸(98%)、L-乳酸、锂盐(99.7%)、氯化钠(99.5%),均购自美国Sigma公司;(2)常规方法试剂:试剂为宁波美康生物科技股份有限公司(简称美康生物)生产的LDH试剂盒。
3. 参考物质、质控品、校准品(1)参考物质:参考测量程序准确性评价用参考物质为有证参考物质ERM-AD453[批号为000931,认定值±不确定度为(502±7)U/L];(2)质控品:参考测量程序精密度评价用质控品为C.f.a.s(Roche公司);(3)校准品:常规方法的校准品由美康生物提供,A法的校准品由美康生物初步定值(191.52 U/L);B法的校准品由美康生物参考实验室最终定值(174.0 U/L),可以溯源到ERM-AD453。按说明书规定复溶和使用ERM-AD453、质控品、常规方法校准品。
4. 血清样品的制备收集湖北省中医院非传染性疾病患者血清20份,血清LDH浓度范围为109~500 U/L,制备成20份不同浓度人血清样本,冷冻于-70 ℃保存。使用前从-70 ℃取出,室温融解后使用;常规方法偏倚校正效果验证使用的血清样本为检测当天收集的20份不同浓度的新鲜单人份血清。
二、方法
1. 参考测量程序测定美康生物参考实验室按照IFCC参考测量程序[5]第3部分准备实验条件,用参考物质ERM-AD453验证参考测量程序测定结果正确度,要求:3次测定结果在“认定值±不确定度”范围内。该室自建立IFCC参考测量程序后每年都通过参加国际室间比对实验来维持测定结果的正确度(IFCC-RELA能力验证,具体见http://www.dgkl-rfb.de:81/;美康生物参考实验室为87号实验室)。用C.f.a.s质控品验证参考测量程序的精密度,要求:样本每天测定5次,连续测定2 d,10次测定的变异系数(CV)<1%。在参考测量程序测量的正确度和精密度达到要求后进行20份不同浓度冷冻人混合血清样本测定。测定顺序为质控品→样本→质控品,每个样本重复测定2次,其均值作为评价数据,每10份血清加测一个质控品。
2. 常规方法(A法)测量的正确性评价实验方法常规方法测量系统由美康生物校准品、试剂、试剂配套参数及雅培C-8000全自动生化分析仪组成,严格按照厂家说明书规定进行20份不同浓度冷冻人混合血清样本的LDH测量,测定顺序为质控品→样本→质控品,每个样本重复测定2次,其均值作为评价数据[9]。
3. 常规方法测量的系统偏倚校正效果验证实验在雅培C-8000全自动生化分析仪的2个测量通道上分别以美康生物校准品的认定值、校正值作为校准值校准常规方法,同时测量20份不同浓度的新鲜单人份血清。测定顺序为质控品→样本→质控品,每个样本重复测定2次,以均值作为评价数据。按EP9-A2文件方法判断数据的有效性[10]。验证校正后的方法称B法。
三、统计学方法
采用Origin 8.0软件进行统计分析。以IFCC参考测量程序作为比较方法,厂家常规方法为待评价方法,进行回归分析和常规方法的正确度判定。常规方法的正确性依据回归方程斜率(k)=1.00±0.02、截距接近于0、设定偏移值(国际参考实验室室间质量评价LDH的合格标准为4.5%)进行判断[11]。对存在系统偏移的常规方法校正后测量结果的正确度,以IFCC参考测量程序作为比较方法,校正后的常规方法为待评方法(B法),采用同样模式进行正确性评价。
结果
一、 测定数据的有效性检验
本研究所有数据经检验无离群值。
二、IFCC参考测量程序测定性能评定
ERM-AD453的检测结果在“认定值±不确定度”范围内,用C.f.a.s样本验证参考测量程序的精密度,CV<1%,见表1。符合IFCC参考测量程序检测的性能要求。

表1 IFCC参考测量程序性能
三、常规方法测量的正确性评价实验结果
用经性能评定合格的参考测量程序和厂家常规系统同时测量20份不同浓度的冷冻人混合血清样本,以IFCC参考测量程序为比较方法,厂家测量系统(校准品认定值定标,A法)作为待评方法,依据《临床检验质量管理技术基础》[11]的判定依据和偏移图图形分析法进行回归分析评价。结果发现常规测量系统与IFCC参考测量程序测量结果存在系统偏差,其测量结果明显偏高,A法与参考测量程序的平均偏移为7.24%,见图1、图2。根据回归方程,调整校准品的认定值,校正后该方法校准品值为174.0 U/L。用修订常规系统 (B法)和参考测量程序再次同时测定20份不同浓度的冷冻人混合血清样本,发现修订常规系统和参考测量程序测量结果一致,B法与参考测量程序的平均偏移为-1.37%,见图3、图4。

图1 A法与IFCC参考测量程序测定结果比较
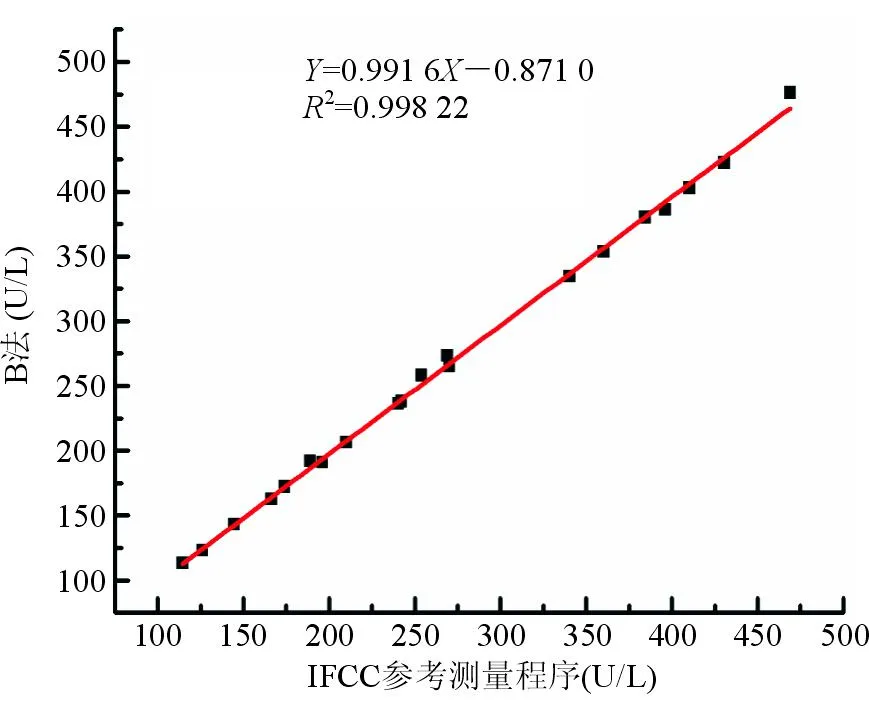
图2 B法与IFCC参考测量程序测定结果比较
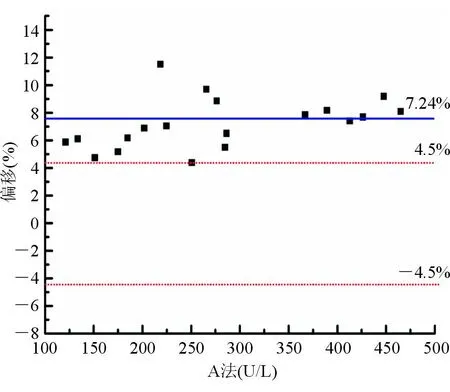
图3 A法与IFCC参考测定程序测定结果的偏移
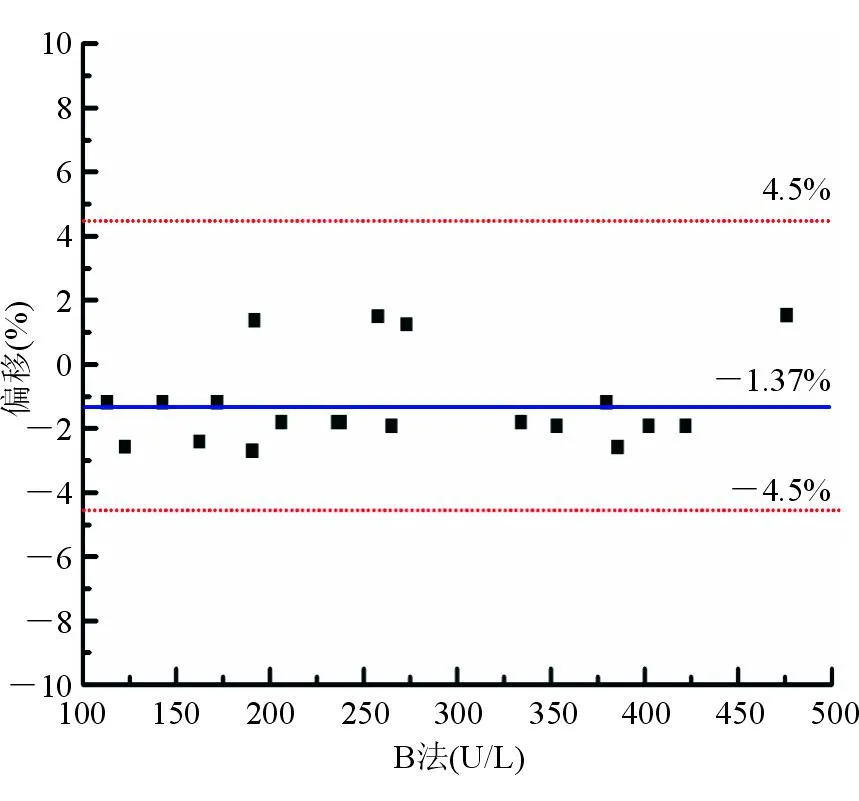
图4 B法与IFCC参考测定程序测定结果的偏移
四、常规方法测量的系统偏倚校正效果验证结果
以厂家常规方法A校准品校正值替代认定值建立B方法,用B方法和参考测量程序同时测量20份不同浓度的新鲜单人份血清,以验证其校正效果。校正后的相关方程为Y=0.988X-0.470,R2=0.998 5,依据回归方程的k在1.00±0.02范围内[11]、设定偏移值(国际参考实验室时间质量评价LDH合格标准4.5%)评价标准,B法测定结果正确,见图5。

图5 B法与IFCC参考测量程序校验结果比较及偏移图
讨论
常规检测系统包括仪器、试剂、校准品和操作程序,使用自动化分析仪日常检验的精密度得到了显著的提高;在优良试剂盒的配合下,结果可靠性的关键是准确度。在常规检测系统仪器、试剂和操作程序一定的情况下,决定新鲜患者标本测定结果准确性的关键因素是校准品值。本研究通过常规方法与参考测量程序进行方法学比对调节校准品值,实现临床样本测定结果的准确性,继而达到溯源的目的,这也是校准的意义所在。
目前,绝大多数临床实验室使用的是商品试剂盒或分析系统。因此,厂家产品校准品定值的溯源性显得尤为重要,欧盟体外诊断器具指令提出的溯源性要求和ISO17511及ISO18153都是针对诊断器具生产厂家。要实现临床检验量值溯源性,解决常规方法测量结果量值溯源问题[12-14],就是要建立并应用参考系统,参考系统通常包括参考物质、参考方法和参考实验室。由于参考系统工作对设施设备、人员技术等方面要求较高,操作繁琐,价格昂贵,而且要维持其成本很高。所以,参考实验室工作应该由少数有能力、有实力的优秀实验室来实施,一般常规检测实验室没有能力对检测方法进行所谓的“溯源性校正”。“溯源性校正”主要由体外诊断器具生产厂商进行。
本研究是美康生物参考实验室在建立LDH参考系统的基础上,采用IFCC参考测量程序评价常规方法测量结果的正确度。对存在系统偏倚的A方法的校准品重新赋值,建立校正后厂家常规方法(B法)与IFCC参考测量程序同时测定20份不同浓度的冷冻人混合血清样本。
用参考测量程序和厂家常规系统同时测定20份不同浓度的冷冻人混合血清样本,常规检测系统(A法)与参考测量程序测定结果线性回归方程为Y=1.092X-4.529,R2=0.999,平均偏移为7.24%。以《临床检验质量管理技术基础》[11]中2种方法的线性回归方程的k=1.00±0.02、截距≈0作为一致性的标准,再结合偏移图图形分析法(以参考测量程序测定结果为横坐标,常规方法测定均值与参考测量程序测定结果的偏移程度为纵坐标作图)进行回归分析评价。以常规方法与参考测量程序的平均偏移≤±4.5%为标准(IFCC允许偏移范围)判断常规方法的正确度。A法与IFCC参考测量程序测定结果存在系统偏差,其测定结果明显偏高(偏移为7.24%)。对存在系统偏移的A法的校准品重新赋值(174 U/L),建立校正后厂家常规方法(B法),并与IFCC参考测量程序同时测定20份不同浓度的冷冻人混合血清样本,B法与参考测量程序测定结果线性回归方程为Y=0.991 6X-0.871 0,R2为0.998 22,平均偏移降为-1.37%。结果表明A法校正后可实现测定结果正确。为了验证常规方法测定的系统偏移校正效果,采用B法与IFCC参考测量程序同时测定20份不同浓度的新鲜单人份血清,测定结果线性回归方程为Y=0.988X-0.470,R2=0.998 5,平均偏倚为-1.37%。结果进一步验证说明了A法校正后可实现测定结果正确。
参考文献
[1]CARL AB,EDWARD RA,DAVID EB. Tietz textbook of clinical chemistry and molecular diagnostics[M].Missouri:Elsevier Medicine,2011:112-113.
[2]王治国,李小鹏,武平原.临床检验室内质量控制数据实验室间比对[J].中华检验医学杂志,2004,27(10):701-702.
[3]International Standards Organization. Medical laboratories-particular requirements for quality and competence[S]. ISO 15189,ISO.2003.
[4]International Standards Organization. In vitro diagnostic medical devices measurement of quantities in biological samples metrological traceability of values for catalytic concentration of enzymes assigned to calibrators and control materials [S]. ISO 18153,ISO,2003.
[5]SCHUMANN G,BONORA R,CERIOTTI F,et al. IFCC primary reference procedures for the measurement of catalytic activity concentraions of enzymes at 37degrees C. Part 3.Reference procedure for the measurement of catalytic concentration of lactate dehydrogenase[J]. Clin Chem Lab Med,2002,40(6):643-648.
[6]CATTOZZO G,FRANZINI C,MELZI D′ERIL GM. Commutability of calibration and control materials for serum lipase[J]. Clin Chem,2001,47(12):2108-2113.
[7]CATTOZZO G,GUERRA E,CERIOTTI F,et al. Commutable calibrator with value assigned by the IFCC reference procedure to harmonize serum lactate dehydrogenase activity results measured by 2 different methods[J]. Clin Chem,2008,54(8):1394-1355.
[8]FRANCK PF,STEEN G,LOMBARTS AJ,et al. Multicenter harmonization of common enzyme results by fresh patient-pool sera[J]. Clin Chem,1998,44(3):614-621.
[9]陈宝荣,孙慧颖,邵燕,等.IFCC参考方法对两种测量系统GGT结果正确性的验证[J]. 标记免疫分析与临床,2011,18(5):336-341.
[10]Clinical and Laboratory Standards Institute. Method comparison and bias estimation using patient samples[S].EP9-A2,CLSI,2002.
[11]冯仁丰. 临床检验质量管理技术基础[M]. 上海:上海科学技术文献出版社,2003:7.
[12]PANTEGHINI M. Traceability as a unique tool to improve standardization in laboratory medicine [J]. Clin Biochem,2009,42(4-5):236-240.
[13]INFUSINO I,SCHUMANN G,CERIOTTI F,et al. Standardization in clinical enzymology:a challenge for the theory of metrological traceability[J]. Clin Chem Lab Med,2010,48(3):301-307.
[14]陈宝荣,孙慧颖,邵燕,等. 血清CK常规方法测量结果的正确性评价与系统偏倚的修正[J]. 中华检验医学杂志,2011,34(12):1078-1080.
(本文编辑:龚晓霖)