益生菌联合早期肠内营养治疗重症急性胰腺炎临床疗效的Meta分析
益生菌联合早期肠内营养治疗重症急性胰腺炎临床疗效的Meta分析
王春亚,王国恩,郭蕾,周秀,吴媛
(西安交通大学医学院第二附属医院重症医学科,陕西西安710004)
【摘要】目的:系统评价益生菌联合早期肠内营养在重症急性胰腺炎(severe acute pancreatitis,SAP)中的应用效果。方法:计算机检索MEDLINE(1966年至2014年2月)、中国期刊全文数据库(CNKI,1992年至2014年2月)和万方数据库(1992年至2014年2月)发表的关于益生菌联合早期肠内营养治疗重症急性胰腺炎的临床随机对照试验,应用ReviewMan5.1软件对纳入研究进行分析。结果: 6篇文献纳入研究并进行Meta分析,结果显示,治疗组干预能降低重症急性胰腺炎患者的感染率[OR =0.21,95%CI(0.12,0.38)]、死亡率[OR =0.37,95% CI(0.14,0.94)]、住院时间[WMD =-10.93,95% CI(-13.92,-7.93)]和住院花费[WMD =-1.39,95%CI(-1.70,-1.09)]。结论:益生菌联合早期肠内营养干预可降低重症急性胰腺炎患者的感染和死亡风险,并能降低住院花费,缩短住院时间。
【关键词】重症急性胰腺炎;益生菌;肠内营养; Meta分析
急性重症胰腺炎(severe acute pancreatitis,SAP)是临床常见急危重症之一,早期即并发休克、全身炎症反应综合征及多脏器功能不全,发病急,病死率高,严重威胁患者生命[1-2]。该病发展过程中,代谢紊乱、禁饮食、广泛的全身炎症反应、营养底物摄入不足,易导致患者出现严重营养不良和免疫力下降,从而增加感染风险。有研究报道,肠道菌群易位诱发的感染是导致SAP的主要因素,早期肠内营养可促进小肠黏膜的生长,利于胃肠道功能恢复,防止菌群易位[3-4],对改善患者的营养状况,减少感染发生,缩短住院时间尤为重要。微生态制剂可调整肠道菌群,保护黏膜屏障,减少细菌移位及炎症因子的产生,并增强机体免疫功能[5]。近年来,临床上陆续开展关于益生菌联合早期肠内营养治疗SAP的研究,然而,其应用的有效性和安全性仍存在争议。本文旨在对益生菌联合早期肠内营养治疗SAP的临床效果进行系统评价,以期为其临床应用提供循证医学证据。
1 资料和方法
1.1文献检索
计算机检索MEDLINE (1966年至2014年2 月)、CNKI全文数据库(1992年至2014年2月)和万方数据库(1992年至2014年2月)收录的文献,并人工检索纳入文献中相关的参考文献。英文数据库检索词包括“probiotics”、“enteral nutrition”、“severe acute pancreatitis”;中文检索词包括“益生菌”、“肠内营养”、“重症急性胰腺炎”。
1.2纳入与排除标准
纳入标准: (1)受试者均确诊为急性重症胰腺炎; (2)研究类型为随机对照试验; (3)治疗组在对照组治疗基础上加用益生菌联合早期肠内营养(早期定义为48~72 h起),其他干预措施均相同。排除标准:非中英文、综述、非临床随机对照研究、短篇报道以及报道不全的研究。
1.3文献质量评价
由两名研究人员按照统一标准独立检索文献,参照Jadad量表从随机化分配方式、盲法、和随访三个方面对纳入研究的质量进行评估。如遇分歧通过讨论解决或由第三位研究者协助解决。
1.4数据提取
由2名研究人员提取研究相关资料,包括实验设计、人群、干预措施和结局指标,其中结局指标又包括死亡率、感染率、住院时间和住院花费,并交叉核对,意见不一致时进行讨论或征求第三方研究者意见解决。
1.5统计学分析
方法采用Cochrane协作网提供的Review Manager 5.1软件进行Meta分析。计量资料采用加权均数差(Weighted Mean Difference,WMD)作为评价指标并计算其95%可信区间;计数资料用比值比(OR)为评价指标并计算95%可信区间。对纳入研究进行异质性检验,当Q检验P>0.1且I2<50%,则认为各研究结果间具有较好的同质性,采用固定效应模型进行分析;反之则采用随机效应模型进行分析。P<0.05为差异具有统计学意义。
2 结果
2.1纳入文献一般情况
共检索到175篇文献,经筛选和评价,最终入选6篇文献[6-11](5篇中文[6-10],1篇英文[11]),纳入文献一般资料见表1。入组病例均采用国际或国内公认的SAP诊断标准,干预前治疗组和对照组的性别、年龄、危重症评分等一般资料差异无统计学意义。对照组治疗措施包括禁饮食、胃肠减压、抑酸、抑酶和肠外营养等,治疗组在对照组基础上于入院48~72 h内经空肠给予鼻饲肠内营养乳剂,同时应用枯草杆菌二联活菌或双歧杆菌三联活菌等益生菌辅助治疗。

表1 纳入文献一般资料
2.2纳入文献质量评价
6项研究均为随机对照研究,且均描述随机方法,其中周家德[6]、崔立红[7]、Wang[11]等描述了排除标准,但6项研究均未采用盲法,且未描述失访情况。文献质量评价见表2。
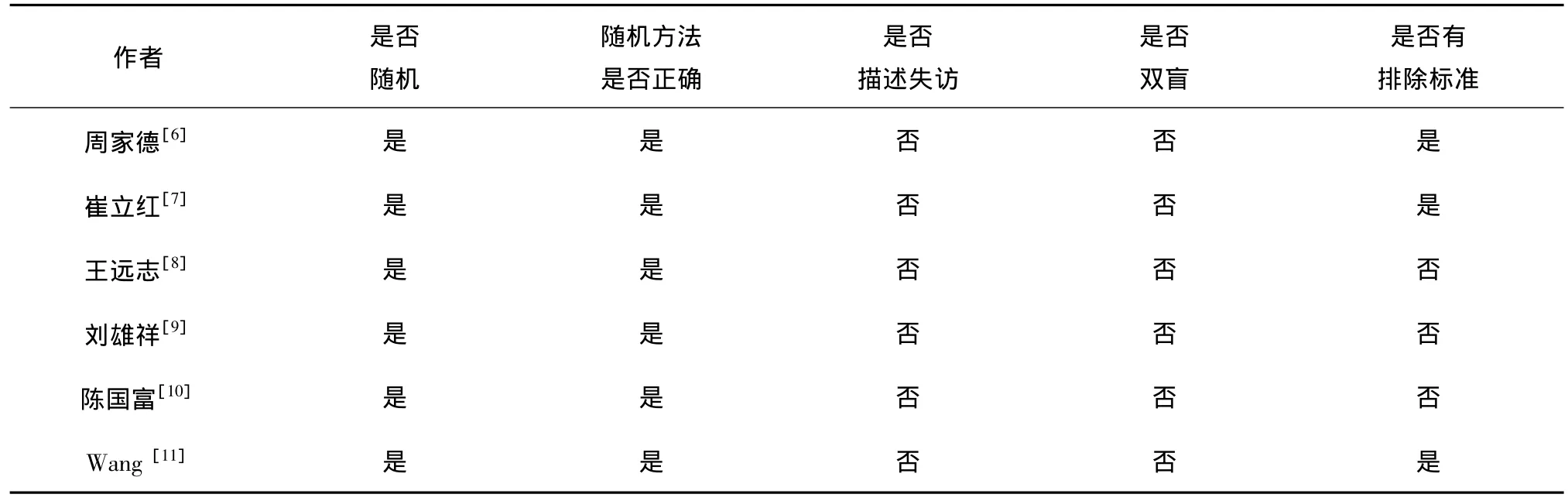
表2 纳入文献质量评价
2.3结局指标分析
2.3.1感染率6项研究[6-11]均就SAP的感染率做了对比分析,异质性检验结果I2=0%,P =0.61,采用固定效应模型进行Meta分析,结果显示试验组和对照组间SAP患者感染率差异有统计学意义[OR =0.21,95%CI(0.12,0.38)],见图1。
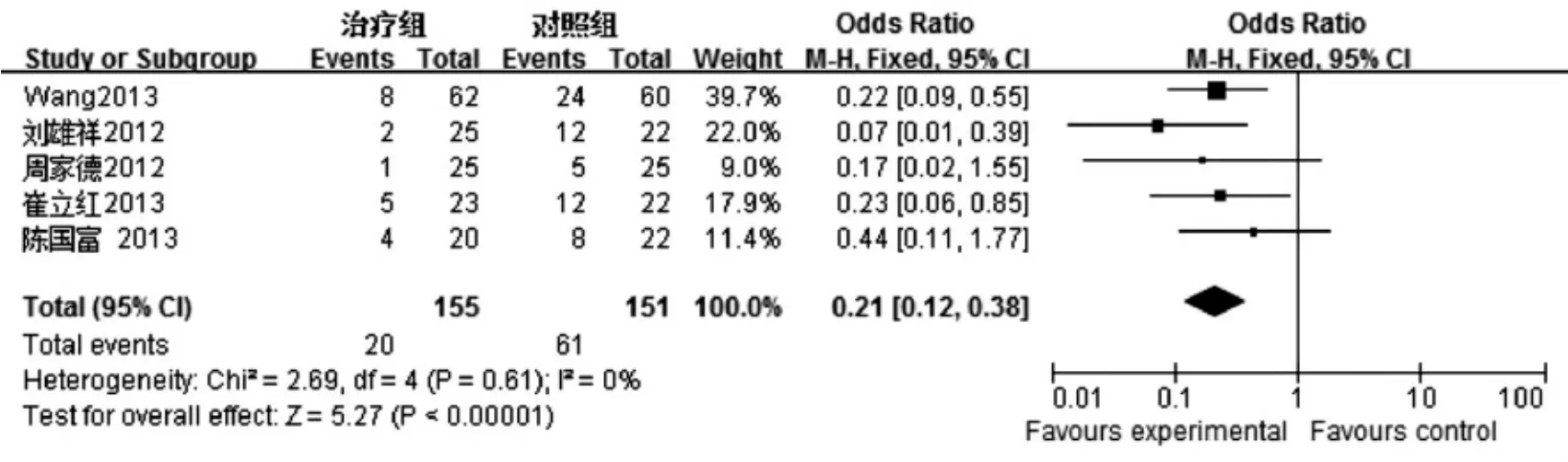
图1 益生菌联合早期肠内营养治疗SAP对感染率影响的Meta分析
2.3.2死亡率6项中有5项[6-7,9-11]涉及SAP相关死亡率,异质性检验结果I2=0%,P =0.52,采用固定效应模型进行Meta分析,结果显示试验组和对照组间差异有统计学意义[OR = 0.37,95% CI(0.14,0.94)],见图2。
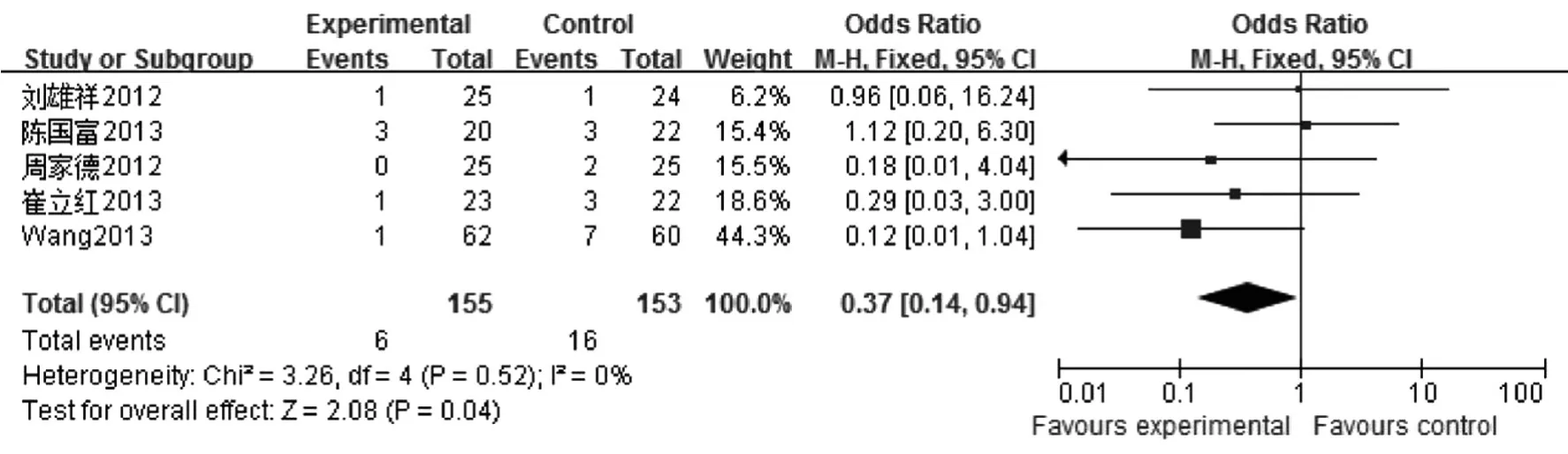
图2 益生菌联合早期肠内营养治疗对SAP死亡率影响的Meta分析
2.3.3住院花费6项中有3项[8-10]涉及住院花费,异质性检验结果I2= 39%,P = 0.20,采用固定效应模型进行Meta分析显示,治疗组和对照组间差异有统计学意义[WMD =-10.93,95% CI (-13.92,-7.93)],见图3。
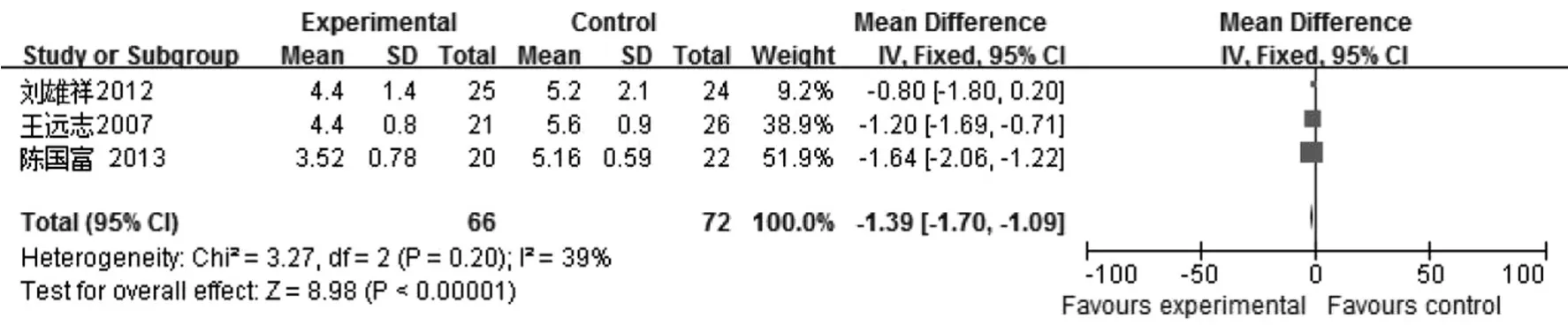
图3 益生菌联合早期肠内营养治疗SAP对住院花费影响的Meta分析
2.3.4住院时间6项中有5项[6-10]涉及SAP住院时间,异质性检验结果I2= 60%,P = 0.04,采用随机效应模型进行Meta分析,结果显示治疗组和对照组间差异有统计学意义[WMD =-1.39,95% CI(-1.70,-1.09)],见图4。
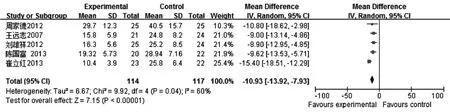
图4 益生菌联合早期肠内营养治疗SAP对住院时间影响的Meta分析
3 讨论
SAP早期即出现全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),导致机体能量及蛋白质消耗增加,加之需要禁食,患者常常表现为严重营养不良,进而免疫低下,感染风险增加。由于肠道屏障功能受损、肠道细菌易位导致的感染下,大量炎症介质被激活释放,除损伤胰腺外,还能引起多器官功能障碍综合征[12-13]。因此营养支持治疗极其重要。相关研究表明表明,疾病发生后48~72 h起对SAP患者施行空肠营养安全性高,且具有以下方面优势: (1)有利于维持肠道黏膜的完整性,刺激肠道蠕动和释放免疫介质,增加肠壁血供; (2)减少炎症介质释放,降低氧化应激和全身炎症反应综合征; (3)保持肠道黏膜的完整性有助于减少细菌过度生长和细菌移位,从而降低感染发生率[14-16]。
近年来益生菌成为临床治疗SAP的研究热点。杨建军等[17]通过建立SAP大鼠模型,发现益生菌联合肠内营养能增加MAdCAM-1表达,提高胃肠免疫屏障,减少菌群易位。Zou等[18]使用益生菌加其它免疫营养要素治疗动物SAP模型,发现该疗法能够显著降低肠黏膜的通透性、血中内毒素浓度及细菌易位的发生率,同时能维持肠道黏膜结构的完整性。临床研究表明[19],应用益生菌可改善临床症状,降低SAP并发症的发生率。关于肠内营养联合益生菌治疗SAP的研究,亦有相关文献发表,但缺乏大规模临床试验的证据支持,本文通过对相关文献进行系统评价,旨在为益生菌联合早期肠内营养治疗SAP提供循证医学证据。
本研究结果显示,益生菌联合肠内营养干预能够降低SAP患者的死亡率[OR = 0.37,95% CI (0.14,0.94)]及感染率[OR = 0.21,95% CI(0.12,0.38)],提示两者联合可能减轻了肠道菌群易位及肠黏膜屏障功能的损害,从而减少了肠源性感染的风险,继而降低其死亡风险[20]。同时益生菌联合肠内营养治疗可缩短SAP患者的住院时间[WMD =-10.93,95% CI(-13.92,-7.93)],降低住院花费[WMD =-1.39,95%CI(-1.70,-1.09)],从而减轻了SAP患者的经济负担,具有较高临床意义。杨晶等[21]通过对益生菌在SAP患者中应用效果的Meta分析显示,其能够缩短患者住院时间,但SAP感染和死亡率差异无统计学意义,和本研究结果并不一致,这可能和不同的文献筛选标准有关,杨晶等[21]报道中有2例纳入研究实验组的干预方案仅为益生菌,而本研究中纳入研究的实验组均为联合干预方案。另一方面,本研究纳入文献数量以及样本总量相对偏少,可能影响检验效能,且由于本研究所涉及研究以中文文献为主,可能产生语种偏倚,建议后续开展大规模、多中心、双盲随机对照研究来评价益生菌联合早期肠内营养治疗SAP的效果。
参考文献
[1]Cruz-Santamaria DM,Taxonera C,Giner M.Update on pathogenesis and clinical management of acute pancreatitis[J].World J Gastrointest Pathophysiol,2012,3(3):60-70.
[2]许爱平,李淑德.重症急性胰腺炎治疗研究进展[J].世界华人消化杂志,2010,18(3):213-216.
[3]Noor MT,Radhakrishna Y,Kochhar R,et al.Bacteriology of infection in severe acute pancreatitis[J].JoP,2011,12(1):19-25.
[4]Sharma M,Sachdev V,Singh N,et al.Alterations in intestinal permeability and endotoxemia in severe acute pancreatitis[J].Trop Gastroenterol,2012,33(1):45-50.
[5]Hooijmans CR,de Vries RB,Rovers MM,et al.The effects of probiotic supplementation on experimental acute pancreatitis: a systematic review and meta-analysis[J].PloS one,2012,7 (11): e48811.
[6]周家德.益生菌联合早期肠内营养治疗重症急性胰腺炎疗效观察[J].现代医院,2012,12(5):70-71.
[7]崔立红,王晓辉,彭丽华,等.早期肠内营养加微生态制剂对重症急性胰腺炎患者疗效的影响[J].中华危重病急救医学,2013,25(4):224-228.
[8]王远志,丁岩冰,吴健,等.早期肠内营养联合肠屏障保护剂治疗急性重症胰腺炎64例[J].世界华人消化杂志,2007,15 (33):3545-3548.
[9]刘雄祥,刘文,许剑,等.早期肠内营养联合益生菌治疗重症胰腺炎[J].中国医药导报,2012,9(9):72-74.
[10]陈国富,耿长辉,赫玲玲,等.早期空肠内营养联合双歧杆菌与肠外,肠内联合阶段性营养支持治疗重症急性胰腺炎的比较研究[J].齐齐哈尔医学院学报,2013,(3):316-318.
[11]Wang G,Wen J,Xu L,et al.Effect of enteral nutrition and ecoimmunonutrition on bacterial translocation and cytokine production in patients with severe acute pancreatitis[J].J Surg Res,2013,183 (2):592-597.
[12]Kyanpaa ML,Repo H,Puolakkainen PA.Inflammation and immunosuppression in severe acute pancreatitis[J].World J Gastroenterol,2010,16(23):2867-2872.
[13]Malmstr m ML,Hansen MB,Andersen AM,et al.Cytokines and organ failure in acute pancreatitis: inflammatory response in acute pancreatitis[J].Pancreas,2012,41(2):271-277.
[14]Yi F,Ge L,Zhao J,et al.Meta-analysis: total parenteral nutrition versus total enteral nutrition in predicted severe acute pancreatitis [J].Intern Med,2012,51(6):523-530.
[15]Singh N,Sharma B,Sharma M,et al.Evaluation of early enteral feeding through nasogastric and nasojejunal tube in severe acute pancreatitis: a noninferiority randomized controlled trial[J].Pancreas,2012,41(1):153-159.
[16]龙润,冯志杰.重症急性胰腺炎的营养支持治疗[J].中国全科医学,2010,13(8):911-914.
[17]杨建军,耿翔,高志光,等.益生菌及肠内外营养对重症急性胰腺炎大鼠肠道黏附分子及免疫屏障的影响[J].世界华人消化杂志,2006,14(10):953-957.
[18]Zou XP,Chen M,Wei W,et al.Effects of enteral immunonutrition on the maintenance of gut barrier function and immune function in pigs with severe acute pancreatitis[J].JPEN J Parenter Enteral Nutr,2010,34(5):554-566.
[19]徐敏,郭继中,王磊.益生菌在重症急性胰腺炎中的应用[J].齐齐哈尔医学院学报,2012,33(17):2369-2370.
[20]文礼,赵龙,金涛,等.重症急性胰腺炎继发感染的临床特点[J].中国中西医结合外科杂志,2010,16(2):148-151.
[21]杨晶,王海鹏,周莉,等.益生菌在重症急性胰腺炎患者中作用效果的Meta分析[J].中华消化杂志,2012,32(2):93-97.
(学术编辑:高晓凤)
Effects of probiotics combined with early enteral nutrition on patients with severe acute pancreatitis: a meta analysis
WANG Chun-ya,WANG Guo-en,GUO Lei,ZHOU Xiu,WU Yuan
(ICU,the Second Affiliated Hospital of Xi’an Jiaotong University,Xi’an 710004,Shaanxi,China)
【Abstract】Objective: To systematically review the effect of combined treatment of probiotics and early enteral nutrition for severe acute pancreatitis (SAP).Methods: Randomized controlled trials of probiotics combined with early enteral nutrition on patients with SAP were searched in Medline (from 1996 to Feb.2014),CNKI (from 1992 to Feb.2014)and WANFANG DATA (from 1992 to Feb.2014).Data of included studies were extracted and analyzed by ReviewMan 5.1 software.Results: Six studies were included in this review.The results showed that there were significant differences between intervention and control group in the infection rate[OR = 0.21,95%CI(0.12,0.38)],mortality rate[OR =0.37,95%CI(0.14,0.94)],length of stay[WMD =-10.93,95% CI(-13.92,-7.93)]and cost of hospitalization[WMD =-1.39,95%CI(-1.70,-1.09)]related to SAP.Conclusion: Findings from studies included indicate a potential benefit of combined treatment of probiotics early enteral nutrition,which and reduce the risk of infection and death,as well as length of stay and cost related to SAP.
【Key words】Severe acute pancreatitis; Probiotics; Enteral nutrition; Meta analysis
作者简介:王春亚(1976-),女,陕西西安人,硕士,主治医师,主要从事ARDS发病机制与治疗研究。E-mail: Uncanny2006@163.com
基金项目:中国高校医学期刊临床专项资金(11520492)
收稿日期:2015-04-10
doi:10.3969/j.issn.1005-3697.2015.03.11
【文章编号】1005-3697(2015)03-0318-05
【中图分类号】R576
【文献标志码】A
网络出版时间: 2015-6-19 17∶39网络出版地址: http://www.cnki.net/kcms/detail/51.1254.R.20150619.1739.008.html

