无动物源成分培养基用于人脐带间充质干细胞培养的研究
无动物源成分培养基用于人脐带间充质干细胞培养的研究
任春红1,张昕2
(1.汕头大学医学院第一附属医院内镜中心;
2.汕头大学医学院第一附属医院内镜中心中心实验室,广东汕头515041)
摘要:目的建立一种无动物源成份无血清的间充质干细胞培养基XF/SF-MSCM,并探讨其支持人脐带间充质干细胞(hUC-MSCs)体外增殖、维持分化潜能的效果。方法组织块贴壁法分离获得原代人脐带间充质干细胞,P1代起分别使用自制的XF/SF-MSCM培养基与含10%胎牛血清的传统培养基(SC-MSCM)对脐带间充质干细胞进行连续培养传代至P6代,观察比较两组P6代细胞的形态及增殖能力,以流式细胞术检测连续传代后细胞的免疫学表型,比较其成骨、成脂肪的分化潜能。结果分离获得的原代P0脐带间充质干细胞,分别在XF/SF-MSCM与SC-MSCM两种培养基中连续培养传代,细胞增殖能力及形态无显著差别。两组P6代细胞的生长曲线相似,但XF/SF-MSCM组间充质干细胞贴壁的紧密程度稍低;流式细胞检测结果显示,XF/SF-MSCM组细胞保持了间充质干细胞的免疫学表型,高表达CD29、CD44、CD90,不表达CD31、CD34、CD45并维持了良好的成骨和脂肪细胞的分化能力。结论本室制备的无动物源成份无血清培养基XF/SF-MSCM可支持脐带间充质干细胞的体外扩增,维持其免疫学表型及分化潜能,提供数量充足的高质量间充质干细胞,满足临床治疗及生物医学研究的需要。
关键词:脐带间质干细胞;无血清培养基;细胞培养;增殖
中图分类号:R3
基金项目:中国博士后科学基金面上项目(NO:2013M531872)
作者简介:任春红(1975—),女,山东青州人,汕头大学医学院第一附属医院消化内科主治医师。
[收稿日期2014-11-17;责任编辑赵菊梅]
Culture of human umbilical cord mesenchymal stem cells by
Xeno/serum-free medium
RENChun-hong1,ZHANGXin2*
(1.Endoscopic Center of the First Affiliated Hospital of Shantou University Medical College,
Shantou,515041 China;2.Central Laboratory of the First Affiliated Hospital of Shantou
University Medical College,Shantou,515041 China)
Abstract:Objective To establish a xeno/serum-free medium for human umbilical cord mesenchymal stem cells (hUC-MSCs) and evaluate its capacity to support the expansion of hUC-MSCs in vitro.Methods Primary hUC-MSCs were isolated from Wharton's Jelly of umbilical cord of healthy newborn.Cells were respectively maintained and consecutively passaged in our homemade xeno/serum-free medium (XF/SF-MSCM) and conventional serum containing medium (SC-MSCM) as a control from passage1 (P1) to passage 6(P6).Cell morphology and proliferation were observed and compared.The immunological phenotype of P6 hUC-MSCs was analyzed by Flow Cytometry and the differentiation potency was also investigated.Results There is no significant difference in proliferation rate and morphology between hUC-MSCs cultured in X/SF-MSCM and SC-MSCM.The growth curve of P6 cells was similar when they were cultured in two culture systems.The P6 cells cultured in XF/SF-MSCM showed
MSCs specific surface marker expression phenotype:CD29+,CD44+,CD90+ and CD31-,CD34-,CD45-.Furthermore,P6cells maintained in XF/SF-MSCM could be induced to adipocyte and osteoplastic differentiation.Conclusion Our homemade XF/SF-MSCM for human umbilical cord mesenchymal stem cells (hUC-MSCs) can efficiently support the sequential passage and expansion of hUC-MSCs in vitro and maintain the differentiation potentials. The XF/SF-MSCM medium provides an efficient amplification system to produce sufficient and high quality MSCs for either clinical studies or applications.
Key words:Umbilical Cord mesenchymal stem cells; Serum-free medium; Cell culture; Proliferation
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)具有高度的自我更新能力和多向分化潜能,极具临床应用价值。但为获得足够治疗剂量的细胞,目前多采用含胎牛血清的培养基进行体外扩增,会带来动物源性成分及病原体的污染,增加了MSCs临床应用的风险[1]。因此,本室研制了一种无动物源性成分的MSCs专用无血清培养基用于hUC-MSCs的体外培养,并与含胎牛血清的培养基进行了平行对照研究,观察了其对hUC-MSCs的增殖及分化潜能的维持效果,以期提高MSCs临床应用的安全性。
1材料与方法
1.1材料
人脐带组织取自汕头大学医学院第一附属医院产科健康足月妊娠的剖宫产儿,组织使用经院伦理委员会批准。DMEM/F12培养基(Hyclone);重组人血清白蛋白(rHSA)、转铁蛋白(Transferrin)、还原型谷胱甘肽(G-SH)、亚硒酸钠及胰岛素(Sigma);胎牛血清(FBS,BiochromAG);重组人表皮生长因子(rhEGF)与碱性成纤维细胞生长因子(rhbFGF,R&D);L-谷氨酰胺、非必需氨基酸(NEAA)、双抗、0.25%胰蛋白酶-0.02%EDTA及地塞米松(Gibco);茜素红、油红(Oil-Red)-O、β-巯基乙醇、二甲基亚砜(DMSO)、胰蛋白酶抑制剂、3-异丁基-1-甲基黄嘌呤(IBMX)、β-磷酸甘油及维生素C(Sigma);抗人CD29-FITC、CD90-FITC、CD34-FITC、CD45-PE单克隆抗体(四正柏公司),CD31-FITC及CD44-FITC单克隆抗体(eBioscience);倒置显微镜(Olympus);AccuriC6流式细胞仪(BD)。
1.2方法
1.2.1脐带的采集与准备新鲜脐带无菌采集后存放于含有肝素及抗生素的PBS中,置4℃冰盒内带回,4 h内处理。
1.2.2组织块贴壁法分离原代hUC-MSCs用含抗生素的PBS反复清洗脐带,剥除脐带外膜及动静脉,将华尔通胶剪成1~2 mm3组织块,接种于100 mm培养皿中,间距2~5 mm,加少量含10%胎牛血清的DMEM/F12原代培养基,37℃、5% CO2,饱和湿度培养24~48 h,后添加培养基至没过组织块;第7天换新鲜培养基,显微镜下观察细胞生长情况,每3~4 d更换1次培养基,10~14 d后去除组织块。
1.2.3hUC-MSCs传代和培养原代细胞长至约80%融合时,按1:1传代,在两种培养基中培养,分别为实验组(无血清培养基XF/SF-MSCM)和对照组(含血清培养基SC-MSCM),按1∶3传代。XF/SF-MSCM以DMEM/F12为基础培养基,加入10 g/LrHSA、胰蛋白酶抑制剂、NEAA、转铁蛋白、胰岛素、亚硒酸钠、10 ng/mLrhEGF、10 ng/mLrhbFGF、L-谷氨酰胺、G-SH、氢化考的松、β-巯基乙醇及双抗。SC-MSCM为含有10%FBS的DMEM/F12。
1.2.4细胞增殖状况的比较hUC-MSCs分别在两种培养基中连续传至第6代,按照0.5×105/孔的密度接种于12孔板中。依次在细胞培养的第1~10天不同时间点进行计数,至细胞生长的平台期止,绘制生长曲线,每个时间点设三个复孔,实验重复三次。
1.2.5流式细胞术鉴定hUC-MSCs表型分别制备实验组与对照组的P6代细胞悬液,10%山羊血清封闭15 min,后分别与荧光素标记的抗人CD29-FITC、CD90-FITC、CD44-FITC、CD31-FITC、CD34-FITC和CD45-PE等单克隆抗体室温避光孵育30 min,以FITC和PE标记的小鼠IgG2bκ同型抗体为对照。PBS洗1次后重悬于400μlPBS,流式细胞分析。
1.2.6hUC-MSCs的成脂诱导分化取实验组与对照组状态良好的P6代hUC-MSCs,分别按2.5×104/孔接种于12孔板中,在XF/SF-MSCM与SC-MSCM培养基中培养至70%融合,换为脂肪诱导培养基:高糖DMEM加10%FBS、1 μmol/L地塞米松、0.5 mmol/L IBMX、60 μmol/L吲哚美辛与5 μg/mL胰岛素,每3 d更换培养基,连续诱导14 d,用2%油红O染色鉴定分化细胞内脂滴的形成。
1.2.7hUC-MSCs的成骨诱导分化取实验组与对照组状态良好的P6代hUC-MSCs,按1.0×104/孔的密度接种于12孔板中,继续培养至50%~60%融合,换为成骨诱导培养基:含10%FBS的高糖DMEM中添加0.1 μmol/L地塞米松、50 μmol/L维生素C和10 mmol/Lβ-磷酸甘油。每3~4 d更换1次培养基,诱导2~3 W,镜下观察有无骨质沉积结节,4%的多聚甲醛固定30 min;PBS洗涤后,1 mL茜素红染液染色3~5 min,镜下观察、拍照记录。
2结果
2.1hUC-MSCs分离、培养和形态观察
组织贴壁法分离培养4 d左右,可观察到少量梭形细胞从组织块爬出。第8天,部分原代细胞在组织块周围呈单层生长(图1A,B),后逐渐融合。镜下可见,两种培养体系传代后的细胞呈扁平的长梭形成纤维样,形态均一,达80%融合时,细胞排列紧密,呈有极性的旋涡或指纹状。同对照组相比,实验组细胞贴壁的紧密程度稍低,但贴壁率及细胞的生长状态无明显差别(图1C-F)。

图1 人脐带间充质干细胞形态
注:(100×)(A:培养4 d后的组织块;B:培养8 d后的组织块;C、D:XF/SF-MSCM中传代培养第1天与第3天;E、F:SC-MSCM中传代培养第1天与第3天)
2.2两种培养体系中细胞的增殖能力
选取两组连续传至第6代的hUC-MSCs,观察生长情况。结果可见,P6代细胞接种后,生长潜伏期(0~24 h)增殖缓慢,2 d后进入对数生长期,持续3~4 d,到第6天左右细胞生长进入平台期(图2)。实验组与对照组细胞的生长曲线相似。
2.3hUC-MSCs免疫表型的测定
对在两种培养基中连续传至第6代的hUC-MSCs进行流式细胞检测,结果显示,连续传代后,实验组细胞高表达CD29、CD44、CD90,不表达造血干细胞标志CD34、CD45及内皮细胞标志CD31(图3),说明在XF/SF-MSCM中连续传代后,hUC-MSCs仍维持了特异性免疫表型。

图2 第6代脐带间充质干细胞生长曲线
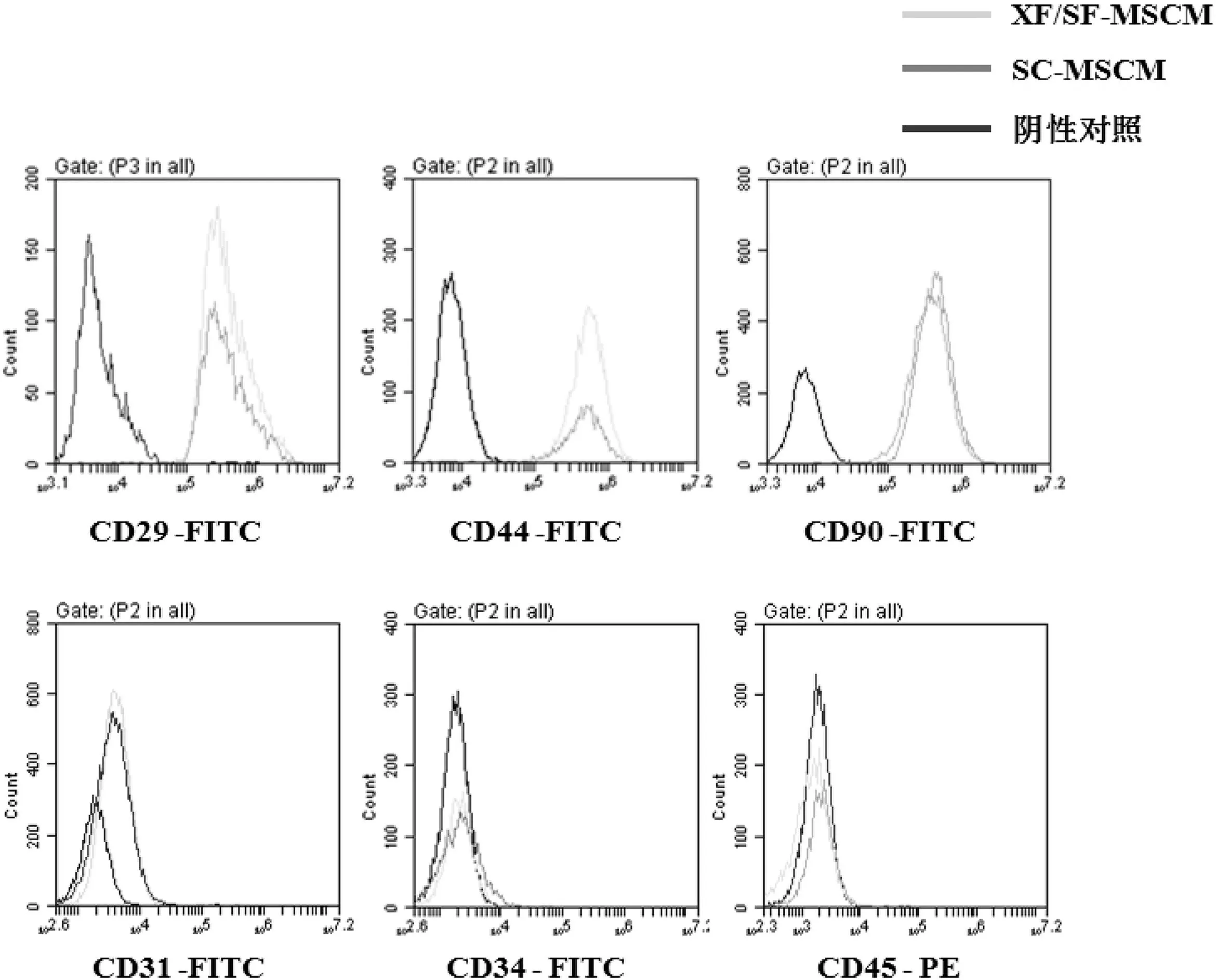
图3 XF/SF-MSCM与SC-MSCM培养的第6代
2.4hUC-MSCs成骨、成脂肪分化能力检测
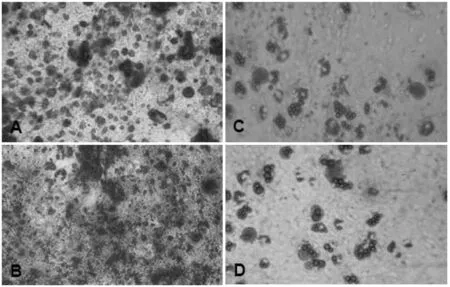
图4 间充质干细胞多向分化潜能的鉴定
注:(A、C:SC-MSCM培养的第6代hUC-MSCs的成脂、成骨分化;B、D:XF/SF-MSCM培养的第6代hUC-MSCs的成脂、成骨分化)
使用两种培养基中连续传至第6代的hUC-MSCs,分别向成脂肪和成骨方向诱导分化,结果显示,向脂肪诱导分化14 d后,镜下可见在两组细胞中均有大量脂滴形成,油红O染色呈强阳性(图4A,B);对成骨诱导3周的细胞进行茜素红染色,镜下同样可观察到在两组细胞中含大量深红色骨质钙化结节(图4C,D),证明脐带间充质干细胞在XF/SF-MSCM培养基中连续传代后,仍保持了良好的向脂肪、骨等细胞的分化潜能。
3讨论
1991年,McElreavey等从人脐带华尔通胶(Wharton′sjelly,WJ)中发现并首次分离培养出人脐带间充质干细胞(hUC-MSCs)。同骨髓、脐血来源的MSCs相比,hUC-MSCs伦理学争议少、来源丰富、取材方便、增殖能力更强,并具有免疫原性低、调节免疫、支持造血、旁分泌、低致瘤性等优点,因此显示了更为广阔的临床应用前景。为解决目前MSCs体外扩增普遍使用动物血清带来的动物源性成分及病原体污染的问题,本室建立了一种无动物源性成分、成分明确的MSCs专用培养基XF/SF-MSCM:以DMEM/F12为基础,添加了细胞生长必需的营养成分,保护细胞免受理化因素损伤的缓冲、抗氧化成分及可支持MSCs集落生成的rhEGF、rhbFGF等因子。
本研究在原代细胞分离过程中采用了组织块贴壁法,以避免酶消化对细胞的损伤及脐带中造血、内皮细胞的污染[2-4]。结果显示,组织块贴壁培养1d后即有细胞游出,第10天相邻组织块间的细胞开始融合。传代后细胞形态均一,其他类型细胞极少,流式细胞检测显示纯度很高。
本研究自P1代细胞起即使用XF/SF-MSCM培养基进行连续传代培养,而未采取逐步替代血清的方法[5]。与对照组(SC-MSCM)相比,实验组(XF/SF-MSCM)组细胞的增殖效率、细胞生长曲线及免疫学表型、成骨及成脂肪分化潜能均无差别。在连续传代过程中,两组细胞接种24h贴壁率无明显差别(数据未显示),但镜下观察及传代时胰酶消化的难易程度均显示,实验组细胞贴壁的紧密程度低于对照组,表明本培养基配方中仍缺乏促细胞贴壁因子,这也是目前无血清培养基普遍存在的问题。间充质干细胞的贴壁率直接影响其生存与增殖,尤其在原代细胞分离过程中,常用解决方法是在培养介质表面预铺层粘连蛋白、纤粘连蛋白、I型胶原等促贴壁物质[6-7]。本研究曾尝试在未预铺促贴壁物质的条件下使用XF/SF-MSCM分离原代细胞,细胞获得率远低于血清培养基组(数据未显示)。但促贴壁剂价格昂贵或为动物来源,并不适于临床大规模制备细胞。目前大部分临床研究仍将含胎牛血清的培养基用于原代细胞的分离,美国的FDA也允许使用动物血清,但对血清质量及检测做了严格规定。此外,也有实验室开始使用人血小板裂解物作为血清替代物,效果较好[8]。
本研究结果显示,本室的XF/SF-MSCM培养基能有效支持脐带间充质干细胞的体外扩增,且连续传代后细胞仍保持其免疫学表型及分化潜能,为提供数量充足的高质量间充质干细胞用于临床治疗及生物医学研究奠定实验了方法学基础。
参考文献:
[1]Kuo TK,Hung SP,Chuang CH,et al.Stem cell therapy for liver disease:parameters governing the success of using bone marrow mesenchymal stem cells [J].Gastroenterology,2008,134(7):2111-2121.
[2]Patric Horn,Simone Bork,Wolfgan Wagner.Standardized Isolation of human Mesenchymal Stromal Cells with Red Blood cell lysis[M].2011.
[3]Broska M,Geiger H,Gauer E,et al.Epithelial differentiation of human adipose derived stem cells[J].Biochem Biophys Res Commun 2005,330 (1): 142-150.
[4]Guilak F,Lott KE,Awad HA,et al.Clonal analysis of the differentiation potential of human adipose-derived adult stem cells[J].Cell Physiol,2006,206 (1): 229-237.
[5]张文成,王韫芳,常铭洋,等,临床研究用间充质干细胞的体外制备策略[J].中国医药生物技术,2012,(7)5: 327-332.
[6]Marastoni S,Ligresti G,Lorenzon E,et al.Extracellular matrix:a matter of life and death[J].Connect Tissue Res.2008,49(3):203-206.
[7]O'Brien FJ,Harley BA,Yannas IV,et al.The effect of pore size on cell adhesion in collagen-GAG scaffolds [J].Biomaterials,2005,26(4): 433-441.
[8]Bernardo ME,Avanzini MA,Perotti C,et al.Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches:further insights in the search for a fetal calf serum substitute[J].J Cell Physiol.2007,211(1):121-130.

