双酚A在不同碳材料上的吸附热力学与动力学研究
王家宏, 尹小龙
(陕西科技大学 资源与环境学院, 陕西 西安 710021)
双酚A在不同碳材料上的吸附热力学与动力学研究
王家宏, 尹小龙
(陕西科技大学 资源与环境学院, 陕西 西安710021)
摘要:以碳纳米管(MWCNT)、活性炭(AC)和石墨(G)为吸附剂,研究了其对水中双酚A(BPA)的吸附性能,探讨了三种吸附剂对水中BPA的吸附热力学和动力学规律,分析其吸附机理.结果表明:AC对BPA的吸附效果最好,理论最大吸附量可达553.18 mg/g,G对BPA的吸附量最低,理论最大吸附量为17.80 mg/g.此外,随着温度的升高,BPA在三种吸附剂上的吸附量都逐渐降低,吸附行为为放热过程;三种吸附剂对BPA的吸附等温线均可用Langmuir等温线方程拟合,吸附过程为有利吸附.BPA在MWCNT和AC上的吸附动力学可用拟二级动力学方程更好的拟合,G对BPA的吸附更符合拟一级动力学方程,且在其吸附过程中都会受到边界层扩散的影响.当pH<8时,三种吸附剂对BPA的吸附均随pH的变化不大,但当pH>8时,随着溶液pH的增大,BPA在三种吸附剂上的吸附量明显降低.
关键词:双酚A; 碳材料; 吸附; 热力学; 动力学
0引言
随着工业化进程的加快,一类能够进入人体内部,并具有类似雌性激素作用,危害人体正常激素分泌的污染物引起了人们的广泛关注.它能与人体中相应的激素受体结合,导致人体自然分泌的激素无法被激素受体接受,使得人体激素过剩,干扰了血液中激素的正常水平,从而对人体的生殖、发育等产生一系列的影响[1-4].人们将这类物质称作为内分泌干扰物(EDCs),从废水中去除内分泌干扰物是环境保护领域关注的焦点之一.双酚A(BPA)是内分泌干扰物中的一种,是重要的有机化工原料,作为制造聚碳酸酯,环氧树脂,聚砜树脂的中间体,被广泛应用于生产增塑剂、阻燃剂、抗氧化剂和热稳定剂等产品[5].但是,BPA在水中很难被生物降解,且其对普通的化学氧化具有一定的抵抗作用,普遍存在于水体中,进入人体后与雌激素受体具有一定亲和力,诱导乳腺癌、前列腺癌等症状的发生,威胁人类健康[6].因此,研究去除水中的BPA具有很大的实际意义,也成为当前研究的热点.
目前,废水中的BPA的处理方法主要有吸附法[7]、光催化氧化法[8]、电化学法[9]和生物法[10]等,与其他方法相比,吸附法作为一种操作简单,去除率高、污染小且吸附剂可再生等优点,广泛用于含BPA废水的处理.碳材料由于具有较大的比表面积、丰富的微孔结构、简单易得等特点常被用作吸附剂去除水中的有机物和重金属.本实验选用MWCNT、AC和G三种碳材料作为吸附剂,吸附去除模拟废水中的BPA,比较三种吸附剂对BPA的吸附去除效果,考察温度、时间、pH等对其吸附效果的影响,研究三种吸附剂对BPA的吸附热力学和吸附动力学规律,探索其吸附机理.
1实验部分
1.1试剂与仪器
药品及试剂:双酚A购自国药集团化学有限公司;石墨粉为光谱纯,购自国药集团化学有限公司;多壁碳纳米管购自中国科学院成都有机化学有限公司;活性炭购自太原新华化工厂;其余药品均为分析纯,购自国药集团化学有限公司.
实验仪器:TE124S电子天平(赛多利斯科学仪器北京有限公司)、磁力搅拌器(IKA公司)、振荡培养箱(常州国华电器有限公司)、PHS-3C pH计(上海精密科学仪器有限公司)、UV-2600AH紫外-可见分光光度计(尤尼柯上海仪器有限公司)、磁力搅拌器(IKA公司).
1.2吸附实验
1.2.1吸附等温线
BPA储备液的配制:称取0.1 g BPA溶于适量的甲醇中,再转移到500 mL的容量瓶中定容,得到200 mg/L的BPA溶液,密封避光保存,备用.BPA浓度的测定采用紫外分光光度法,通过对其波长的扫描发现BPA的最大吸收波长为276 nm[11].
取适量不同初始浓度的BPA溶液40 mL,加入20 mg左右的MWCNT、AC、G吸附剂,调节初始pH为5.0左右,分别在15 ℃、25 ℃、35 ℃恒温条件下振荡反应24 h.吸附平衡后,用0.45μm的滤膜过滤,取滤液测其吸光度.根据公式(1)计算BPA的平衡吸附量.
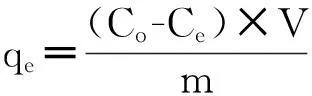
(1)
式中,qe为吸附剂对BPA的平衡吸附量(mg/g),Co为BPA的初始浓度(mg/L),Ce为溶液中BPA的平衡浓度(mg/L),V为溶液的体积(mL),m为吸附剂的质量(mg).
1.2.2吸附动力学
称取约200 mg的吸附剂加入到适当初始浓度的BPA溶液中,调节pH为5.0左右,25 ℃条件下磁力搅拌,于不同时间间隔计时取样,过滤测其BPA的浓度,并根据公式(1)计算该时刻吸附剂对BPA的吸附量.
1.2.3溶液pH对吸附效果的影响
分别称取约20 mg的MWCNT、AC、G加入到40 mL浓度分别为40、300 、40 mg/L的BPA溶液中,调节pH在2~11的范围内,在25 ℃条件下恒温振荡反应24 h,吸附平衡后过滤分离,测上清液的吸光度,计算BPA的平衡吸附量.
2结果与讨论
2.1吸附等温线
吸附等温线是能够说明吸附剂与吸附质之间吸附机制的一个重要因素.图1显示了不同温度(15 ℃、25 ℃、35 ℃)下MWCNT(a)、AC(b)、G(c)三种碳材料吸附剂对BPA的吸附效果.由图可知,AC对BPA的吸附效果明显高于MWCNT和G,BPA在G上的吸附量最低,MWCNT对BPA的吸附量也相对较好.另外,三种材料对BPA的吸附量都随着BPA平衡浓度的升高而不断增大.随着吸附温度的升高, BPA在吸附剂上的吸附量都逐渐降低,这可能是由于BPA在水中的溶解度随着温度的升高而增加,当温度增大时,更多的BPA溶解到水中,从而使吸附量有所下降[12],同时也表明BPA在三种碳材料吸附剂上的吸附为放热过程,降低温度有利于吸附剂对BPA的吸附.
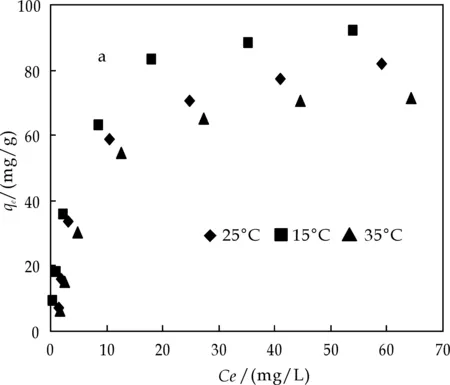
(a) 不同温度下MWCNT对BPA的吸附等温线

(b) 不同温度下AC对BPA的吸附等温线

(c) 不同温度下G对BPA的吸附等温线图1 不同温度下MWCNT、AC、G对BPA的吸附等温线
为了更加深入的探究BPA在三种材料上的吸附机制,采用Langmuir和Freundlich方程分析实验结果,分别通过origin进行等温吸附方程非线性拟合,拟合参数如表1所示.Langmuir和Freundlich方程表述如下:
Langmuir方程:

(2)
Freundlich方程:

(3)
式中:qe为饱和时吸附剂对BPA的最大吸附量(mg/g),qm为理论最大平衡吸附量(mg/g),Ce为溶液的平衡浓度(mg/L),b为亲和系数(L/mg),Kf为Freundlich吸附常数(L/mg),n为与温度相关的特征常数.
由表1可以看出,Langmuir 方程拟合相关系数(R2)都明显高于Freundlich方程拟合相关系数,且Langmuir 方程的理论最大吸附量接近实验结果,这说明Langmuir方程能更好的拟合MWCNT、AC、G对BPA的吸附等温线.另外,从表中还可以看出,AC对BPA的理论最大吸附量可达553.18 mg/g,明显高于MWCNT的99.39 mg/g和G的17.80 mg/g,说明AC对BPA的吸附效果最好,MWCNT次之,G对BPA的吸附量最低. Langmuir方程主要是用来描述化学吸附过程的,适用于单层吸附过程,因此BPA在三种碳材料上的吸附为单层吸附.
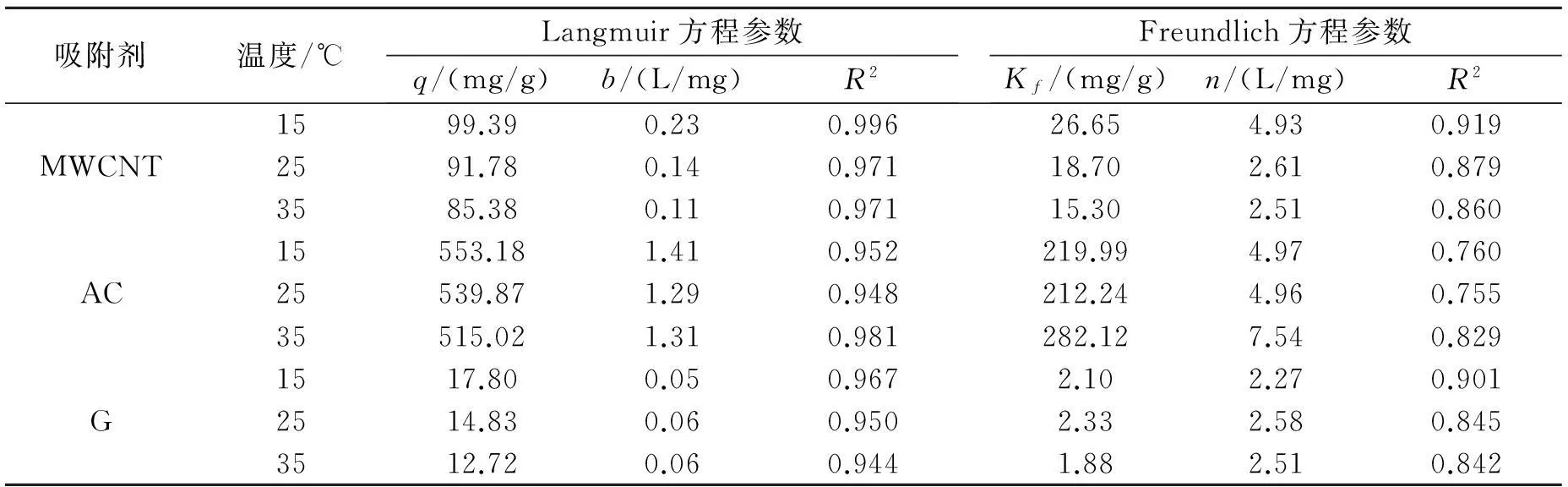
表1 不同温度下MWCNT、AC、G对BPA的吸附等温线拟合参数
对于Langmuir模型而言,分离因子RL可以用来判断吸附剂与吸附质间的亲和作用力.当RL>1时,吸附为不利吸附;当RL=1时为线性吸附,当RL<1时为有利吸附[13].分离因子的计算如下:
(4)
式中RL为分离因子,Co为溶液的初始浓度(mg/L),b为Langmuir方程的常数.
经过计算可知,在不同温度下,不同的BPA初始浓度时,三种材料吸附BPA的分离因子RL在0.002~0.80之间,说明BPA在三种吸附剂上的吸附均为有利吸附.
为进一步探索温度对吸附平衡的影响,应用吉布斯方程分析吸附材料对BPA吸附的热力学行为[14].吉布斯方程如下:
DG0=-RTlnKc
(5)
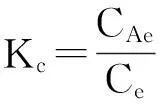
(6)
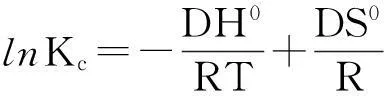
(7)
式中DG0是吸附的标准自由能改变量(J/mol),DH0是标准吸附热(J/mol),DS0吸附的标准熵变值(J/mol),CAe吸附平衡时被吸附的溶液浓度(mg/L),Ce平衡时溶液浓度(mg/L),T绝对温度(K),R气体摩尔常数(8.314 KJ·g-1·mol-1),Kc平衡吸附常数.
基于三种材料对BPA的吸附,分别取不同温度下,适当初始浓度的BPA溶液,根据吉布斯方程,将lnKc与1/T作图,根据斜率及截距计算相应浓度的热力学参数.具体参数如表2所示.
由表2可以看出,三种材料对BPA的等温吸附焓变DH0均为负值,表明吸附过程是一个放热的过程;DH0的大小还反映了吸附质与吸附剂之间的作用力性质,B Von Oepen等[15]认为作用力的类型可以由DH0来判断,如表3所示,本实验中吸附剂对BPA的吸附热为4~35 KJ/mol,均小于60 KJ/mol,故推断其主要吸附机理为范德华力、疏水作用、偶极键力及氢键力的作用,为物理吸附过程.MWCNT和AC表面含有较多的π电子,能够与BPA苯环上的π电子之间产生π-π共轭效应和π-π色散作用[16,17].吸附自由能变DG0是驱动力的体现,MWCNT和AC吸附BPA的都是负值,表明其吸附可自发进行,而G吸附BPA的DG0是正值,表明G对BPA的吸附能力较弱;此外,随着温度的升高,DG0的值逐渐增大,这说明随着温度的升高,吸附反应越不易进行.三种材料对BPA的吸附熵变DS0均小于零,表明吸附过程为熵减少的过程,在固液吸附体系中,溶质分子吸附与溶质分子的脱附是同时进行的,溶质吸附在吸附剂上,是一个熵减少的过程,而溶剂分子的脱附是一个熵增加的过程,吸附过程的熵变是二者的总和,表中的熵变DS0均为负值,表明吸附的溶质分子的熵减少大于脱附的溶剂分子的熵增加,这主要是因为BPA被吸附到碳材料上之后使其活动受限,活性降低,BPA分子的排列比在溶剂中有序,混乱度减小、自由度下降,从而使其吸附过程是一个熵减过程,同时吸附熵变也与吸附剂的孔径大小和分布有关[18].

表2 MWCNT、AC、G吸附BPA的热力学参数
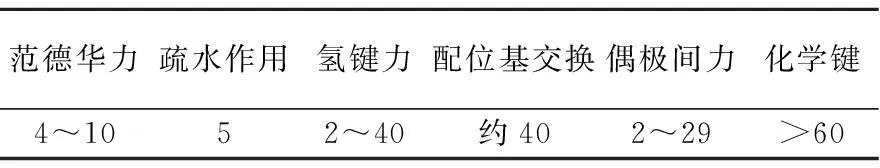
表3 各种作用力引起的吸附热/(KJ/mol)
2.2吸附动力学
图2为MWCNT(a)、AC(b)、G(c)三种碳材料吸附剂对不同初始浓度BPA的吸附动力学.由图可知,在刚开始的吸附过程中,三种材料对BPA的吸附都比较快,随着吸附的进行,吸附速率逐渐下降并趋于平衡,在60 min左右基本达到吸附平衡.这是因为随着吸附的进行,吸附剂上的活性位点逐渐减少,从而导致吸附速率下降直至平衡.
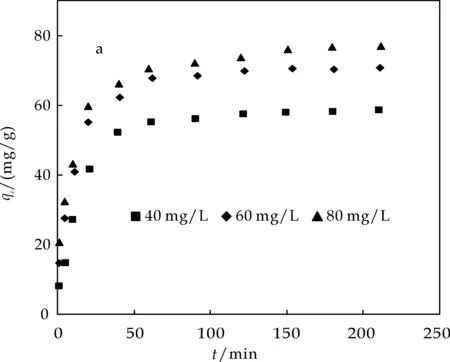
(a)不同初始浓度下BPA在MWCNT上的吸附动力学
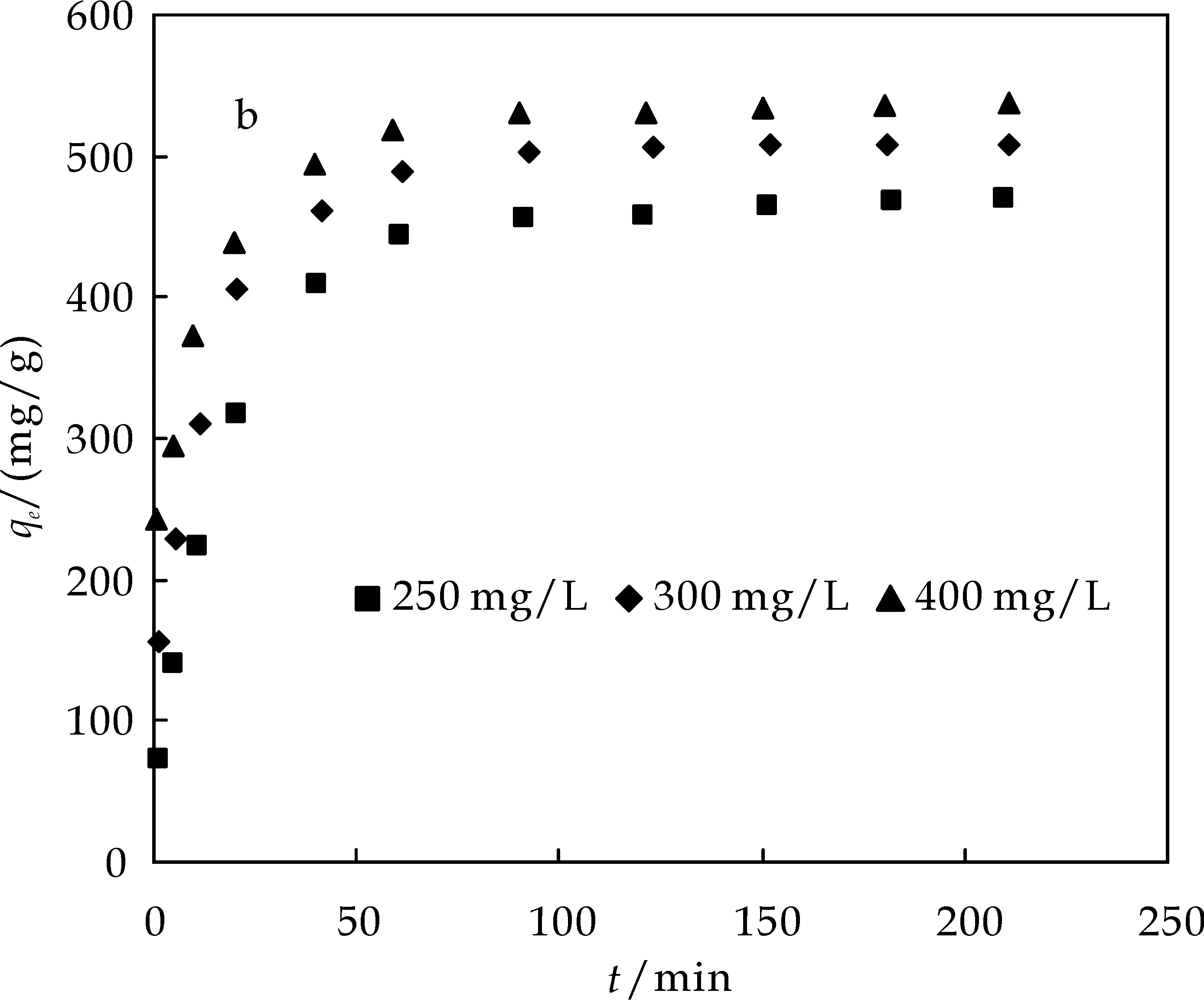
(b)不同初始浓度下BPA在AC上的吸附动力学

(c)不同初始浓度下BPA在G上的吸附动力学图2 不同初始浓度下BPA在MWCNT、AC、G上的吸附动力学
为进一步探究吸附剂对BPA的吸附机理和控速过程,对吸附过程分别利用拟一级动力学方程和拟二级动力学方程对实验结果进行非线性拟合.拟合参数如表4所示.
拟一级动力学方程:

(8)
拟二级动力学方程:
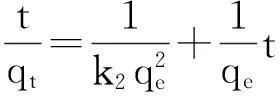
(9)
式中qe为平衡吸附量 (mg/g);qt为t时刻的吸附量 (mg/g);t为吸附时间 (min);k1为拟一级动力学系数 (1/min);k2拟二级动力学[g/(mg·min)].

表4 WMCNT、AC、G吸附BPA的拟一级、二级动力学方程参数
由表4可知,拟一级动力学和拟二级动力学都能较好的拟合吸附剂对BPA的吸附,但对于MWCNT和AC吸附BPA而言,拟二级动力学方程拟合得到的相关系数(R2)较高于拟一级动力学方程拟合得到的相关系数,而且,拟二级动力学方程拟合计算的理论最大值比拟一级动力学方程的计算值更接近于实验实测值,说明拟二级动力学方程可以更好的拟合MWCNT和AC对BPA的吸附动力学.对于G吸附BPA,拟一级动力学方程拟合得到的相关系数(R2)较高于拟二级动力学方程拟合得到的相关系数,而且,拟一级动力学方程拟合计算的理论最大值比拟二级动力学方程的计算值更接近于实验实测值,说明拟一级动力学方程可以更好的拟合BPA在G上的吸附动力学.另外,随着吸附质BPA浓度的增加,MWCNT和AC对BPA吸附的拟二级动力学常数K2和G吸附BPA拟一级动力学常数K1都逐渐降低,说明随着初始浓度的升高,吸附剂对BPA的吸附速率逐渐降低.这可能是因为在低浓度溶液中,吸附剂表面的活性位点比较多,BPA更容易找到吸附位点而被吸附,当浓度增大时,吸附剂表面的吸附位点相对较少,溶液中剩余的BPA分子若要被吸附,需要寻找新的活性位点,克服BPA分子间的斥力,从而导致吸附速率降低.
为进一步探究三种吸附剂对BPA的扩散机制,利用颗粒内扩散方程对吸附动力学进行拟合.内扩散方程如下:
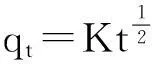
(10)
式中:qt为t时刻的吸附量 (mg/g);K为内扩散的速率常数.
图3为不同初始浓度下,MWCNT(a)、AC(b)、G(c)吸附BPA的颗粒内扩散方程拟合结果.由图可知,经过内扩散拟合后都分别出现了3条不同斜率的直线,说明在吸附剂吸附BPA的过程中,经历了大概3个不同的步骤,表明BPA在碳材料上的吸附影响因素不止一个.在吸附过程刚开始的时候,内扩散拟合的直线斜率比较大,表明在吸附初期,BPA向吸附剂表面扩散的速度比较快,从而被吸附在吸附剂表面;随着扩散的继续进行,吸附剂上的活性位点不断的被已吸附的BPA占据,使得吸附剂上有效的活性位点逐渐减少,从而使吸附速率减小,这时吸附剂对BPA的吸附也从受扩散控制变为受接触吸附的控制.此外,内扩散拟合的直线没有通过原点,说明BPA在吸附剂上的吸附在一定程度上受到边界层扩散的影响.
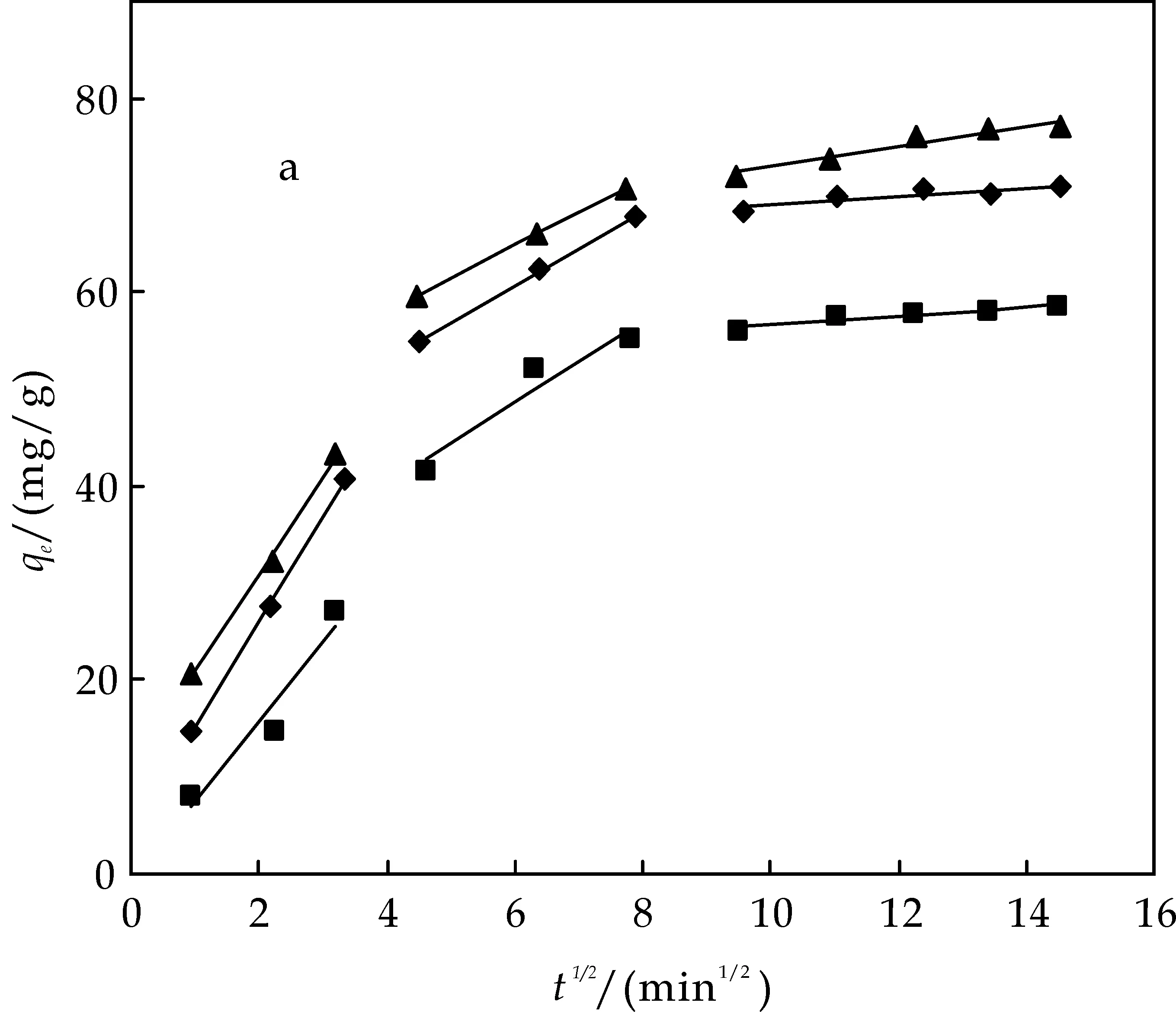
(a) 不同初始浓度下MWCNT吸附BPA颗粒的内扩散模拟
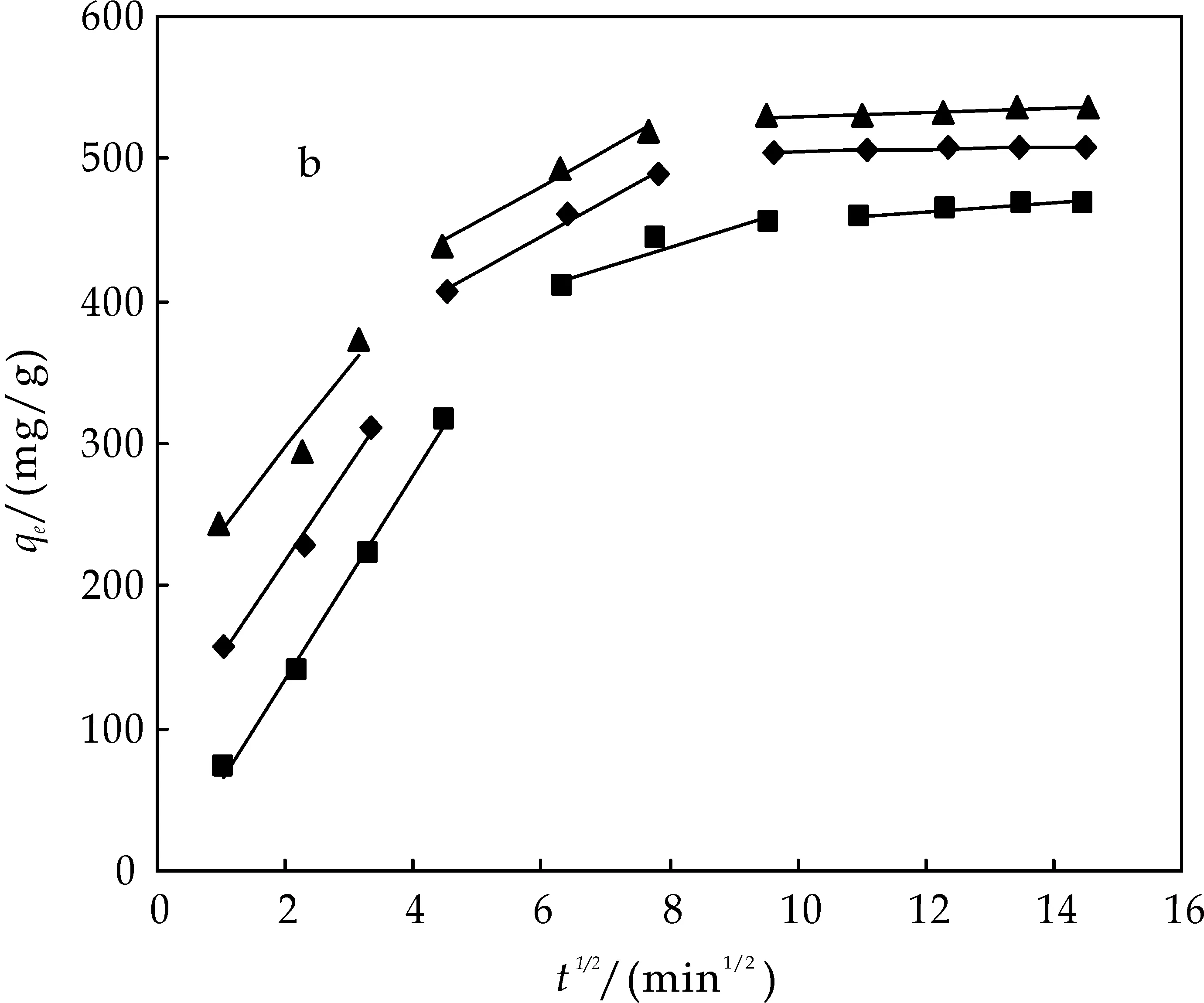
(b) 不同初始浓度下AC吸附BPA颗粒的内扩散模拟

(c) 不同初始浓度下G吸附BPA颗粒的内扩散模拟图3 不同初始浓度下MWCNT、AC、G吸附BPA颗粒的内扩散模拟
2.3溶液pH对吸附效果的影响
溶液的pH值是影响吸附的重要因素之一,因为它可以改变吸附剂和吸附质上的净电荷.图4为pH对BPA在三种材料上的吸附的影响,由图可知,当pH小于8时,三种吸附剂对BPA的吸附量基本保持不变,但当pH大于8时,吸附量逐渐下降;从整体上来看,酸性条件下吸附剂对BPA的吸附效果比碱性条件下的相对较好.这是由BPA在水溶液中的离解平衡常数Ka决定的,当pH>pKa时,BPA主要以离子态存在,BPA的Ka为9.59~11.30[19].通常情况下BPA在水溶液中存在两级电离,Bautista-Toledo等[20]研究发现,在pH=8.0时,BPA发生一级电离,如式(11)所示,当pH=9.0时,BPA发生二级电离,如式(12)所示,所以当pH大于8时,溶液中的BPA主要以离子态存在,因此BPA在吸附剂上的吸附量就会明显降低.同时,吸附上的离子态的BPA会与溶液中的HBPA-和BPA2-产生静电斥力,也会降低吸附剂对BPA的整体吸附效果.
H2BPA→H++HBPA-
(11)
HBPA-→H++BPA2-
(12)

图4 溶液pH对吸附剂吸附BPA的影响
3结论
本实验选用三种碳材料(碳纳米管、活性炭、石墨)作为吸附剂,研究其去除水中的BPA.其中活性炭对BPA的吸附效果最好,最高吸附量可达553.18 mg/g,MWCNT次之,吸附量为99.39 mg/g,石墨对BPA几乎没有吸附量,最大吸附量只有17.80 mg/g.
随着温度的升高,吸附剂对BPA的吸附量都有所增加,吸附过程为吸热过程,以物理吸附为主;吸附剂对BPA的吸附等温线可以用Langmuir等温线方程拟合,吸附过程为有利吸附.在不同的初始浓度下,拟二级动力学方程可以更好的拟合BPA在MWCNT和AC上的吸附动力学,G对BPA的吸附更符合拟一级动力学方程;BPA在吸附剂上的吸附大致有3个不同的步骤,边界层扩散会影响其吸附过程.
溶液pH值在小于8的范围内变化时,对吸附剂吸附BPA几乎没有影响,当pH大于8时,pH的增大会使吸附剂对BPA的吸附量明显减小,这是BPA在碱性条件下会发生电离的结果.
参考文献
[1] Colborn T,Vom Saal F S,Soto A M.Develomental effects of endocrine-disrupting-chemicals in wildlife and humans[J].Environment Health Perspective,1993,101(5):378-384.
[2] 李杰, 司纪亮.环境内分泌干扰物质简介[J].环境与健康杂志,2002,19(1):83-84.
[3] 杜克久,徐晓白.环境雌激素研究进展[J].科学通报,2000,45(21):2 241-2 251.
[4] Kavlock R J,Daston G P,Rosa C D,et al.Research needs for risk assessment of health and environmental effects of endocrine disrupters:A report of the U.S.EPA-sponsored workshop[J].Environmental Health Perspectives,1996,104:715-740.
[5] 薛祖源.双酚A生产工艺现状及展望[J].化工设计,2006,16(2):7-12.
[6] 贾凌志,李君文.环境中双酚A的污染及降解去除的研究进展[J].环境与健康杂志,2004,21(2):120-122.
[7] Kitaoka M,Hayashi K.Adsorption of bisphenol A by cross linkedβ-cyclodextrin polymer[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2002,44:429-431.
[8] Ohka Y,Ando I,Niwa C,et al.Degradation of bisphenol A in water by TiO2photocatalyst[J].Environmental Science and Technology,2001,35(11):2 365-2 368.
[9] Tanaka S,Nakata Y,Kimura T,et al.Electro-chemical decomposition of bisphenol a using Pt/Ti and SnO2/Ti anades[J].Journal of Applied Electrochemistry,2002,32:197-201.
[10] Spivack J,Leib T K,Lobos J H.Novel pathway for bacterial metabolism of bisphenol A,rearrangements and stilbene cleavage in bisphenol A metabolism[J].Journal of Biological Chemistry,1994,269:7 323-7 329.
[11] 叶美军.紫外分光光度法测定环氧树脂中的微量双酚A[J].化学世界,1991,32(12):553-556.
[12] 韩璐, 王浩然, 易小祺,等.粒状活性炭对水中双酚A吸附性能的研究[J].沈阳师范大学学报(自然科学版),2010,28(4):525-529.
[13] Deng S,Bai R.Adsorption and desorption of humic acid on aminated polyacrylonotrile fibers[J].Journal of Colloid and Interface Science,2004,280(1):36-43.
[14] Huang J,liu Y,Wang X.Selective adsorption of tannin from flavonoids by organicalluymodified attapulgite clay[J].Journal of Hazardous Materials,2008,160(2-3):382-387.
[15] Von Oepen B,Krdel W,Klein W.Sorption of nonpolar and polar compounds to soils:processes,measurements and experience with the applicability of the modified OECD-guideline 106[J].Chemosphere,1991,22(3-4):285-304.
[16] Long R Q,Yang R T.Carbo nanotubes as superior sorbent for dioxin removal[J].Journal of the American Chemical Society,2001,23(9):2 058-2 059.
[17] Coughlin R W,Ezra F S.Role of surface acidity in the adsorption of organic pollut ants on the surface of carbon[J].Environmental Science and Technology,1968,2(4):291-297.
[18] 陈素清,梁华定,邱昀芳.碳纳米管吸附水溶液中双酚A的热力学[J].应用化学,2009,26(5):571-575.
[19] Charles A S,Philip B B,Gary M K,et al.A review of the environmental fate,effect,and exposures of bisphenol A[J].Chemosphere,1998,36(10):2 149-2 173.
[20] Bautista Toledo I,Ferro Garcia M A,Rivera Utrilla J,et al.Bisphenol A removal from water by activated carbon.effects of carbon charact-eristics and solution chemistry[J].Environmental Science and Technology,2005,39(16):6 246-6 250.
Study on adsorption thermodynamics and kinetic of
bisphenol A on different carbon materials
WANG Jia-hong, YIN Xiao-long
(College of Resources and Environment, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:In the study,the bisphenol A (BPA) adsorption behavior onto multi-walled carbon nanotubes (MWCNT),activated carbon (AC) and graphite (G) was conducted.The thermodynamics and dynamics for BPA adsorption onto adsorbent were also studied, and adsorption mechanism was discussed. Adsorption experiments results showed that the adsorption capacity of BPA onto AC was highest 527.03 mg/g,and the amount of BPA adsorption onto G was only 14.32 mg/g.The adsorption amount of BPA was reduced with an increase of temperature, indicating of an exothermic reaction.Adsorption isotherm of BPA onto adsorbent could be well fitted by langmuir model,and BPA adsorption was an advantageous adsorption.The pseudo-second-order kinetics could fit BPA adsorption onto MWCNT and AC very well,while BPA adsorption onto G could be described with pseudo-first-order kinetic model and the adsorption process was affected by boundary diffusion.No obvious change of BPA adsorption onto adsorbent was observed at pH below 8,while BPA adsorption onto adsorbent was decreased with the increased pH at pH above 8.
Key words:bisphenol A; carbon materials; adsorption; thermodynamics; kinetics
中图分类号:X523
文献标志码:A
文章编号:1000-5811(2015)02-0027-07
作者简介:王家宏(1979-),男,河南信阳人,副教授,博士,研究方向:环境功能材料
基金项目:国家自然科学基金项目(21107065); 陕西省科技厅自然科学基金青年项目(2012JQ2003); 陕西省科技厅社会发展科技攻关项目(2013K13-01-07)
收稿日期:*2014-12-25

