鱼类烟酸营养生理研究进展
■刘伟 文华
(农业部淡水生物多样性保护与利用重点开放实验室中国水产科学研究院长江水产研究所,湖北武汉430223)
烟酸(niacin)又名尼克酸、VB3、维生素PP、抗糙皮因子等,是所有维生素中结构最简单的,且稳定性最强的一种水溶性B族维生素,与其具有相似生物学活性的衍生物为烟酰胺。本文在国内外相关研究的基础上对烟酸的生理功能,鱼类饲料中的需要量以及烟酸对鱼类生理状态的影响进行了分析和探讨,以期为烟酸在鱼类饲料中的应用提供科学指导。
1 烟酸的生理功能
烟酸的化学纯品于1867年被分离成功,但直到1937年才证实它是狗的抗黑舌因子和人的抗糙皮病维生素[1]。烟酸具有多种生物活性,是烟酰胺腺嘌呤二核苷酸(NAD)和烟酰胺腺嘌呤二核苷酸磷酸(NADP)的辅酶,在体内主要以NADH和NADPH形式存在,参与生物体内300多种氧化还原反应[2]。NDAH主要作为电子载体以辅酶的形式参与分解代谢的氧化反应,如细胞内有氧呼吸及糖酵解途径,而NADPH主要作为供氢体参与生物合成的还原反应,如脂肪酸和类固醇的合成及作为辅酶参与戊糖磷酸循环。因此,它在糖类、脂类和蛋白质的代谢中有着举足轻重的作用,是机体三大物质代谢的基本保障。
2 鱼类饲料中烟酸的需要量(见表1)
根据现有报道,随饲料中烟酸添加水平的增加,鱼类的生长速度增加;当达到一定的水平后,随着饲料中烟酸含量的进一步增大,维持在一定稳定水平。由表1可以看出,大部分报道均以最大生长或最高肝脏烟酸蓄积为判定指标,多数鱼类的烟酸需要量在10~50 mg/kg之间,少部分鱼类可以达到100 mg/kg,甚至更高。
3 影响烟酸需要量的因素
3.1 饲料原料中的烟酸
动植物原料中都含有丰富的烟酸。在鱼类饲料中常用的原料如鱼粉大约含量为60 mg/kg,豆粕为30 mg/kg,棉粕为 40 mg/kg,菜粕为 160 mg/kg[19]。通常认为植物原料中的大部分烟酸以结合形式存在,限制了鱼类的利用。Ng等(1998)通过在饲料中添加不同烟酸水平,以肝脏NAD活性建立的直线模型为依据,测定了斑点叉尾鮰对7种饲料原料(鲱鱼粉、肉骨/血粉、小麦麸、熟化玉米、生玉米、棉粕、豆粕)的烟酸生物利用率,发现鲱鱼粉、肉骨/血粉的烟酸生物利用率接近100%,小麦麸、熟化玉米、生玉米分别为60%、44%和28%,而棉粕和豆粕分别为58%和57%。由此作者认为在典型的商业化配方中,因为原料中的所含的烟酸已满足斑点叉尾鮰的生理需要,烟酸可以不加或者降低用量[20]。林仕梅等(2003)对异育银鲫研究也发现在实用配方中不添加烟酸也可取得与添加烟酸同样的养殖效果[21]。

表1 部分鱼类的饲料中烟酸需要量
3.2 饲料营养成分
已有研究发现碳水化合物种类[5]、脂肪水平[22]等对动物的烟酸营养生理产生作用。但有关色氨酸转化为烟酸的研究较多。对于哺乳动物而言,食物中的色氨酸通过犬尿氨酸途径所产生的吡啶-2,3-二羧酸可转化为烟酸核糖核苷酸[23],但是这种转化率不高,一般在2%左右[24];维生素等营养物质缺乏也降低色氨酸转化为烟酸的效率。但对鱼类来讲,似乎利用色氨酸合成烟酸的能力不强。美洲红点鲑饲料色氨酸即使含量达到了1.7%,也未能阻止其生长不良,并不能减缓其出现缺乏症的时间,表明色氨酸不是烟酸的有效前体[27],鲑鳟鱼类通过色氨酸合成烟酸的能力是有限的[28]。在缺乏烟酸的斑点叉尾鮰饲料中添加色氨酸也未改善其生长、饲料利用效率、血细胞比容和肝脏NAD活性,表明色氨酸不是烟酸的有效前体[29]。利用不添加烟酸的饲料饲养异育银鲫发现色氨酸适宜时,其特定生长率、摄食率和蛋白效率达到最大值,饲料效率和蛋白沉积率也显著高于色氨酸缺乏组,表明异育银鲫幼鱼体内可能存在色氨酸-烟酸转化途径[30]。
除色氨酸外,在大鼠中也发现饲料中亮氨酸(Leu)的含量过高,会提高烟酸的需要,这一般认为是亮氨酸影响到了色氨酸的代谢[31]。而过量的赖氨酸可以提高因为烟酸缺乏而减缓鸡的生长[32]。但在鱼类中,有关此方面的研究还未见相关报道发表。
4 烟酸对鱼类生理状态的影响
饲料中的烟酸不足会降低某些鱼类如草鱼的免疫功能[11]。而过低则会引起动物的病理反应,并表现出一定的缺乏症状,但达到一定的水平后,症状会消失。同时,根据已有的报道也可以发现烟酸的水平也会影响营养物质的蓄积和血液指标的变化。
4.1 鱼类烟酸的缺乏症
烟酸在生物体内的作用很多,因而可以非常容易诱导出鱼类的缺乏症。不同鱼类的烟酸缺乏症表现类似,表现为厌食、生长缓慢、皮肤受损、鳍条出现异常的问题,有的种类会出现眼球突出、贫血等症状,且幼龄鱼的缺乏症更为明显(见表2)。
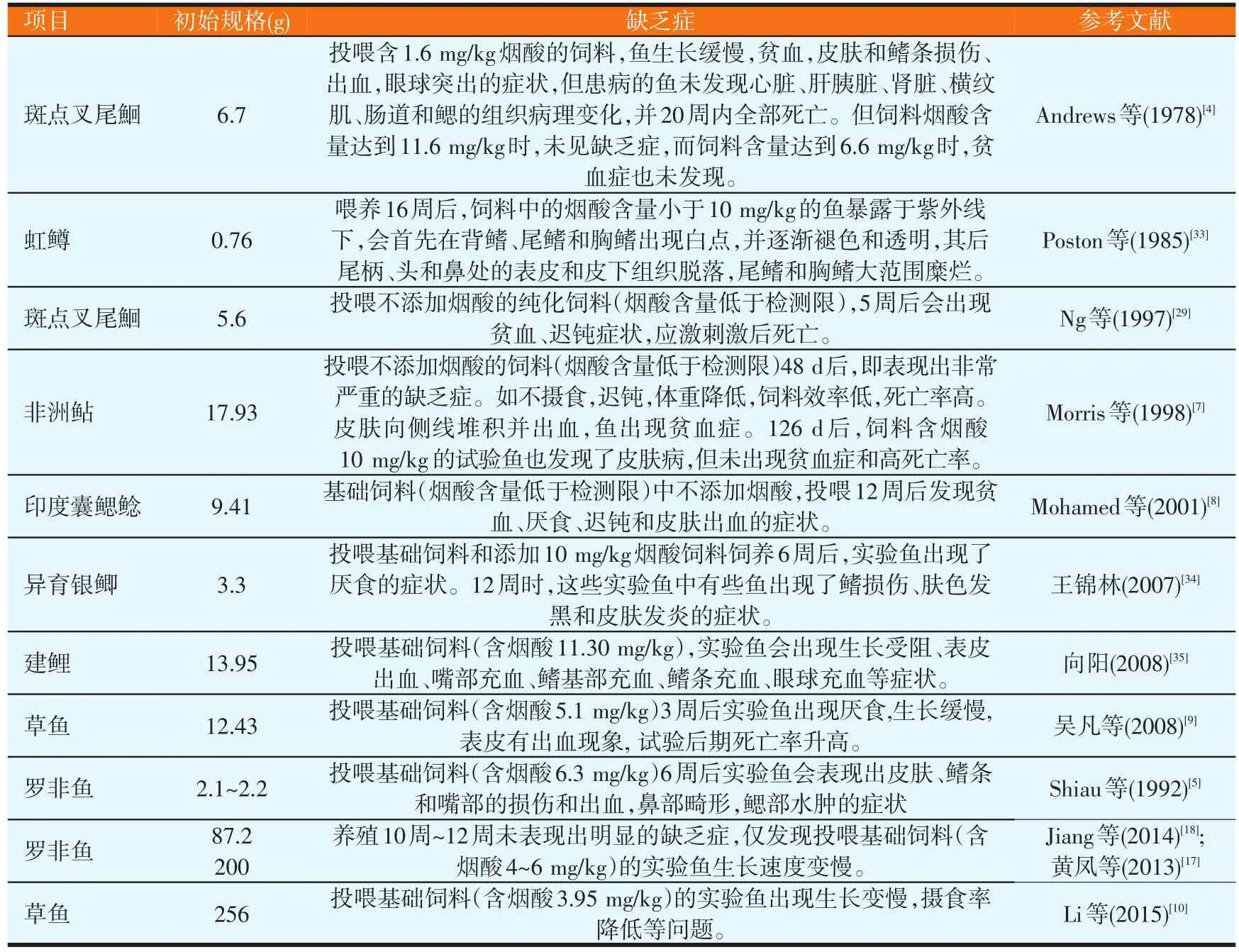
表2 部分鱼类的烟酸缺乏症
4.2 体成分
关于烟酸对试验鱼体脂肪积累的影响研究报道较多。饲料中的烟酸水平对于鱼类体脂肪积累的影响,一般表现为随添加量的增加呈现先增加后稳定的趋势[8,14,35];但是也有鱼类会随着添加量的增加体脂含量逐渐增加,如饲料中添加0~50 mg/kg烟酸使得露斯塔野鲮的体脂肪含量逐渐升高[36]。也有一些研究,如金头鲷的需要量为63~83 mg/kg烟酸,当饲料中烟酸含量少于28.67 mg/kg时,其鱼体脂肪含量会降低,而水分含量会升高[6]。饲料中不添加烟酸的美洲鲇体脂肪含量显著高于饲料烟酸含量为17 mg/kg的试验鱼[7]。也有研究发现摄入大量的烟酸(10 000 mg/kg)的溪红点鲑肝脏脂肪含量增加,体脂肪含量和生长率降低[37]。以上结果表明不同鱼种之间,烟酸的对其脂类代谢的影响有所差异。
也有研究发现,饲料中添加烟酸在一定范围内会提高鱼体的蛋白质含量,但是如果添加量再增加则可能会降低体蛋白含量。对于初始体重87 g的罗非鱼,投喂含6.4~297.8 mg/kg烟酸的六组饲料,发现罗非鱼摄食含68.5~143.8 mg/kg烟酸的饲料,其全鱼粗蛋白显著高于其他组[18]。而对于初始体重220 g的罗非鱼,投喂含11.84~335.36 mg/kg烟酸的六组饲料,发现罗非鱼摄食含157.15、335.36 mg/kg烟酸的饲料组,其全鱼粗蛋白显著高于其他组[17]。对露斯塔野鲮的研究发现,饲料中添加0~30 mg/kg烟酸,随添加量的增加去内脏全鱼的蛋白含量显著升高,但烟酸添加40~50 mg/kg,其蛋白含量则会显著降低[14]。也有一些研究表明,饲料中添加烟酸对鲈鱼[15]、大黄鱼[15]、虹鳟[33]的体成分无显著影响。
4.3 血液指标
血液是动物循环系统的重要组成部分,起着物质运输、生理调节及防御等重要作用。正常血液指标值能反映物种的特性及其正常生理状态,如动物的健康状况、营养水平等;同时,血液指标是动物生理、病理研究的重要参考依据[38]。饲料中烟酸的含量影响部分鱼类血液生理生化指标。当饲料中的烟酸含量小于25 mg/kg时,会轻微的降低金头鲷的血糖水平[6]。饲料中的烟酸含量达到了33.06 mg/kg时可以显著提高非洲鲶的血细胞比容,而当烟酸的含量在50.36~94.07 mg/kg时,血细胞比容又进一步提高[7]。随着饲料中烟酸含量的增加,异育银鲫血液红细胞数也在增加,在44 mg/kg添加组达到最大,而其血细胞比容在17 mg/kg饲料组达到最高,其次为30 mg/kg和44 mg/kg组,此三组的血球容积比都显著高于对照组[34]。随烟酸水平的升高87.2 g的吉富罗非鱼的高密度脂蛋白胆固醇水平逐渐升高,而甘油三酯水平有逐渐降低的趋势[18]。在饲料中添加0~160 mg/kg的烟酸,当添加量为10~160 mg/kg时,虹鳟肝脏脂肪含量显著高于0~5 mg/kg[33]组。草鱼的研究中发现在饲料(基础饲料含烟酸5 mg/kg)中添加10~320 mg/kg的烟酸可以增加草鱼的体脂肪含量,提高血清中HDL和LDL的水平[9],而在罗非鱼的饲料(基础饲料含有6~11 mg/kg)中添加 20~320 mg/kg的烟酸可以提高罗非鱼成鱼(220~550 g)的体脂肪含量,降低血清TG水平,而血清HDL和CHOL水平先升高后降低;但对于体重80~370 g的罗非鱼则未发现影响体脂肪含量,而提高了血清HDL水平,降低了血清TG水平[17-18],表明烟酸影响鱼类脂类代谢。
5 小结
值得注意的是,烟酸一方面作为一种生物必需的维生素,另一方面可作为脂类代谢调节剂,其高水平的摄入对一些哺乳动物而言具有调节脂类代谢的作用,改善非酒精性脂肪肝[39]、肥胖[40]等病症的症状,提高机体的健康水平。鱼体沉积大量脂肪于肝脏、腹腔等部位是人工养殖鱼类中经常遇到的脂类代谢异常现象。脂肪沉积过多,会导致鱼类食用价值降低,抗应激能力下降,遭遇不利环境因素甚至会大量死亡,给生产造成巨大损失。目前,尚不清楚高水平烟酸是否也会对此现象产生改善作用。因此,今后的研究要重点关注以下方面:①饲料原料中可利用的烟酸量、饲料营养物质组成的变化与鱼类生长和生理的需要量之间的关系,为精准的饲料配方设计提供基础资料;②高水平烟酸对鱼类脂类代谢调节的作用,为鱼体脂肪代谢的调控以及烟酸在鱼类饲料中的合理使用提供参考依据。

