哈蟆油蛋白抗疲劳活性及SDS-PAGE凝胶成像分析研究
哈蟆油蛋白抗疲劳活性及SDS-PAGE凝胶成像分析研究
鲍悦1,宗颖2,孙佳明1*,张辉1*
(1.长春中医药大学中医药与生物工程研发中心,长春 130117;2.吉林农业大学,长春 130117)
摘要:目的对哈蟆油蛋白抗疲劳活性及不同来源的哈蟆油与混伪品的鉴别研究。方法采用Lowry法测定哈蟆油总蛋白的含量,并运用SDS-聚丙烯酰胺凝胶电泳法分离哈蟆油总蛋白;采用整体动物实验观察小鼠游泳和爬杆时间;利用SDS-PAGE和凝胶成像分析系统对不同来源哈蟆油及其混伪品进行鉴别。结果测得哈蟆油水溶性蛋白的含量为42%,哈蟆油中蛋白的分子量在1万~12万可以分离出较清晰的蛋白质点,并具有7条主蛋白带;哈蟆油组和哈蟆油蛋白组相对于对照组均能延长小鼠游泳和爬杆的时间,差异具有统计学意义,且哈蟆油蛋白组优于哈蟆油组;经SDS-PAGE电泳的凝胶成像分析系统分析,表明4个不同地区的哈蟆油均有相同的电泳行为,泳道上有6条主带,而伪品大蟾蜍的干燥输卵管只有一条明显的主谱带。结论哈蟆油总蛋白是哈蟆油中抗疲劳有效组分,SDS-PAGE电泳的凝胶成像分析法可用于不同来源的哈蟆油与混伪品的鉴别,为哈蟆油的开发利用提供了必要的科学依据。
关键词:哈蟆油;活性蛋白;SDS-PAGE凝胶成像分析
DOI:10.13463/j.cnki.jlzyy.2015.05.020
中图分类号:R282.74文献标志码: A
文章编号:1003-5699(2015)05-0498-04
基金项目:国家中医药行业专项名贵珍稀动物药及混伪品鉴定技术及规范应用研究(2015468002-2);吉林省科技厅重点项目(YYZX201007)。
作者简介:鲍悦(1990-),女,硕士研究生,主要从事中药学研究。
收稿日期:(责任编辑:张瑞彬2014-04-10)

*通信作者:张辉,电话-(0431)86172080,电子信箱-zhanghui_8080@163.com
孙佳明,电话-(0431)86172280,电子信箱-sun_jiaming2000@163.com
Analysis and Research on the anti fatigue activity of Oviductus
Ranae protein and SDS-PAGE gel imaging
BAO Yue1,ZONG Ying2,SUN Jiaming1*,ZHANG Hui1*
(1.Traditional Chinese medicine and biological engineering research and development center,
Changchun University of Chinese Medicine,Changchun 130117,China;
2.Jilin Agricultural University,Changchun 130117,China)
Abstract:ObjectiveStudy on Anti fatigue activity of Oviductus Ranae protein and identification of different sources of Oviductus Ranae and adulterants.MethodsDetermination of content of total protein of toad oil by Lowry method,separate the total proteins of toad oil using SDS-polyacrylamide gel electrophoresis;To observe the mice swimming time and pole climbing time using the whole animal experiment;Analysis system with SDS-PAGE and gel imaging to identify different sources of toad oil and their adulterants.ResultsThe measured content of toad oil soluble protein was 42%;The relative molecular weight is between 1 million-12 million and clear protein spots can be separated In this interval,there are seven main protein bands;Oviductus Ranae group and the Oviductus Ranae protein group compared with the control group could prolong mice swimming and climbing pole time,with statistical significance,and the Oviduct-us Ranae protein group was better than that of Oviductus Ranae group.By SDS-PAGE electrophoresis gel imaging analysis system analysis,showed that Oviductus Ranae in four different areas of oil have the same electrophoresis,there are six main bands,Adulterants Bufo drying fallopian tube only one obvious main bands.ConclusionsThe total protein of Oviductus Ranae is toad oil anti fatigue component,SDS-PAGE electrophoresis gel imaging analysis method can be used for different sources of toad oil identification and adulterants,To provide the necessary scientific basis for the development and utilization of Oviductus ranae.
Keywords:Oviductus Ranae;protein activity;SDS-PAGE gel imaging
哈蟆油(Oviductus Ranae)为蛙科动物中国林蛙RanatemporariachensinensisDavid雌蛙的干燥输卵管。据《中华人民共和国药典》(2010年版)1部收载,哈蟆油具有补肾益精,养阴润肺的功效。临床用于阴虚体弱,神疲乏力,心悸失眠,盗汗不止,痨嗽咳血等症的治疗[1-2]。多年来,我国学者对哈蟆油进行了较为全面、系统的研究[3-12],在前人对哈蟆油研究的基础上[13-17],本实验对哈蟆油活性蛋白的提取、蛋白含量、药效学考察等方面进行了更加系统深入的研究。由于国内外市场对哈蟆油的需求量不断增加,市场销售价格昂贵,因此市场上出现较多的伪品和掺杂品,例如马铃薯、甘薯加工品、鳕鱼(明太鱼)精巢、琼脂蛋白胨、青蛙油、中华大蟾蜍输卵管等。尤其是中华大蟾蜍输卵管在性状特征上与哈蟆油极为相似,为保证用药的安全有效,需对其进行有效的真伪鉴别。本实验采用SDS-PAGE和凝胶成像分析系统相结合的方法,针对不同来源的哈蟆油及其伪品的总蛋白进行比较实验,为哈蟆油的开发利用提供了必要的科学依据。
1实验材料
1.1实验仪器Agilent 1100高效液相色谱仪,凝胶成像及分析系统Lab Works 4.6,FO-1000真空冷冻干燥机,DYCZ-24D型双垂直电泳槽,ECP3000型三恒电泳仪等。
1.2实验试剂三羟甲基氨基丙烷(Tris),丙烯酰胺(Acrylamide),N,N亚甲基双丙烯酰胺(N,N-Methylene Bisacrylamideminimu),过硫酸铵(Ammonium Persulfate),十二万基硫酸钠(SDS),L-甘氨酸(L-Glycune),β-巯基乙醇(β-Mercaptoethanol),考马斯亮蓝(Marker,Coomassie Brilliant Blue),溴酚蓝(Bromphenol Blue),小牛血清。所用生化试剂均为进口分装及电泳纯,其他试剂为国产分析纯。
1.3实验药材哈蟆油来自吉林省舒兰市,吉林省桦甸市,内蒙古,青海省。经长春中医药大学姜大成教授鉴定为蛙科动物中国林蛙(Rana chensinensis)的干燥输卵管。
2实验方法
2.1哈蟆油总蛋白的提取取哈蟆油干品200 g,剔除表面筋膜,研钵研磨成颗粒状,用100倍量pH 7.5 200 mmol的磷酸盐缓冲液,于4 ℃浸泡,分次用高速组织捣碎机粉碎,直至匀浆液成为乳白色糊状,所得匀浆液离心(4 ℃,12 000 r/min,20 min),合并上清液,沉淀烘干待用。清液加95%乙醇至醇浓度达到50%,4 ℃静置24 h,滤过,清液减压浓缩至糖浆状,冻干得到哈蟆油总蛋白粗品,-80 ℃保存待用。
2.2哈蟆油蛋白的含量测定按Lowry法[19]测定哈蟆油蛋白的浓度,以牛血清白蛋白为标准蛋白。
2.2.1标准曲线绘制配制1 mg/mL牛血清蛋白(BSA)溶液,称取10 mg蒸馏水溶解,定容到10 mL作为标准溶液。分别吸取10、20、40、80、100 μL的标准溶液,加水至100 μL,空白调零管直接吸取100 μL。每管加入5 mL的考马斯亮蓝试剂,快速混匀,室温反应5 min,在5~20 min之间检测595 nm波长下的吸光值。需注意的是石英比色皿可与CBB-G250染料结合,故用玻璃或塑料比色皿检测,检测完毕用醇涮洗。以牛血清蛋白标准溶液在每管中的蛋白浓度(μg/mL)为横坐标(X),以测得的吸光值为纵坐标(Y),作标准曲线回归方程。
2.2.2样品含量测定称取哈蟆油蛋白粗提物0.010 15 g,加入200 mmol Tris-HCl缓冲液(pH 7.5)10 mL于离心管中,12 000 r/min离心1 min,取上清液。另取试管1支,加入上清液0.4 mL,蒸馏水0.6 mL,再加入试剂甲5 mL,混匀后放置10 min,然后加入试剂乙0.5 mL,迅速混匀,室温下放置30 min,以不含蛋白质的1号试管为对照,与样品试管内的溶液于640 nm波长下比色,记下吸光度。
2.3总蛋白的SDS-PAGE电泳分析参照Laemmli方法[18]进行电泳,采用不连续胶系统,5%浓缩胶和12%分离胶,用考马斯亮蓝法染色。标准相对分子量蛋白(marker,Amersham公司出品)为兔磷酸化酶B(97.4 kDa),牛血清白蛋白(66.2 kDa),兔肌动蛋白(43.0 kDa),牛碳酸酐酶(31.0 kDa),胰蛋白酶抑制剂(20.1 kDa),鸡蛋清溶菌酶(14.4 kDa)。样品为上述所得总蛋白冻干品。
2.4凝胶成像法对哈蟆油真伪鉴别分别取舒兰、桦甸、内蒙古、青海的哈蟆油干品及伪品大蟾蜍输卵管的干品,剔除表面筋膜,研钵研磨成颗粒状,精密称定1 g,分别用pH 7.5 200 mmol磷酸盐缓冲液,定容至100 mL,4 ℃浸泡膨胀24 h,用高速组织捣碎机粉碎,直至匀浆液成为乳白色糊状,所得匀浆液离心(4 ℃,12 000 r/min,20 min),取上清液参照Laemmli方法[18]进行电泳,凝胶成像及分析系统进行分析。
2.5哈蟆油总蛋白抗疲劳活性的考察

3实验结果
3.1标准曲线绘制以牛血清白蛋白为标准蛋白,得到吸光度Y与浓度X(μg/mL)的回归方程为Y=0.001 7X+0.015 6,相关系数r=0.999 6。
3.2哈蟆油蛋白的含量测定采用紫外分光光度法测得样品吸光度,根据上述的回归方程算得样品中蛋白质含量,计算哈蟆油蛋白质百分含量。结果表明哈蟆油的水溶性蛋白的含量约为42%。
3.3总蛋白SDS-PAGE电泳分析聚丙烯酰胺凝胶电泳表明,哈蟆油中蛋白的分子量在1万~12万之间可以分离出较清晰的蛋白质点,有7条主蛋白带。
3.4凝胶成像法对哈蟆油真伪鉴别由电泳的凝胶成像及分析系统分析表明舒兰、桦甸、内蒙古、青海的哈蟆油均有相同的电泳行为,泳道上有6条主带,而伪品大蟾蜍的干燥输卵管只有一条明显的主谱带。结果见图1~图2。

1Maker 2舒兰 3桦甸 4内蒙古 5青海 6、7 大蟾蜍(由左至右) 图1 不同来源哈蟆油及其伪品电泳图谱
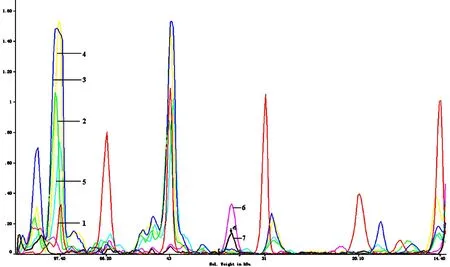
1Maker 2舒兰 3桦甸 4内蒙古 5青海 6、7 大蟾蜍 图2 不同来源哈蟆油及其伪品蛋白凝胶成像分析图
3.5哈蟆油总蛋白抗疲劳活性的考察
3.5.1小鼠游泳实验结果实验结果表明:哈蟆油组和哈蟆油蛋白组相对于对照组均能延长小鼠游泳时间,差异具有统计学意义(P<0.001)。见表1。
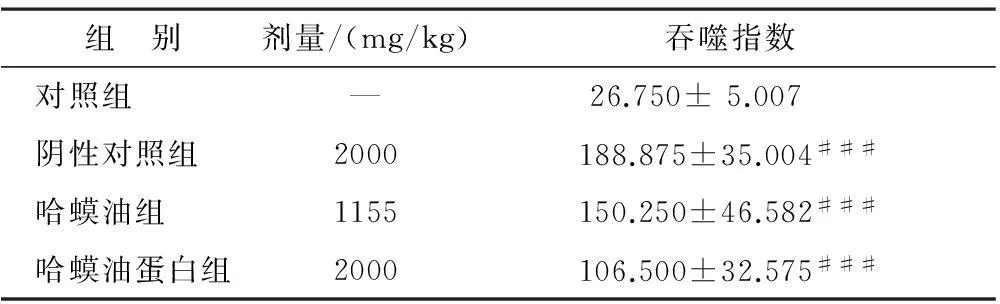
组 别剂量/(mg/kg)吞噬指数对照组 —26.750±5.007 阴性对照组 2000188.875±35.004###哈蟆油组 1155150.250±46.582###哈蟆油蛋白组2000106.500±32.575###
注:与对照组比较,###P<0.001
3.5.2小鼠爬杆实验结果实验结果表明:哈蟆油组和哈蟆油蛋白组相对于对照组均能延长小鼠爬杆时间,差异具有统计学意义(P<0.001)。见表2。
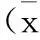

组 别剂量/(mg/kg)爬杆时间/s对照组 —22.750±7.769 阴性对照组 2000189.250±59.816###哈蟆油组 1155191.375±42.588###哈蟆油蛋白组2000128.625±36.965###
注:与对照组比较,###P<0.001
4结论
从小鼠游泳耗竭时间可以反映出某种物质对抗疲劳的效果[18],并且本实验对小鼠爬杆时间也进行了考察,实验结果显示,哈蟆油组和哈蟆油蛋白组相对于对照组均能延长小鼠游泳和爬杆的时间,差异具有统计学意义,并且哈蟆油蛋白组优于哈蟆油组,表明哈蟆油蛋白是哈蟆油抗疲劳的有效组分。
基于上述实验结果,本研究以哈蟆油蛋白为研究对象,依据有效成分和药材质量控制相结合的原则,运用SDS-PAGE和凝胶成像分析系统对不同来源的哈蟆油及其混伪品进行鉴别,发现其具有优越的鉴别能力。该研究结果可以从技术上对药材市场中哈蟆油的混伪品进行有效的鉴别,为保证临床用药的安全及有效性提供有利的技术保障,同时也为哈蟆油保健食品的开发奠定基础。
参考文献:
[1]国家药典委员会.中华人民共和国药典:1部[M].北京:中国医药科技出版社,2010.
[2]《中国药用动物志》协作组.中国药用动物志[M].天津:天津科学技术出版社,1983.
[3]谢程,张兰杰,张炜煜,等.哈蟆油对免疫功能低下或增强小鼠的免疫调节作用[J].中国老年学杂志,2010,30(11):3132-3133.
[4]顾红缨,林卓,徐云,等.哈蟆油调节小鼠细胞免疫功能的实验研究[J].吉林中医药,2010,30(12):1103-1104.
[5]王丽兰,王之光,姜言功,等.哈士蟆油成分分析[J].中草药,1982,13(9):5.
[6]崔桂友.哈蟆油的形态结构观察和化学成分测定[J].生物学杂志,2000,17(1):27.
[7]王红燕,徐绥绪.哈士蟆油化学及药理学研究概况[J].中成药,1998,20(9):39.
[8]范玉林,崔香顺,姚玉霞.哈士蟆油成分研究的进展[J].吉林农业大学学报,1996,18(3):105.
[9]卢立明,宋少江,武勇.哈蟆卵油化学成分研究[J].中国药物化学杂志,2001,11(4):224.
[10]刘仁杰,孙,王刚,等.中国林蛙产品的开发现状与研究进展[J].粮油加工(电子版),2014(12):72-75.
[11]袁文彬,李宜平,王淑敏.林蛙油不同干燥处理方法蛋白质含量测定[J].吉林中医药,2011,31(2):163-164.
[12]杨名赫,佟庆,高利,等.东北林蛙的分类与哈蟆油[J].养殖技术顾问,2011(12):229.
[13]白雪媛.哈蟆油HPLC指纹图谱的研究及其在真伪鉴别中的应用[D].长春:长春中医药大学,2007.
[14]高晓晨,刘冬,白俊武,等.哈蟆油基原物种DNA分子鉴定研究[J].吉林中医药,2014,34(11):1147-1148,1162.
[15]周光新,张鹤,董颖,等.胰蛋白酶酶解法制备哈蟆油蛋白工艺的研究[J].食品科技,2013(10):236-240.
[16]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T.4[J].Nature,1970,227(259):680.
[17]张龙翔,张庭芳,李令媛.生化实验方法与技术[M].2版.北京:高等教育出版,1997:314.
[18]李国莉,杨建军,任彬彬,等.宁夏枸杞对密闭缺氧小鼠自由基防御体系的影响[J].卫生研究,2002,31(1):30-31.

